Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.1 Ciudad de México ene./mar. 2011
Revisiones bibliográficas
Las naftoquinonas: más que pigmentos naturales
Naphthoquinones: more than natural pigments
Lluvia Itzel López L.1, Elisa Leyva2, Ramón Fernando García de la Cruz2
1 Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila.
2 Facultad de Ciencias Químicas, Universidad Autónoma de San Luis Potosí.
Correspondencia:
Dra. Lluvia Itzel López López,
Facultad de Ciencias Químicas,
Universidad Autónoma de Coahuila,
Blvd. V. Carranza e Ing. José Cárdenas s/n
Col. República, C.P. 25280, Saltillo, Coahuila
Tel. (844) 415 5752, 415 5392, Fax 415 9534
e- mail: lluvialopez@uadec.edu.mx lluviaitzellopez@hotmail.com
Fecha de recepción: 20 de agosto de 2010.
Fecha de recepción de modificaciones: 29 de noviembre de 2010.
Fecha de aceptación: 24 de enero de 2011.
Resumen
La estructura 1,4-naftoquinona se encuentra en un gran número de compuestos de origen natural y es asociada con diversas propiedades biológicas. En la mayoría de los casos, la actividad biológica de las naftoquinonas se ha relacionado con sus propiedades de oxidación-reducción y ácido-base, las cuales pueden ser moduladas modificando sintéticamente los sustituyentes unidos al anillo 1,4-naftoquinona. La síntesis de nuevos derivados de 1,4-naftoquinona es de particular importancia, ya que estos compuestos muestran importantes actividades como agentes antiparasitarios, antibacterianos, antifúngicos y anticancerígenos. En esta revisión se muestra el panorama actual de los compuestos que contienen la estructura 1,4-naftoquinona tanto aislados de fuentes naturales como de origen sintético. También, se describen las actividades biológicas reportadas y los principales mecanismos de acción que se han propuesto para estos compuestos.
Palabras clave: 1,4-naftoquinona, antiparasitarios, antibacterianos, antifúngicos, anticancerígenos.
Abstract
The naphthoquinone structure is found in several natural compounds and is associated with diverse biological properties. In most cases, the biological activity of naphthoquinones has been related to their redox and acid-base properties, which can be modulated by directly adding a substituent to the 1,4-naphthoquinone ring. The synthesis of novel derivatives of 1,4-naphthoquinone is of important interest, since these compounds exhibit strong action as antimalarial, antibacterial, antifungical, and anticancer agents. This review presents a recent overview about compounds with a 1,4-naphthoquinone structure isolated from natural or synthetic sources. The reported biological activities and the proposed action mechanisms for these compounds are also described.
Key words: 1,4-naphthoquinone, antimalarial, antibacterial, antifungical, anticancer agent.
Introducción
Las naftoquinonas son pigmentos naturales, que tienen como característica estructural poseer dos grupos carbonilo en las posiciones 1,4 y con menor frecuencia en 1,2 ó 1,3 en el anillo del naftaleno, de donde deriva su nombre común. En la naturaleza se presentan con grupos hidroxilo y/o metilo como sustituyentes, además de encontrarse en forma libre o condensada con diversos monosacáridos1,2. La distribución de las naftoquinonas es amplia, ya que se han aislado de plantas, hongos, bacterias, e inclusive de animales. Sin embargo, se encuentran en mayor proporción en plantas superiores de determinadas familias de Angiospermas como: Ebenaceae, Droseraceae, Bignoniaceae, Verbenaceae, Plumbaginaceae, Juglandaceae, Boraginaceae, etc. 1-4.
Además de las propiedades tintóreas de las naftoquinonas y sus derivados, se han descrito importantes actividades biológicas destacando como agentes antiparasitarios, antibacterianos, antifúngicos y anticancerígenos. Debido a ello las naftoquinonas han sido sujeto de estudio por diversos grupos de investigación. En el presente trabajo se aborda el panorama actual de las naftoquinonas y sus derivados, su aislamiento de fuentes naturales, las principales actividades biológicas mostradas y los mecanismos de acción propuestos.
Distribución en la naturaleza de las naftoquinonas
La medicina tradicional es una fuente que ha ofrecido una gran diversidad de moléculas biológicamente activas y las naftoquinonas no son la excepción. Si bien, el primer uso de éstos compuestos fue en la industria de los pigmentos, en la literatura se encuentran numerosos reportes de sus actividades biológicas. Las naftoquinonas naturales, lawsona, juglona, plumbagina, lapachol, alkalina y shikona (Figura 1) aisladas de fuentes vegetales destacan por su uso en la medicina tradicional1-4.
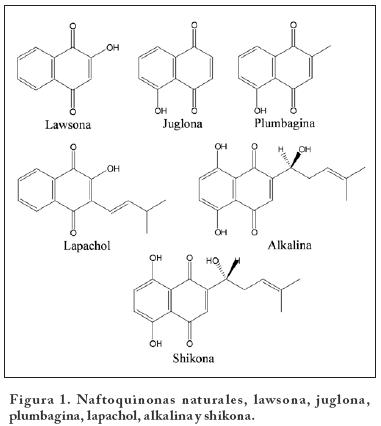
La lawsona (2-hidroxi-1,4-naftoquinona) es un pigmento color naranja obtenido de las hojas y tallos de la henna (Lawsonia inermes L., Lythraceae), utilizada como colorante del cabello y lana dándoles una coloración rojo-caoba. En la cultura del medio oriente su uso es de manera ancestral, en donde se han encontrado momias con decoraciones en manos y pies utilizando la henna como colorante1-4. Otra naftoquinona usada por sus propiedades tintóreas es la juglona (5-hidroxi-1,4-naftoquinona), la cual se obtiene de las hojas y cáscara del fruto del nogal (Juglans regia L., Juglandaceae). Su uso es común en la tinción de madera, a la cual le proporciona un tono marrón, además de la protección contra organismos saprófitos2,3.
La plumbagina (2-metil-5-hidroxi-1,4-naftoquinona), se encuentra en las hojas, corteza y raíces de especies de géneros como Plumbago (Plumbaginaceae), Drosera (Droseraceae) y Diospyros (Ebenaceae)1-4. Se ha descrito el uso de Plumbago zeylanica en el tratamiento del dolor reumático, en donde la plumbagina se muestra como la responsable de tal efecto. Otras actividades descritas para la plumbagina son como antiespasmódica, antibacteriana, antifúngica antiparasitaria y anticancerígena5.
En la corteza y la madera de plantas de los géneros Tabebuia spp. y Tecoma spp. (Bignoniáceas), se encuentra el lapachol (2-hidroxi-3-(3-metil-2-butenil)-1,4-naftoquinona), con actividades antitumorales, antibacterianas, antimaláricas y antifúngicas1-4. La alkalina se obtiene de la raíz desecada de Ancusa (Alkanna tinctoria, Boraginaceae), la cual es utilizada por sus propiedades como colorante en la detección histoquímica de aceites y grasas. En cambio, su enantiómero la shikona, ha sido usada por sus propiedades antiinflamatorias en el tratamiento de quemaduras, heridas y úlceras. La shikona es aislada de las semillas del mijo (Lithospermum officinae)1,3.
Además de sus propiedades como colorantes las naftoquinonas naturales presentan actividades biológicas importantes. Por ejemplo, el lapachol y sus análogos se han utilizado en el tratamiento de la tiña, diarrea, gonorrea, infecciones parasitarias, como antitumorales y antifúngicos6,7. Las avicequinonas A, B y C aisladas de Avicennia alba (Avicenniaceae)8 con estructura heterocíclica tipo hidrofurano unido a la 1,4-naftoquinona, los dímeros dilapachona y adenofilona aisladas de Heterophragma adenophyllum9 y la malvona A aislada de Malva sylvestris L.10, con sustitución 2,3-dimetoxi en el anillo de la 1,4-naftoquinona hidroxilada, se relacionan estructuralmente con el lapachol (Figura 2).

La cribariona B y lindbladiona aisladas de las especies Cribaria cancellata y Lindbladia tubulina son naftoquinonas polihidroxiladas que muestran una promisoria actividad antifúngica11,12 (Figura 3). Otros derivados polihidroxilados son los llamados equinocromos encontrados en las espinas y caparazones de los erizones de mar3,4.

Recientemente, se ha reportado la síntesis de la fumaquinona13, un antibiótico aislado de los cultivos de Streptomyces fumanus (LLF42248)14 presenta una actividad selectiva contra bacterias gram positivas a una concentración mínima inhibitoria (CMI) de 64 μg/mL. La fumaquinona pertenece a una familia de compuestos cuya característica es la presencia de una cadena isoprenoide o el anillo dihidrofurano unido al esqueleto de la 1,4-naftoquinona. Como miembros de esta familia se encuentran la furaquinocina C y la neomarinona. La neomarinona fue aislada de una bacteria marina (cepa CNH099) y ha mostrado propiedades antitumorales15. La síntesis total de su estructura ha sido reportada16. Además el esqueleto de la fumaquinona se encuentra en otros compuestos como la fibrostatina D (Figura 4).

Propiedades biológicas de las naftoquinonas
Las quinonas, incluidas las naftoquinonas son el segundo grupo de compuestos que se encuentran en etapa de investigación clínica y preclínica debido a la gran diversidad de propiedades biológicas descritas, destacando como antiparasitarios, antibacterianos, anticancerígenos y antifúngicos. Debido a la urgente necesidad de encontrar nuevas moléculas sintéticas o semisintéticas activas contra los diferentes microorganismos, las naftoquinonas constituyen un grupo de compuestos de importante investigación.
Actividad antiparasitaria
La malaria o paludismo es una de las enfermedades tropicales más importantes causada por la infección de un parásito protozoario del género Plasmodium. La población en riesgo ha aumentado debido a la dificultad por erradicar al mosquito vector y a la resistencia de los parásitos a los fármacos antimaláricos. Debido a la búsqueda urgente de nuevos agentes antimaláricos, se encontró que las naftoquinonas tienen capacidad inhibitoria contra Plasmodium. Por ejemplo, el compuesto 2-hidroxi-3-fenil-1,4-naftoquinona (Figura 5) se reportó por poseer actividad antimalárica cuatro veces mayor que la quinina17. Como resultado de esta observación, los reportes de nuevas moléculas con estructura de 1,4-naftoquinona fueron en aumento, los compuestos 2-hidroxi-3-[(1-adamantil) alquil)]-1,4-naftoquinona18, 2-hidroxi-3-ciclohexilpropil-1,4-naftoquinona19, 2-alquilamino-3-cloro-1,4-naftoquinona20 y 2-amino-1,4-naftoquinona imina21 (Figura 5) son ejemplo de ello, estas moléculas son activas contra diversas especies de Plasmodium. Se ha descrito que los derivados 2-amino-1,4-naftoquinona y 4-amino-1,2-naftoquinona presentan una actividad mayor contra P. falciparum comparada con los derivados 2-hidroxi-1,4-naftoquinona y quinonas diméricas22.

La síntesis de la 2-[trans-4-(4'-clorofenil)ciclohexil]-3-hidroxi-1,4-naftoquinona (Figura 6) conocida como atovacuona, ha sido uno de los mayores logros en el estudio de las naftoquinonas como antimaláricos. Este fármaco es actualmente utilizado contra Plasmodium. Las investigaciones se centran en el mecanismo de acción el cual tiene como blanco la cadena respiratoria mitocondrial de los parásitos sensibles entre el citocromo B y el c1 del complejo III23.

Compuestos relacionados estructuralmente con el lapachol y la β-lapachona han mostrado buena actividad antimalárica contra P. falciparum24, ejemplo de ello es el compuesto 2-(1-hidroxietil) nafto[2,3-b]furano-4,9-diona (Figura 7), aislado de Kigelia pinnata. Esta naftoquinona muestra ser activa a una CMI de 0.627 μM contra la cepa resistente a cloroquina K1 de P. falciparum, y en una CMI de 0.718 μM para la cepa T9-96 que es sensible a la cloroquina25.

Se ha descrito la síntesis de 26 análogos de las Rinacantinas, las cuales poseen actividad anticancerígena26, con funcionalización éster alifática en el anillo de la 1,4-naftoquinona. Prácticamente el total de los derivados mostraron propiedades antimaláricas contra P. falciparum en el rango de 0.03-16.63 μM. La longitud de la cadena alifática y la presencia de sustituyentes en el C-10 sobre la cadena propilo afectan la actividad. Se destacan los derivados rh1 y rh2 (Figura 8). El compuesto rh1 mostró actividad antimalárica a una concentración inhibitoria al 50 (CI50) de 5.4 μg/mL y el rh2 de 8 μg/mL contra P. falciparum cepa 3D7 cyt bc1, además de presentar baja citotoxicidad contra las células Vero27.

La Schistosomiasis producida por Schistosoma mansoni es una parasitosis de proceso complicado que en algunos casos resulta fatal, el parásito vive en el agua y entra al huésped por penetración de la piel. Derivados amino del lapachol han mostrado actividad contra Biomphalaria glabrata, quien es el huésped intermediario en el ciclo de infección del parásito28. Además se ha reportado la actividad contra B. glabrata de compuestos con estructura 2-hidroxi-3-alquil-1,4-naftoquinona29.
Otros parásitos susceptibles a las naftoquinonas son Leishmania, Tripanosoma y Toxoplasma. Las sales de potasio y acetato del lapachol, isolapachol y dihidrolapachol han mostrado actividad contra L. amazonensis y L. braziliensis, especies que se relacionan con la leishmaniasis tegumentaria30. Derivados de 1,4-naftoquinona con sustitución 2 y 3 por diferentes aminas muestran actividad contra Tripanosoma cruzi31. La naftoquinona hidroxilada 2-hidroxi-3-(1-propen-3-fenil)-1,4-naftoquinona se reporta con activad antiparasitaria contra Toxoplasma gondii32.
Actividad antibacteriana
La Drosera se ha usado desde el siglo XVI como potente antitusígeno y en una gran variedad de enfermedades respiratorias, incluyendo la tuberculosis. Extractos de diversas especies de Drosera muestran actividad contra Staphylococcus aureus, siendo la plumbagina uno de los compuestos con mayor actividad33.
El aislamiento de la juglona y 7-metiljuglona se ha realizado de Diospyros lycioides, presentando actividad contra Streptococcus mutans y S. sanguis responsables de caries dental, y sobre Porphyromonas gingivalis y Prevotella intermedia causantes de gingivitis. Cabe mencionar que de manera tradicional se acostumbra masticar la planta D. lycioides en la limpieza bucal34.
Se ha reportado la actividad antibacteriana de compuestos hidroxilados como la 5-amino-8-hidroxi-1,4-naftoquinona (Figura 9) contra S. aureus, S. intermedius y S. epidermidis a una CMI en el rango de 30 a 125 μg/mL35. Diversas especies de micobacterias también muestran susceptibilidad por derivados hidroxilados como la 5,8-dihidroxi-1,4-naftoquinona (Figura 9), a una CMI de 6.25 μg/mL. Otros derivados azufrados de la naftoquinona (Figura 9) con sustitución p-anisidilo muestran actividad contra Streptococcus faecalis y Klebsiella pneumoniae a una CMI de 6.25 μg/mL y los compuestos con sustitución o-anisidilo, fenilo y metilo, presentan actividad antimicrobiana a una CMI de 6.25 μg/mL para Escherichia coli36.

La 8-hidroxi-2-(1-hidroxietil)nafto[2,3-b]furano-4,9-diona, análogo cíclico del lapachol, se ha reportado como agente antibacteriano, mostrando actividad contra Helicobacter pilori, Staphylococcus, Enterococcus, Bacillus y Clostridium en un rango de 1.56 a 25 μg/mL37,38. La quinona dimérica Newbouldiaquinona-A, presenta actividad contra diversas especies como Enterobacter, Escherichia, Klebsiella, Morganella, Proteus, Pseudomonas, Shigella, Salmonella, Bacillus, Staphylococcus y Streptococcus en un rango de 0.31 a 9.76 μg/rriL, destacando la actividad contra Enterobacter aerogens de 24 veces más activo que el antibiótico de referencia gentamicina39.
Los derivados sintéticos benzo[b]carbazol-6,11-diona (Figura 10) debido a sus analogías estructurales con los antibióticos kinamicinas, han mostrado actividad contra bacterias Gram positivas y en menor grado contra Gram negativas, además de exhibir moderadas propiedades antitumorales40,41.

De manera general, los compuestos de estructura 1,4-naftoquinona son 8 veces más activos que los derivados que poseen estructura 1,2-naftoquinona42 sobre las bacterias Gram positivas como Staphylococcus aureus, Streptococcus pyogenes, Enterococcus faecium y Bacillus subtillis con relación a las bacterias Gram negativas33,43.
Actividad antifúngica
La actividad antifúngica de las naftoquinonas se describió en el compuesto 2,3-dicloro-1,4-naftoquinona, usado en la agricultura en el control de plagas y en la industria textil44. La planta Impatiens balsamina es utilizada en la medicina tradicional China por sus propiedades antibacterianas y antifúngicas. De las partes aéreas de la planta se ha aislado el compuesto 2-metoxi-1,4-naftoquinona, el cual presentó actividad antifúngica contra 4 cepas de Candida albicans, Fusarium oxysporum, Microsporum gypseum y Trichophyton mentagrophytes en un rango de 0.31 a 1.25 μg/mL. La actividad mostrada por éste compuesto es aún mayor que la actividad del fármaco antifúngico anfotericina B45. Candida albicans además es susceptible a la plumbagina a una concentración de 0.78 μg/mL46.
La incorporación adicional de un grupo arilamino, ariltiol o átomos de halógeno a la estructura de la 1,4-naftoquinona aumenta la eficacia de la actividad biológica. Al respecto, los derivados 2/3-ariltio- y 2,3-bis(ariltio)-5-hidroxi/5-metoxi-1,4-naftoquinona (Figura 11) muestran actividad contra diversas especies de Candida y Aspergillus niger, en un rango de CMI entre 64-0.5 μg/mL para C. albicans, C. tropicalis, C. krusei y A. niger. Los derivados con sustitución por átomos de flúor y cloro presentaron mejor actividad en comparación con los derivados sustituidos por el grupo metilo o sin sustitución sobre el anillo ariltio47.
Otros hongos susceptibles a derivados aminados y azufrados de la naftoquinona son Cryptococcus neoformans, Trichophyton mentagraphytes, Aspergillus fumigatus y Sporothrix schenckii (Figura 12), con un rango de actividad de 0.78 a 1.56 μg/mL, siendo estos valores de CMI comparables con los fármacos antifúngicos anfotericina B y miconazol48,49.

El lapachol también ha sido identificado como agente antifúngico contra Candida elegans50. La actividad del lapachol contra C. albicans, C. tropicalis y Crypotococcus neoformans es similar a la anfotericina B. La actividad antifúngica del lapachol reside probablemente en su interacción con la membrana celular del hongo51.
Actividad anticancerígena
Entre las diversas actividades que han mostrado las naftoquinonas y sus análogos está su capacidad anticancerígena. Se ha investigado el efecto de la β-lapachona sobre el crecimiento de la línea celular HepG2, demostrándose que inhibe la viabilidad de las células por la inducción de la apoptosis, ya que se evidencia con la formación de cuerpos apoptóticos y la fragmentación del ADN, estos resultados indican su potencial uso como agente en el tratamiento de cáncer de hígado52. También la plumbagina ha mostrado actividad anticancerígena sobre células tumorales de pulmón. Se ha reportado los efectos de esta naftoquinona natural sobre los microtúbulos, mostrando que la polimerización de la tubulina es inhibida por la plumbagina con una CI50 de 38 ± 0.5 μM53.
Otra naftoquinona natural con propiedad anticancerígena es la menadiona. Derivados de la menadiona mostraron actividad inhibitoria contra la enzima indolamino-2,3-dioxigenasa, la cual representa un blanco terapéutico emergente en el estudio y tratamiento de diversos tipos de cáncer, infecciones virales crónicas y otras enfermedades con algún tipo de inmunosupresión54.
Las naftoquinonas naturales aisladas de Rhincanthus nasutus, nombradas Rinacantinas-M, -N y -Q junto con otro número de C-(3)- análogos, son compuestos naturales usados en el tratamiento del cáncer. Diversos compuestos análogos muestran potente actividad anticancerígena comparada con la adriamicina (Figura 13)26.

Las naftoquinonas del tipo benzo[b]nafto[2,3-d]furano-6,11-diona (Figura 14), presentaron actividad anticancerígena contra la línea celular de leucemia promielocítica humana SCLC, tanto sensible como resistente a cisplatino55. Uno de los blancos interesantes en el desarrollo de nuevos agentes anticancerígenos son las fosfatasas CDC25, debido a que son reguladores clave en el ciclo celular eucarionte. Las isoformas A y B de las fosfatasas CDC25 se sobreexpresan en diferentes tumores y líneas celulares cancerígenas. Se han investigado derivados análogos de la vitamina K3 como inhibidores de las isoformas A y B de la fosfatasa CDC2556.

Considerando que la metástasis y la angiogénesis son procesos patológicos cruciales en el cáncer, se ha analizado el efecto del lapachol como agente antimetástico. Los resultados mostraron que el lapachol, en la concentración máxima no tóxica de 400 μg/mL para las células HeLa inhibe la invasión celular57. De manera similar la neovascularización es un proceso de gran importancia en el desarrollo de tumores y el tratamiento antiangiogénico podría bloquear el crecimiento tumoral. En la angiogénesis, el NO juega un papel muy importante en la migración y crecimiento celular vascular endotelial. El efecto in vitro de la β-lapachona sobre células endoteliales (línea celular vascular humana EAhy926) y las células endoteliales vasculares umbilicales humanas (HUVEC), demostró que el NO puede atenuar el efecto apoptótico de la β-lapachona sobre las células endoteliales humanas, sugiriendo a la β-lapachona como una potencial droga antiangiogénica58.
Otras actividades descritas
Las naftoquinonas y sus derivados naturales y sintéticos, además de sus actividades como antiparasitarios, antibacterianos, antifúngicos y anticancerígenos, han mostrado una gran diversidad de propiedades biológicas. Los compuestos 2-hidroxi-3-(2-metilbut-3-enil)-1,4-naftoquinona y su correspondiente acetato (Figura 15) se aislaron de Calceolaria andina L., y se evaluó su actividad como pesticidas, mostrando actividad contra diversas especies de homopteranos y ácaros, siendo débilmente activos contra especies benéficas, además de una toxicidad dérmica y oral baja en mamíferos59.

Las investigaciones de nuevos agentes antitrombóticos, han conducido al desarrollo de los compuestos CP201 (2-cloro-3-(3,5-diterbutil-4-hidroxifenil)-1,4-naftoquinona), NQ12 (2-cloro-3-(4-etilcarboxifenilamino)-1,4-naftoquinona), NQ301 (2-cloro-3-(4-acetofenilamino)-1,4-naftoquinona), NQ304 (2-cloro-3-(4-hexilfenilamino)-1,4-naftoquinona) y J78 (2-cloro-3-(2'-bromo-4'-fluorofenilamino)-8-hidroxi-1,4-naftoquinona) (Figura 16). Estos derivados de 1,4-naftoquinona mostraron efecto inhibitorio sobre la agregación plaquetaria en plasma humano in vitro y sobre la trombosis pulmonar in vivo, con resultados prometedores60,61.

Los derivados OQ1 y OQ21 con estructura 6-(fluoro-fenilamino)quinolino-5,8-diona (Figura 17), se han descrito como inhibidores potentes de la vasorelajación endotelial62. La actividad antiinflamatoria también ha sido estudiada, en particular la β-lapachona mostró bloquear de manera dosis dependiente la expresión de citocinas proinflamatorias como la interleucina IL-1β, IL-6 y el factor de necrosis tumoral TF-α63.

Mecanismo de acción de las naftoquinonas
Muchas de las actividades biológicas que presentan las naftoquinonas se han explicado con base a su capacidad de aceptar uno o dos electrones para formar su correspondiente radical anión ó dianión y a sus propiedades ácido-base (Figura 18). Estas propiedades dependen directamente de su estructura química y de la naturaleza electrónica de los grupos que sustituyen el núcleo naftoquinona64. En general, se ha descrito que su toxicidad es ocasionada por dos mecanismos principales: generación de especies reactivas de oxígeno (ROS), o mediante la formación de aductos con macromoléculas tales como el ADN y proteínas65,66,67.

Bajo condiciones fisiológicas las naftoquinonas pueden experimentar una reducción no enzimática por ganancia de un electrón generando la semiquinona, que es una especie de moderada toxicidad, mediante la transferencia electrónica de un radical apropiado65. La formación de la semiquinona también puede llevarse a cabo enzimáticamente, usualmente por una reacción de reducción mediada por flavoenzimas. La reducción de la naftoquinona puede seguir un mecanismo de un electrón, en donde participan la NADPH-citocromo P450 reductasa, NADH deshidrogenasa y la NADP ferredoxina reductasa, y por un mecanismo mixto de reducción por uno y dos electrones, con participación de las enzimas NAD(P)H deshidrogenasa (ó DT-Diaforasa) y la lipoamida deshidrogenasa. Bajo condiciones aeróbicas, los radicales semiquinona pueden auto-oxidarse para regenerar la quinona con la subsecuente formación de aniones superóxido generando peróxido de hidrógeno. Tanto las especies radicales activas de oxígeno como el peróxido de hidrógeno resultan particularmente tóxicos para la célula31, alterando en última instancia procesos celulares básicos como la biosíntesis de ácidos nucleicos y los mecanismos responsables de la biosíntesis de energía en forma de ATP. Las naftoquinonas naturales y sintéticas muestran su actividad antiprotozoaria por la generación de especies reactivas de oxígeno causando la peroxidación de lípidos y la alteración en el transporte electrónico con inhibición de la respiración celular32.
La atovacuona, un análogo de la ubiquinonna, interfiere en el proceso normal de electrones en la cadena de electrones en la mitocondria. Se ha demostrado que en especies de Plasmodium, el sitio primario de acción del compuesto se localiza entre el citocromo B y el c1 del complejo III 68 y que corresponde al acarreador electrónico Fe-S del complejo III69.
Se tienen reportes de que la interacción de las naftoquinonas con proteínas estructurales y enzimáticas, afectan vías y procesos metabólicos determinantes en la funcionalidad celular. Así, derivados de la 2-metil-1,4-naftoquinona actúan como inhibidores de la carboxilasa dependiente de la vitamina K, afectando la conversión de los residuos glutarilo de proteínas precursoras a residuos γ-carboxiglutarilo70. Las isoformas A y B de las fosfatasas CDC25 son inhibidas por derivados de la vitamina K, afectando la actividad de regulación en el ciclo celular eucarionte en células cancerígenas56. La β-lapachona se ha descrito como un inhibidor selectivo y potente de la transcriptasa reversa de los retrovirus, disminuyendo su replicación en humanos71.
El efecto de la plumbagina sobre los microtúbulos, ha revelado que la polimerización de la tubulina es inhibida de una manera dosis-dependiente, proponiéndose que compite con el sitio de unión con la colchicina53.
Otros mecanismos de acción relacionados con la toxicidad de las naftoquinonas y sus derivados, es con base a los sustituyentes del anillo farmacóforo de la 1,4-naftoquinona, interaccionando con la membrana celular microbiana, en función de la lipofília de los sustituyentes, ó bien con ácidos nucleicos mediante la intercalación de su parte 1,4-naftoquinona entre los pares de bases de la doble hélice del ADN, con la consecuente inhibición en la replicación y trascripción, ambos procesos involucrados en funciones determinantes en la viabilidad celular tales como la división y expresión de genes.
La identificación, caracterización y síntesis química de nuevos componentes representa actualmente una alternativa de enorme potencial en el diseño de nuevas moléculas con potente actividad farmacológica. La comprensión de los mecanismos moleculares de acción de los compuestos obtenidos mediante síntesis química, podrían generar en un futuro moléculas con elevado potencial de acción y altamente selectivas, si como blanco de acción actúan sobre moléculas o componentes celulares ausentes en la célula huésped.
Conclusiones
La urgente necesidad de encontrar nuevas estructuras químicas con actividades biológicas más selectivas y con menores efectos adversos, presentan a las naftoquinonas como un grupo prometedor de compuestos dado la gran diversidad de actividades descritas en la literatura.
Estos compuestos si bien, en un inicio se describieron y se siguen usando por sus propiedades como colorantes, son importantes considerando las actividades biológicas mostradas. Las naftoquinonas naturales se destacan por poseer en su estructura grupos hidroxilo, metilo y metoxilo, así como derivados hidrofuranos y naftoquinonas diméricas. Entre las naftoquinonas sintéticas, los derivados con sustitución en el C-2 de la 1,4-naftoquinona por los grupos amino, fenilo y tiol, se destacan por la actividad antiparasitaria, antifúngica, antibacteriana y anticancerígena. Sin embargo se han reportado otras actividades como antitrombóticos, antiinflamatorios y antivirales.
Las actividades biológicas que muestran las naftoquinonas y sus derivados son afectadas y/o moduladas por los grupos que sustituyen el anillo farmacóforo 1,4-naftoquinona. El mecanismo general de acción propuesto se relaciona con sus propiedades ácido-base y óxido-reducción, constituyendo un grupo de compuestos de suma importancia con un enorme potencial de uso como agentes terapéuticos.
Agradecimientos
Lluvia Itzel López L., agradece al CONACYT la beca No. 176951 para la realización de estudios de Doctorado y al apoyo financiero de Fondo de Apoyo a la Investigación FAI de la UASLP por medio del convenio C02-FAI-04-18.23.
Referencias
1. Bruneton J. 2001. Farmacognosia. Fitoquímica. Plantas medicinales, 2a ed. ACRIBIA, S. A., España. [ Links ]
2. Bruneton J. 1991. Elementos de Fitoquímica y de Farmacognosia, ACRIBIA, S.A., España. [ Links ]
3. Kuklinskli C. 2000. Farmacognosia, Omega, España. [ Links ]
4. Thomson, R.H. 1957. Naturally Occurring Quinones, Butter Worths Scientific Publications, USA. [ Links ]
5. Hsieh, Y.-J., Lin, L.-Ch., Tsai, T.-H. 2005. Determination and identification of Plumbagin from the roots of Plumbago zeylanica L. by liquid chromatography with tandem mass spectrometry. Journal of Chromatography A, 1083:141-145. [ Links ]
6. Lima, N.M.F., Correia, C.S., Leon, L.L., Machado, G. M.C., Madeíra, M.F., Santana, A.E.G., Goulart, M.O.F. 2004. Antileishmanial activity of lapachol analogues. Memórias do Instituto Oswaldo Cruz, 99(7):757-761. [ Links ]
7. Salas C., Tapia R.A., Ciudad K., Armstrong, V., Orellana M., Kemmerling U., Ferreira J., Maya J.D., Morello A. 2008. Trypanosoma cruzi: activities of lapachol and alpha-and beta-lapachone derivatives against epimastigote and trypomastigote forms. Bioorganic and Medicinal Chemistry, 16(2):668-674. [ Links ]
8. Ito Ch., Katsuno Sh., Kondo Y., Tan H. T.-W., Furukawa H. 2000. Chemical constituents of Avicennia alba. Isolation and structural elucidation of new naphthoquinones and their analogues. Chemical and Pharmaceutical Bulletin, 48:339-343. [ Links ]
9. Jassbi A.R., Singh P., Jain S., Tahara S. 2004. Novel naphthoquinones from Heterophragma adenophyllum. Helvetica Chimica Acta, 87:820-823. [ Links ]
10. Veshkurova O., Golubenko Z., Pshenichnov E., Arzanova I. , Uzbekov V., Sultanova E., Salikhov Sh., Williams H.J., Reibenspies J. H., Puckhaber L. S., Stipanovic R.D. 2006. Malvone A, a phitoalexin found in Malva sylvestris (family Malvaceae). Phytochemistry, 67:2376-2379. [ Links ]
11. Iwata D., Ishibashi M., Yamamoto Y. 2003. Cribarione B, a new naphthoquinone pigment from the myxomycete Cribaria cancellata. Journal of Natural Products, 66:1611-1612. [ Links ]
12. Misono Y., Ishikawa Y., Yamamoto Y., Hayashi M., Komiyama K., Ishibashi M. 2003. Dihydrolindbladiones. Three new naphthoquinone pigments from a myxomycete Lindbladia tubulina. Journal of Natural Products, 66:999-1001. [ Links ]
13. Peña-López M., Martínez M., Sarandeses L.A., Pérez Sestelo, J. 2010. A Versatile Synthesis of Fumaquinone. Journal of Organic Chemistry, Nota, April 21.
14. Charan R. D., Schlingmann G., Bernan V. S., Feng X., Carter G. T. 2005. Fumaquinone a new prenylated naphthoquinone from Streptomyces fumanus. Journal of Antibiotics, 58(4):271-274. [ Links ]
15. Hardt I.H., Jensen P.R., Fenical W. 2000. Neomarinone, and new cytotoxic marinone derivatives, produced by a marine filamentous bacterium (actinomycetales). Tetrahedron Letters, 41:2073-2076. [ Links ]
16. Peña-López M., Martínez M. M., Sarandeses L. A., Pérez Sestelo J. 2009. Total synthesis of (+)-neomarinone. Chemistry —A European Journal, 15:910-916. [ Links ]
17. Zaugg H. E., Rapala R.T., Leffler M. T. 1948. Naphthoquinone antimalarials. XIV. 2-Hydroxy-3-aryl-1,4-naphthoquinones. Journal of the American Chemical Society, 70:3224-3228. [ Links ]
18. Fieser L. F., Nazer M. Z., Archer S., Berberian D.A., Slighter R.G. 1967. Naphthoquinone antimalarials. XXX. 2-Hydroxy-3-[ω-(1-adamantyl)alkyl]-1,4-naphthoquinones. Journal of Medicinal Chemistry, 10:517-521. [ Links ]
19. Fieser L. F., Schimer J.P., Archer S., Lorenz R.R., Pfaffenbach P.I. 1967 Naphthoquinone antimalarials. XXIX. 2-Hydroxy-3-(ω-cyclohexylalkyl)-1,4-naphthoquinones. Journal of Medicinal Chemistry, 10:513-517. [ Links ]
20. Prescott, B. 1969. Potential antimalarial agents. Derivatives of 2-chloro-1,4-naphthoquinone. Journal of Medicinal Chemistry, 12:181-182. [ Links ]
21. Bullock F.J., Tweedie J.F., McRitchie D.D., Tucker M.A. 1970. Antiprotozoal quinones. IV. 2-Amino-1,4-naphthoquinones imines as potential antimalarials. Journal of Medicinal Chemistry, 13:550-552. [ Links ]
22. Kapadia G.J., Azuine M.A., Balasubramanian V., Sridhar R. 2001. Aminonaphthoquinones -A novel class of compounds with potent antimalarial activity against Plasmodium falciparum. Pharmacology Research, 43:363-367. [ Links ]
23. Goodman & Gilman. 1996. Las Bases Farmacológicas de la Terapeútica, 9a. ed. Vol. II. McGraw-Hill-Interamericana, México. [ Links ]
24. Pérez-Sacau E., Estévez-Braun A., Ravelo A.G., Gutiérrez D., Giménez A. 2005. Antiplasmodial activity of naphthoquinones related to lapachol and β-lapachona. Chemistry & Biodiversity, 2:264-274. [ Links ]
25. Weiss C.R., Moideen S.V.K., Croft S.L., Houghton P.J. 2000. Activity of extracts and isolated naphthoquinones from Kigelia pinnata against Plasmodiumfalciparum. Journal of Natural Products, 63:1306-1309. [ Links ]
26. Kongkathip N., Luangkamin S., Kongkathip B., Sangma C., Grigg R., Kongsaevee P., Prabpai S., Pradidphol N., Piyaviriyagul S., Siripong P. 2004. Synthesis of novel Rhinacanthins and related anticancer naphthoquinone esters. Journal of Medicinal Chemistry, 47:4427-4438. [ Links ]
27. Kongkathip N., Pradidphol N., Hasitapan K., Grigg R., Kao W-.Ch., Hunte C., Fisher N., Warman A.J., Biagini G.A., Kongsaeree P., Chuawong P., Kongkathip B. 2010. Transforming Rhinacanthin analogues from potent anticancer agents into potent antimalarial agents. Journal of Medicinal Chemistry, 53:1211-1221. [ Links ]
28. Silva T.M.S., Camara C.A., Barbosa T.P., Soares A.Z., Da Cunha L.C., Angelo C. Pinto A. C., Vargas M.D. 2005. Molluscicidal activity of synthetic lapachol amino and hydrogenated derivatives. Bioorganic and Medicinal Chemistry, 13:193-196. [ Links ]
29. Lima N.M.F., Correia C.S., Ferraz P.A.L., Pinto A.V., Pinto M.R.F., Santana A.E.G., Goulart M.O.F. 2002. Molluscicidal hydroxynaphthoquinones and derivatives: correlation between their redox potentials and activity against Biomphalaria glabrata. Memórias do Instituto Oswaldo Cruz, 6:822-829. [ Links ]
30. Teixeria M.J., Almeida Y.M., Viana J.R., Holanda J.G., Rodríguez T.P., Prata J.R.C. Jrs., Coelho I.C.B., Rao V.S., Pompeu M.M.L. 2001. In vitro and in vivo leishmanicidal activity of 2-hydroxy-3-(3-methyl-2-butenyl)-1,4-naphthoquinone (lapachol). Phytotherapy Research, 15:44-48. [ Links ]
31. Salmon-Chemin L., Buisine E., Yardley V., Kohler S., Debreu M.-A., Landry V., Sergheraert Ch., Croft S.L., Krauth-Siegel R.L., Davioud-Charvet E. 2001. 2- and 3-substituted 1,4-naphthoquinone derivatives as subversive substrates of trypanothione reductase and lipoamide dehydrogenasa from Trypanosoma cruzi: synthesis and correlation between redox cycling activities and in vitro cytotoxicity. Journal of Medicinal Chemistry, 44:548-565. [ Links ]
32. Ferreira R.A., Oliveira A.B., Ribeiro M.F.B., Tafuri W.L., Vitor R.W.A. 2006. Toxoplasma gondii: in vitro and in vivo activities of the hydroxynaphthoquinone 2-hydroxy-3-(1-propen-3-phenyl)-1,4-naphthoquinone alone or combined with sulfadiazine. Experimental Parasitology, 113:125-129. [ Links ]
33. Ferreira D.T., Andrei C.C., Ostrensky H., Saridakis Faria, T.J., Vinhato E., Carvalho K.E., Feijó J., Daniel S., Machado S.L., Saridakis D.P., Braz-Filho, R. 2004. Antimicrobial activity and chemical investigation of Brazilian Drosera. Memórias do Instituto Oswaldo Cruz, Rio deJaneiro, 99:753-755. [ Links ]
34. Cai L., Wei G.-X., Van der Bijl, P., Wu, C.D. 2000. Namibian chewing stick, Diospyros lycioides, contains antibacterial compounds against oral pathogens. Journal of Agricultural and Food Chemistry, 48:909-914. [ Links ]
35. Riffel A., Medina L.F., Stefan V., Santos R.C., Bizani D., Brandelli A. 2002. In vitro antimicrobial activity of a new series of 1,4-naphthoquinone. Brazilian Journal of Medical and Biological Research, 35:811-818. [ Links ]
36. Tandon V.K., Yadav D. B., Singh R.V., Vaish M., Chaturvedi A.K., Shukla P.K. 2005. Synthesis and biological evaluation of novel 1,4-naphthoquinone derivatives as antibacterial and antiviral agents. Bioorganic and Medicinal Chemistry Letters, 15:3463-3466. [ Links ]
37. Nagata K., Hirai K.I., Koyama J., Wada Y., Tamura T. 1998. Antimicrobial activity of novel furanonaphthoquinone analogs. Antimicrobials Agents and Chemotherapy, 42:700-702. [ Links ]
38. Eyong K.O., Folefoc G.N., Kuete V., Beng V.P., Krohn K., Hussain H., Nkengfack A.E., Saeftel M., Salem R. S., Hoerauf A. 2006. Newbouldiaquinone A: a naphthoquinone-anthraquinone ether coupled pigment, as a potential antimicrobial and antimalarial agent from Newbouldia laevis. Phytochemistry, 67:605-609. [ Links ]
39. Kuete V., Eyong K.O., Beng V.P., Folefoc G.N., Hussain H. , Krohn K., Nkengfack A.E. 2007. Antimicrobial activity of the methanolic extract and the chemical constituents isolated from Newbouldia laevis. Pharmazie, 62:552-556. [ Links ]
40. Knölker H.J., Sullivan N. 1994. Palladium-promoted synthesis of hydroxy-substituted 5-cyano-5H-benzo[b] carbazol-6,11-dionas. Tetrahedron, 50:10893-10908. [ Links ]
41. Chen N., Carriére M.B., Laufer R.S., Dimitrienko G.I. 2008. A biogenetically-inspired synthesis of a ring-D model of kinamycin F: insights into the conformation of ring D. Organic Letters, 10:381-384. [ Links ]
42. Tran T., Saheba E., Arcerio A.V., Chavez V., Li Q Martínez L.E., Primm T.P. 2004. Quinones as antimycobacterial agents. Bioorganic and Medicinal Chemistry, 12:4809-4813. [ Links ]
43. Adeniyi B.A., Fong H.H.S., Pezzuto J.M., Luyengi L., Odelola H.A. 2000. Antibacterial activity of diospyrin, isodiospyrin and bisisodiospyrin from the root of Diospyros piscatoria (Gurke) (Ebenaceae). Phytotherapy Research, 14:112-117. [ Links ]
44. Horst W.P.T., Felix E.L. 1943. 2,3-Dichloro-1,4- naphthoquinone. A potent organic fungicide. Industral & Engineering Chemistry Research, 35:1255-1259. [ Links ]
45. Yang X., Summerhurst D.K., Koval S.F., Ficker C., Smith M.L., Bernards M.A. 2001. Isolation of an antimicrobial compounds from Impatiens balsamina L. using bioassay-guided fractionation. Phytotherapy Research, 15:676-680. [ Links ]
46. De Paiva S.R., Figueiredo M.R., Aragão T.V., Coelho-Kaplan M.A. 2003. Antimicrobial activity in vitro of plumbagin isolated from Plumbago species. Memórias do Instituto Oswaldo Cruz, Rio de Janeiro, 98:959-961. [ Links ]
47. Ryu Ch.-K., Shim J.-Y., Chae M.J., Choi I.H., Han J.-Y., Jung O.-J., Lee J.Y., Jeong S.H. 2005. Synthesis and antifungal activity of 2/3-arylthio- and 2,3-bis(arylthio)-5-hydroxy-/5-methoxy-1,4-naphthoquinones. European Journalof Medicinal Chemistry, 40:438-444. [ Links ]
48. Tandon V.K., Chor R.B., Singh R.V., Raib S., Yadava D.B. 2004. Design, synthesis and evaluation of novel I, 4-naphthoquinone derivatives as antifungal and anticancer agents. Bioorganic and Medicinal Chemistry Letters, 14:1079-1083. [ Links ]
49. Tandon V.K., Yadav D.B., Singh R.V., Chaturvedic A.K., Shuklac P.K. 2005. Synthesis and biological evaluation of novel (L)α-amino acid methyl ester, heteroalkyl, and aryl substituted 1,4-naphthoquinone derivatives as antifungal and antibacterial agents. Bioorganic and Medicinal Chemistry Letters, 15:5324-5328. [ Links ]
50. Breger J., Fuchs B.B., Aperis G., Mor T., Ausubel F.M. 2007. Antifungal chemical compounds identified using a C. elegans pathogenicity assay. PLos Pathogens, 3:168-178. [ Links ]
51. Guiraud P., Steiman R., Campos-Takaki G.-M., Seigle-Murandi F., Buochberg M.S. 1994. Comparison of antibacterial and antifungal activities of lapachol and beta-lapachona. Planta Medica, 60:373-374. [ Links ]
52. Woo H.J., Park K.-Y., Rhu Ch-.H., Lee W.H., Choi B.T., Kim G.Y., Park Y.-M., Choi Y.-H. 2006. Lapachone, a quinone isolated from Tabebuia avellanedae, induces apoptosis in HepG2 hepatoma cell line through induction of bax and activation of caspase. Journal of Medicinal Food, 9(2):161-168. [ Links ]
53. Bipul R., Acharya B.R., Bhattacharyya B., Chakrabarti G. 2008. The natural naphthoquinone Plumbagin exhibits antiproliferative activity and disrupts the microtubule network through tubulin binding. Biochemistry, 47(30):7838-7845. [ Links ]
54. Kumar S., Malachowski W.P., DuHadaway J. B., LaLonde J.M., Carroll P.J., Jaller D., Metz R., Prendergast G.C., Muller A.J. 2008. Indoleamine 2,3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors. Journal of Medicinal Chemistry, 51:1706-1718. [ Links ]
55. Chang H.-X., Chou T.-Ch., Savaraj N., Liu L. F., Yu Ch., Cheng C.C. 1999. Design of antineoplastic agents based on the "2.phenylnaphthalene-type" structural pattern. Synthesis and biological activity of 2-chloro-3-(substituted phenoxy)-1,4-naphthoquinones and related 5,8-dihydroxy-1,4-naphthoquinones. Journal of Medicinal Chemistry, 42:405-408. [ Links ]
56. Brun M-P., Braud E., Angotti, D., Mondésert O., Quaranta M., Montes M., Miteva M., Gresh N., Ducommun B., Garbay C. 2005. Design, synthesis, and biological evaluation of novel naphthoquinone derivatives with CDC25 phosphatasa inhibitory activity. Bioorganic and Medicinal Chemistry, 13:4871-4879. [ Links ]
57. Balassiano I.T., De Paulo S.A., Silva N.H., Cabral M.C., Carvalho M.C. 2005. Demostration of the lapachol as a potential drug for reducing cancer metastasis. Oncology Reports, 13:329-333. [ Links ]
58. Kung H.-N., Chien C.-L., Chau G.-Y., Don M.-J., Lu K.-S., Chau Y.-P. 2007. Involvement of NO/cGMP signaling in the apoptotic and anti-angiogenic effects of beta-lapachone on endothelial cells in vitro. Journal of Cellular Physiology, 211:522-532. [ Links ]
59. Khambay B.P.S., Batty D., Cahill M., Denholm I. 1999. Isolation, characterization, and biological activity of naphthoquinones from Calceolaria andina L. Journal of Agricultural and Food Chemistry, 47:770-775. [ Links ]
60. Yuk D.Y., Ryu Ch.K., Hong J.T., Chung K.H., Kang W.S., Kim Y., Yoo M.K., Lee Ch. H., Yun Y.P. 2000. Antithrombotic and antiplatelet activities of 2-chloro-3-[4-(ethylcarboxy)-phenyl]-amino-1,4-naphthoquinone (NQ12), a newly synthesized 1,4-naphthoquinone derivative. Biochemical Pharmacology, 60:1001-1008. [ Links ]
61. Jin Y.-R., Cho M.-R., Ryu Ch.-K., Chung J.-H., Yuk D.-Y., Hong J.-T., Lee K.-S., Lee J.-J., Lee M.-L., Lim Y., Yun Y.-P. 2005. Antiplatelet activity ofJ78 (2-chloro-3-[2'-bromo-4'-fluoro-phenyl]-amino-8-hydroxy-1,4-naphthoquinone), an antithrombotic agent, is mediated by thromboxane (TX) A2 receptor blockade with TXA2 synthase inhibition and suppression of cytosolic Ca2+ mobilization. Journal of Pharmacology and Experimental Therapeutics, 312: 214-219. [ Links ]
62. Lee J.-A., Jung S.-H., Bae M.K., Ryu Ch.-K., Lee J.-Y., Cheng J.-H., Kim. H.-J. 2000. Pharmacological effects of novel quinine compounds, 6-(fluorinated-phenyl) amino-5,8-quinolinediones, an inhibition of drug-induced relaxation of rat aorta and their putative action mechanism. GeneralPharmacolology, 34:33-42. [ Links ]
63. Moon D.-Oh., Choi Y.H., Kim N.-D., Park Y.-M., Kim G.-Y. 2007. Antiinflammatory effects of beta-lapachone in lipopoly-saccharide-stimulated BV2 microgalia. International Immunopharmacology, 7:506-514. [ Links ]
64. Aguilar-Martínez M., Cuevas G., Jiménez-Estrada M., González I., Lotina-Hennsen B., Macías-Ruvalcaba N. 1999. An experimental and theoretical study of the substituent effects on the redox properties of 2-[(R-phenyl) amine]-1,4-naphthalenediones in acetonitrile. Journal of Organic Chemistry, 64:3684-3694. [ Links ]
65. Bergeron F., Klarskov K., Hunting D.J., Wagner J.R. 2007. Near-UV photolysis of 2-methyl-1,4-naphthoquinone-DNA duplexes: characterization of reversible and stable interstrand cross-links between quinones and adenine moieties. Chemical Research in Toxicology, 20:745-756. [ Links ]
66. Bitter S., Gorohovsky O., Paz-Tal L., Becker J.Y. 2002. Synthesis, electrochemical and spectral properties of some ω-n-quinonyl amino acids. Amino Acids, 22:71-93. [ Links ]
67. Wang Y. 2008. Bulky DNA lesions induced by reactive oxygen species. Chemical Research in Toxicology, 21:276-281. [ Links ]
68. Fry M., Pudney M. 1992. Site of action of the antimalarial hydroxynaphthoquinone, 2-[trans-4-(4'-chlorophenyl) cyclohexyl]-3-hidroxy-1,4-naphthoquinone (566C80). Biochemical pharmacology, 43:1545-1553. [ Links ]
69. Harmon H.J., Struble V.G. 1983. Effects of 2-hydroxy-3-undecyl-1,4-naphhoquinone on respiration of electron transport particules a mitochondria: topographical location of the rieske iron-sulfur protein and the quinine binding site. Biochemistry, 22:4394-4400. [ Links ]
70. Dhaon M.K., Lehrman S.R., Rich D.H., Engelke J.A., Suttie J.W. 1984. Derivatives of 2-methyl-1,4-naphthoquinone as substrates and inhibitors of the vitamin k dependent carboxilasa. Journal of Medicinal Chemistry, 27:1196-1201. [ Links ]
71. Li C.J., Zhang L.J., Dezube B.J., Crumpacker C.S., Pardee A.B. 1993. Three inhibitors of type-1-human-immunodeficiency virus long terminal repeat-directed gene-expression and virus-replication. Proceedings of the National Academy of Sciences, 90:1839-1842. [ Links ]














