Introducción
Durante la maduración de los quesos, la proteólisis contribuye a la generación de péptidos, los cuales pueden ejercer alguna actividad biológica, ya sea antioxidante, antimicrobiana, antihipertensiva, opioide, antiangiogénica, etc. (Santiago-López et al., 2018; Rafiq et al., 2021). Los péptidos con actividad antioxidante son capaces de captar radicales libres y especies reactivas de oxígeno (ROS) (Khan et al., 2019). Este tipo de péptidos ha sido reportado en varios quesos alrededor del mundo (Dias da Silva et al., 2019; Kariyawasam et al., 2019; Timón et al., 2019; Banihashemi et al., 2020; Turan y Durak, 2022) y en el caso de quesos mexicanos las investigaciones más recientes se han realizado en quesos tales como el queso crema de Chiapas, el fresco, el cocido (Aguilar-Toalá et al., 2022) y el panela (López-Villafaña et al., 2023).
Por otro lado, la maduración permite que los quesos desarrollen características sensoriales determinadas en gran medida por los procesos bioquímicos que se llevan a cabo y por los factores que impactan la textura. Estos factores incluyen a los glóbulos de grasa, agua, minerales, bacterias y solutos disueltos como la lactosa, el ácido láctico, las sales solubles y los péptidos ocluidos dentro de la matriz de proteína, entre los cuales varias fuerzas moleculares (puentes de hidrógeno y disulfuro) pueden influir en la funcionalidad del queso (Lamichhane et al., 2018; Domingues et al., 2019). Las diferencias sensoriales entre productos pueden ser descritas y cuantificadas mediante un perfil sensorial, como el perfil Flash (Domingues et al., 2019).
El queso añejo de Zacazonapan es un alimento tradicional mexicano producido en el suroeste del Estado de México, al ser un queso artesanal se elabora a pequeña escala, con leche cruda, bajo técnicas tradicionales y goza de prestigio social local (Aguilar-Toalá et al., 2022). Investigaciones recientes en el queso añejo de Zacazonapan se han centrado en las emociones de sus consumidores (Torres-Salas y Hernández-Montes, 2021bb), en los valores humanos (Torres-Salas y Hernández-Montes, 2021a), las comunalidades de significado para el queso (Torres-Salas y Hernández-Montes, 2020) y en la actividad antimicrobiana de sus extractos solubles (Torres-Salas, et al., 2021). Sin embargo, no existe información sobre la producción de péptidos con actividad antioxidante, ni de las características sensoriales y texturales desarrolladas en este queso durante la maduración. En este contexto, la presente investigación tuvo como objetivos realizar un análisis composicional del queso añejo de Zacazonapan, determinar el grado de hidrólisis de las proteínas y la actividad antioxidante que poseen los péptidos generados en el transcurso de la maduración. Además, en este periodo se evaluaron los cambios en los atributos sensoriales del queso y sus características texturales instrumentales.
Materiales y métodos
Reactivos analíticos
El reactivo de Bradford, albumina sérica bovina (BSA, por sus siglas en inglés), L-leucina, 2, 2-difenil-1-picrilhidrazil (DPPH, por sus siglas en inglés), 2,2’-Azobis (2-metilpropionamidina) dihidrocloruro (AAPH, por sus siglas en inglés), fluoresceína y trolox correspondieron a la empresa Sigma-Aldrich (Minessota, USA). El ácido 2, 4, 6-trinitrobenceno-1-sulfónico (TNBS, por sus siglas en inglés) de la marca Fluka, Sigma-Aldrich (Steinheim, Suiza).
Obtención de muestras
Piezas de queso (un kilogramo) se obtuvieron de dos queserías de Zacazonapan, Estado de México, México (codificados como A y B). Las piezas para las tres repeticiones se elaboraron en días consecutivos, cada pieza se obtuvo de un lote de leche cuajada en la misma tina. Posteriormente, se almacenaron a 15 °C y una humedad relativa de 85 %, para muestrearse durante la maduración a los 0, 30, 95 y 180 d.
Análisis fisicoquímicos del queso
El pH se determinó con un potenciómetro Conductronic pH120 (Conductronic, Puebla, México) como lo describe Villegas (2004) y la actividad de agua (aw) con el método reportado por Öztürk y Akin (2021b) mediante un equipo Aqualab Serie 3 (Decagon Devices Inc., Washington, USA). El análisis composicional se realizó con un analizador FoodScanTM Lab (FOSS Analytical AB, Hillerød, Dinamarca). Las determinaciones se realizaron por triplicado para los quesos de ambas fábricas, en los cuatro tiempos de maduración (0, 30, 95 y 180 d).
Extracción de compuestos solubles en agua
La extracción se realizó como lo describen Pritchard et al. (2010) , con modificaciones. 250 g de queso se homogeneizaron con 750 mL de agua destilada durante 5 min en una licuadora (Osterizer, Wisconsin, USA). A continuación, la mezcla se agitó a 150 rpm durante 1 h a 40 °C en una incubadora orbital (Thermo Fisher Scientific, Massachusetts, USA). El pH se ajustó a 4.6 con HCl 1 M y la mezcla se centrifugó a 8801 g durante 10 min a 4 °C y se descartó tanto la capa superior de grasa como el sedimento. El extracto acuoso se filtró por gravedad a través de una capa de algodón y posteriormente utilizando papel Whatman No. 42, en condiciones de vacío. Los extractos se almacenaron a - 20 °C y antes de cada prueba se centrifugaron a 3438 g durante 10 min a 4 °C (Centrifuga Eppendorff 5810, Hamburgo, Alemania) y se filtraron usando papel Whatman 42.
Determinación de proteína soluble en extractos acuosos
La proteína soluble se cuantificó de acuerdo al método descrito por Bradford (1976). Una alícuota de 50 μL del extracto acuoso se mezcló con 1.5 mL de reactivo de Bradford. Después de 5 min, la absorbancia se leyó a 595 nm (Genesys 10S UV-VIS, Thermo Scientific™, Massachusetts, USA). En el blanco se sustituyó el extracto por agua destilada. Bajo las mismas condiciones se preparó una curva estándar de BSA (0.1 - 1.4 mg/mL) y cada determinación se realizó por triplicado.
Determinación de grado de hidrólisis de proteínas
Este parámetro se determinó como lo describe Adler-Nissen (1979), con algunas modificaciones. Alícuotas de 64 μL de extracto acuoso se mezclaron con 1 mL de tampón de fosfato de sodio 0.2125 M a pH 8.2 y 0.5 mL de TNBS al 0.2 % (v/v). La mezcla se agitó e incubó en baño de agua (OVAN TL60E, Suministro Grupo Esper, S. L., USA) durante 30 min a 50 °C, bajo condiciones de oscuridad. Concluido el tiempo se adicionó 1 mL de Na2SO3 0.1 M para detener la reacción y se dejó reposar 10 min. En el blanco se sustituyó la muestra por agua destilada. Bajo las mismas condiciones se construyó una curva estándar de L-leucina (0 - 6 mM). La absorbancia se midió a 420 nm (Genesys 10S UV-VIS, Thermo Scientific™, Massachusetts, USA) y cada determinación se realizó por triplicado.
La hidrólisis total se realizó pesando 0.5 g del queso al tiempo cero de maduración y se adicionaron 2.5 mL de HCl 6 N, la mezcla de reacción se incubó a 100 °C durante 24 h (EC33, Ríos Rocha S. A., Ciudad de México, México). Después se adicionaron 2.5 mL de NaOH y la mezcla se filtró a través de papel Whatman No. 1. Al sobrenadante se aplicó la metodología descrita para los extractos acuosos. El porcentaje de grado de hidrólisis (% GH) se calculó con la ecuación 1:
Donde: NH2tx = cantidad de grupos α-amino libres al tiempo x de maduración, NH2t0 = cantidad de grupos α-amino libres al tiempo 0 de maduración y NH2HT = cantidad de grupos α-amino libres totales en la muestra de queso a los 0 d de maduración.
Determinación in vitro de la actividad antioxidante
Captación del radical libre DPPH
La determinación se realizó como lo describe Hernández-Galán et al. (2017), con modificaciones. Un volumen de 0.5 mL de extracto acuoso (proteína 0.3 mg/mL) o agua destilada (blanco), se mezcló con 1.5 mL de DPPH 0.125 mM (en metanol al 80 % v/v) y se dejó reposar durante 60 min en la oscuridad. Enseguida, las muestras se centrifugaron a 3483 g durante 5 min a 4 °C (Centrifuga Eppendorff 5810, Hamburgo, Alemania) y la absorbancia se leyó a 515 nm (Genesys 10S UV-VIS, Thermo Scientific™, Massachusetts, USA). El porcentaje de captación del radical DPPH se calculó con la ecuación 2:
Donde ABlanco= absorbancia del blanco y AExtracto= absorbancia del extracto soluble.
Capacidad de absorción de radicales de oxígeno (ORAC)
La determinación se realizó según el método descrito por Dávalos et al. (2004), con algunas modificaciones. Un volumen de 25 µL del extracto acuoso, o tampón de fosfato de potasio 75 mM a pH 7.4 en el caso del blanco y el control, se mezcló con 150 µL de fluoresceína 1.4 µM (diluida 1:1000 con tampón de fosfato de potasio 75 mM, pH 7.4). La mezcla se incubó durante 20 min a 37 °C, enseguida se añadieron 25 µL de AAPH 0.15 M. Una vez iniciada la reacción, las lecturas de fluorescencia a 37 °C se tomaron en intervalos de 1 min durante 1 h, a una longitud de onda de excitación de 485 nm y 535 nm de emisión, mediante un equipo BioTek Synergy 2 (Winooski, Vermont, USA). Bajo las mismas condiciones se preparó una curva de trolox (5 a 100 µM). Los cálculos de las áreas bajo la curva de decaimiento de la fluorescencia (AUC) de los extractos acuosos y curva estándar de trolox, se determinaron con el software Gen5TM (1. 11 versión 2005, Winooski, Vermont, USA) del equipo BioTek Synergy 2. Las determinaciones se realizaron por triplicado y los resultados se expresaron como µM equivalentes de trolox/mL de extracto.
Perfil flash del queso añejo de Zacazonapan
El método utilizado fue el descrito por Dairou y Sieffermann (2002), con modificaciones. Para la prueba se reclutaron a 17 estudiantes del Departamento de Ingeniería Agroindustrial de la Universidad Autónoma Chapingo (UACh). En la primera sesión, a cada panelista se le presentaron las muestras del queso A y del B con 0, 30 y 180 d de maduración. Las seis muestras (dos cubos de queso de 1 x 1 x 1.5 cm por muestra) fueron presentadas de forma aleatoria y simultánea en vasos de plástico del No. 0, codificados con números aleatorios de tres dígitos. Posteriormente, a los panelistas se les pidió crear una lista de atributos para diferenciar las muestras. A continuación, se socializó y consensó la información en una lista de 14 atributos (color amarillo, apariencia porosa, olor a pies, aroma a leche ácida, firmeza o dureza (al presionar el queso con las muelas), desmoronable (en boca), arenosidad o granulosidad, humedad, sabor salado, sabor ácido, sabor a queso madurado, pungencia o picor, sabor residual amargo, duración del sabor en la boca). En una segunda sesión, a cada panelista se le presentaron nuevamente las seis muestras simultáneamente (dos cubos de queso de 1 x 1 x 1.5 cm por muestra) y se le pidió jerarquizarlas para cada atributo utilizando una escala ordinal del 1 al 6, considerando 6 como la muestra con la mayor intensidad del atributo. Los panelistas tuvieron disponible agua y galletas habaneras clásicas (Gamesa) para enjuagarse la boca entre muestras.
Análisis de perfil de textura (APT)
El APT se realizó con el método señalado por Hernández-Morales et al. (2010), mediante un analizador de textura TA Xt2i (Stable Micro Systems; Surrey, UK) con una celda de carga de 5 kg. Las muestras (cilindros de 10 mm de diámetro y de altura) se comprimieron uniaxialmente a una deformación del 50 % utilizando un disco de acrílico de 35 mm de diámetro (A/BE35) y una velocidad de pre-ensayo y post-ensayo del cabezal de 1 mm/s. Los datos de la doble compresión permitieron obtener curvas de fuerza/tiempo (Figura 1), a partir de las cuales se calcularon los parámetros del APT como: la dureza que es el pico de fuerza (F) del área uno (A1) de la primera compresión, la adhesividad representa el trabajo necesario para retirar el disco que comprime la muestra y corresponde al área tres (A3). La cohesividad definida como la propiedad que le permite al queso permanecer unido después de una primera compresión y se calcula como el cociente del área dos entre el área uno (A2/A1). La elasticidad se refiere a la habilidad del queso para retornar a su altura original después de una primera compresión y se calcula dividiendo la distancia dos entre la uno (D2/D1). Finalmente, la masticabilidad se refiere al trabajo necesario para realizar una doble compresión y corresponde al producto de F * (A2/A1) * (D2/D1) (Rahman et al., 2021).
Figura 1 Curva de análisis de perfil de textura (APT). Los cálculos de las propiedades texturales: dureza = F (N), adhesividad = A3 (N·s), Cohesividad = A2/A1 (adimensional), elasticidad = D1/D2 (adimensional) y masticabilidad = dureza x cohesividad x elasticidad (N). Modificado de Rahman et al. (2021).
Análisis estadístico
El diseño aplicado fue un completamente al azar con arreglo factorial, el cual consideró dos factores: queso (dos niveles A y B) y tiempo de maduración (cuatro niveles 0, 30, 95 y 180 d). Las medias se compararon con la prueba de diferencia mínima significativa (DMS) con α = 5 %, usando el programa estadístico SAS versión 9.0 (SAS Institute Inc., Carolina del Norte, USA). En el perfil flash se utilizó un diseño completamente al azar para seleccionar panelistas que mostrarán diferencia significativa (p ≤ 0.05) en la mayoría de los atributos, mediante el programa SAS 9.0 (SAS Institute Inc., Cary, NC, USA). Con los datos de los panelistas seleccionados se realizó un análisis procrusteano generalizado (APG) mediante el programa XLSTAT versión 2014 (Addinsoft, USA).
Resultados y discusión
Análisis fisicoquímico del queso
El análisis estadístico indicó diferencia significativa (p ≤ 0.05) respecto a los factores queso, tiempo de maduración y su interacción. En la figura 2 se muestran las variables de respuesta con diferencia significativa respecto al factor queso, en este caso, el queso B registró los mayores contenidos en proteína (28.33 %), sólidos totales (64.74 %) y sal (2.28 %). Esta última variable se asocia con la reducción de la actividad de agua (aw) que, a su vez, regula el crecimiento microbiano afectando la actividad enzimática. En la maduración, la actividad enzimática sobre las proteínas es determinante en el desarrollo de compuestos del sabor y en la formación de péptidos de alto y mediano peso molecular, así como en la presencia de aminoácidos libres (Fox et al., 2017; Tekin y Hayaloglu, 2022).
Por otra parte, el queso A presentó el mayor porcentaje de grasa (27.80 %) y de humedad (37.92 %) (Figura 2). Esta última variable se encuentra relacionada con las etapas del proceso de elaboración del queso, por ejemplo, las veces que la cuajada se corta y se drena, así como el número de veces que es molida antes de colocarse en los moldes (Hernández-Morales et al., 2010).
Las variables que presentaron diferencia significativa, respecto al factor tiempo de maduración, se muestran en la Figura 3. La proteína en el tiempo 180 d presentó un incremento del 10.8 % comparado con el tiempo 0 d. Respecto al contenido de grasa se observó el mayor valor a los 180 d (29.59 %). En consecuencia, los sólidos totales incrementaron de 54.02 a 71.23 % durante el transcurso de la maduración. Por otra parte, la humedad disminuyó 1.6 veces entre el tiempo inicial y el final de la maduración. Este comportamiento es similar al reportado en queso Provolone, donde la humedad promedio inicial fue 45.70 % y decreció hasta 34.73 % a los 270 d (Manzo et al., 2019). La tendencia en las diversas variables de respuesta puede explicarse considerando que la elaboración de queso constituye un proceso de deshidratación, el cual está determinado por factores como la temperatura, sinéresis, acidificación de la pasta, trabajo mecánico, adición de sal y la maduración del queso. Estos factores favorecen la concentración de los principales componentes de la leche (proteína y grasa) y la pérdida de agua (Fox et al., 2017; Tekin y Hayaloglu, 2022).
Referente a la interacción de factores queso-tiempo de maduración, el pH en el queso A disminuyó hasta 5.26 a los 30 d (Figura 4), mientras que en el queso B permaneció constante entre 5.31-5.39 (Figura 4). El descenso del pH está asociado con la lactosa residual, la cual es metabolizada en ácido láctico y otros ácidos orgánicos. Otros factores implicados en el comportamiento del pH son la relación ácido láctico y compuestos amortiguadores formados durante la proteólisis en el queso, así como la desaminación de aminoácidos y la conversión de ácidos grasos a metilcetonas (Manzo et al., 2019; Ruvalcaba-Gómez et al., 2020; Tekin y Hayaloglu, 2022).
Figura 4 pH, actividad de agua (aw) y minerales de los quesos A y B a los 0, 30, 95 y 180 d de maduración. Los resultados se reportan como valores promedio (± error estándar) con diferencia significativa (DMS, p ≤ 0.05) para la interacción de factores queso y tiempo de maduración. Las letras a, b, c y d indican diferencia entre tiempos; x, y indican diferencia entre quesos.

Figure 4: pH, water activity (aw) and minerals of cheeses A and B at 0, 30, 95 and 180 d of ripening. The results are reported as mean values (± standard error) with significant differences (DMS, p ≤ 0.05) for the interaction of cheese factors and ripening time. The letters a, b, c and d indicate difference between times; x, y indicate difference between cheeses.
Otra variable de respuesta importante durante la maduración es la actividad de agua (aw), la cual debe mantenerse en un mínimo de 0.92 para favorecer el crecimiento de los microorganismos presentes en el queso (Fox et al., 2017). En el queso añejo de Zacazonapan al finalizar la maduración (180 d) la aw disminuyó a 0.93 en el queso A y 0.90 en el queso B (Figura 4). Este comportamiento ha sido observado en queso Tulum, el cual presentó una aw de 0.942 a los siete días de elaboración, mientras que a los 180 d de maduración fue de 0.888 (Öztürk et al., 2021b), los autores relacionaron este cambio con la disminución de la humedad. Por otra parte, el contenido de sal afecta la aw, ya que al incrementarse promueve las interacciones agua-proteína, por el efecto “salting-in” que permite la hidratación e hinchazón de la matriz de caseína. La aw también disminuye por la hidrólisis de enlaces peptídicos, donde se liberan dos grupos cargados (NH3+/COO-) que interactúan con el agua libre del queso (McSweeney y Sousa, 2000; Lamichhane et al., 2018).
El porcentaje de minerales se incrementó conforme transcurrió la maduración, el queso B presentó los valores más altos entre 6.51 - 8.36 % (Figura 4). Cabe destacar que, el contenido de minerales es afectado por la acidificación, por ejemplo, controla la velocidad de disolución del fosfato de calcio coloidal de las micelas de caseína (Ruvalcaba-Gómez et al., 2020).
Contenido de proteína soluble en extractos
El contenido de proteína soluble es una medida de la proteólisis primaria llevada a cabo durante la maduración del queso (Álvarez et al., 2022). El análisis estadístico indicó diferencia significativa (p ≤0.05) con respecto a la interacción de queso y tiempo de maduración. Los valores más altos se presentaron a los 95 d, siendo 1.24 y 0.88 mg/mL para el queso A y B, respectivamente, los cuales disminuyeron con el transcurso de la maduración (Figura 5). Esto concuerda con lo encontrado por Alonzo-Paz et al. (2016) en extractos acuosos de queso Cotija, cuyo contenido de proteína a los 8 d fue de 0.54 mg/mL y disminuyó a los 90 d de maduración a 0.24 mg/mL. Por otra parte, autores señalan un incremento de la proteína soluble en queso Gouda, en este caso al tiempo 0 se observó un 0.249 mg/mL de proteína soluble y al finalizar la maduración de 0.261 mg/mL (Álvarez et al., 2022). Algunos autores asocian este comportamiento, al incremento o disminución en la liberación de péptidos hidrófobos, los cuales modifican el perfil de solubilidad del contenido proteínico (Sarmadi y Ismail, 2010; Alonzo-Paz et al., 2016).
Figura 5 Proteína soluble (mg/mL) en extractos de queso añejo de Zacazonapan durante la maduración. Los resultados se reportan como valores promedio (± error estándar) con diferencia significativa (DMS, p ≤ 0.05) para la interacción queso-tiempo de maduración. Las letras a, b, y c indican diferencia entre tiempos; x, y indican diferencia entre quesos.
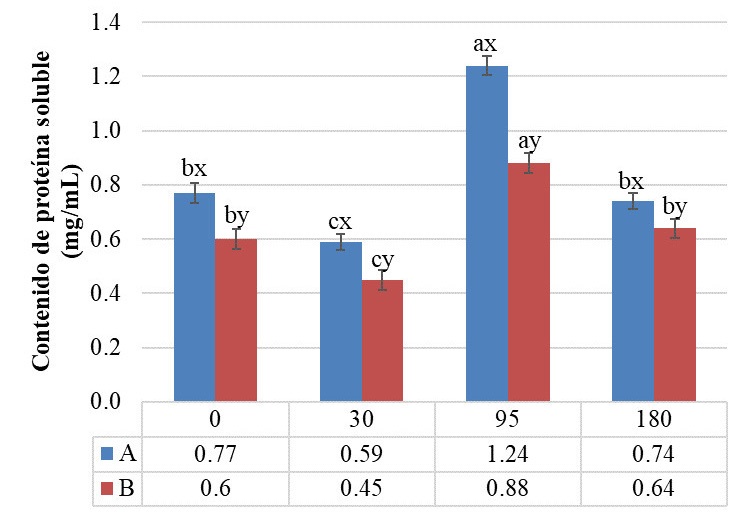
Figure 5: Soluble protein (mg/mL,) in extracts of añejo Zacazonapan cheese during ripening. The results are reported as mean values (± standard error) with a significant difference (DMS, p ≤ 0.05) for the cheese-ripening time interaction. The letters a, b and c indicate difference between times; x, y indicate difference between cheeses.
Grado de hidrólisis de proteínas
El grado de hidrólisis presentó diferencia significativa (p ≤ 0.05) con respecto al tiempo de maduración, siendo de 7.43 y 6.44 % a los 95 y 180 d de maduración, respectivamente (Figura 6). Esta tendencia al incrementó en el grado de hidrólisis de proteínas durante la maduración ha sido reportado en queso de cabra (Espinosa-Pesqueira et al., 2018) y en queso Gouda (Álvarez et al., 2022).
El incremento presentado en la proteólisis del queso añejo de Zacazonapan se considera bajo, por encontrarse en un intervalo del 1 al 10 % (Vioque et al., 2001). En queso Cotija se ha reportado un grado de hidrólisis inicial de 7.89 % y en el transcurso de 90 d se incrementó a un 25 %. Cabe destacar que, este comportamiento se asocia con factores referentes al procesamiento del queso, como la aplicación de tratamiento térmico, adición de cultivos iniciadores, uso de leche cruda y la maduración (Aguilar-Toalá et al., 2022). En específico, la microbiota presente en cada tipo de queso impacta la actividad enzimática; particularmente, porque utiliza a las proteínas como fuente de nitrógeno y genera la liberación de péptidos y aminoácidos a partir de la matriz proteica para garantizar su crecimiento (Matar et al., 1996; Aguilar-Toalá et al., 2022; Turan y Durak, 2022).
Actividad antioxidante
Captación del radical libre DPPH
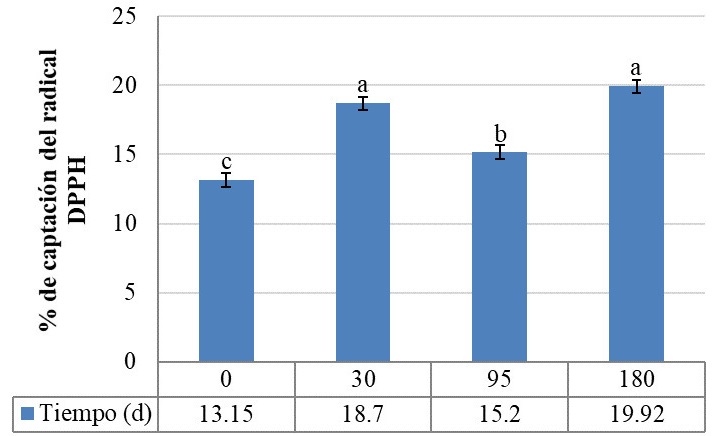
La capacidad antioxidante de los extractos acuosos por captación del radical libre DPPH se muestra en la figura 7, el análisis estadístico indicó diferencia significativa (p ≤ 0.05) respecto al factor tiempo de maduración, siendo los quesos con 30 y 180 d los que presentaron los mayores porcentajes (18.70 y 19.92 %, respectivamente). Este porcentaje es superior al reportado en queso Gouda, el cual inició con 6 % y tuvo un incrementó de 0.6 unidades al concluir los 90 d de maduración, los autores argumentan que la estructura de los aminoácidos presentes en los péptidos no permitió la captación del radical DPPH (Álvarez et al., 2022). Un comportamiento similar fue reportado en queso Domiati, cuya capacidad de captar el radical DPPH alcanzó un máximo a los 45 d y decreció a los 90 d de maduración (Taha et al., 2020).
Öztürk y Akin (2018) señalan que la capacidad antioxidante se incrementa al transcurrir el tiempo de maduración, en el caso de queso Tulum al día 0 se observó un 13.25 % y al cabo de 120 d el porcentaje de captación del radical DPPH fue de 30.96 %. Por otro lado, Yang et al. (2021) han reportado en queso Cheddar un incremento de la capacidad antioxidante a los 5 meses de maduración (55.9 %) y un posterior decremento a los 9 meses (48.53 %). Este comportamiento se asocia con la proteólisis generada durante la maduración, en la cual los péptidos se liberan, acumulan y finalmente se degradan a aminoácidos, por lo que durante una maduración prolongada pueden generarse fragmentos peptídicos sin actividad biológica (Öztürk y Akin, 2021a; Baptista y Gigante, 2020).
Capacidad de absorción de radicales de oxígeno (ORAC)
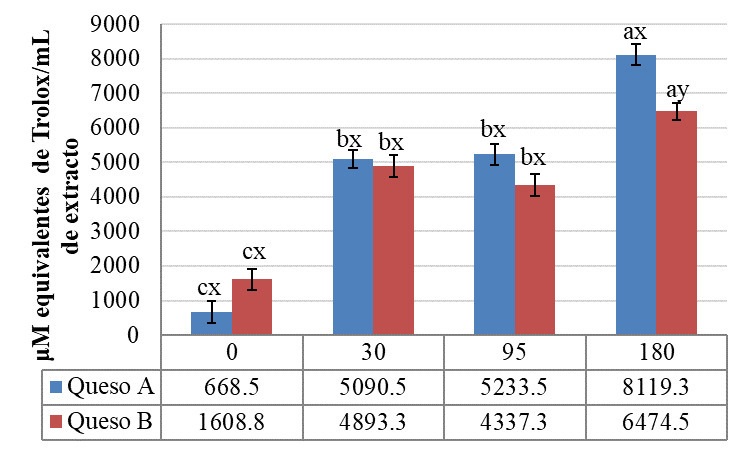
La capacidad de absorción de radicales peroxilo (ROO·) presente en los extractos solubles del queso añejo de Zacazonapan se muestra en la Figura 8, el análisis estadístico mostró una diferencia significativa (p ≤ 0.05) respecto a la interacción de factores queso-tiempo de maduración. El método utilizado para determinar la actividad antioxidante presenta un comportamiento similar a lo reportado previamente en la captación del DPPH. La capacidad de absorber radicales peroxilo de los péptidos presentes en los extractos fue de 668.5 y de 1608.8 µM equivalentes de trolox/ mL de extracto al tiempo 0, para los quesos A y B, el cual aumentó a los 180 d hasta 8119.3 y 6474.5 µM equivalentes de trolox/mL de extracto, respectivamente. Estos valores son superiores a los reportados para queso crema de Chiapas (185.6 - 311.1 µM equivalentes de trolox/mL de extracto), queso fresco (158.8 - 176.1 µM equivalentes de trolox/mL de extracto soluble) y queso cocido (159.0 - 23.9 µM equivalentes de trolox/mL de extracto soluble), con menor tiempo de maduración entre 10 - 20 d (Aguilar-Toalá et al., 2022). Adicional a la dinámica de los péptidos durante el transcurso de la maduración, Hernández-Ledesma et al. (2005) señalan una elevada actividad antioxidante de péptidos obtenidos a partir de hidrolizados de α-lactoalbumina y β-lactoglobulina, relacionada con la presencia de aminoácidos tales como el Trp, la Tyr y la Cys, los cuales son donantes de hidrógeno para los radicales ROO·. Los primeros dos aminoácidos promueven la formación de radicales indoílo y fenoxilo más estables, mientras que la Met puede ser oxidada a sulfóxido de Met.
Figura 8 Capacidad de absorción de radicales de oxígeno. Los resultados se reportan como valores promedio (± error estándar) con diferencia significativa (DMS, p ≤ 0.05) respecto para la interacción queso-tiempo de maduración. Las letras a, b y c indican diferencia entre tiempos; x, y indican diferencia entre quesos.
Perfil flash del queso añejo de Zacazonapan
A partir del análisis estadístico se seleccionaron 10 atributos para describir las muestras y 15 panelistas, por su capacidad de discriminación entre muestras, expresada en el mayor número de variables de respuesta significativas. El análisis de componentes principales (ACP) indicó que, la variabilidad total que explican los dos primeros componentes fue de 89.13 %, en el componente uno (CP1, 67.04 %) las cargas más importantes incluyeron a los atributos de pungencia o picor, sabor a queso madurado, firmeza o dureza y apariencia porosa. En el componente dos (CP2, 22.10 %) las cargas más importantes las presentaron los atributos de color amarillo, arenosidad o granulosidad, desmoronable (en boca), aroma a leche ácida (Cuadro 1).
Cuadro 1 Cargas de los atributos sensoriales para los dos primeros componentes principales (CP1 y CP2).
Table 1: Charges of sensory attributes for the first two principal components (PC1 and PC2).
| Atributo sensorial | CP1 | CP2 |
| Color amarillo | 0.607 | 0.791 |
| Apariencia porosa | 0.983 | -0.084 |
| Olor a pies | 0.970 | 0.103 |
| Aroma a leche ácida | 0.705 | 0.630 |
| Firmeza o dureza | 0.984 | 0.082 |
| Desmoronable (en boca) | 0.665 | -0.733 |
| Arenosidad o granulosidad | 0.618 | -0.775 |
| Sabor a queso madurado | 0.993 | 0.003 |
| Pungencia o picor | 0.995 | 0.076 |
| Sabor residual amargo | 0.974 | 0.216 |
Los atributos sensoriales como el aroma, sabor, color, textura y apariencia son factores determinantes en la aceptabilidad de los quesos madurados (Khattan et al., 2019). En la Figura 9 se observa la distribución de los quesos de acuerdo a los atributos consensuados, los quesos con una maduración de 180 d se asociaron con atributos como: sabor residual amargo, olor a pies, firmeza o dureza, pungencia o picor, sabor a queso madurado y apariencia porosa; características opuestas a los quesos frescos. Las características desarrolladas en sabor y aroma, durante la maduración, se asocian a la mezcla de compuestos volátiles y no volátiles producto de reacciones bioquímicas como la proteólisis, lipólisis y glicólisis (Khattab et al., 2019). En la proteólisis se liberan péptidos hidrofóbicos que se asocian al sabor amargo, y también se liberan aminoácidos que contribuyen al sabor dulce (Ala, Gly, Ser, Thr, Lys y Pro), ácido (Asp, Glu y Asn), amargo (His, Met, Val, Arg, Phe, etc.) y umami (glutamato y aspartato de sodio) en el queso (Fox et al., 2017).
Análisis de perfil de textura (APT)
El sabor y la textura del queso se ven afectados a medida que avanza la maduración, los resultados del análisis de varianza indican diferencia significativa (p ≤ 0.05) respecto a la interacción queso-tiempo de maduración para los parámetros dureza, adhesividad, elasticidad y masticabilidad (Cuadro 2). La mayor dureza se alcanzó a los 180 d, siendo de 8.82 N para el queso B y de 11.13 N para el queso A. Estos quesos se caracterizaron por un menor contenido de humedad y mayor contenido de proteína, lo cual se asocia con una microestructura de las redes proteicas más ramificada, más densa y con mayor grado de reticulación (Enab y Abd, 2012). Este incremento en la dureza fue observado en el queso Tulum, a los dos primeros días de maduración presentó una fuerza de 1456.35 N, la cual aumentó a 3303.64 N, a los 90 d (Tomar et al., 2020). A diferencia del queso Cheddar, en el cual la dureza disminuyó de 15.69 a 8.15 N en un tiempo de 90 d, debido a las condiciones y características de su proceso, por ejemplo, una humedad adecuada permite que el agua se una a la red de caseína y mantenga una buena textura en el queso tipo Cheddar, si la humedad es alta causaría una disminución de la viscosidad y la dureza del queso (Hickey et al., 2018; Zhao et al., 2019).
Cuadro 2 Dureza, adhesividad, elasticidad y masticabilidad del queso añejo de Zacazonapan con diferencia significativa (p ≤ 0.05) respecto a la interacción de factores queso y tiempo de maduración.
Table 2: Hardness, adhesiveness elasticity and chewiness of añejo Zacazonapan cheese with significant difference (p ≤ 0.05) for interaction of cheese and ripening time factors.
| Parámetro | Queso | Tiempo de maduración (d) | |||
| 0 | 30 | 95 | 180 | ||
| Dureza (N) | A | 1.47 ± 0.35dzxw | 2.61 ± 0.35cx | 6.78 ± 0.35bx | 11.13 ± 0.28ax |
| B | 1.33 ± 0.35dx | 2.47 ± 0.35cx | 6.85 ± 0.35bx | 8.82 ± 0.35ay | |
| Adhesividad (N·s) | A | -0.02 ± 0.02cx | -0.10 ± 0.02bx | -0.22 ± 0.01ax | -0.22 ± 0.01ax |
| B | -0.005 ± 0.02ax | -0.03 ± 0.02ay | -0.04 ± 0.02ay | -0.01 ± 0.02ay | |
| Elasticidad | A | 0.23 ± 0.05cx | 0.40 ± 0.05bx | 0.49 ± 0.05abx | 0.63 ± 0.05ax |
| B | 0.50 ± 0.05ay | 0.54 ± 0.05ax | 0.45 ± 0.05ax | 0.48 ± 0.05ax | |
| Masticabilidad | A | 0.26 ± 0.11cx | 0.42 ± 0.11bx | 1.27 ± 0.11abx | 1.42 ± 0.11ax |
| B | 0.28 ± 0.11ay | 0.34 ± 0.11ax | 0.44 ± 0.11ax | 0.48 ± 0.11ax | |
zMedias ± error estándar seguidas con distinta letra (a, b, c, d) en fila indican diferencia estadística entre tiempos (DMS, p ≤ 0.05).
zMeans ± standard error with different letters (a, b, c, d) in a row indicate statistical difference between cheeses (DMS, p ≤ 0.05).
La adhesividad fue mayor en el queso A con - 0.22 N·s a los 95 y 180 d de maduración, mientras que el queso B no presentó diferencia significativa durante el transcurso de la maduración. Por otra parte, la elasticidad del queso A fue de 0.23 al inicio de la maduración e incremento 0.4 unidades a los 180 d (0.63). Otra variable textural importante para el consumidor es la masticabilidad (Lamichhane et al., 2018), en la cual ambos quesos presentaron un aumentó al concluir los 180 d de maduración, siendo de 1.42 y 0.48 para los quesos A y B, respectivamente. Hernández-Morales et al. (2010) relacionan valores menores en elasticidad, dureza y masticabilidad con un alto contenido de grasa en quesos de Zacazonapan con 23 a 27 d de maduración.
Respecto a la cohesividad, el análisis estadístico señaló diferencia significativa (p ≤ 0.05) para los factores queso y tiempo de maduración. La mayor cohesividad se observó en el queso A (0.32 N), mientras que al finalizar la maduración este atributo sensorial decreció 0.28 unidades respecto al tiempo 0 (Cuadro 3). Este comportamiento fue observado en queso Cheddar de dos años, el cual presentó menor cohesividad y elasticidad comparado con un queso Cheddar fresco, que exhibió mayor cohesividad y elasticidad, mediante determinaciones reológicas (Lamothe et al., 2012). En suma, el proceso de elaboración de un queso afecta las características sensoriales (aroma y sabor) y texturales del mismo (Aguilar-Toalá et al., 2022).
Cuadro 3 Cohesividad del queso añejo de Zacazonapan con diferencia significativa (p ≤ 0.05) para los factores queso y tiempo de maduración.
Table 3: Cohesiveness of añejo Zacazonapan cheese with a significant difference (p ≤ 0.05) for cheese and ripening time factors.
| Variable respuesta | Queso | |
| A | B | |
| Cohesividad | 0.32±0.013a | 0.20±0.014b |
| Medias ± error estándar con distinta letra (a, b) en fila indican diferencia estadística entre quesos (DMS, p ≤ 0.05). Means ± standard error with different letters (a, b) in a row indicate statistical difference between cheeses (DMS, p ≤ 0.05). | ||
| Tiempo de maduración (d) | Cohesividad | |
| 0 | 0.43 ± 0.02a | |
| 30 | 0.28 ± 0.02b | |
| 95 | 0.19 ± 0.02c | |
| 180 | 0.15 ± 0.02c | |
| Medias ± error estándar con distinta letra (a, b, c) en columna indican diferencia estadística entre tiempos (DMS, p ≤ 0.05). Means ± standard error with different letters (a, b, c) in column indicate statistical difference between times (DMS, p ≤ 0.05). | ||
Conclusiones
El queso añejo de Zacazonapan mostró cambios fisicoquímicos durante los 180 d de maduración, los cuales se relacionan con los principales componentes del queso (humedad, proteína y grasa). El incremento en la cantidad de proteína soluble en los extractos acuosos del queso y el porcentaje de grado de hidrólisis, son evidencia de la proteólisis llevada a cabo en el periodo de maduración. Este proceso bioquímico generó péptidos con la capacidad de donar electrones al radical libre DPPH o átomos de hidrógeno a los radicales peroxilo (ROO·), haciéndolos moléculas estables y menos perjudiciales (ruptura de la reacción en cadena del radical) para las biomoléculas. Cabe destacar, que este es el primer reporte de péptidos con actividad antioxidante en el queso añejo de Zacazonapan.
Por otra parte, el perfil flash permitió diferenciar entre quesos frescos (0 d) y madurados (180 d) con base en los atributos consensuados por el grupo de panelistas. En este sentido, los atributos sensoriales que describieron al queso añejo de Zacazonapan con 180 d de maduración fueron sabor residual amargo, olor a pies, firmeza o dureza, pungencia o picor, sabor a queso madurado y apariencia porosa. Además, estos quesos presentaron mayor dureza y masticabilidad que los quesos frescos.
La información generada en la presente investigación permitió describir al queso añejo de Zacazonapan desde un ámbito fisicoquímico, bioactivo, sensorial y textural. Este conocimiento abre la posibilidad a los productores para mejorar su proceso de elaboración, resaltar las características sensoriales y el potencial bioactivo de su producto. Así mismo, esta información contribuye a la tipicidad y revalorización del queso, lo cual podría impactar de manera positiva a la cadena agroalimentaria que este sustenta, y a su vez al desarrollo económico rural y regional.











 nueva página del texto (beta)
nueva página del texto (beta)