Introducción
La lignina esta presente en varias regiones de la pared celular de las plantas y es considerada un heteropolímero aromático ramificado, aleatoriamente formado por unidades de fenilpropano. Recientemente, investigaciones relacionadas con la transformación química y biológica de residuos agrícolas en productos de alto valor están dirigiendo la atención a compuesto como la lignina (Ragauskas et al., 2014). Esto se debe a que la conversión de residuos agrícolas en productos finales implica necesariamente la remoción de dicho compuesto. Por ejemplo, para obtener combustibles celulósicos, la separación de la lignina del resto de los componentes de la biomasa es un paso obligatorio. Comúnmente, la industria papelera y las biorrefinerías generan grandes cantidades de lignina como subproductos de sus procesos, pero estas son quemadas para producir energía de bajo costo (Zakzeski et al., 2010). Numerosas investigaciones han propuesto el uso de estas ligninas en diversas aplicaciones, e.g., en resinas fenólicas sustituyendo el fenol químico por el fenol de la lignina (Ghorbani et al., 2016), como un adhesivo natural para medicinas, alimentos y textiles (Mattinen et al., 2018), como materia prima para la fabricación de fibras de carbono (Qu et al., 2021) y como antioxidante de polímeros termoplásticos (Pouteau et al., 2003).
Por otro lado, los materiales lignocelulósicos no convencionales como vainas, cáscaras, frutos secos o malezas están recibiendo mucha atención como fuente de polímeros lignocelulósicos. El lirio acuático (Eichhornia crassipes), una maleza acuática invasora de lagos y ríos ha sido ampliamente explorada como materia prima para la elaboración de biocombustibles (Rezania et al., 2017) ya que contiene una cantidad considerable de lignina (Lara-Serrano et al., 2016). Sin embargo, hasta el día de hoy no existen investigaciones sobre la extracción y caracterización de la lignina obtenida a partir de estas plantas.
Otro material lignocelulósico altamente abundante son las cáscaras de la nuez pecanera (Carya illinoinensis) que se obtienen en grandes cantidades a partir del descascarado de nueces. El procesamiento de dichas nueces descarta del 40 al 50 % de su peso siendo la cáscara este desecho. Las cáscaras de nuez pecanera tienen poco valor económico y su eliminación es costosa. Sin embargo, recientemente se ha reportado que los extractos o infusiones alcohólicas a partir de la cáscara de nuez pecanera poseen actividad antioxidante y antibacteriana (Pinheiro do Prado et al., 2009; Prado et al., 2013). Algunas investigaciones han reportado la extracción de lignina a partir de cáscaras de frutos secos (Quesada-Medina et al., 2010) mientras que la cáscara de nuez pecanera no se ha estudiado para este propósito. Generalmente la extracción de los compuestos fenólicos a partir de cáscaras de frutos secos se realiza utilizando alcoholes como solventes, no obstante, estos logran bajos rendimientos de extracción. En contraste, el uso de ácidos orgánicos (proceso organo-solv) se ha aplicado ampliamente para remover lignina de varias biomasas lignocelulósicas con resultados favorables. El proceso organosolv tiene la capacidad de separar y obtener de forma individual celulosas, hemicelulosas y ligninas, además de que los ácidos orgánicos utilizados pueden recuperarse y reutilizarse. Las ligninas aisladas utilizando ácidos orgánicos (denominada lignina organosolv) tienen mayor pureza que las obtenidas mediante otros procesos químicos (Espinoza-Acosta et al., 2014). Además, la lignina obtenida por el proceso organosolv es altamente soluble en varios solventes orgánicos. Su pureza, actividad antioxidante y alta capacidad de solubilizarse puede ser útil en aplicaciones como adhesivos, resinas fenólicas, antioxidantes y como protector UV de materiales termoplásticos. En este sentido, el objetivo de este trabajo fue la extracción y caracterización de dos materias primas lignocelulósicas no convencionales como fuentes potenciales para la obtención de lignina con propiedades antioxidantes.
Materiales y métodos
Materiales y reactivos
Las plantas de lirio acuático (Eichhornia crassipes) fueron colectadas en el río Mayo en Navojoa, Sonora, México (27º6’11’’N y 110º33’50’’O) mientras que las cáscaras de nuez (Carya illinoinensis) fueron donadas por una productora de nueces local. Para la eliminación de las impurezas las muestras fueron lavadas con agua destilada y se llevaron a sequedad a 60 °C por 24 horas. Las raíces de las plantas de lirio acuático fueron removidas para obtener solamente las hojas y los tallos. Tanto el lirio acuático como las cáscaras de nuez se trituraron en un molino de cuchillas (Fritsch Pulverisette, Alemania) y se pasaron a través de una malla de 2 mm. Las muestras molidas fueron colocadas en bolsas de polipropileno para su posterior análisis. Los reactivos y solventes utilizados para el desarrollo de este estudio fueron grado analítico (i. e., J.T. Baker, FagaLab, Química Meyer y Sigma-Aldrich)
Composición de las materias primas
Las muestras molidas de lirio acuático y cáscaras de nuez pecanera se caracterizaron de acuerdo con los métodos estandarizados de la Asociación Técnica de la Industria del Papel y la Pulpa (TAPPI). Determinación de ceniza (TAPPI T 211 om-16), compuestos extraíbles (TAPPI T 204 cm-07) usando hexano-etanol (60:30 v/v) en lugar de benceno, lignina insoluble en ácido (TAPPI T 222 om-11), y se realizaron determinaciones del contenido de hemicelulosa y celulosa (Wise et al., 1946).
Extracción de lignina
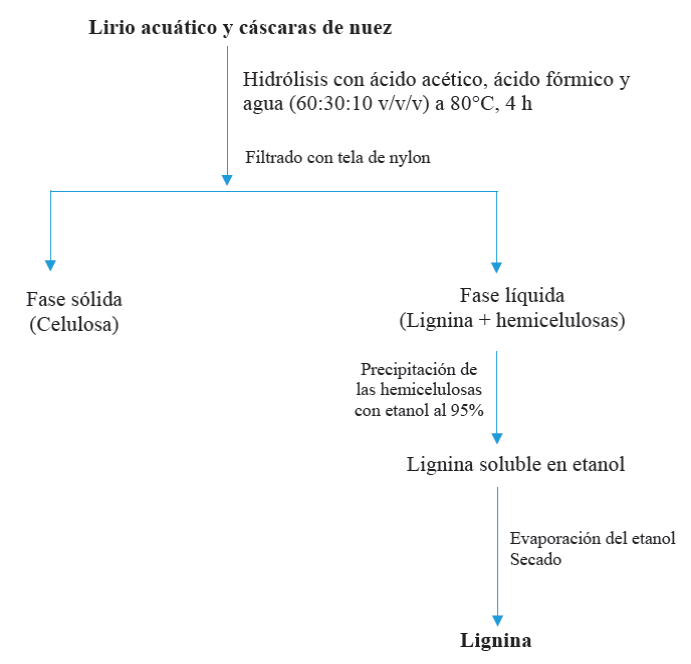
La extracción de la LCN y la LLA se realizó siguiendo la metodología organosolv reportada por Xu et al. (2006). Para extraer la lignina de manera separada el lirio y las cáscaras de nuez molidas fueron sometidos a hidrólisis con una mezcla de ácido acético (AC), ácido fórmico (AF) y agua destilada (AD) (AC/AF/AD 60:30:10 v/v/v relación 1:10 p/v) durante 4 horas. El diagrama general del proceso de extracción de la lignina se muestra en la Figura 1. El rendimiento de extracción de lignina se expresó en porcentaje del peso de la biomasa lignocelulósicas.
Técnicas de caracterización fisicoquímica de lignina Microscopía electrónica de barrido (MEB). La morfología de la lignina se analizó utilizando MEB (JEOL JSM-5800 LV, Tokio, Japón). El microscopio electrónico estaba equipado con un detector para electrones secundarios y retrodispersos a una aceleración del voltaje de 15 kV. Antes de obtener las imágenes las muestras de lignina fueron recubiertas con una capa de oro.
Espectroscopía de rayos X de energia dispersiva (EDS)
El análisis EDS detecta señales de todos los elementos presentes en el material y proporciona un analisis cualitativo. Para dilucidar la composición elemental de las ligninas obtenidas previamente, se empleo MEB equipado con un espectrometro de dispersion de energia. Se rocio cuidadosamente una capa fina de lignina en una cinta de carbono de doble cara montada en porta muestras de aluminio. Todas las muestras se recubrieron con pulverizacion catodica y se utilizó un microscopio electronico de barrido (JEOL JSM-5800 LV, Tokio, Japon) equipado con un detector de electrones retro-dispersados en modo de bajo vacio. Cada muestra de lignina se caracterizo examinando todas las particulas observadas dentro de la imagen completa.
Espectroscopia de infrarrojo por transformada de Fourier.
Los espectros de infrarrojo de las ligninas se obtuvieron en un espectrometro (Perkin Elmer® Spectrum Sistem GX FTIR). Muestras de alrededor de 10 mg de lignina fueron mezcladas con KBr (Aldrich Chemicals, Milwaukee, WI) y se prensaron hasta obtener pellets delgados y transparentes. Las muestras fueron analizadas y las señales de FT-IR se recolectaron en un rango de 4000 y 400 cm-1 y se registraron en el modo de transmitancia como función del número de onda.
Análisis termogravimétrico
El porcentaje de pérdida de peso de las muestras como función de la temperatura fue medido por análisis termogravimétricos utilizando un equipo TGA (TA STD Q500 New Castle, DE EE.UU.). Aproximadamente 3 mg de cada lignina fueron calentadas de 25 a 800 °C con un incremento de temperatura de 10 °C/minutos bajo una atmósfera de aire a una velocidad de flujo de 50 mL/minutos.
Actividad antioxidante
Preparación del extracto. Se preparó una solución de cada tipo de lignina usando metanol como disolvente en una relación 1:10 p/v, la cual se obtuvo por agitación durante 10 minutos (Burrell Scientific Wrist Action, modelo 75, Pittsburgh, Pennsylvania, U.S.A.) y posteriormente se centrifugo por 10 minutos a 10000 g a 25ºC (ThermoFisher Scientific, modelo Heraeus Primo R, USA). El sobrenadante (fracción soluble de lignina) se decanto y se llevó a sequedad a 40 ºC por 24 h. Con la lignina previamente seca se preparó la solución stock, de la cual se tomó una alícuota de 20 μL (con concentración de 250 μg/mL) para determinar la actividad antioxidante.
Radical DPPH. La actividad antioxidante se determino siguiendo el metodo de Brand-Williams et al. (1995) con algunas modificaciones. La medición consistió en evaluar el descenso de la absorbancia del radical libre 2,2-difenil-1-picrilhidrazil (DPPH) en presencia de los extractos de las ligninas. El radical se preparó de la siguiente manera, se pesaron 2.5 mg del radical DPPH y se disolvieron en 100 mL de metanol absoluto hasta obtener una absorbancia de 0.7 ± 0.02 a 515 nm. Para el análisis, 20 μL de cada extracto se mezclaron con 200 μL de DPPH, se dejaron reposar durante 30 minutos antes de medir su absorbancia a 515 nm. Los resultados fueron expresados como porcentaje de actividad secuestrante de radical.
Radical ABTS. Para la medición de la actividad antioxidante por medio de la captación del radical ácido 2,2´-azino-bis(3-etilbenzotiazolin)-6-sulfónico (ABTS) se siguió la metodología propuesta por Re et al. (1999) con modificaciones. Para la preparación de la solución madre del radical fueron pesados 19.3 mg de ABTS y se disolvieron en 5 mL de agua destilada. Por separado se pesaron 0.0378 g de persulfato de potasio (K2S2O8) y se agregó 1 mL de agua. De esta solución se tomaron 88 μL y se añadieron a la solución de radical. Enseguida se homogenizó y se dejó reposar en oscuridad durante 16 h a temperatura ambiente. Para la preparación de la solución de trabajo, se tomó 1 mL de la solución del radical y se diluyó con etanol absoluto hasta obtener una absorbancia de 0.7 ± 0.02 unidades a 734 nm. Para la medición de la actividad antioxidante, se tomaron 20 μL de cada extracto y se mezclaron con 200 μL del radical. Enseguida se incubó por 30 minutos a 25 °C en ausencia de luz antes de tomar la lectura a 743 nm. Los resultados se reportaron como porcentaje de inhibición de la misma forma que el radical DPPH.
Resultados y discusión
Composición de la materia prima
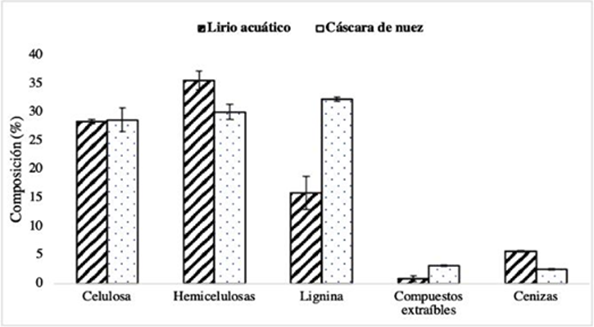
Conocer la composición química de nuevas materias primas es información necesaria para poder dar un uso efectivo a estas biomasas. La composición química de la planta de lirio acuático y la cáscara de nuez fue obtenida siguiendo las técnicas de la TAPPI y los resultados se muestran en la Figura 2. Como en toda biomasa lignocelulósica en ambas materias primas los polímeros más abundantes son la celulosa, la hemicelulosa y la lignina. Además, se detectó la presencia de componentes minoritarios como compuestos lipídicos y cenizas en cantidades menores al 5 %. Se ha reportado que las plantas de lirio acuático son abundantes en celulosas y hemicelulosas y en menor medida están constituidas por lignina (Guragain et al., 2011).
Investigaciones previas han establecido que el contenido de celulosa y hemicelulosa para el lirio acuático se encuentra en un rango de 25 a 50 % (Ahn et al. 2012), el contenido de hemicelulosas puede variar desde 17 hasta 40 % (Nigam 2002; Cheng et al. 2014), y para la lignina los valores oscilan desde un 2.8 % hasta 32 % (Chanakya et al., 1993; Mukherjee and Nandi 2004; Girisuta et al., 2008; Ma et al., 2010). En este estudio el porcentaje de lignina de las plantas de lirio fue de 15.9 %, este valor se encuentra dentro de los rangos reportados anteriormente. Das et al. (2016) concluyeron que la variación en la composición lignoce-lulósica en las plantas de lirio acuático está relacionado a factores como su localización geográfica, las condiciones de crecimiento y la madurez de la planta. El lirio es una planta herbácea perenne y el contenido de lignina presente en este tipo de plantas (clasificadas como hierbas) puede variar entre 5 y 15 % (Abbasi and Abbasi 2010). El porcentaje de lignina del lirio utilizado en este estudio puede ser comparable con porcentaje de lignina presente en el olote de maíz e incluso más alto que el reportado para algunos pastos (Abbasi and Abbasi 2010). El bajo contenido de lignina en el lirio acuático supone una ventaja para su uso como sustrato para la elaboración de combustibles celulósicos (Ruan et al., 2016; Zhang et al., 2016).
Al comparar el contenido de lignina de las materias primas analizadas en este estudio, se encontró que el porcentaje de lignina en las cáscaras de nuez pecanera fue el doble que el encontrado en las plantas de lirio (Figura 2). Se ha reportado anteriormente que las cáscaras de frutos secos de la familia de nueces contienen grandes cantidades de lignina. Jahirul et al. (2012) reportaron que las cáscaras de avellanas, almendras, nuez persa y nuez pecanera contienen desde 20 hasta 52 % de lignina. En este estudio el porcentaje de lignina en las cáscaras de nuez pecanera fue superior al 30 %, coincidiendo con valores obtenidos en otras investigaciones (Li et al., 2018).
El lirio acuático y las cáscaras de nuez pecanera son materiales lignocelulósicos altamente abundantes, renovables y de bajo costo de los cuales se pueden obtener polímeros de interés para la industria de los combustibles celulósicos como el etanol. Durante la elaboración del etanol lignocelulósico, un paso primordial es la remoción de la lignina para mejorar la accesibilidad de la celulosa para su futura conversión en alcohol. De tal manera que el uso del lirio acuático como materia prima para obtener biocombustibles también podría generar cantidades significativas de lignina, lo cual puede ser importante para lograr una completa valorización de esta maleza acuática (Muktham et al., 2016). Con respecto a la LCN esta ha encontrado aplicaciones en el campo de los biomateriales como relleno reforzante de materiales compuestos, compatibilizante de materiales termoplásticos e ingrediente bioactivo con capacidad anti-oxidante debido al alto contenido de compuestos fenólicos (Leon-Bejarano et al., 2020).
Rendimiento de extracción
En este estudio se llevó a cabo la extracción de lignina de dos biomasas lignocelulósicas altamente abundantes en el estado de Sonora, pero poco investigadas para este fin. La extracción de lignina se realizó empleado un procedimiento organosolv utilizando AC/AF/AD. Durante el proceso organo-solv el polímero de la lignina se rompe en partes pequeñas, se disuelve en la biomasa lignocelulósica y se separa en forma de un licor rico en compuestos fenólicos (Ruiz et al., 2011). Dentro de las ventajas que presenta el uso de ácidos orgánicos para remover lignina se encuentra un mayor rendimiento de extracción comparado con otros procesos utilizados para la remoción de lignina (Xu et al., 2006). Además, los solventes utilizados pueden recuperarse y reutilizarse.
El rendimiento de extracción de lignina de las biomasas evaluadas después del tratamiento con AC/AF/AD se presentan en la Tabla 1. Se puede observar que el rendimiento de extracción fue mayor para la cáscara de nuez pecanera (29 %) en comparación con las plantas de lirio acuático (15 %). Estos resultados concuerdan con lo reportado en la Figura 2, donde se muestra que existe mayor porcentaje de lignina en las cáscaras de nuez que en el lirio acuático. Durante el proceso organosolv, los ácidos orgánicos impregnan los tejidos de la biomasa; luego, se produce la ruptura de los enlaces lábiles a los ácidos. Al final de este proceso la lignina y la hemicelulosa son solubilizadas, quedando un residuo sólido constituido fundamentalmente por celulosa. Después de un proceso de purificación para remover las hemicelulosas, la lignina puede recuperarse en estado sólido como un polvo color café oscuro altamente abundante en compuestos fenólicos.
En general, el uso de ácidos orgánicos permite obtener gran rendimiento de lignina, aunque algunas variables del proceso pueden tener impacto en el rendimiento de extracción. Tales variables son el tiempo de extracción, la concentración de los solventes, la relación sólido-líquido, el uso de catalizadores, la temperatura y el tipo de biomasa (Shui et al., 2016; Qin et al., 2021).
Caracterización fisicoquímica de las ligninas
Morfología y análisis elemental. La morfología y la composición elemental de LLA y LCN se estudió mediante análisis de microscopio electrónico de barrido (SEM). Las imágenes SEM, Figura 3A y 3B muestran que LLA y LCN presentan morfología con formas poco definidas, aparentando partículas rocosas con diferentes tamaños, superficies lisas, continuas y sin grietas. LLA muestra una morfología con una mayor distribución de tamaños de partícula que LCN. Como se puede observar, la extracción de lignina utilizando el método organosolv produce partículas de lignina con superficies continuas. Por el contrario, el proceso Kraft para la obtención de ligninas da como resultado partículas solidas de lignina con formas redondeadas o semiesféricas con muchos volúmenes abiertos sobre la superficie rugosa. Dicha morfología es el resultado del proceso de concentración para obtener la lignina del licor de cocimiento (Pua et al., 2011). A diferencia de la lignina organosolv, la lignina Kraft se obtiene a partir de plantas leñosas utilizando una solución de hidróxido de sodio y sulfuro de sodio a temperaturas y presiones elevadas, lo cual produce fragmentación de las partículas de lignina.
Respecto a la composición elemental de LCN y LLA, ambas ligninas destacan por su alto contenido de carbono; no obstante, LLA presentó un mayor porcentaje comparado con LCN. La estructura del polímero de lignina está constituida por grupos funcionales a base de carbono y por enlaces de tipo carbono-carbono, carbono-hidrógeno y carbono-oxígeno. Otros elementos como el azufre, el silicio, el aluminio y el potasio fueron también detectados por análisis EDS (Tabla 2). Tales elementos aparecen por debajo del 0.5 % y son resultado principalmente de trazas de cenizas que quedan en la lignina provenientes de la biomasa de extracción (lirio acuático y cáscara de nuez). Generalmente el contenido de carbono en la lignina puede variar entre 50 y 75 %. Köhnke et al. (2019) reportaron el análisis elemental para varios tipos de ligninas. Ellos encontraron que la lignina organosolv, la Kraft y la alcalina presentaron alrededor del 60 % de contenido de carbono, mientras que la lignina conocida como lignosulfonato presentó un menor porcentaje. En este estudio, el alto contenido de carbono encontrado tanto en LCN y LLA demuestran que pueden ser una materia prima apropiada para la elaboración de fibras de carbono.
Espectroscopia infrarroja con transformada de Fourier (FTIR). La espectroscopia de infrarrojo es un método no destructivo ampliamente utilizado para analizar de manera rápida y sencilla la vibración de los enlaces de los grupos funcionales presentes en ligninas. El espectro de infrarrojo de ambas ligninas organosolv (LCN y LLA) se muestra en la Figura 4. De manera general, se observan las bandas características del espectro de infrarrojo para el polímero de lignina, aunque el rango y agudeza de las bandas varían ligeramente dependiendo del tipo de lignina. En la Tabla 3 aparecen las principales señales detectadas en LCN y LLA, así como los grupos funcionales a las que pertenecen. La banda que aparece a los 3336 cm−1 corresponden al estiramiento de los grupos -OH fenólicos presentes en todas las ligninas. Mientras que la banda detectada alrededor de 2910-2948 cm−1 es atribuida al estiramiento C-H en grupos metileno y metoxilo los cuales forman parte del anillo aromático de la lignina. Las bandas observadas en el rango de los 1700 cm−1 indican la presencia de grupos carbonilos no conjugados. Específicamente, las bandas a 1716 y 1711 cm−1 son atribuidas a la esterificación de los grupos fenol y alcoholes de la cadena de propano (Cα y Cγ) durante el proceso de extracción usando ácido acético y fórmico. La vibración del esqueleto aromático de ambas ligninas se registró en las bandas en el rango de 1508, 1529, y 1628 cm−1. Estas bandas presentaron mayor intensidad en LCN lo que podría indicar mayor grado de conjugación por efecto del tratamiento ácido. Resultados similares fueron obtenidos en estudios que extrajeron lignina de materias primas como la paja de trigo y la fibra de alfalfa sometidas a un proceso organosolv (Sun et al., 2000; Watkins et al., 2015). Igualmente, las señales a los 1300 y 1200 cm−1 indican la presencia de las unidades monoméricas siringil y guaiacil que conforman el polímero de lignina. Estos monómeros son importantes para la producción de compuestos aromáticos de alto valor agregado en la industria petroquímica, la cual utiliza comúnmente recursos fósiles como materias primas.
Tabla 3 Señales obtenidas por espectroscopia de infrarrojo por transformada de Fourier para LCN y LLA.
Table 3 Infrared spectroscopy signals obtained by Fourier transform for LCN and LLA.
| Número de onda (cm-1) | |||
|---|---|---|---|
| LCN | LLA | ||
| Estiramiento | -OH fenólicos | 3336 | 3338 |
| Estiramiento | C-H en grupos metileno y metoxilo | 2948 | 2926 |
| Estiramiento | C=O de grupos carbonilo aromáticos | 1720 | 1720 |
| C=C vibraciones del esqueleto aromático | 1592 | 1628 | |
| C=C vibraciones del esqueleto aromático | 1508 | 1508 | |
| Deformación | C-H en grupos metileno y metoxilo | 1451 | 1445 |
| Estiramiento | C=O de unidades siringil (S) | 1365 | 1367 |
| Estiramiento | C=O de unidades guaiacil (G) | 1221 | 1231 |
| Estiramiento | C-O en grupos éster | 1121 | ND |
| Deformación | C-H de unidades guaiacil (G) | 1027 | 1022 |
Lignina de lirio acuático (LLA). Lignina de cáscara de nuez (LCN)
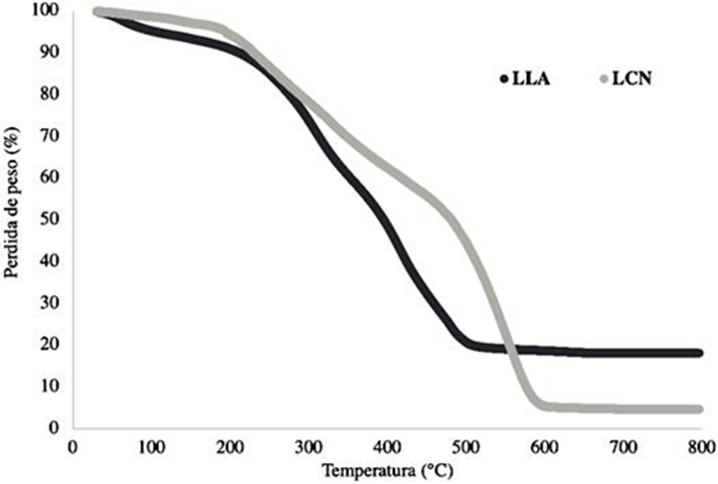
Comportamiento térmico. Con el objetivo de conocer la estabilidad térmica de LLA y LCN estás fueron evaluadas a través de análisis térmicos. El comportamiento térmico de las ligninas se muestra Figura 5 en forma de curvas termogravimétricas que representan la pérdida de peso de las ligninas en función del aumento de la temperatura. La estructura molecular de la lignina se compone principalmente de anillos aromáticos que tienen diversas ramificaciones y tipos de enlaces. La ruptura de estos enlaces químicos se lleva a cabo en un amplio rango de temperatura durante su degradación (desde 100 a 800 ° C) (Yang et al., 2007). En el termograma se pueden observar tres pérdidas de peso principales para ambas ligninas. La primera, corresponde a la evaporación gradual del agua adsorbida por las muestras, lo cual sucede alrededor de los 90 - 100 ºC. La segunda pérdida de peso se presenta en el rango de los 200 - 300 ºC y está relacionada con la degradación de las hemicelulosas presentes en las ligninas (Tejado et al., 2007). Esta pérdida de peso inició a una temperatura más baja en la LLA y puede estar relacionada con la presencia de un mayor contenido de hemicelulosa. En las plantas herbáceas como el lirio, las hemicelulosas y la lignina forman complejos, el tratamiento de extracción organosolv es capaz de romper los enlaces que mantienen unidos tales complejos, aunque siempre persisten pequeños remanentes de hemicelulosa incluso después del proceso de purificación de la lignina (Buranov and Mazza 2008).
La tercera pérdida de peso ocurrió en un rango de temperaturas desde 300 hasta los 600ºC en ambas ligninas. Por encima de los 300 °C sucede la ruptura de los enlaces β-O-4 que mantienen unido al polímero de lignina (Chu et al., 2013). Por encima de los 400 ºC se produce la descomposición de los anillos aromáticos y el rompimiento de los enlaces C-C en las cadenas alifáticas de la lignina. Seguido de la liberación de los grupos OCH3 de los anillos aromáticos a 550 ºC lo que lleva a la formación del residuo carbonoso (El Kaihal et al., 2018).
La pérdida de peso de la LLA inició a menor temperatura que para la LCN, sin embargo, el residuo carbonoso de LLA fue mayor (20 % en peso) que el que presentó LCN (~5 % en peso). Esto se debe a que la LLA tiene mayor resistencia a altas temperaturas, ya que entre los 500 a 800 ºC, el porcentaje en peso de la LLA se mantuvo estable. La presencia de altos remanentes de residuo carbonoso está relacionada con una mayor estabilidad térmica del polímero de lignina.
Actividad antioxidante
La lignina es un polímero aromático que contiene una gran cantidad de compuestos fenólicos que le permiten actuar como antioxidante. Los resultados de la actividad antioxidante de LLA y LCN expresada como porcentaje de inhibición de los radicales DPPH y ABTS se muestran en la Tabla 4. La capacidad para inhibir a los radicales se estudió para cada tipo de lignina en 3 sistemas de solventes: etanol, metanol, etanol-metanol (50:50 v/v). De acuerdo con el análisis de varianza, tanto el tipo de lignina como el tipo de solvente presentaron un efecto significativo en la inhibición de los radicales DPPH y ABTS (p< 0.0001). De manera general, la LCN mostró un mayor porcentaje de inhibición en ambos radicales en comparación con la LLA. Del mismo modo, se observó que la mayor actividad inhibitoria en las ligninas estudiadas se encontró en la fracción soluble en la mezcla etanol-metanol (50:50 v/v) seguido de la fracción soluble en metanol.
Table 4 Antioxidant activity of LCN and LLA against DPPH and ABTS radicals.
| Solvente | DPPH (%) | ABTS (%) | |
|---|---|---|---|
| Etanol | LLA | 5.70 ± 2.38 a | 3.05 ± 0.59 a |
| LCN | 20.65± 3.41 b | 12.60± 0.44 b | |
| Metanol | LLA | 18.32± 0.96 b | 12.52± 0.73 b |
| LCN | 66.08± 4.39 d | 46.40± 1.56 d | |
| Etanol/Metanol | LLA | 29.71± 1.19 c | 21.17± 0.65 c |
| 50:50 (v/v) | LCN | 86.20± 5.20 e | 56.36± 0.98 e |
Lignina de lirio acuático (LLA). Lignina de cáscara de nuez (LCN). Letras distintas en la misma columna indican diferencias significativas (p<0.05).
2,2-difenil-1-picrilhidrazilo (DPPH). Ácido 2,2’-azino-bis-(3-etillbenzotiazo-lin-6-sulfonico) (ABTS).
Sakagami et al. (2005) reportó que la eficacia de la lignina como antioxidante está relacionada con su estructura química y su solubilidad. Investigaciones previas muestran que la lignina de tipo organosolv es altamente soluble en etanol y metanol (Arshanitsa et al., 2013). Esto pude ser explicado por la teoría de Hildebrand (Quesada-Medina et al., 2010). La teoría menciona que los solventes orgánicos con mayor capacidad para solubilizar la lignina son aquellos con un parámetro de solubilidad de Hildebrand cercano a 22.5 MPa1/2 y el aumento de este valor da como resultado mayor solubilidad (Schuerch, 1952). Los parámetro de solubilidad que presentan el etanol y el metanol son de 26.2 y 36.2 MPa1/2 respectivamente.
La lignina es un polímero aromático con una estructura química compleja, que contiene gran cantidad de anillos aromáticos con grupos funcionales hidroxilo y metoxilos. Para la actividad antioxidante de la lignina, los grupos hidroxilo fenólicos libres y la sustitución ortometoxi en los anillos aromáticos es esencial. La presencia de estos grupos funcionales permite terminar reacciones de propagación de oxidación inducidas por el oxígeno y sus especies reactivas (Arshanitsa et al., 2013). En este trabajo se encontró que la LLA presentó menor capacidad antioxidante en comparación con la LCN. Dicho comportamiento podría deberse a una menor solubilidad de la LLA en los solventes evaluados, así como a la presencia de grupos hidroxilo alifáticos y polisacáridos como la hemicelulosa. Se ha reportado que la presencia de hemicelulosas tiene la capacidad de cambiar la polaridad de la lignina, lo cual disminuye la cantidad de sus compuestos fenólicos (Mahmood et al., 2018). Además, la presencia de hemicelulosa también puede disminuir la capacidad anti-oxidante de la lignina debido a la formación de enlaces de hidrógeno entre los carbohidratos y los grupos -OH fenólicos de la lignina que posteriormente interfieren con las propiedades antioxidantes (García et al. 2010; Dizhbite et al. 2004). Azadfar et al. (2015) estudiaron la actividad antioxidante en lignina organosolv de paja de trigo y encontraron 86.9% de inhibición del radical DPPH. En este trabajo, resultados similares en el porcentaje de inhibición del radical DPPH fueron encontradas en la fracción de LCN solubilizada en mezclas de etanol-metanol 50:50 v/v. Asimismo, LCN mostró un porcentaje de inhibición cercano a los encontrados en antioxidantes comerciales como el hidroxitolueno butilado (BHT), ácido ferúlico o el guayacol.
Las investigaciones realizadas sobre la actividad antioxidante de cáscara de nuez pecaneras concuerdan en que los principales componentes de estos residuos son el ácido clorogénico, taninos condensados, epigalocatequina, catequina galato, y ácido gálico (Prado et al., 2013). Tales compuestos han demostrado tener una actividad biológica antioxidante, y se ha encontrado mayor presencia de ellos en las cáscaras que en el fruto de la nuez (Villarreal-Lozoya et al., 2007; Pinheiro do Prado et al., 2009). En los resultados obtenidos (Tabla 4) se observó que la LCN mostró gran capacidad para inhibir los radicales DPPH y ABTS y dicha inhibición fue mayor cuando se usó mezcla de solventes. Kurek et al. (2018) reportaron alto contenido de compuestos fenólicos, taninos condensados y alta actividad antioxidante en extractos de cáscara de nuez comparado con extractos acuosos. La alta actividad antioxidante encontrada en la LCN indica que puede ser utilizada como materia prima para aplicaciones en la industria farmacéutica y alimentaria.
Conclusiones
Esta investigación presenta por primera vez la extracción de lignina de lirio acuático y cáscaras de nuez pecanera utilizando un proceso organosolv. Los resultados de la caracterización de las materias primas demostraron que el tratamiento de materiales lignocelulósicos no convencionales con ácidos orgánicos es efectivo para la separación de los principales componentes químicos. Bajo las condiciones establecidas en el proceso organosolv, el rendimiento de extracción fue considerablemente mayor para la LCN en comparación con la LLA. Ambas ligninas presentaron alto contenido de carbono y muy bajo contenido de impurezas de origen mineral. Los resultados de la espectroscopía de infrarrojo mostraron las vibraciones típicas de las estructuras químicas de ligninas extraídas utilizando solventes orgánicos. La LLA presentó mayor estabilidad térmica y mayor residuo carbonoso que la LCN. La LLA presentó excelentes propiedades de resistencia a la temperatura siendo estable térmicamente en el rango de 500 hasta 800 ºC. Finalmente, la LCN presentó una gran capacidad de inhibir los radicales DPPH y ABTS en los solventes evaluados, por encima de la LLA. Los resultados de este estudio sugieren la valorización potencial de dos residuos lignocelulósicos altamente abundantes los cuales se pueden separar efectivamente en sus principales polímeros y dar a estas moléculas una aplicación específica. Además, las cáscaras de nuez pecanera representan una fuente abundante y sostenible de compuestos fenólicos tales como ligninas y taninos con un gran potencial como antioxidantes.











 nueva página del texto (beta)
nueva página del texto (beta)