Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.63 no.5 México sep./oct. 2006
Artículo original
Púrpura de Henoch–Schönlein. Reporte de 105 pacientes pediátricos
Henoch–Schönlein purpura in children: Report of 105 patients
Dra. Jimena Cáceres–Mosquera1, Dra. Yolanda Fuentes–Velasco1, Dr. Benjamín Romero–Navarro1, Dr. Saúl Valverde–Rosas1, M en C. Pilar García–Roca1, Dra. Rebeca Gomezchico–Velasco1, Dr. Guillermo Ramón–García2, Dr. Roberto Carreño–Manjarrez3, Dra. Rocío Maldonado1, Dr. Luis Velásquez–Jones1, D en C.B. Mara Medeiros–Domingo1
1 Departamentos de Nefrología
2 Patología
3 Medicina Interna, Hospital Infantil de México Federico Gómez México, D. F., México
Solicitud de sobretiros:
Dra. Mara Medeiros Domingo
Departamento de Nefrología, Hospital Infantil de México Federico Gómez
Calle Dr. Márquez 162, Col. Doctores, Deleg. Cuauhtemoc, C. P. 06720, México, D. F., México.
Fecha de recepción: 19–10–2006
Fecha de aprobación: 30–11 –2006
Resumen
Introducción. La púrpura de Henoch–Schönlein (PHS) es la vasculitis más frecuente en niños. Objetivo: conocer la presentación clínica y evolución de los pacientes con PHS que se han tratado en el hospital en los últimos 5 años.
Material y métodos. Estudio retrospectivo en pacientes que acudieron al Hospital Infantil de México Federico Gómez, del 1 de enero de 2000 al 31 de diciembre de 2005, con diagnóstico de PHS.
Resultados. Se encontraron 105 pacientes con una mediana de edad de 6 años. El tiempo promedio de seguimiento fue de 15 meses. Todos presentaron lesiones dérmicas, 49.5% dolor abdominal y 41% artritis; 45 (42.9%) pacientes manifestaron nefropatía, con un promedio de aparición de 4.5 meses después de las lesiones dérmicas. Sólo en 37.7% de los casos con nefropatía desaparecieron las alteraciones urinarias. Se realizó biopsia renal en 14 pacientes. La lesión histopatológica más frecuente fue el grado IIIA. La edad de presentación tuvo relación estadísticamente significativa con la presencia de nefritis, los mayores de 10 años tuvieron mayor incidencia de nefritis y los menores de 5 años menor incidencia (Chi cuadrada, P < 0.05). La incidencia global de insuficiencia renal crónica fue de 0.95%.
Conclusión. La edad de presentación es un factor pronóstico para la evolución de la enfermedad. Si bien la púrpura es una vasculitis, la principal complicación a largo plazo es renal, por lo que el seguimiento de los pacientes debe ser supervisado por un nefrólogo pediatra.
Palabras clave. Púrpura de Henoch–Shönlein; nefritis por púrpura; hematuria; vasculitis.
Abstract
Introduction. Henoch–Schönlein purpura (HSP) is the most frequent vasculitis in children. Objective: To describe the clinical presentation and clinical outcome in children with HSP treated in our hospital in the last 5 years.
Material and methods. A retrospective study was performed in HSP patients diagnosed between January 1st 2001 and December 31st 2005.
Results. HSP was diagnosed in 105 patients, median age 6 years old. All had the skin manifestations, 49.5% abdominal pain and 41% arthritis; 45 patients developed HSP nephritis (42.9%), mean presentation time was 4.5 months after HSP diagnosis. Renal biopsy was performed in 14 patients, and the most common histopathological finding was HSP nephritis grade III A. Age of onset older than 10 years was statistically significant for nephritis development (Chi Square < 0.05). Chronic renal insufficiency incidence was 0.95%.
Conclusions. The main complication of HSP is nephritis. Follow–up should include evaluation by a pediatric nephrologist. Age of onset older than 10 years is an important risk factor for HSP nephritis.
Key words. Henoch–Schönlein purpura; nephritis; vasculitis; hematuria.
Introducción
La púrpura de Henoch–Schönlein (PHS) es la vasculitis más frecuente en pediatría, con una incidencia anual de aproximadamente 13 a 22 casos por cada 100 000 niños.1,2 Involucra comúnmente los pequeños vasos en piel, intestino y glomérulo, asociado con púrpura, cólico, hematuria, artralgias o artritis. Generalmente su incidencia disminuye con la edad.3 Si bien se desconoce la causa, se sabe que la inmunoglobulina A (IgA) juega un papel fundamental en la fisiopatología de la enfermedad; existe elevación en la concentración sérica de IgA en 50–70% de los pacientes con PHS, principalmente en el inicio de la enfermedad y a expensas de la subclase IgA1. La incidencia es mayor en otoño e invierno. Se ha asociado a infecciones virales o bacterianas, así como a diversos fármacos y toxinas.4
La afección renal es la complicación más frecuente y potencialmente más grave de la PHS, se presenta en 20 a 49% de los pacientes.5,6 Las manifestaciones renales incluyen hematuria, proteinuria, síndrome nefrítico, síndrome nefrótico y síndrome nefrótico–nefrítico; generalmente aparecen en las primeras cuatro semanas del inicio de la PHS y rara vez preceden a la aparición de las lesiones dérmicas.7 Algunos pacientes pueden tener manifestaciones de nefritis hasta un año después de la púrpura.8
El presente trabajo tuvo como propósito conocer la presentación clínica y evolución de los pacientes con PHS que se han tratado en nuestro hospital en los últimos cinco años.
Material y métodos
Se realizó un estudio retrospectivo de 105 pacientes que acudieron al Hospital Infantil de México Federico Gómez del 1 de enero de 2000 al 31 de diciembre de 2005 con diagnóstico de PHS, para lo cual debían contar con por lo menos dos de los siguientes criterios propuestos por el Colegio Americano de Reumatología:9 1. Púrpura palpable sin trombocitopenia, 2. Edad menor a 20 años al inicio de los síntomas, 3. Angina intestinal, dolor abdominal difuso que empeora después de ingerir alimentos, o el diagnóstico de isquemia intestinal que generalmente se acompaña de evacuaciones con sangre, 4. Biopsia de piel con vasculitis leucocitoclástica.
La presencia de dos o más criterios tiene una sensibilidad de 87.1% y especificidad de 87.7%.10
Las biopsias renales se clasificaron según lo propuesto por el ISKDC (International Study of Kidney Diseases in Children):11 I: lesiones glomerulares mínimas, ausencia de medias lunas; II: ausencia de medias lunas; Ha: proliferación mesangial pura; lib: proliferación endocapilar focal y segmentaria; lie: proliferación endocapilar difusa; III: presencia de proliferación extracapilar en menos de 50% de los glomérulos; Illa: en asociación con proliferación endocapilar focal y segmentaria; Illb: con proliferación endocapilar difusa; IV: proliferación extracapilar en 50 a 75% de los glomérulos; IVa: en asociación con proliferación endocapilar focal y segmentaria; IVb: con proliferación endocapilar difusa; V: proliferación extracapilar en más de 75% de los glomérulos; Va: en asociación con proliferación endocapilar focal y segmentaria; Vb: con proliferación difusa; VI: glomerulonefritis pseudomembranoproliferativa. En todas las biopsias renales se realizó inmunofluorescencia para IgA.
Definiciones clínicas
Artritis. Edema de las articulaciones o edema periarticular doloroso.
Sangrado intestinal. Presencia de evacuaciones sanguinolentas, melena o sangre oculta en heces positiva.
Nefritis por púrpura. Presencia de hematuria (macro o microscópica) con o sin proteinuria.
Hematuria. Más de cinco eritrocitos por campo seco fuerte o presencia de hemoglobina >1+ en el examen general de orina.
Proteinuria significativa: 4 a 40 mg/m2 SC/h en colección de orina nocturna de 12 horas.
Proteinuria nefrótica: más de 40 mg/m2 SC/h en colección de orina nocturna de 12 horas.
Hipertensión arterial. Presión arterial sistólica o diastólica > al percentil 95 para género, edad y talla.12
El análisis estadístico se hizo utilizando el programa SPSS versión 13. Las diferencias entre los pacientes que hicieron nefritis y sin nefritis se determinaron por Chi cuadrada.
Resultados
Sesenta y dos pacientes fueron de sexo femenino y 43 del masculino. La mediana de edad fue de seis años (variación de 1 a 14 años), 12 pacientes fueron mayores de 10 años.
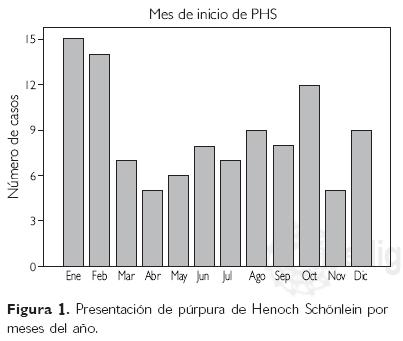
La presentación por meses del año se muestra en la figura 1; hubo picos en enero (15), febrero (14) y octubre (12); 59% de los casos se presentaron en los meses de otoño e invierno y 41% durante primavera y verano.
Las características demográficas de los pacientes y las manifestaciones clínicas se muestran en el cuadro 1. El tiempo promedio de seguimiento fue de 15 meses.
Todos los pacientes tuvieron las manifestaciones dérmicas; 52 pacientes presentaron dolor abdominal (49.5%), 43 artritis (41%), y sangrado de tubo digestivo 10 pacientes (9.5%). Un paciente con orquitis (0.95%); 45 pacientes (42.9%) tuvieron nefropatía, 23 al inicio del padecimiento y 22 durante el seguimiento. La mediana de presentación de las manifestaciones renales fue de 4.5 meses (variación de 0 a 29 meses) después de la presentación de las manifestaciones dérmicas.
Sesenta y cinco pacientes recibieron tratamiento con prednisona al diagnosticarse PHS (dosis promedio 1 mg/kg/día y tiempo promedio de un mes [variación de una semana a dos meses]), que se indicó para tratamiento de dolor abdominal con o sin sangrado o por nefritis.
Se analizaron las diferentes variables como: sexo, edad, manifestaciones dérmicas, articulares y gastrointestinales, tratamiento con esteroides en los pacientes que presentaron nefritis y aquellos sin nefritis. Se encontró que la edad de presentación tuvo relación estadísticamente significativa con la presencia de nefritis, los mayores de 10 años tuvieron mayor incidencia de nefritis y los menores de cinco años menor incidencia (Chi cuadrada P < 0.05).
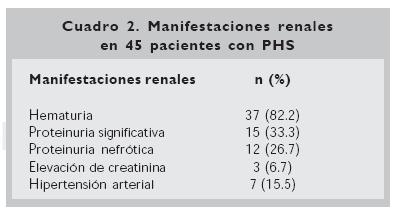
Las manifestaciones renales se detallan en el cuadro 2. De los 45 pacientes con nefropatía la mayoría cursó con hematuria (82%), 27 pacientes tuvieron proteinuria (60%), que fue significativa en 33.3% y nefrótica en 26.7%. Siete pacientes (15.5%) tuvieron síndrome nefrítico agudo, manifestado por hematuria e hipertensión arterial. Tres pacientes presentaron elevación aguda de creatinina y sólo uno de ellos evolucionó a insuficiencia renal crónica. El tiempo de seguimiento de estos 45 pacientes fue en promedio de 18 meses (variación 2 a 36 meses), en 17 casos desaparecieron las alteraciones urinarias (37.7%), persisten con hematuria 12 (26.6%), hematuria y proteinuria 10 (22.2%) y seis con proteinuria (13.3%).
Se realizó biopsia renal en 14 pacientes; el diagnóstico histopatológico y la evolución de estos niños se detallan en el cuadro 3. La indicación de biopsia fue proteinuria nefrótica en todos los pacientes, además de elevación de creatinina en el caso cuatro. Trece tuvieron inmunofluorescencia positiva para IgA en mesangio. En la paciente dos se indicó la biopsia renal por proteinuria nefrótica, sin embargo el tejido obtenido fue insuficiente para diagnóstico histopatológico por no tener glomérulos; la inmunofluoresencia para IgA fue negativa y no se realizó nueva biopsia renal por presentar disminución progresiva de la proteinuria hasta desaparecer.
La lesión histopatológica más frecuente fue el grado IIIa, proliferación mesangial con proliferación extracapilar en menos de 50% de los glomérulos (30.7%), tan solo una paciente con proliferación endo y extracapilar difusa en más de 75% de los glomérulos (tipo Vb) evolucionó a insuficiencia renal crónica terminal y fue trasladada a otra institución para continuar su manejo; equivale a una incidencia global de insuficiencia renal crónica de 0.95%, considerando a todos los pacientes con PHS y de 2.2% en los que presentaron nefropatía por PHS.
Discusión
La PHS es la vasculitis más frecuente en la infancia. Si bien puede presentarse en todas las edades, desde niños de seis meses hasta adultos de 86 años,3 la mayor parte de los casos ocurre en la etapa escolar; el promedio de edad en la serie que aquí se reporta fue de seis años, similar a lo reportado en otros estudios. A diferencia de lo que se reporta en otras series, se encontró predominio del sexo femenino.
La presencia de púrpura cutánea es requisito para el diagnóstico de la enfermedad. Las manifestaciones clínicas más frecuentes después de las lesiones dérmicas fueron los síntomas abdominales que incluyeron: dolor, sangrado intestinal o vómito en 52% de los pacientes. Se encontró artritis en 41% y nefropatía en 42.9%.
En la literatura se ha reportado la artritis como la segunda manifestación más frecuente. En 20% de los pacientes, tanto la artritis como el dolor abdominal pueden presentarse hasta dos semanas antes de las lesiones dérmicas.13 La menor incidencia de artritis en este estudio puede deberse a su carácter retrospectivo. Las manifestaciones renales rara vez preceden a las lesiones dérmicas, pero es frecuente que se presenten meses después de que las lesiones en piel han desaparecido. No se encontraron complicaciones abdominales; sin embargo, se sabe que la PHS puede ocasionar infarto y perforación intestinal así como intususcepción en 1 a 5%.
La edad de presentación es un factor pronóstico para la evolución de la enfermedad, se sabe que los adultos tienen hasta 85% de incidencia de nefritis y 13% puede evolucionar a uremia terminal; los niños menores de dos años tienen menos complicaciones abdominales y nefritis. La edad al inicio del padecimiento fue el único dato clínico que en esta serie se asoció al desarrollo de nefropatía, siendo significativamente más frecuente en niños mayores de 10 años y menos frecuente en niños menores de cinco años; esto también ha sido reportado en otras series.14
En 17/45 (37.8%) pacientes las alteraciones urinarias desaparecieron en el seguimiento. En este hospital se realiza biopsia renal cuando los pacientes presentan deterioro progresivo en la función renal, proteinuria nefrótica inicial o proteinuria significativa por más de ocho semanas. La hematuria macro o microscópica por sí sola no amerita biopsia renal.
De 14 pacientes, en quienes se realizó biopsia renal, la lesión histológica más frecuente fue la proliferación mesangial con proliferación extracapilar en menos de 50% de los glomérulos (grado IIIa) que se encontró en 4/14 pacientes (30.7%), y continúa siendo similar a lo reportado por Mota y col.15 en 1975, quienes encontraron que 19/52 (36%) pacientes con nefritis por PHS y biopsia renal tuvieron grado IIIa.
En la serie que aquí se informa, tan solo un paciente evolucionó a uremia (0.9%), sin embargo el tiempo de seguimiento promedio es aún muy corto.
La nefritis por PHS fue la causa de uremia terminal en 1.7% de los niños en Europa. Se ha reportado evolución a insuficiencia renal crónica 20–24 años después del diagnóstico de 9 a 35% de los niños, según diversas series.8,16,17 El riesgo de desarrollar insuficiencia renal crónica está relacionado con la presentación clínica inicial, siendo más frecuente en aquellos pacientes que tuvieron síntomas renales más graves al inicio de la enfermedad, tales como síndrome nefrítico–nefrótico, síndrome nefrótico y/o retención de azoados.1,5,18 Sin embargo se ha descrito que aún pacientes con alteraciones urinarias mínimas pueden llegar a insuficiencia renal crónica después de décadas. En una serie de 52 pacientes, Ronkaineny col.19 vieron que 17% tenían deterioro en la función renal en el seguimiento a 24 años, y que la gravedad de la biopsia inicial no se correlacionaba con el riesgo a una mala evolución. Es importante señalar que 70% de los embarazos de las mujeres que padecieron PHS en la infancia se complicaron con hipertensión y proteinuria.
El 50% de los pacientes con PHS y uremia que reciben trasplante renal presentan depósitos de IgA en el injerto, 25% pueden tener evidencia clínica de recurrenciay 10% pierden el riñon nuevamente por esta causa.
A pesar de muchos intentos terapéuticos, no existe un consenso internacional para el tratamiento de la nefritis por PHS. No existen estudios prospectivos, aleatorizados y controlados en esta enfermedad. La interpretación de los resultados disponibles en la literatura es difícil ya que generalmente son series pequeñas de casos. Hay quien emplea tratamiento con esteroides para prevenir la nefritis, sin embargo otros autores no han visto que esta práctica provea beneficios. Existe evidencia clínica de que los esteroides son útiles en el manejo de la artritis y el dolor abdominal, pero no influyen en la púrpura, la duración de la enfermedad o la frecuencia de recurrencias.20 Las formas más agresivas de tratamiento, tales como bolos de metilprednisolona, ciclofosfamida, azatioprina y plasmaféresis, se han intentado en los estados graves con proliferación extracapilar difusa, ya que los pacientes tienen alto riesgo de evolucionar a uremia terminal.6,21,22
En los casos de proteinuria persistente se ha sugerido el tratamiento con inhibidores de enzima convertasa, antagonistas de receptores de angiotensina o ciclosporina, ya que existe evidencia de que dichos medicamentos disminuyen la progresión del daño renal al disminuir la proteinuria.23–25
Si bien la púrpura es una vasculitis, la principal complicación a largo plazo es renal por lo que el tratamiento debe ser siempre supervisado por un nefrólogo pediatra.
Referencias
1. Ballinger S. Henoch–Schönlein purpura. Curr Opln Rheumatol. 2003; 15: 591–4. [ Links ]
2. Gardner–Medwin JM, Dolezalova P, Cummins C, Southwood TR. Incidence of Henoch–Schönlein purpura, Kawasaki disease, and rare vasculltles in children of different ethnic origins. Lancet. 2002; 360: 1197–202. [ Links ]
3. Saulsbury FT. Henoch–Schönlein purpura. Curr Opin Rheumatol. 2001; 13: 35–40. [ Links ]
4. Fervenza FC. Henoch–Schönlein purpura nephritis. Int J Dermatol. 2003; 42: 170–7. [ Links ]
5. Sano H, Izumlda M, Shimizu H, Ogawa Y. Risk factors of renal involvement and significant proteinuria In Henoch–Schönlein purpura. Eur J Pediatr. 2002; 161: 196–201. [ Links ]
6. Rostoker G. Schönlein–Henoch purpura in children and adults: diagnosis, pathophyslology and management. Bio Drugs. 2001; 15: 99–138. [ Links ]
7. Mrusek S, Kruger M, Greiner P, Kleinschmidt M, Brandis M, Ehl S. Henoch–Schönlein purpura. Lancet. 2004; 363: 1116. [ Links ]
8. Kaku Y, Nohara K, Honda S. Renal Involvement in Henóch–Schönlein purpura: a multlvariate analysis of prognostic factors. Kidney Int. 1998; 53: 1755–9. [ Links ]
9. Mills JA, Michel BA, Bloch DA, Calabrese LH, Hunder GG, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Henoch–Schönlein purpura. Arthritis Rheum. 1990; 33:1114–21. [ Links ]
10. Michel BA, Hunder GG, Bloch DA, Calabrese LH. Hypersensitivity vasculitis and Henoch–Schönlein purpura: a comparison between the two disorders. J Rheumatol. 1992; 19: 721–8. [ Links ]
11. Szeto CC, Choi PC, To KF, Li PK, Hul J, Chow KM, et al. Grading of acute and chronic renal lesions In Henoch–Schönlein purpura. Mod Pathol. 2001; 14: 635–40. [ Links ]
12. The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics. 2004; 114: 555–76. [ Links ]
13. Saulsbury FT. Henoch–Schönlein purpura in children. Report of 100 patients and review of the literature. Medicine (Baltimore). 1999; 78: 395–409. [ Links ]
14. Shin Jl, Park JM, Shin YH, Hwang DH, Kim JH, Lee JS. Predictive factors for nephritis, relapse, and significant proteinuria in childhood Henoch–Schönlein purpura. Scand J Rheumatol. 2006; 35: 56–60. [ Links ]
15. Mota HF, Valbuena PR, Gordillo PG. Long term prognosis of anaphylactoid purpura nephropathy. Paediatrician. 1975; 4: 52–9. [ Links ]
16. Coppo R, Mazzucco G, Cagnoli L, Lupo A, Schena FP. Long–term prognosis of Henoch–Schönlein nephritis in adults and children. Italian Group of Renal Immunopathology Collaborative Study on Henoch–Schönlein purpura. Nephrol Dial Transplant. 1997; 12: 2277–83. [ Links ]
17. Scharer K, Krmar R, Querfeld U, Ruder H, Waldherr R, Schaefer F. Clinical outcome of Henoch–Schönlein purpura nephritis in children. Pediatr Nephrol. 1999; 13: 816–23. [ Links ]
18. Coppo R, Andrulli S, Amore A, Gianoglio B, Conti G, Peruzzi L, et al. Predictors of outcome in Henoch–Schönlein nephritis in children and adults. Am J Kidney Dis. 2006; 47: 993–1003. [ Links ]
19. Ronkainen J, Nuutinen M, Koskimies O. The adult kidney 24 years after childhood Henoch–Schönlein purpura: a retrospective cohort study. Lancet. 2002; 360: 666–70. [ Links ]
20. Rosenblum N D, Winter HS. Steroid effects on the course of abdominal pain in children with Henoch–Schönlein purpura. Pediatrics. 1987; 79: 1018–21. [ Links ]
21. Iijima K, Ito–Kariya S, Nakamura H, Yoshikawa N. Multiple combined therapy for severe Henoch–Schönlein nephritis in children. Pediatr Nephrol. 1998; 12: 244–8. [ Links ]
22. Kawasaki Y, Suzuki J, Murai M, Takahashi A, Isome M, Nozawa R, et al. Plasmapheresis therapy for rapidly progressive Henoch–Schönlein nephritis. Pediatr Nephrol. 2004; 19: 920–3. [ Links ]
23. Ronkainen J, Autio–Harmainen H, Nuutinen M. Cyclosporin A for the treatment of severe Henoch–Schönlein glomerulonephritis. Pediatr Nephrol. 2003; 18: 1138–42. [ Links ]
24. Someya T, Kaneko K, Fujinaga S, Ohtaki R, Hira M, Yamashiro Y. Cyclosporine A for heavy proteinuria in a child with Henoch–Schönlein purpura nephritis. Pediatr Int. 2004; 46: 111–3. [ Links ]
25. García–Álvarez R, Gordillo–Paniagua G. Nefropatía de la púrpura anafiiactoide y mesangiopatía por depósitos de IgA. En: Gordillo–Paniagua G, Exeni RA, de la Cruz J, editores. Nefrología pediátrica. Madrid: Elsevier; 2003. p. 225–32. [ Links ]














