Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 no.2 Ciudad de México abr. 2005
Revisión de temas cardiológicos
Estado actual de la ecocardiografía de contraste en la perfusión miocárdica
Contrast echocardiography in myocardial perfusion today
Marjorie Molina–Carrión,* José Luis Lozano,* Miguel Zabalgoitia*
* De la División de Cardiología, University of Texas Health Science Center at San Antonio.
Correspondencia:
Dr. Miguel Zabalgoitia,
División de Cardiología, University of Texas Health Science Center at San Antonio,
7703 Floyd Curl Drive. San Antonio, Texas 77229–3900,
Teléfono: 210–617–5300, extensión 6301.
E–mail: zabalgoitia@uthscsa.edu
Recibido: 16 de mayo de 2005
Aceptado: 30 de mayo de 2005
Resumen
Avances en la ingeniería ultrasónica han llevado a la creación de micropartículas "inteligentes" con capacidad de atravesar en cantidad suficiente la barrera pulmonar transcapilar para permitir la obtención de imágenes de corazón izquierdo, lo que ha hecho posible la evaluación de la perfusión miocárdica. Si bien la Food and Drug Administration de los Estados Unidos ha aprobado varios agentes de contraste para empleo en opacificación ventricular y visualización de bordes endocárdicos en sujetos que tienen estudios subóptimos, no ha aprobado hasta el momento ningún agente de contraste para uso en perfusión miocárdica. En la actualidad existen dos estudios multicéntricos a gran escala que fueron diseñados exclusivamente para perfusión miocárdica en comparación con medicina nuclear y coronariografía. Nuestro laboratorio ha tenido la oportunidad de participar activamente en ambos estudios. Esta revisión incluye el diseño, criterios de interpretación y resultados preliminares de CARDIOsphere. Además, presentamos criterios de interpretación del estudio con la burbuja AI–700 que se encuentra actualmente en fase III de investigación clínica. La ecocardiografía de contraste para perfusión miocárdica enfrenta varios retos que deberá resolver antes de que se establezca como una alternativa eficiente. Una limitante común es la aplicabilidad de este método en sujetos con mala ventana acústica, la creación de artefactos intrínsecos al sistema como son la atenuación distal y lateral, la inevitable curva de aprendizaje, y el establecimiento de criterios en la cuantificación de los defectos.
Palabras clave: Perfusión miocárdica. Agentes de contraste. Ecocardiografía de contraste.
Summary
Advances in ultrasonic engineering have made possible the development of "intelligent" micro–particles with the capacity of passing through the pulmonary circulation in sufficient amount to acquire images of the left heart, making possible the evaluation of myocardial perfusión. Although the Food and Drug Administration of the United States has approved several contrast agents for use in ventricular opacification and visualization of endocardial borders in subjects that have sub-optimal studies, at this time, it has not approved any agent of contrast for use in myocardial perfusión. Currently, there are two multicenter studies on a great scale that were exclusively designed for myocardial perfusión in comparison with nuclear medicine and angiography. Our laboratory has had the opportunity to actively participate in both trials. This revision includes the design, interpretation criteria, and preliminary results of CARDIOsphere. As well, we are presenting the interpretation criteria of the AI–700 bubble, which is currently in phase III of clinical investigation. Myocardial perfusión assessment with contrast echocardiography faces several challenges that need to be addressed before it becomes established as an efficient alternative. A common limitation is the viability of this method in subjects with bad acoustic window, the creation of intrinsic artifacts to the system, as distal and lateral attenuation; the unavoidable learning curve, and the settlement of defect quantification criteria. (Arch Cardiol Mex 2005; 75: 197–209).
Keywords: Myocardial perfusión. Contrast agents. Contrast echocardiography.
El uso de los medios de contraste en ecocardiografía empezó en 1968 con observaciones de Joyner, y publicaciones de Gramiak y Shak sobre la generación de ecos reforzados durante ecocardiografía Modo–M en cavidades cardíacas izquierdas luego de la inyección de diferentes soluciones en la aorta ascendente.12 Este efecto provocado con sustancias que contenían burbujas de aire se aprovechó para opacificar las cavidades derechas, detectar cortocircuitos intra y extracardíacos, y para reforzamiento de señales de flujo Doppler; sin embargo, su empleo fue parcialmente relegado a inicio de los años 80, con la aparición del Doppler a color. La opacificación del miocardio por inyección intracoronaria de agentes reflectores del ultrasonido, fue obtenida por primera vez en 1980 por DeMaria,3 y si bien esto representó un progreso importante, el acceso a las cavidades izquierdas y a la circulación coronaria estaba restringido a la inyección directa de contraste en la raíz aórtica y en los ostium coronarios. En la misma década, Feinstein y col. demostraron que se podía generar opacificación de las cavidades izquierdas al inyectar por vía intravenosa partículas muy pequeñas, sonificadas en albúmina humana, que tenían la capacidad de atravesar la barrera pulmonar.4 Más tarde, en la década de los 90, Villanueva demostró que la inyección de partículas de albúmina sonificada en la aurícula derecha era capaz de generar contraste del miocardio durante la fase de hiperemia farmacológica con lo cual permitiría valorar el área coronaria en riesgo.5 Como complemento, múltiples publicaciones sobre visualización de bordes endocárdicos y escores de contractilidad segmentaria en pacientes isquémicos han soportado el uso clínico en esas condiciones.68
Las partículas utilizadas para estudio de cavidades izquierdas a finales de los 90 contenían gases estabilizados protegidos por cubiertas que impedían su liberación pero con el inconveniente de generar limitado efecto de contraste. Las más modernas están constituidas por gases de alto peso molecular con cubiertas dobles, lo cual les da más resistencia a la destrucción por ultrasonido, propiedad denominada persistencia. Acorde al progreso de las sustancias inyectadas, la tecnología ha dado pasos agigantados con la generación de nuevos sistemas para detección de contraste en la pared miocárdica y medición del flujo coronario. Si bien varios agentes han sido aprobados por la Food and Drug Administration (FDA) para mejorar la visualización del borde endocárdico frente a imágenes subóptimas durante eco de estrés, hasta la actualidad ninguno ha sido aprobado para uso en perfusión miocárdica. No cabe duda que éste es el campo más importante de aplicación actual de los medios de contraste y el que brinda mayor expectativa. Esta revisión estará específicamente dirigida al uso de la ecocardiografía de contraste para perfusión miocárdica.
Agentes de contraste
Tal como se describe en la Tabla I las burbujas utilizadas en estudios de perfusión miocárdica deben tener ciertas cualidades en relación a su tamaño, cubierta, constitución, persistencia, resonancia y seguridad. La Figura 1 ilustra el equilibrio en sangre dado por la densidad del gas, las características de su cubierta y el diámetro. Además, las "burbujas perfectas" deben ser de fácil administración, no tóxicas, sensibles a la interacción del ultrasonido, y persistir en la circulación en forma proporcional a su concentración sanguínea.

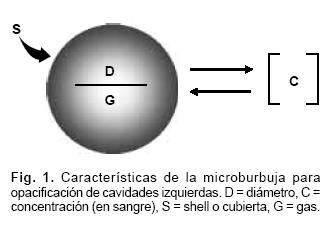
Los agentes de contraste capaces de visualizarse en las cavidades izquierdas después de inyección intravenosa son más pequeños que los glóbulos rojos y tienen una reología similar a éstos por lo cual pueden atravesar los capilares pulmonares sin ser atrapadas;9 además tienen componentes poco difusibles, de alto peso molecular, estabilizados por cubiertas que no les permiten difundir fuera de la circulación sanguínea.10 Estas burbujas contienen gases estabilizados (nitrógeno, perfluorocarbono) y una cubierta (lípidos, albúmina, polisacáridos), que cuando es "rígida" tiene tendencia a romperse con energía ultrasónica y cuando es elástica tiene mayor capacidad de ser comprimida o resonada.10,11
La cantidad necesaria de administración varía dependiendo del agente utilizado, el equipo ultrasónico, y las características del paciente. El agente puede ser administrado en bolo, o por infusión continua. La calidad de la imagen nos da la pauta a seguir en cuanto a la cantidad total. La obtención de imágenes con contraste alcanza una definición espacial (< 1 mm) mayor a la obtenida con medicina nuclear.
Adquisición de imágenes
Las microburbujas interactuán a través de la creación de interfases físicas entre sus componentes (elementos de diferente densidad acústica),12,13 que les permite reforzar la señal ecocardiográfica, y mediante su capacidad de ser afectadas por la energía ultrasónica,12–15 sin embargo, cada una tiene sus propias cualidades y especificaciones. La respuesta de las microburbujas ante la energía emitida se basa en el concepto de linealidad, todas pueden generar respuestas lineales y no lineales. La no linealidad es una propiedad del medio (tejido, contraste) que permite que la señal emitida no sea proporcional a la señal entrante, y está dada por un coeficiente. En los tejidos el coeficiente es de 3 a 7 y en los agentes de contraste puede ser mayor a 1,000 e implica una capacidad de resonancia baja o alta.14 Las ondas ultrasónicas generan en su propagación fases de compresión y rarefacción que inducen contracción y dilatación de las microburbujas y vibración a alta frecuencia. Este efecto se conoce como "resonancia" y produce tres efectos fundamentales:12,15–19 a) abajos niveles de energía generan una respuesta lineal (realce fundamental); b) a niveles más altos de energía generan respuestas no lineales y respuestas armónicas (predilección natural de las burbujas a vibrar a dos veces la frecuencia de sonificación inicial); y c) a niveles "muy altos" de energía, ésta es absorbida rápidamente por las microburbujas y se producen excursiones de vibración que exceden la integridad de su estructura, rompiéndola.15,19,20
El reconocimiento de estas propiedades ha justificado la creación de sistemas apropiados para detectar en forma selectiva los ecos provenientes de microburbujas resonantes.14,15,18,21,22
• Segunda armónica: Recepción al doble de la frecuencia inicial (por ejemplo, emisióna 1.8, recepción a 3.6 MHz).
• Armónicas de fusión: Emisión de un grupo de frecuencias y recepción a otro grupo, doble de las primeras, fusionando unas con otras. Mejora la calidad de las imágenes, tanto en el campo lejano (bajas frecuencias = penetración), como cercano (altas frecuencias = resolución).
• De pulso invertido: Cancela la interacción lineal y genera persistencia de la interacción no lineal. Detecta mejor la burbuja y elimina el tejido. Emite dos pulsos consecutivos, de manera que el segundo es una imagen especular del primero. Cuando los ecos se suman se obtiene un tercero que contiene armónicos altos y bajos del fundamental.
Además se han generado mecanismos para poder precisar las variantes de emisión de ultrasonidos (continuo y gatillado, con imágenes intermitentes coordinadas con las fases del ciclo cardíaco y/o imágenes aceleradas intermitentes).22
• Emisión continua: Si las burbujas son interrogadas a su frecuencia de resonancia, tienden a romperse y liberar su gas. La sonificación continua a su frecuencia de resonancia depletará las microburbujas.
• Emisión intermitente: Al incrementar el número de cuadros de interrogación de ultrasonido las imágenes son limitadas a cuadros de pocos segundos lo que limita la destrucción de las microburbujas. Cada disparo de ultrasonido se encuentra cada vez con una concentración mayor de microburbujas en el tejido. En cada pausa las microburbujas rotas son "lavadas" y reemplazadas por nuevas.21
• Emisión gatillada: Cuando los disparos se realizan acorde al electrocardiograma: sístole, diastole, o ambas fases.16,22
• Emisión gatillada intermitente: Cuando es obtenida en forma intermitente en cada ciclo cardíaco o durante múltiples ciclos.22,23
Índice mecánico (IM)
El índice mecánico (IM) es la medida de magnitud de energía emitida por el transductor de ultrasonido. Como se indica en la Tabla II, variaciones en el IM (intensidad y tipo de emisión: continua o intermitente) permite preservar o destruir las microburbujas utilizadas.12,15 Si el IM es muy bajo, alrededor de 0.1, se genera oscilación linear, los procesos de compresión y rarefacción son iguales en amplitud y se obtienen imágenes fundamentales. Si el IM es de 0.2 – 0.7 se genera oscilación no linear con mayor rarefacción que compresión y por lo tanto generación de armónicas. Si el IM es muy alto, de 0.8 – 1.9, se produce destrucción extensa de microburbujas.
Es importante recordar que en imágenes estándar bidimensionales (2D) en adultos la penetración aumenta con IM muy alto de 1.5 – 1.7; sin embargo, cuando se utiliza contraste para perfusión miocardica estos niveles generan destrucción masiva de las microburbujas. Cuando se utiliza Tiempo–Real es recomendable trabajar con índices mecánicos muy bajos (0.2 a 0.3) para obtener el efecto de zonificación sin destrucción. El nivel de compresión o rango dinámico comúnmente utilizado es alto, lo que torna oscuro el endocardio, generando alto contraste con la cavidad que se verá blanca, facilitando la visualización en imágenes 2D. Otros factores que influyen en la adquisición de imágenes con contraste son la frecuencia de transductor y el ajuste del foco. En general, el foco debe localizarse a nivel de la válvula mitral para definir mejor la perfusión de la pared lateral. Si existe duda en cuanto a un posible defecto de perfusión apical, se repite la adquisición con reajuste del foco a nivel apical.
Técnicas de adquisición
La tecnología en imágenes de contraste puede ser dividida en tres grupos,24 como se resume en la Tabla III. La finalidad en cada uno es lograr separar el contraste del tejido y alcanzar mayor definición. Las técnicas de alto poder ultrasónico son sensibles para detectar contraste en el miocardio pero tienen poder limitado para valorar la movilidad de la pared; las de bajo poder en Tiempo–Real, son menos sensibles para detectar contraste pero proveen mayor información sobre la movilidad parietal y generan excelente opacificación ventricular. Además es una técnica fácil de usar y evita la formación de artefactos lo que es de gran importancia durante estudios de estrés.
Opacificación miocardica
La inyección de contraste produce aumento de intensidad de las señales miocárdicas. Debido a que la perfusión del miocardio corresponde sólo al 3–5% del gasto cardíaco la cantidad de contraste administrada para opacificar el ventrículo izquierdo debe ser alta. Aproximadamente el 90% del volumen sanguíneo miocárdico se encuentra en la microcirculación (arteriolas, capilares y vénulas), lo cual explica que la ecocardiografía de contraste para perfusión miocardica permita vizualizar precisamente los sitios de transferencia de oxígeno.
Teoría de la dilución del indicador
Una teoría utilizada para explicar el proceso de cuantificación de la perfusión miocardica por contraste es la dilución del indicador,22,25,26 según la cual tras administrar un bolo de contraste a la circulación coronaria se puede estimar el grado de perfusión miocardica al establecer la relación entre la intensidad de contraste presente en el miocardio y su tiempo de travesía. El ejemplo más utilizado es considerar la circulación coronaria como un tanque lleno de volumen que mantiene un flujo constante pasando a través de él; al administrar contraste, se genera un incremento inmediato en la reflexión del ultrasonido, lo cual se mantiene por un tiempo determinado, hasta que empieza a disminuir acorde a la disminución de su concentración. Esto se puede graficar con curvas intensidad – tiempo. Si en vez de uno consideramos la presencia de varios tanques en serie que representan varios ciclos cardíacos y se gráfica con curvas, se puede medir la cantidad de contraste que opacifica la cavidad ventricular izquierda y la que llega al miocardio en uno o más ciclos cardíacos, así como el tiempo que tarda en producirse este efecto.20,25,26 Además, con altas concentraciones de contraste se observa atenuación del miocardio y disminuye su reflectividad.27
Determinación de flujo coronario
El análisis de las imágenes adquiridas puede ser: cualitativo, semicuantitativo, o cuantitativo. El análisis cuantitativo se basa en la construcción de curvas de video intensidad–tiempo (estudio de la fase de relleno luego del proceso de destrucción completa de microburbujas). Hasta el momento, no existen suficientes estudios que justifiquen su aplicación clínica por lo cual, el análisis cuantitativo se considera tan sólo una herramienta de investigación.
En teoría es posible analizar la mejoría en la movilidad segmentaria de zonas previamente acinéticas, observándose que los segmentos que presentan mejoría tienen valores más elevados en el pico de la curva intensidad – tiempo en relación a valores previos. El problema en la utilización de estas curvas es el análisis del tiempo, ya que en ocasiones la cantidad de contraste inyectada no genera cambios importantes en la videointensidad, lo que podría expresarse como un tiempo de tránsito muy breve. Sin embargo, vale la pena recordar que el efecto del contraste en el miocardio es dependiente de múltiples variables, incluyendo factores físicos del material de contraste utilizado, flujo coronario, volumen sanguíneo intramiocárdico, y gradiente de presión intracoronaria.
La mayoría de los estudios clínicos reportados en la literatura utilizan el análisis semi–quantitativo. Un esquema popular es el de calificar cada uno de los 16 segmentos miocárdicos a una escala de "0, 1, y 2", en donde "0" corresponde a un defecto de perfusión completo, "1" es un defecto parcial, también llamado "en parches", y "2" es una opacificación completa del segmento en cuestión sin defecto de perfusión. En la misma escala, si un segmento no puede ser evaluado por estar muy distal con atenuación o con un artefacto obvio de movimiento, dicho segmento se marca "no evaluable" y se indica con una "X". Los segmentos son posteriormente evaluados de acuerdo a la distribución típica de las arterias coronarias en 3 territorios: descendente anterior, circunfleja, y coronaria derecha.
Estudios actuales de perfusión miocárdica
Si bien utilizando diferentes agentes de contraste se han realizado múltiples estudios que han servido para aumentar la experiencia local de diversas instituciones, incluyendo la nuestra,28,29 es necesario aclarar que hasta el momento sólo existen dos estudios multicéntricos, diseñados específicamente para perfusión miocárdica: a) CARDIOsphere, cuyos resultados están siendo analizados por la FDA, y b) AI–700, que se encuentra actualmente en fase III de investigación clínica. Nuestro laboratorio obtuvo el segundo lugar entre los 35 centros participantes del estudio CARDIOsphere. En la actualidad estamos activamente reclutando pacientes en el estudio con la burbuja AI–700. Se espera completar este estudio multicéntrico, internacional a finales del 2005.
CARDIOsphere (POINT Biomedical, San Carlos, CA)30
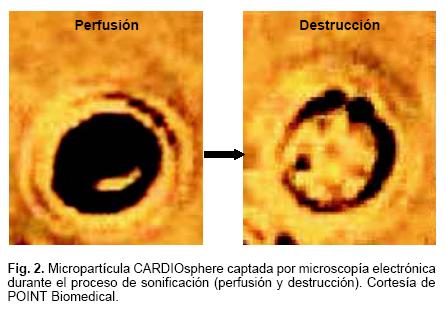
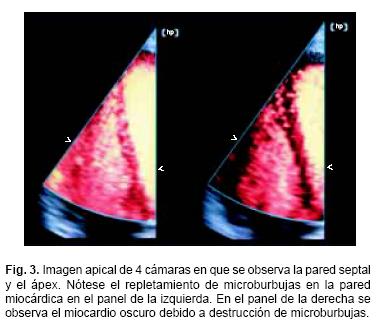
POINT Biomedical ha desarrollado una nueva plataforma tecnológica con el desarrollo de microesferas porosas, basada en la configuración BISphere (una cubierta dentro de otra cubierta): una interna constituida por polímeros biodegradables que proveen estructura física y para control de la respuesta acústica y otra externa que funciona como interfase biológica. Cada capa de la cubierta puede ser modificada en forma independiente para cubrir requerimientos específicos. El núcleo de la esfera puede ser llenado con un gas, por ejemplo nitrógeno, para imágenes de ultrasonido, como la burbuja CARDIOsphere.30 CARDIOsphere es una microburbuja de 4um, que tiene una superficie de características muy similares a los glóbulos rojos. Está constituida por nitrógeno (gas muy soluble) y una doble cubierta de polilactide. Sus cualidades aumentan su resistencia ante el efecto del ultrasonido, así como su capacidad de resonancia y ecogenicidad. La Figura 2 ilustra la micropartícula durante perfusión y destrucción. Después de la inyección intravenosa, el gas se mantiene encapsulado y biológicamente inaccesible, propiedades que se aprovechan durante la fase de perfusión. Al ser expuesto a condiciones específicas de ultrasonido, el nitrógeno se disuelve rápidamente y genera una imagen de alta intensidad que es proporcional a la concentración de microesferas en el miocardio y por lo tanto equivalente al flujo sanguíneo, con un coeficiente de incremento en intensidad del contraste paralelo y directamente relacionado con el grado de perfusión. Se visualiza mejor con imágenes de ultrasonido en Power Doppler gatillado empleando armónicas. En cuestión de segundos se rellenan los capilares miocárdicos lo que se refleja en cambios de la imagen de ultrasonido que permite una valoración semicuantitativa de perfusión. En presencia de estenosis coronaria obstructiva se genera un llenado tardío. En el proceso de adquisición de imágenes, se consigue separar la imagen generada por la presencia de contraste en los vasos de la generada por el tejido, los tonos marrón (rojo–amarillento) corresponden a la presencia de contraste miocárdico y el amarillo al ventrículo izquierdo opacificado, como se observa en la Figura 3. La atenuación es más común en segmentos periféricos, fenómeno que se conoce como anisotropismo, particularmente cuando se utiliza un IM bajo.
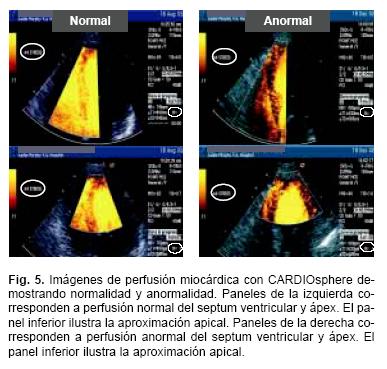
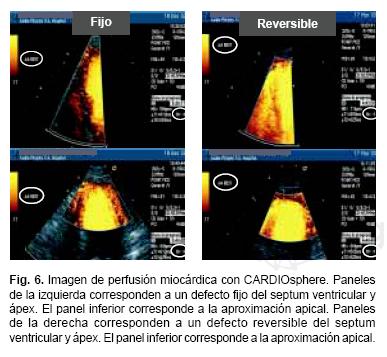
Las Tablas IV y V sumarizan la metodología usada en la obtención e interpretación de las imágenes de perfusión. El análisis por territorios vasculares se realizó de acuerdo al esquema de segmentación que se muestra en la Figura 4. Ejemplos de presencia o ausencia de un defecto subendocárdico y su persistencia durante las fases de estrés y reposo (normalidad, anormalidad, y presencia de defecto fijo y reversible) se muestran en las Figuras 5 y 6.
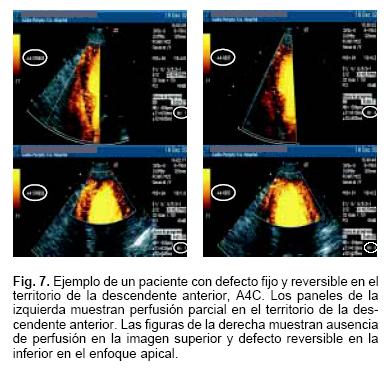
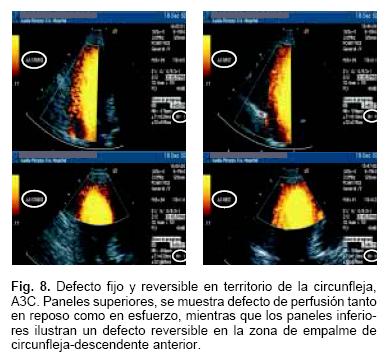
Las imágenes mostradas en las Figuras 7 y 8 son ejemplos de perfusión anormal en el territorio de la descendente anterior y circunfleja. En la Figura 9 presentamos el estudio de medicina nuclear con Talio que demuestra múltiples defectos de perfusión. Finalmente, la Figura 10 muestra la angiografía coronaria del mismo paciente con presencia de múltiples lesiones obstructivas en los 3 territorios vasculares.
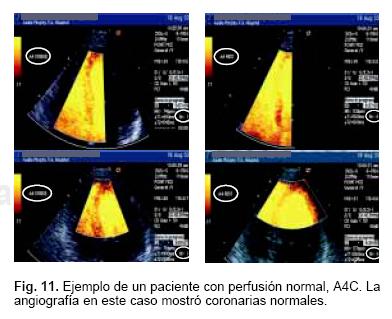
La Figura 11 corresponde a un caso en que el ecocardiograma con contraste no mostró defectos de perfusión, lo cual fue corroborado por angiografía coronaria normal. El estudio de medicina nuclear con Talio que se muestra en la Figura 12 corresponde a este paciente en donde se observa un defecto fijo de perfusión en la pared inferior muy probablemente debido a un artefacto (atenuación diafragmática).
CARDIOsphere fue el primer estudio multicéntrico de perfusión miocárdica realizado a gran escala en 884 pacientes. Las imágenes con CARDIOsphere y medicina nuclear fueron evaluadas por múltiples lectores cegados a los resultados entre sí. Se utilizó un diseño de no inferioridad y el desempeño relativo de las dos modalidades fue comparado con un estándar de referencia (angiografía coronaria cuantitativa) en más del 75% de los pacientes. Este estándar considera obstrucción significativa > 50%, y severa > 75%.
Uno de los aspectos más importantes por recalcar en el estudio CARDIOsphere es que la lectura de los estudios ecocardiográficos, de medicina nuclear, y angiográficos fue realizada por laboratorios centrales, cegados entre sí en relación a resultados y a cualquier información clínica. Los resultados mostrados en la Figura 13 son preliminares y están disponibles en la página www.pointbio.com, de la compañía POINT Biomedical, San Carlos, CA.28 Es importante mencionar que existen varias limitaciones con el uso de esta tecnología, las más relevantes son: 1) el método es aplicable en pacientes con buena ventana acústica, 2) los movimientos tanto del paciente como del operador pueden crear artefactos, y 3) el análisis simultáneo de perfusión y movimiento parietal segmentario durante estrés no es posible.
AI–700. ACUSPHERE (ACUSphere Inc, Cambridge MA)31 www.acusphere.com
AI–700 es un contraste de segunda generación específicamente generado para entrega intravenosa de gases en ecocardiografia con contraste, para determinación de perfusión y flujo sanguíneo miocárdico y como marcador de flujo coronario. Sus micropartículas son mucho más pequeñas que los glóbulos rojos (2 µm) de manera que atraviesan libremente los capilares pulmonares más pequeños y tienen gran capacidad de reflexión de ultrasonido por lo cual actúan como trazadores. Alcanza una concentración de 2.2 x 109 micropartículas.32,33 Luego de ser reconstituido se administra por vía intravenosa en bolo o en infusión continua.
AI–700 está constituido de una cubierta de polímeros sintéticos biodegradables que no se rompen fácilmente durante la obtención de imágenes. Contiene en su interior perfluorobutano, gas menos soluble que el agua por lo cual permanece mayor tiempo dentro de las micropartículas, logrando alta concentración miocárdica por largo tiempo (persistencia).
Actualmente se están llevando a cabo investigaciones clínicas en fase III para lo cual plantea estudiar más de 650 pacientes siendo los puntos a valorarse la sensibilidad y especificidad del método en relación a medicina nuclear y a angiografía coronaria. En forma similar al estudio CARDIOsphere, los resultados con la burbuja AI–700 se interpretan en laboratorios centrales de ecocardiografia, medicina nuclear y angiografía coronaria cegados entre sí a los resultados e información clínica.
Para evaluar perfusión miocárdica se divide el miocardio en regiones de acuerdo a la distribución coronaria con esquemas ya establecidos en las 3 vistas apicales: 4–cámaras, 2–cámaras, y 3–cámaras. Se obtienen imágenes tanto en reposo como en esfuerzo. Los estudios de medicina nuclear durante la fase de estrés (con dipiridamol) y la ecocardiografia se pueden realizar el mismo día o en días separados. Como se describe en la Tabla VI la adquisición de imágenes con ACUSphere se hace en dos modalidades, en Tiempo–Real con empleo de bajos y altos niveles de energía para asegurar el llenado (bajo IM), destrucción (alto DVI), seguido inmediatamente de repletamiento parietal por microburbujas (bajo DVI). La interpretación de las imágenes en Tiempo Real incluyen una combinación de análisis parietal segmentario simultáneamente con la presencia o ausencia de defectos de perfusión subendocárdica. Posteriormente se cambia al modo de ultraarmónicas para obtener imágenes gatilladas y sincronizadas con el electrocardiograma durante sístole en intervalos 1:1, 1:2, y 1:4.
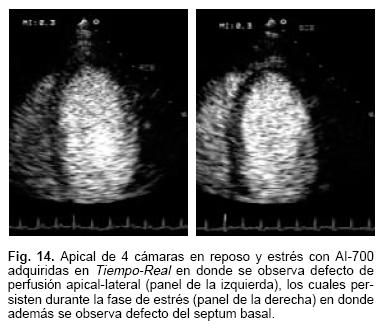
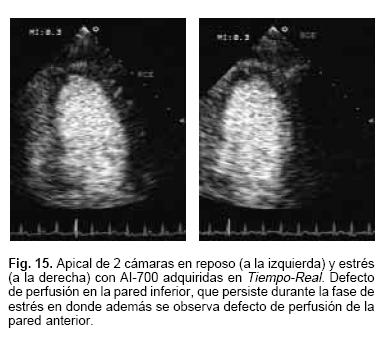
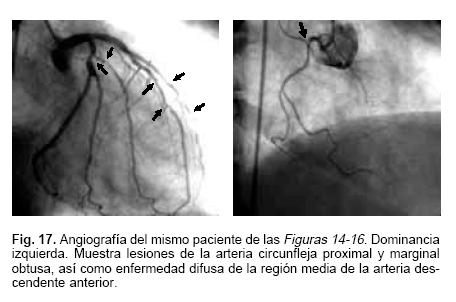
Las imágenes mostradas en las Figuras 14 y 15 corresponden a estudios de perfusión miocárdica con este agente adquiridas en Tiempo–Real en 4 y 2 cámaras durante el reposo y la fase de estrés. En el estudio de medicina nuclear con sesta MIBI, en la Figura 16 se aprecian defectos inferoseptal, lateral, y defecto ligero apical. La coronariografía mostrada en la Figura 17, en este caso con dominancia izquierda, con lesiones trivasculares, defectos múltiples de la arteria circunfleja y enfermedad difusa de la descendente anterior en su segmento medio.
Conclusiones
En la enfermedad coronaria, el análisis de la perfusión miocárdica sigue siendo el objetivo central de los estudios no invasivos. Por décadas la perfusión miocárdica con ecocardiografia estuvo relegada ante la poca eficacia de los agentes empleados, la incomprensión de sus principios básicos, y las limitantes impuestas por la tecnología. Con las nuevas generaciones de contraste constituidas por micropartículas "inteligentes", con destrucción selectiva y modulada en forma externa, y el desarrollo de nuevas técnicas de adquisición, se plantea ahorro de tiempo, seguridad, y efectividad en el proceso de estratificación y diagnóstico en pacientes con enfermedad coronaria.
En los siguientes 3 a 5 años, estos autores predicen que existirá por lo menos un agente de contraste comercialmente disponible para perfusión miocárdica. Sin embargo, su uso en la práctica clínica diaria dependerá de las características del paciente (ventana acústica), de la indicación clínica (isquemia, viabilidad miocárdica), de la experiencia del laboratorio (curva de aprendizaje), del costo, y lo más importante, de la evidencia de que sus resultados efectivamente influyen en el desenlace del paciente.
Una vez que la técnica se establezca habrá oportunidad de aprovechar sus propiedades en estudios de perfusión, no sólo para identificar su presencia o ausencia o para evaluar la movilidad segmentaria parietal, sino para definir criterios que permitan interpretar viabilidad: miocardio aturdido, miocardio hibernante. Lacuantificación de los defectos es otro reto que la ecocardiografía de perfusión miocárdica tendrá que abatir para poder competir con métodos ya establecidos como son la medicina nuclear y la tomografía de emisión de positrones.
Referencias
1. Gramiak R, Shah PM: Echocardiography of the aortic root. Invest Radiol 1968; 3: 356–366. [ Links ]
2. Gramiak R, Nanda NC, Shah PM: Echocardiography detection of the pulmonary valve. Radiology 1972; 102: 153–157. [ Links ]
3. DeMaria AN, Bommer WJ, Riggs K: Echocardiography visualization of myocardial perfusión by left heart an intracoronary injections of echo contrast agents, (abstr) Circulation 1980; 62(Suppl. II): 143. [ Links ]
4. Feinstein SB, Shah PM, Bing RJ: Microbubble dinamycs visualization in the intact capillary circulation. J A Coll Cardiol 1984a; 4: 595–600. [ Links ]
5. Villanueva FS, Glashen WP, Sklenar J: Assessment of risk area during coronary occlusion and infarct size after reperfusion with myocardial contrast echocardiography using left and right atrial injections of contrast. Circulation 1993; 88: 596. [ Links ]
6. Shroder K, Agrawal R, Voller H, Schilief R, Scroder R: Improvenment of endocardial border delineation in suboptimal stress– echocardiograms using the new heart contrast agent SH U 508 a. Int J Cardia Imagin 1994; 10: 45–51. [ Links ]
7. Porter T, Xie F, Kricsfeld A, Chiou A, Dabestani A: Improved endocardial border resolution during dobutamine stress echocardiography with intravenous sonicated dextrose albumin. J A Coll Cardiol 1994; 23: 1440–1443. [ Links ]
8. Falcone RA, Marcovitz PA, Perez JE, Dittrich HC, Hopkins WE, Armstrong WF: Intravenous albuminex during dobutamine stress echocardiography: Enhanced localization of left ventricular endocardial borders. A Heart J 1995; 130:254–258. [ Links ]
9. Jayaweera AR, Edwards N, Glasheen WP, Villanueva FS, Abbott RD, Kaul S: In vivo myocardial kinetics of air–filled albumin microbubbles during myocardial contrast echocardiography. Comparison with radiolabeled red blood cells. Circ Res 1994; 74: 1157–1165. [ Links ]
10. Porter TR, Xie F, Kricsfeld A, Deligonul U, Kilzer K: Reduction in left ventricular cavitary attenuation and improvement in posterior myocardial contrast with higher molecular weight intravenous perfluorocarbon–exposed sonicated dextrose albumin microbubbles. J Am Soc Echocardiogr 1996; 9: 437–441. [ Links ]
11. Ota T, Hillman ND, Craig D, Kisslo J, Smith PK: Contrast echocardiography: influence of ultrasonic machine settings, mixing conditions, and pressurization on pixel intensity and microsphere size of Albunex solutions in vitro. J Am Soc Echocardiogr 1997; 10: 31–40. [ Links ]
12. Miller AP, Nanda N: Contrast Echocardiography: New Agents. Ultrasound in Med and Biol 2004; 30(4): 425–434. [ Links ]
13. Morse PM, Ingard KU: Theoretical acoustics. New York: McGraw–Hill 1968: 436–441. [ Links ]
14. García Fernández MA, García Orta R, Martínez Selles M: Avances en ecocardiografia. Ecocardiografía de contraste. En: Ayuela JM, López Pérez JM, Fiol M. Ecocardiografia en el paciente crítico. Barcelona. Springer–Berlag–Iberic. 2000: 376–381. [ Links ]
15. De Jong N, Comet R, Lancee CT: Higher harmonics of vibrating gas–filled microspheres. Part one: simulations. Ultrasonics 1994; 32: 447–453. [ Links ]
16. Wei K, Skyba DM, Firschke C, Jayaweera AR, Lindner JR, Kaul S: Interactions between microbubbles and ultrasound: in vitro and in vivo observations. J Am Coll Cardiol 1997; 29: 1081–1088. [ Links ]
17. De Jong N, Hoff L, Skotland T, Bom N: Absorption and scatter of encapsulated gas filled microspheres: theoretical considerations and some measurements. Ultrasonics 1992; 30: 95–103. [ Links ]
18. Miller DL: Ultrasonic detection of resonant cavitation bubbles in a flow tube by their second–harmonic emissions. Ultrasonics 1981; 19: 217–224. [ Links ]
19. Burns PN: Harmonic imaging with ultrasound contrast agents. Clin Radiol 1996; 51: 50–55. [ Links ]
20. De Jong N, Cornet R, Lancee CT: Higher harmonics of vibrating gas–filled microspheres. Part two: measurements. Ultrasonics 1994; 32: 455–459. [ Links ]
21. Porter TR, Xie F, Li S, et al: Increased ultrasound contrast and decreased ultrasound destruction rates with triggered ultrasound imaging. J Am Soc Echo– Cardiogr 1996; 9: 599–605. [ Links ]
22. Rubin DN, Thomas JD: New Imaging Technology: measurement of myocardial perfusión by contrast echocardiography. Coronary Artery Disease 2000; 11: 221–226. [ Links ]
23. Porter TR, Xie F: Transient myocardial contrast foliowing initial exposure to diagnostic ultrasound pressures with minute doses of intravenously injected micro bubbles: demonstration and potential mechanisms. Circulation 1995; 92: 2391–2395. [ Links ]
24. Monaghan MJ: Contrast Echocardiography: from left ventricular opacification to myocardial perfusion. Are the promises to be realized? Heart 2003; 89: 1389–1390. [ Links ]
25. Zierler KR: A simplified explanation of the theory of indicator–dilution for measurement of fluid flow and volume and other distributive phenomena. Bull Johns Hopkins Hosp 1958; 103: 199–223. [ Links ]
26. Meier P, Zierfer KL: On the theory of indicator–dilution method for measurement of blood flow and volume. J Appl Physiol 1954; 6: 731–740. [ Links ]
27. Powsner SM, Keller MW. Saniie J, Feinstein SB: Quantitation of echo–contrast effects. Am J Physiologic Imaging 1986; 1: 124–128. [ Links ]
28. Oraby MA, Hays J, Maklady FA, El–Hawary AA, Yaneza LO, Zabalgoitia M: Comparison of real–time coherent contrast imaging to dipyridamole thallium–201 single–photon emission computed tomography for assessment of myocardial perfusion and left ventricula rwall motion. Am J Cardiol 2002; 90: 449–54. [ Links ]
29. Orobay MA, Hays J, Maklady FA, El–Hawary AA, Zabalgoitia M: Assessment of myocardial perfusion during pharmacologic contrast stress echocardiography. Am J Cardiol 2002; 89: 640–4. [ Links ]
30. Pointbio: Demostración del producto. Página web: www.pointbio.com 2005 [ Links ]
31. Acusphere: Demostración del producto. Página web: www.acuspher.com 2005 [ Links ]
32. Walovitch RC, Kwan OL, Picard MH: Inicial safely and myocardial perfusión imaging results with AI–700 synthetic polymeric ultrasound contrast agent. J Am Soc Echocardiogr 2000; 13(251A): 457. [ Links ]
33. Church C: The acoustical responses of AI–700 in vitro. J Am Soc Echocardiogr 2000; 13(251B): 457. [ Links ]














