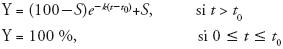Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.45 no.8 Texcoco nov./dic. 2011
Protección vegetal
Variación de fenotipos de crecimiento y de virulencia en cepas mutantes de Beauveria bassiana (Bals.) Vuill. resistentes a 2–desoxi–D–glucosa
Virulence and growth phenotypes variation in mutant strains of Beauveria bassiana (Bals.) Vuill. resistant to 2–deoxy–D–glucose
Roberto Montesinos–Matías1, Gustavo Viniegra–González1, Raquel Alatorre–Rosas 2, Francisco Gallardo–Escamilla1(†), Octavio Loera1*
1 Universidad Autónoma Metropolitana–Iztapalapa, Departamento de Biotecnología, 09340, México, D.F. México. * Autor responsable.
2 Fitosanidad. Campus Montecillo. Colegio de Postgraduados. 56230. Montecillo, Estado de México. (loera@xanum.uam.mx).
Recibido: junio, 2011.
Aprobado: noviembre, 2011.
Resumen
En los procesos de mejoramiento de cepas de hongos entomopatógenos es necesario conocer cuáles son y cómo inciden las variables más importantes en las cepas más virulentas. En este estudio se evaluó una serie de variables de crecimiento y de virulencia de una cepa parental de Beauveria bassiana (Bals.) Vuill. (Hypocreales: Cordycipitaceae) (88) y mutantes derivadas resistentes al compuesto tóxico 2–desoxi–D–glucosa (2DG). La 2DG es un análogo tóxico de la glucosa, y se ha usado con frecuencia para aislar diversas mutantes de microorganismos desregulados en el metabolismo del carbono. De las variables evaluadas, previo al bioensayo de virulencia sobre larvas de Tenebrio molitor (Coleoptera: Tenebrionidae), el porcentaje de germinación de conidios (G) se correlacionó mejor con los parámetros de virulencia como el tiempo de inicio de muerte (t0) (r=–0.879; p<0.05), tiempo letal 50 (TL50) (r=–0.869; p<0.05) y mortalidad máxima M (r=0.589; p=0.1). Las demás variables evaluadas mostraron una correlación menor con la virulencia. Se destaca la alta correlación de t0 con el TL50 (r=0.967; p<0.05), variable determinada en la etapa temprana de infección de B. bassiana en larvas de T. molitor. Las cepas mutantes 881.2, 882.5 y 885.5 resistentes a 2DG mostraron características mejoradas en la virulencia comparadas con la cepa parental (88). Lo anterior se corroboró mediante coeficientes de regresión simple y Análisis de Componentes Principales (ACP), usados para examinar la relación entre las variables de estudio. El análisis de los resultados muestra las características fisiológicas con mayor influencia para seleccionar cepas más virulentas de hongos entomopatógenos.
Palabras clave: control biológico, virulencia, germinación, Tenebrio molitor, Análisis de Componentes Principales.
Abstract
In the breeding processes of fungal strains of entomopathogenic, it is necessary to know which ones they are and how the most important variables have influence on the most virulent strains. In this study an evaluation was made of a series of growth and virulence variables of a parental strain of Beauveria bassiana (Bals.) Vuill. (Hyocreales: Cordycipitaceae) (88) and derived mutants resistant to the toxic compound 2–doxy–D–glucose (2DG). 2DG is a toxic analogue of glucose, and has frequently been used to isolate a variety deregulated mutants in the metabolism of carbon in some microorganisms. Of the variables evaluated, prior to the bioassay of virulence on larvae of Tenebrio molitor (Coleoptera: Tenebrionidae), the percentage of germination of conidia (G) was best correlated with the parameters of virulence such as time of onset of death (t0) (r=–0.879; p<0.05), lethal time 50 (LT50) (r=–0.869; p<0.05) and maximum mortality M (r=0.589; p=0.1). The other variables evaluated showed a lower correlation with virulence. There is a high correlation of t0 with the LT50 (r=0.967; p<0.05), a variable determined in the early stage of infection of B. bassiana in larvae of T. molitor. The mutant strains 881.2, 882.5 and 885.5 resistant to 2DG showed improved characteristics in virulence compared with the parental strain (88). The above was confirmed through simple regression coefficients and Principal Components Analysis (PCA), used to examine the relationship among the variables of study. The analysis of the results shows the physiological characteristics with highest influence to select more virulent strains of entomopathogenic fungi.
Key words: biological control, virulence, germination, Tenebrio molitor, Principal Components Analysis.
Introducción
En relación al desarrollo del control biológico, los hongos entomopatógenos (HE) fueron los primeros agentes microbianos usados para el control de plagas de insectos (Glare, 2004; Zimmermann, 2007). Estos microorganismos pueden infectar a los insectos a través de la penetración de su cutícula, mediante múltiples mecanismos de acción, lo que les confiere una alta capacidad para evitar que el hospedero desarrolle resistencia. El hongo Beauveria bassiana (Bals.) Vuill (Hypocreales: Cordycipitaceae) es una de las especies más estudiadas y usadas en el mundo, y puede infectar a más de 200 especies en nueve órdenes de insectos (Roy y Pell, 2000; Zimmermann, 2007). Aunque el proceso de patogénesis es multivariable, algunas características se relacionan positivamente con la virulencia para algunas interacciones hongo–hospedero; estas características incluyen la velocidad de germinación (Varela y Morales, 1996; Altre et al., 1999; Safavi et al., 2007), velocidad de crecimiento (Samuels et al., 1989; Varela y Morales, 1996; Khachatourians y Qazi, 2008), densidad superficial de esporulación (Feng y Johnson, 1990; Varela y Morales, 1996; Khachatourians y Qazi, 2008), así como la producción de toxinas (Glare, 2004; Khachatourians y Qazi, 2008) y niveles altos de enzimas extracelulares que destruyen el tejido del insecto (Gupta et al., 1994; Khachatourians y Qazi, 2008; Montesinos–Matías et al., 2011).
En los programas de mejoramiento de cepas es importante determinar el nivel de correlación entre estas variables fisiológicas y de crecimiento con la virulencia (Talaei–Hassanloui et al., 2006), de tal manera que se analicen y seleccionen cepas, silvestres o mutantes, que destaquen por su mejora significativa en varias de estas características, además de saber hasta qué punto se comparten entre las cepas aisladas más agresivas. Esto a su vez tiene fines prácticos para el desarrollo de agentes de biocontrol a partir de colecciones de cepas aisladas de cada región. Por ejemplo, en México se ha mostrado la conveniencia de aislar cepas de HE adaptadas a las condiciones climáticas de cada zona geográfica (De la Rosa et al., 1997; De la Rosa et al., 2000) y se ha comparado la virulencia de estos HE contra insectos que afectan a los cultivos (De la Rosa et al., 2002; Flores et al., 2002; Chan–Copul et al., 2010).
Una de la principales limitaciones en el desarrollo de los bioinsecticidas es que, en relación a los insecticidas químicos, después de su aplicación se requiere más tiempo (5–10 d) para mitigar la plaga, tiempo en el cual el insecto puede causar serios daños a la cosecha (Quesada–Moraga et al., 2006; Fan et al., 2007). Aunque en la naturaleza, los hongos mutan de manera natural provocando variaciones ligadas a la selección en la población, el mejoramiento de estos hongos se puede lograr por genética clásica (Robledo–Monterrubio et al., 2009), o bien por técnicas que involucran la inserción de secuencias de ADN ajenas a la especie en estudio (St Leger et al., 1996; Fang et al., 2005, 2009; Fan et al., 2007). Cuando en un HE se insertan genes o secuencias de otras especies, hay restricciones para el uso y liberación de estas cepas al medio ambiente, como lo establece en México la Ley de Bioseguridad de Organismos Genéticamente Modificados (OGM) (Reglamento de la Ley de Bioseguridad, 2008). El uso de microorganismos manipulados por genética clásica como método de mejoramiento de la virulencia, es una alternativa concreta al uso de OGM, además no representa un riesgo en la conservación de la biodiversidad (Ritter et al., 2004). Robledo–Monterrubio et al., (2009) desarrollaron una metodología para obtener cepas mejoradas de B. bassiana, mediante radiación ultravioleta (uv) y las mutantes se seleccionaron a partir de la resistencia a 2–desoxi–D–glucosa (2DG) en medios con quitina coloidal. Además se seleccionaron aquellas cepas que no perdieron la capacidad de esporulación, la secreción de enzimas hidrolíticas, y con una tasa de crecimiento igual o mayor al aislado silvestre (88) (Robledo–Monterrubio et al., 2009).
El objetivo de este estudio fue evaluar y correlacionar los fenotipos fisiológicos de una cepa silvestre de B. bassiana y sus mutantes, aisladas previamente (Robledo–Monterrubio et al., 2009), con la virulencia hacia Tenebrio molitor (Coleoptera: Tenebrionidae), el cual es considerado como plaga en almacenes de granos (Rodríguez–Gómez et al., 2009).
Materiales y Métodos
Microorganismos
Se usó la cepa silvestre de B. bassiana (88) y seis mutantes derivadas (881.2, 882.2, 882.5, 884.5, 885.5 y 887.5), por un proceso de mutagénesis con luz ultravioleta en un estudio previo (Robledo–Monterrubio et al., 2009), donde se expusieron los conidios de la cepa silvestre a luz ultravioleta (350μW/cm–2) hasta obtener un porcentaje de sobrevivencia entre 50 y 10 % y las mutantes se recuperaron en medio con quitina y 2 desoxi–D–glucosa (0.2 o 0.5 g L–1). Estas mutantes y la cepa silvestre se reactivaron por pase sobre larvas de T. molitor para recuperar las características de virulencia (Safavi et al., 2007). Los conidios de insectos micosados tomados con el asa se sembraron por estría en medio agar maltosa Sabouraud (AMS) más desoxicolato de sodio al 0.05 % (Sigma, México) con la finalidad de recuperar colonias compactas (Goettel e Inglis, 1997). De este cultivo, se propagaron colonias independientes en medio agar maltosa Sabouraud al 2 %, más un suplemento de extracto de levadura (0.5 %) y avena pulverizada (1.5 %) (SMAYO) por 10 d a 28 °C. Los conidios producidos en este medio se usaron para las pruebas subsecuentes.
Identificación molecular a través de genes de ADNt
Para la extracción del ADN genómico de la cepa silvestre (88) se empleó un kit de purificación de ADN de Wizard® Genomic Promega (Cat. A1120). La amplificación del fragmento de ITS por PCR se realizó con los cebadores (primers) ITS5 (5'–GGA AGT AAA AGT CGT AAC AAG–3') e ITS4b (5'–TCC TCC GCT TAT TGA TAT GC–3'), usando 30 ciclos de desnaturalización (94 °C por 45 s), hibridación (55 °C por 1 min) y polimerización (72 °C por 45 s). Los cebadores se diseñaron de las secuencias conservadas 18S–ADNr y 28S–ADNr en hongos (White et al., 1990). La secuencia de nucleótidos de los fragmentos amplificados se compararon con las secuencias ya publicadas en la base de datos del NCBI (National Center for Biotechnology Information).
Prueba de germinación (G)
El porcentaje de conidios germinados se determinó siguiendo la metodología descrita por Goettel e Inglis et al. (1997). Sobre un portaobjetos, en condiciones de asepsia, se colocó una gota de una solución de agaragua al 1.5 %. Se dejó enfriar y se colocó 50 μL de una suspensión de conidios, cuya concentración fue de 1×106 conidios mL–1. El portaobjetos se colocó sobre un disco de papel filtro humedecido dentro de una caja Petri y se incubó a 28 °C durante 24 h. Los conidios se consideraron como germinados si el tubo germinativo era mayor al diámetro del propio conidio (Safavi et al., 2007). Los conidios aquí evaluados se utilizaron para la prueba del bioensayo.
Tasa de crecimiento radial (V) y producción de conidios (p)
Cada cepa se sembró por picadura en el centro de cajas petri de 49 mm de diámetro con 10 mL de medio SMAYO, empleando un palillo de madera estéril cuya punta se sumergió por 3 s en una suspensión de 1×106 conidios mL–1 (Rodríguez–Gómez et al., 2009). Se aseguró que el palillo tocara el fondo de las cajas Petri (4 mm de profundidad). Se midió el crecimiento radial con un Vernier cada 24 h. Las mediciones se detuvieron cuando al menos una de las cepas le faltaba medio centímetro para llegar al borde de la caja. Se calculó la pendiente por regresión lineal, este valor se tomó como tasa de crecimiento radial (Vr), expresada en mm d–1 (Safavi et al., 2007). La producción de conidios se midió al final del crecimiento radial. Se cortó con un tubo de ensayo (1 cm diámetro), tres fragmentos del hongo ya esporulado entre el centro y el borde de la colonia de cada cepa (Kamp y Bidochka, 2002). Se cosecharon los conidios usando Tween 80 al 0.05 % (v/v) en tubos Falcon de 15 ml. Se realizó el conteo al microscopio con la cámara de Neubauer, al final se reportó la densidad como conidios producidos cm–2. Se realizaron cinco repeticiones (una caja fue una repetición) por cepa para evaluar ambas variables.
Cría de insectos y bioensayos
Se estableció una colonia de T. molitor en cajas de plástico rectangulares para los diferentes estadios de desarrollo. Los insectos se mantuvieron a temperatura ambiente, se les alimentó con una mezcla de avena y salvado de trigo (1:1), además se colocó un algodón húmedo estéril en cada caja.
Para las pruebas de virulencia se emplearon grupos de 10 larvas, melanizadas de un solo color y un tamaño de 2 cm de longitud, que fueron sumergidas en 30 mL de una suspensión con conidios de B. bassiana (1×108 conidios mL–1) o solución de Tween 80 al 0.05 % (v/v) (Testigo) por 15 s (Safavi et al., 2007). Se realizaron cinco repeticiones por tratamiento. Una vez que se infectaron los insectos, se agregó alimento estéril (avena/ salvado de trigo 1:1) en cada caja Petri. Las cajas se incubaron a 28± 1 °C con un fotoperiodo de 12:12 h en contenedores de plástico transparente con papel filtro húmedo. La mortalidad se registró diariamente y los insectos muertos se colocaron en cámaras húmedas para promover el crecimiento del hongo, confirmando que la muerte fue ocasionada por la infección de B. bassiana. Al final del bioensayo se evaluó el tiempo de inicio de muerte (t0, d) (Gupta et al., 1994), el tiempo para alcanzar 50 % de mortalidad (H^, d), la velocidad específica de muerte (k, d–1) y la mortalidad máxima acumulada (M, %); que se calcularon con el ajuste de los datos al siguiente modelo de decaimiento exponencial:
donde, Y es el porcentaje de sobrevivencia al tiempo t y S el nivel de sobrevivencia asintótica estimada (%); Y  S, para t
S, para t  ∞ (Rodríguez–Gómez et al., 2009).
∞ (Rodríguez–Gómez et al., 2009).
Producción de conidios sobre cadáveres de T. molitor (F)
En cadáveres micosados, con 12 d de haber sido infectados con el hongo, se midió la producción de conidios. Se seleccionaron al azar cuatro cadáveres de T. monitor, se llevaron a un volumen de 10 mL de Tween 80 al 0.05 % y se agitó por 5 min con una barra magnética (Tefera y Pringle, 2003). En esta suspensión se realizó el conteo en cámara de Neubauer y se reportó el promedio (conidios producidos larva–1) y la desviación estándar (SD) de estas observaciones.
Análisis de datos
Los resultados se expresaron como valores promedios ± SD. Con los datos se hizo un análisis de varianza (ANDEVA) y una prueba de Tukey (p<0.05) para las medias. Para determinar la correlación de las variables se usó una análisis de correlación simple (Pearson) y un método de estadística multivariable de Análisis de Componentes Principales (ACP), en el cual se transforman las variables originales (conjunto de variables) en componentes principales (variables sintéticas) que son funciones lineales de las primeras (Ramette, 2007). El primer CP (CP1) representa la mayor porción de variabilidad de los datos y sucesivamente los componentes restantes (CP2, CP3, etc.), la mayor porción de variabilidad remanente. El programa para analizar los datos fue el SPSS versión 13 (SPSS Inc., Chicago, IL).
Resultados y Discusión
Identificación molecular
La cepa silvestre (88) fue proporcionada por el Laboratorio de Patología de Insectos del Instituto de Fitosanidad del Colegio de Postgraduados, Montecillo, México. Esta cepa fue aislada originalmente del insecto Hypothenemus hampei en una finca de café ubicada en el sureste del estado de Oaxaca. Se planteó su identificación molecular a nivel de especie, debido a que sólo había sido caracterizada a nivel morfológico. El producto de amplificación de ITS fue de 596 pb. Después se realizó la comparación de las secuencias homólogas de la base de datos BLAST (Basic Local Alignment Search Tool) (http://blast.ncbi.nlm.nih.gov/Blast.cgi) y se obtuvo un porcentaje de similitud de más del 99 % con Cordyceps bassiana y B. bassiana (número de acceso GenBank es HM189220). Con base en esta comparación, se consideró a las cepas de estudio como B. bassiana, que es la fase asexual de Cordyceps bassiana (Cho et al., 2006).
Caracterización fenotípica de cepas de B. bassiana
Las características fisiológicas evaluadas de la cepa silvestre y las mutantes se resumen en el Cuadro 1. Estos fenotipos evaluados se reconocen como factores de virulencia en B. bassiana (Feng y Johnson, 1990; Posada y Vega, 2005; Safavi et al, 2007). De acuerdo con el protocolo de mutagénesis utilizado por Robledo–Monterrubio et al. (2009), se seleccionaron sólo aquellas mutantes que no perdieron significativamente la capacidad de esporulación, secreción de enzímas hidrolíticas y con una tasa de crecimiento igual o mayor a la cepa silvestre. Como se observa en el Cuadro 1, las mutantes mostraron fenotipos diversos en las variables medidas derivadas de la estrategia de selección.
La germinación mostró diferencias estadísticamente significativas (p<0.05) entre cepas. Esta variable se incrementó sólo en la cepa 881.2 (98.4 %), mientras que las cepas 882.2 (85.10±3.8 %), 885.5 (88.8 ±4.6 %) y 887.5 (89.1 ±2.7 %) mostraron un porcentaje de germinación similar a la cepa silvestre (90.2 %). Las mutantes 882.5 (78.80± 2.4 %) y 884.5 (57.34±4.1 %) mostraron los valores menores. Es importante señalar que el método de mutación fue al azar como ya se mencionó, por lo cual se esperaría una variación en estas variables medidas (Cuadro 1). La germinación en hongos entomopatógenos comúnmente se evalúa a las 24 h (Goettel e Inglis, 1997), pero Posada y Vega (2005) recomiendan evaluar la germinación de 12 a 72 h porque esta variable se afecta por el medio de cultivo usado durante la prueba, así como también de las características fisiológicas del inóculo. La evaluación en este lapso de tiempo permite tener una mejor idea del potencial del patógeno para las pruebas de virulencia posterior (Posada y Vega, 2005). Al seleccionar aislados con una rápida germinación aumenta la probabilidad de éxito en campo; en contraste, los aislados con una lenta germinación son más sensibles a las variaciones ambientales. La velocidad de germinación es una de las determinantes de virulencia más reportada (Shah et al., 2005).
La Vr también mostró diferencias estadísticas significativas (p<0.05) entre las cepas evaluadas, con un intervalo de 1.98 mm d–1 (88) a 2.43 mm d–1 (881.2) (Cuadro 1). Todas las mutantes seleccionadas mostraron un crecimiento radial superior a la cepa silvestre, aun cuando los valores obtenidos en el presente estudio son inferiores a lo reportado por Safavi et al. (2007). Es importante considerar que la tasa de crecimiento radial es una variable que depende de diversos factores, por ejemplo, el tipo de cepa utilizada, la naturaleza del sustrato donde crece el hongo, la relación C/N del sustrato usado, entre otros factores ( Shah et al., 2005; Safavi et al., 2007). La tasa de crecimiento radial es un indicativo de la capacidad del hongo para invadir los sustratos donde crece, pero también se relaciona con su capacidad para crecer sobre la cutícula, como estrategia competitiva contra otros microorganismos durante el ciclo saprobio, lo que acelera la infección del hospedero (Varela y Morales, 1996).
La densidad superficial de conidios de B. bassiana de igual manera mostró diferencias estadísticas significativas entre cepas (p<0.05) (Cuadro 1). La mutante 881.2 (75.6±5.5×107 conidios cm–2) alcanzó la mayor producción de conidios, mientras que la cepa silvestre (15.35 ± 2.03×107 conidios cm–2) y la cepa 882.2 (4.27±0.63×107 conidios cm–2) mostraron entre 80 % y 94 % menor producción, en comparación a la cepa 881.2. El proceso de mutagénesis en B. bassiana afectó de manera distinta las variables fisiológicas analizadas. Considerando la producción de conidios cm–2 para la cepa 881.2, con un tiempo de cosecha de 10 d de cultivo, ésta fue 78 veces superior a lo reportado por Kamp y Bidochka (2002), utilizando medio SDA al 4 % y un tiempo de incubación de 15 d. Los conidios son las unidades infectivas de los HE y el estudio de su producción es esencial durante las prácticas comerciales o de laboratorio.
La determinación de la cantidad de conidios de B. bassiana producidos en los insectos muertos de T. molitor se realizó a los 12 d de incubación postmuerte (Cuadro 1) para asegurar que el hongo completara su ciclo de vida saprobio (Posada y Vega, 2005). Esta variable mostró diferencias estadísticas significativas (p<0.05) con valores de 1.75×107 (885.5) a 26.54 x107 (882.5) conidios por larva. De manera específica, la cepa 882.5 tuvo una producción de más de ocho veces superior a la cepa 88. La capacidad de esporulación del hongo sobre su hospedero es fundamental para diseminar la enfermedad en condiciones de campo, pues permite reinfecciones a partir de insectos muertos. Además, al pasar por el insecto, se mantiene la virulencia del HE. Esta capacidad de esporulación in vivo también se considera como criterio durante la selección de aislados más virulentos (Posada y Vega, 2005; Pava–Ripoll et al, 2008).
Bioensayos de virulencia en larvas de T. molitor
El Cuadro 2 muestra los parámetros de virulencia obtenidos para las cepas de B. bassiana evaluados, utilizando larvas de T. molitor como hospedero. El TL50 mostró diferencias estadísticas significativas entre cepas (p<0.05). Las mutantes 882.5 y 881.2 tuvieron el TL50 menor, 5.6± 0.34 d y 5.72± 0.41 d. En contraste, la cepa 884.5 no alcanzó el 50 % de mortalidad aun después de los 12 d postinfección. Estos valores de TL50 obtenidos para la cepa silvestre y 882.5 son similares a lo reportado por Rodríguez–Gómez et al. (2009). En este sentido, Safavi et al. (2007) muestran valores de TL50 entre 3.05 y 8.86 d para B. bassiana utilizando larvas de T. molitor como hospedero. Sin embargo, estos autores variaron algunas condiciones, por ejemplo, el tiempo de inmersión de los insectos en la suspensión de conidios fue el doble (30 s), y además los insectos se mantuvieron sin alimento durante el bioensayo. Según Siva–Jonhy y Thomson (2002), la privación nutricional tiene implicaciones en la modulación del sistema inmune en T. molitor, haciéndolos más susceptible a la infección por B. bassiana, lo que repercute en la interpretación o comparación de variables de virulencia.
Con el propósito de mejorar la virulencia de algunos HE se ha recurrido a la incorporación de genes de enzimas hidrolíticas que participan en el proceso de infección. Por ejemplo, la expresión constitutiva de la proteasa Pr1A en Metarhizium anisopliae (Metschn.) Sorokin resultó en una disminución de 25 % en el TL50 sobre larvas de Manduca sexta (St Leger et al., 1996). Del mismo modo, con la sobreexpresión de un gen de quitinasa (Bb chit1–Bm Ch BD) en cepas de B. bassiana se logró reducir el TL50 hasta en 23 % (Fan et al., 2007). Fang et al. (2009) reportan que la sobreexpresión en forma combinada de estos genes (Bbchit1 y cdep1) en B. bassiana 0062, lograron reducir el TL50 en 24.9 %. En el presente estudio, mediante otra estrategia de mejoramiento (genética clásica), el TL50 disminuyó en 16 % y 17 % para las mutantes 881.2 y 882.5, en comparación a la cepa silvestre (Cuadro 2). Además, el porcentaje de mortalidad máxima acumulada (M) de las cepas analizadas aumentó en 47 % y 49 % para las cepas 881.2 (96.93±3.5 %) y 882.5 (97.84±4.1 %) en comparación con la silvestre (65.84±5.15 %). Es importante mencionar que en México no está permitido la liberación de organismos transgénicos (Reglamento de la Ley de Bioseguridad, 2008); sin embargo, las cepas mejoradas por radiación uv no tienen esta limitante.
En relación a la variable t0, los valores obtenidos muestran una estrecha relación con el TL50 (r= 0.967; p<0.05). Las cepas más infectivas requieren un tiempo menor para iniciar la muerte de los insectos (Cuadro 2, Figura (1) 2). Este fenómeno (etapa temprana de infección) se explica en parte por la modificación de las variables de crecimiento, así como por la alteración en la secreción de enzimas para hidrolizar la cutícula de T. molitor (Montesinos–Matías et al., 2011). En el caso de la velocidad especifica de muerte (k), los valores estimados mostraron diferencias estadísticamente significativas (p<0.05) (Cuadro 2).


Análisis de correlación de variables de crecimiento y virulencia
La Figura 1 muestra la correlación simple (Pearson) de cada par de variable evaluada, haciendo énfasis en fenotipos de crecimiento y variables de virulencia. Al considera los fenotipos evaluados previos al bioensayo, el porcentaje de germinación (G) tuvo la mejor correlación con las variables de virulencia t0 (r=–0.879: p<0.05), TL50 (r=–0.869; p<0.05) y M (r=0.589; p=0.1).
Posteriormente, para englobar todas las variables evaluadas en un análisis de correlación se usó el método ACP. El análisis indicó que 84.24 % de la variabilidad se puede explicar por tres componentes: CP1 (53.92 %), CP2 (19.22 %) y CP3 (11.08 %). El diagrama generado mediante ACP (Figura 2) muestra a los grupos de variables que denotan correlación positiva entre ellas, por ejemplo, k, ρ, Vr y G; o entre el TL50 y t0. La velocidad específica de muerte (k) mostró una fuerte correlación con las variables de crecimiento Vr, G y ρ, evaluadas previo al bioensayo de virulencia.
La Figura 2 muestra la distribución de cada cepa ( ) en el plano cartesiano y la variable que mejor la caracteriza, por ejemplo, la cepa 881.2 sobresale en los parámetros k, ρ, Vr y G. Con base en esta herramienta de análisis, las mutantes 881.2 y 882.5 resistentes a 2DG son promisorias como agentes de control biológico, debido a que muestran características mejoradas en variables de crecimiento y de virulencia (Figura 2). El ACP se ha empleado en ecología microbiana como herramienta de análisis a diversos conjuntos de datos de fenotipos y genotipos, y es uno de los análisis exploratorios más usados (Ramette, 2007).
) en el plano cartesiano y la variable que mejor la caracteriza, por ejemplo, la cepa 881.2 sobresale en los parámetros k, ρ, Vr y G. Con base en esta herramienta de análisis, las mutantes 881.2 y 882.5 resistentes a 2DG son promisorias como agentes de control biológico, debido a que muestran características mejoradas en variables de crecimiento y de virulencia (Figura 2). El ACP se ha empleado en ecología microbiana como herramienta de análisis a diversos conjuntos de datos de fenotipos y genotipos, y es uno de los análisis exploratorios más usados (Ramette, 2007).
Esta correlación positiva, entre algunos fenotipos de crecimiento y la mayor virulencia en HE, coincide con algunos reportes previos (Varela y Morales, 1996; Altre et al., 1999; Safavi et al., 2007). Sin embargo, en este estudio se usó como primer criterio la resistencia a 2DG para la selección de mutantes, puesto que en otros hongos filamentosos ya se ha descrito que la resistencia a 2DG se asocia con la desrepresión de enzimas hidrolíticas, alteración de los patrones de esporulación y crecimiento radial, y de algunos metabolitos de interés industrial (Minjares–Carranco et al., 1997). Los mecanismos de resistencia a 2DG se relacionan con la sobreexpresión de enzimas quinasas y fosforilasas, que a su vez participan en diversas rutas de transducción de señales (Randez–Gil et al., 1995). Beauveria bassiana es el único HE en el que se ha probado esta estrategia de mejoramiento de cepas (Robledo–Monterrubio et al., 2009).
Los factores de virulencia individuales se han descrito para diversos HE; sin embargo, como sucede con otros hongos, B. bassiana emplea múltiples mecanismos de acción durante el proceso de infección en su hospedero, muchos de los cuales no están aun dilucidados, en particular a nivel molecular (Cho et al., 2006). Esta es la primera vez que se sigue esta estrategia, análisis de fenotipos propuestos, como herramienta para analizar y seleccionar mutantes superiores en parámetros como la rapidez en que muere el insecto, lo que las hace candidatas para utilizarse en programas de control biológico.
Conclusiones
Después del análisis de fenotipos propuestos, el uso de la resistencia a 2DG como criterio de selección de mutantes permitió identificar a las mutantes 881.2 y 882.5 como las más agresivas. Las variables de crecimiento G y Vr se correlacionaron mejor con los parámetros de virulencia t0, TL50 y M. La afirmación previa fue corroborada mediante un ACP y coeficientes de regresión simple. Este trabajo contribuye con un método de análisis y selección de cepas mejoradas, aplicable a HE, basado en características fisiológicas y de virulencia. Lo anterior tiene impacto en programas de control biológico, con énfasis en un uso más eficiente del tiempo, trabajo y recursos disponibles.
Agradecimientos
Al CONACYT por la beca otorgada a R. Montesinos Matías (Reg. No. 202363) y por el proyecto de Ciencia Básica 152420–z, a la UAM–Iztapalapa (DCBS) y a la Red Promep por el financiamiento conjunto para esta investigación".
Literatura citada
Altre, J. A., J. D. Vandenberg, and F. A. Cantone. 1999. Pathogenicity of Paecilomyces fumosoroseus isolates to Diamondback Moth, Plutella xylostella: Correlation with spore size, germination speed, and attachment to cuticle. J. Invertebr. Pathol. 73: 332–338. [ Links ]
Chan–Copul, W., E. Ruiz–Sánchez, J. Cristobal–Alejo, A. Pérez–Gutiérrez, R. Munguía–Rosales, and J. Lara–Reyna. 2010. In vitro development of four Paecilomyces (Isaria) fumosoroseus isolates and their pathogenicity on immature whitefly. Agrociencia 44(5): 587–597. [ Links ]
Cho, E. M., L. Liu, W. Farmerie, and N. O. Keyhani. 2006. EST analysis of cDNA libraries from the entomopathogenic fungus Beauveria (Cordyceps) bassiana. I. Evidence for stage–specific gene expression in aerial conidia, in vitro blastospores and submerged conidia. Microbiology 152: 2843–2854. [ Links ]
De la Rosa, W., R. Alatorre–Rosas, J. Trujillo, and J. F. Barrera. 1997. Virulence of Beauveria bassiana (Deuteromycetes) strains against the coffee berry borer (Coleoptera: Scolytidae). J. Econ. Entomol. 90 (9): 1534–1538. [ Links ]
De la Rosa, W., R. Alatorre–Rosas, J. F. Barrera, and C. Toriello. 2000. Effect of Beauveria bassiana and Metarhizium anisopliae (Deuteromycetes) upon the coffee berry borer (Coleoptera:Scolytidae) under field conditions. J. Econ. Entomol. 90 ( 9): 1409–1414. [ Links ]
De la Rosa, W., F. L. Lopez, and P. Liedo. 2002. Beauveria bassiana as a pathogen of the Mexican fruit fly (Diptera: Tephritidae) under laboratory conditions. J. Econ. Entomol. 95 (1): 36–43. [ Links ]
Fan, Y., W. Fang, S. Guo, X. Pei, Y. Zhang, Y. Xiao, D. Li, K. Jin, M. J. Bidochka, and Y. Pei. 2007. Increased insect virulence in Beauveria bassiana strain overexpressing and engineered chitinase. Appl. Environ. Microbiol. 73(1): 295–302 [ Links ]
Fang, W., B. Leng, Y. Xiao, K. Jin, J. Ma, Y. Fan, J. Feng, X. Yang, Y. Zhang, and Y. Pei. 2005. Cloning of Beauveria bassiana chitinase gene Bbchit1 and its application to improve fungal strain virulence. Appl. Environ. Microbiol. 71(1): 363–370. [ Links ]
Fang, W., J. Feng, Y. Fan, Y. Zhang, M.J. Bidochka, R.J. St. Leger, and Y. Pei. 2009. Expressing a fusion protein with protease and chitinase activities increases the virulence of the insect pathogen Beauveria bassiana. J. Invertebr. Pathol. 102: 155–159. [ Links ]
Feng, M. G., and J. B. Johnson. 1990. Relative virulence of six isolates of Beauveria bassiana on Diuraphis noxia (Homoptera: Aphididae). Environ. Entomol. 19 (3): 185–790. [ Links ]
Flores, A. G., W. de la Rosa, J. C. Rojas, and A. E. Castro–Ramirez. 2002. Evaluation of Beauveria bassiana and Metharhizium anisopliae (mitosporic) against species of the "White grub complex" in the south of Mexico. Southwest. Entomol. 27: 73–83. [ Links ]
Glare, T. R., 2004. Biotechnological Potential of Entomopatho–genic Fungal Biotechnology in Agricultural, Food, and Environmental Applications. Mycology Series Vol. 21. Arora, D. K. (ed). Edit Marcel Dekker Inc. New York, USA, 700 p. [ Links ]
Goettel, M. S., and D. G. Inglis. 1997. Fungi: Hyphomycetes. In: Lacey. L. A. (ed). Manual of Techniques in Insect Pathology. California, USA, Academic Press, INC. pp: 213–249. [ Links ]
Gupta, S. C., T. D. Leathers, G. N. El–Sayed, and C. M. Ignoffo. 1994. Relationships among Enzyme Activities and Virulence Parameters in Beauveria bassiana infections of Galleria mellonella and Trhichoplusia ni. J. Invertebr. Pathol. 64: 13–17. [ Links ]
Kamp, A. M., and M. J. Bidochka 2002. Conidium production by insect pathogenic fungi on commercially available agars. Lett. Appl. Microbiol. 35: 74–77 [ Links ]
Khachatourians, G. G., and S. S. Qazi. 2008. Biochemistry and molecular biology of entomopathogenic fungi. The Mycota VI. Human and Animal Relationships. 2nd Ed. Springer–Verlag Berlin Heildelberg. pp: 33–53. [ Links ]
Minjares–Carranco, A., B. A. Trejo–Aguilar, G. Aguilar, and G. Viniegra–González. 1997. Physiological comparison between pectinase–producing mutants of Aspergillus niger adapted either to solid–state fermentation or submerged fermentation. Enzyme Microb. Technol. 21: 25–31. [ Links ]
Montesinos–Matías, R., G. Viniegra–González, R. Alatorre–Rosas, and O. Loera. 2011. Relationship between virulence and enzymatic profiles in the cuticle of Tenebrio molitor by 2–deoxy–D–glucose–resistant mutants of Beauveria bassiana (Bals.) Vuill. World J. Microb. Biot. 27: 2095–2102. [ Links ]
Pava–Ripoll, M., F. J. Posada, B. Momen, C. Wang, and R. J. St. Leger. 2008. Increased pathogenicity against coffee berry borer, Hypothenemus hampei (Coleoptera: Curculionidae) by Metarhizium anisopliae expressing the scorpion toxin (AaIT) gene. J. Invertebr. Pathol. 99: 220–226. [ Links ]
Posada, F. J., and F. E. Vega. 2005. A new method to evaluate the biocontrol potential of single spore isolates of fungal entomopathogens. J. Insect Sci. 5 (37): 1–10 [ Links ]
Quesada–Moraga, E., E. A. A. Maranhao, P. Valverde–García, and C. Santiago–Alvarez. 2006. Selection of Beauveria bassiana isolates for control of the whiteflies Bemisia tabaci and Trialeurodes vaporariorum on the basis of their virulence, thermal requirements, and toxicogenic activity. Biol. Control 36: 274–287. [ Links ]
Ramette, A. 2007. Multivariate analyses in microbial ecology. FEMS Microbiol. Ecol. 62: 142–160. [ Links ]
Randez–Gil, F., A. Blasco, J. A. Prieto, and P. Sanz. 1995. Title DOGR1 and DOGR2: Two genes from Saccharomyces cerevisiae that confer 2–deoxyglucose resistance when overexpressed. Yeast 11: 1233–1240. [ Links ]
Reglamento de la Ley de Bioseguridad de Organismos Genéticamente Modificados. Diario Oficial, Viernes 19 de Marzo de 2008. Secretaría de Salud. México. [ Links ]
Ritter, W., R. Garduño, S. Guzmán, H. Vanderwals, H. Ritter, N. Estrella, R. Luévano, G. Urban, N. Sánchez, T. Rodríguez, A. Tejeda, R. Klimek, T. Perez, J. Suarez, A. Ramos, C. Corona, H. Nava, J. Jiménez, and S. Orozco. 2004. Agroecología vs. Biotecnología agrícola transgénica. Ciencia y Mar 23: 19–30. [ Links ]
Robledo–Monterrubio, R., R. Alatorre–Rosas, G. Viniegra–Gonzalez, and O. Loera. 2009. Selection of Improved Beauveria bassiana (Bals.) Vuill. strains based on 2–deoxy–D–glucose Resistance and Physiological Analysis. J. Invertebr. Pathol. 101: 222–227. [ Links ]
Rodríguez–Gómez, D., O. Loera, G. Saucedo–Castañeda, and G. Viniegra–González. 2009. Substrate influence on physiology and virulence of Beauveria bassiana acting on larvae of Tenebrio molitor. World J. Microb. Biot. 25: 513–518 [ Links ]
Roy, H. E., and J. K. Pell. 2000. Interactions between Entomopathogenic fungi and other natural enemies: Implications for biological control. Biocontrol Sci. Techn. 10: 737–752. [ Links ]
Safavi, S. A., F. A. Shah, A. K. Pakdel, G. R. Rasoulian, A. R. Bandani, and T. M. Butt. 2007. Effect of nutrition on growth and virulence off the entomopathogenic fungus Beauveria bassiana. FEMS Microbiol. Lett. 270: 116–123. [ Links ]
Samuels, K. D. Z., J. B. Heale, and M. Llewellyn. 1989. Characteristics Relating to the Pathogenicity of Metarhizium anisopliae toward Nilaparvata lugens. J. Invertebr. Pathol. 53: 25–31. [ Links ]
Shah, F. A., C. S. Wang, and T. B. Butt. 2005. Nutrition influences growth and virulence of the insect–pathogenic fungus Metarhizium anisopliae. FEMS Microbiol. Lett. 251: 259266. [ Links ]
Siva–Jonhy M. T., and J. J. W. Thompson. 2002. Short–term nutrient deprivation effects immune function. Phys. Entomol. 27: 206–212. [ Links ]
St Leger, R. J., L. Joshi, M. J. Bidochka, and D. W. Roberts. 1996. Construction of an improved mycoinsecticide ove–rexpressing a toxic protease. Proc. Natl. Acad. Sci. USA 93: 6349–6354. [ Links ]
Talaei–Hassanloui, R., A. Kharazi–Pakdel, M. Goettel, and J. Mozaffari. 2006. Variation in virulence of Beauveria bassiana isolates and its relatedness to some morphological characteristics. Biocontrol Sci. Techn. 16(5): 525–534. [ Links ]
Tefera, T., and K. L. Pringle. 2003. Effect of exposure method to Beauveria bassiana and conidia concentration on mortality, mycosis, and sporulation in cadavers of Chilopartellus (Lepidoptera: Pyralidae). J. Invertebr. Pathol. 84:90–95. [ Links ]
Varela, A., and E. Morales. 1996. Characterization of some Beauveria bassiana Isolates and Their Virulence toward the Coffee Berry Borer Hypothenemus hampei. J. Invertebr. Pathol. 67: 147–152. [ Links ]
White, T. J., T. Bruns, S. Lee, and J. Taylor 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis, M.A. D. H. Gelfand, J. J. Sninsky, and T. J. White (eds). PCR Protocols: A Guide to Methods and Applications. Academic Press, San Diego. Pp: 315–322 [ Links ]
Zimmermann, G. 2007. Review on safety of the entomopathogenic fungi Beauveria bassiana and Beauveria brongniartii. Biocontrol Sci. Techn. 17: 553–596. [ Links ]