Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.7 Texcoco oct./nov. 2008
Recursos naturales renovables
Germinación de semillas de seis especies de Bursera del centro de México
Seed germination of six Bursera species from central Mexico
Consuelo Bonfil–Sanders1*, Isabel Cajero–Lázaro1 y Richard Y. Evans2
1 Departamento de Ecología y Recursos Naturales. Facultad de Ciencias, UNAM. Circuito Exterior, Ciudad Universitaria, 04510, México D. F., México. *Autor responsable: (cbonfil@gmail.com).
2 Department of Plant Sciences, University of California, Davis, CA 95616. USA.
Recibido: Noviembre, 2007.
Aprobado: Septiembre, 2008.
Resumen
A pesar de que la tasa de deforestación de los bosques tropicales secos en México es alta, muy pocas especies nativas se propagan en viveros locales, lo que limita su restauración. Muchas especies de Bursera son elementos dominantes de estos bosques, pero su propagación es difícil por la germinación reducida de las semillas. En este trabajo se evalúa la germinación de semillas de seis especies de Bursera (B. bicolor, B. bipinnata, B. copallifera, B. fagaroides, B. glabrifolia y B. grandifolia) del noroeste de Morelos, México. En un primer ensayo se encontró una alta proporción de semillas vanas en B. bipinnata, B. fagaroides y B. grandifolia. La germinación fue mayor con temperatura fluctuante que con temperatura constante. La germinación de semillas almacenadas de estas tres especies durante seis meses a temperatura ambiente y en refrigeración (5 °C) no difirió significativamente y fue del 30 al 60% en B. bicolor, B. copallifera y B. glabrifolia. Una solución de benzyladenina (150 ppm) aumentó la germinación de una de las tres especies (B. copallifera). En campo, las semillas de B. bicolor y B. copallifera presentaron porcentajes de germinación similares a los registrados a temperatura fluctuante.
Palabras clave: Bosques tropicales secos, Bursera, germinación de semillas, restauración.
Abstract
Although the deforestation rate of the dry tropical forests in México is high, very few native species are propagated in local nurseries, which limits their restoration. Many Bursera species are dominant elements of these forests, but their propagation is difficult because of the reduced germination of their seeds. In this work an evaluation is made of seed germination of six species of Bursera (B. bicolor, B. bipinnata, B. cipallifera, B. fagaroides, B. glabrifolia and B. grandifolia) of the northwestern region of Morelos, México. In a first assay, a high proportion of empty seeds was found in B. pinnata, B. fagaroides and B. grandifolia. Germination was higher with fluctuating temperature rather than with constant temperature. The germination of stored seeds of these three species during six months at room temperature and in refrigeration (5 °C) did not differ significantly and was from 30 to 60% in B. bicolor, B. copallifera and B. glabrifolia. A solution of benzyladenine (150 ppm) increased germination of one of the three species (B. copallifera). In the field, the seeds of B. bicolor and B. copallifera presented germination percentages similar to those registered at fluctuating temperature.
Key words: Dry tropical forests, Bursera, seed germination, restoration.
INTRODUCCIÓN
Ante la magnitud de la deforestación de los bosques tropicales secos más extensos de México –las selvas bajas caducifolias–, es urgente la propagación de sus especies nativas. Alrededor de 70% del área de selva baja se ha perdido en las últimas décadas, y 50% del área cubierta por este tipo de vegetación está formada por bosques perturbados (Trejo y Dirzo, 2000).
En México se distribuyen alrededor de 80 de las 100 especies de Bursera identificadas, la mayoría de las cuales son elementos conspicuos de muchos bosques tropicales (Rzedowski et al., 2005), aunque suelen ser reemplazadas por especies más tolerantes al disturbio en los sitios perturbados. La propagación de las especies de Bursera es muy relevante para restablecer poblaciones que, como las de B. glabrifolia, han sido diezmadas para elaborar artesanías (Purata et al., 2004). Desafortunadamente, en México pocas especies de selva baja se propagan actualmente, y sólo unas cuantas especies de Bursera se propagan por estacas (Bonfil et al., 2007).
Los reportes sobre la germinación de semillas de Bursera son escasos y variados (Vázquez–Yanes et al., 1999), pero destacan los de baja germinación (Andrés–Hernández y Espinosa–Organista, 2002). Bajo condiciones naturales, la germinación es frecuentemente menor que en laboratorio o invernadero (Ray y Brown, 1995; Ortiz–Pulido y Rico–Gray, 2006). No encontramos estudios publicados que evalúen el efecto de diferentes tratamientos pre–germinativos en Bursera, con excepción de uno realizado con B. penicillata (DC.) Engl. (Nargaraja y Farooqi, 1989).
En este trabajo se analiza la germinación de semillas de seis especies de Bursera: B. bicolor (Willd. ex Schltdl.) Engl., B. bipinnata (DC.) Engl., B. copallifera (Sessé & Moc. ex DC.) Bullock, B. fagaroides (H.B.K.) Engl., B. glabrifolia (H.B.K.) Engl., y B. grandifolia (Schltdl.) Engl., comunes en Morelos, México. En particular, se compara la germinación bajo condiciones de temperatura constante vs. temperatura fluctuante, así como el efecto del almacenamiento y algunos tratamientos pre–germinativos en la germinación de semillas de tres de las especies. En ellas se compara también la germinación en campo con la registrada en condiciones controladas.
MATERIALES Y MÉTODOS
Entre septiembre y octubre de 2002 se recolectaron frutos de cinco especies de Bursera (B. bicolor, B. bipinnata, B. copallifera, B. glabrifolia y B. fagaroides) al norte de Cuentepec, NO de Morelos, México (18° 51' 39'' N, 99° 25' 15'' W), y de B. grandifolia en la rivera del río Tembembe, cerca de Cuentepec. Los frutos se obtuvieron de al menos cinco árboles por especie, y se dejaron secar en un invernadero durante cuatro semanas. Se conservaron sólo las semillas de apariencia sana (sin orificios, deformaciones o manchas), y se mezclaron los lotes de cada especie.
Se realizó una primera prueba de germinación 30 días después de la recolecta. Se probaron dos tratamientos pregerminativos y dos temperaturas en semillas de las seis especies. Los tratamientos pregerminativos fueron: a) inmersión en ácido clorhídrico (pH 1.5, sol. 0.03 N) durante 15 min, b) escarificación mecánica con lija (realizada manualmente,  40 s por semilla) y, c) testigo control, sin tratar. Las semillas se desinfectaron por inmersión en hipoclorito de sodio al 10% (10 min) y se colocaron en cajas de Petri en un medio compuesto por tierra negra pasteurizada, perlita y arena inerte (2:1:1, volumen), con 20 semillas por caja; cada caja se cubrió con una película plástica. Se colocaron al azar cinco cajas por tratamiento en una cámara de germinación a temperatura constante (25 °C, fotoperiodo de 12 h), y otras cinco en otra con temperatura fluctuante (18–32 °C cada 12 h, mismo fotoperiodo). Las semillas se regaron cada tercer día con agua destilada y se les aplicó semanalmente una solución de Captan al 5% durante el primer mes, como fungicida. Las cajas se cambiaron de posición semanalmente durante los 60 días de observación para evitar posibles variaciones en las condiciones dentro de la cámara. Cada tercer día se registró la germinación, definida como la emergencia de una radícula de 5 mm. Los datos de porcentaje de germinación (previamente transformados con la función arcoseno) se analizaron mediante Análisis de Varianza de dos vías (factores: temperatura y tratamiento pre–germinativo).
40 s por semilla) y, c) testigo control, sin tratar. Las semillas se desinfectaron por inmersión en hipoclorito de sodio al 10% (10 min) y se colocaron en cajas de Petri en un medio compuesto por tierra negra pasteurizada, perlita y arena inerte (2:1:1, volumen), con 20 semillas por caja; cada caja se cubrió con una película plástica. Se colocaron al azar cinco cajas por tratamiento en una cámara de germinación a temperatura constante (25 °C, fotoperiodo de 12 h), y otras cinco en otra con temperatura fluctuante (18–32 °C cada 12 h, mismo fotoperiodo). Las semillas se regaron cada tercer día con agua destilada y se les aplicó semanalmente una solución de Captan al 5% durante el primer mes, como fungicida. Las cajas se cambiaron de posición semanalmente durante los 60 días de observación para evitar posibles variaciones en las condiciones dentro de la cámara. Cada tercer día se registró la germinación, definida como la emergencia de una radícula de 5 mm. Los datos de porcentaje de germinación (previamente transformados con la función arcoseno) se analizaron mediante Análisis de Varianza de dos vías (factores: temperatura y tratamiento pre–germinativo).
Posteriormente se realizaron dos pruebas subsecuentes para estimar, de forma indirecta, la viabilidad de las semillas de las seis especies. En la primera, se analizaron 90–100 semillas por especie mediante imágenes de rayos X (Faxitron N, Model 43804N), las que permitieron diferenciar a las semillas llenas de las vanas (sin embrión). En la segunda, se analizaron por flotación en agua más de 300 semillas por especie (dependiendo de la disponibilidad), para separar las semillas vanas (vacias) de las que se hunden (llenas) (Landis et al., 1998).
Debido a que tres especies (B. bipinnata, B. fagaroides y B. grandifolia) presentaron una proporción muy baja de semillas llenas, los siguientes experimentos sólo se realizaron con las otras tres especies. Para analizar el efecto de las condiciones de almacenamiento, las semillas llenas (por el método de flotación) de B. bicolor, B. copallifera y B. glabrifolia, se dividieron en dos grupos: uno se almacenó a temperatura ambiente (promedio  20 °C) en un cuarto en bolsas de papel y el otro en un refrigerador a 5 °C, durante 170 días. Al final de este periodo, las semillas de cada condición de almacenamiento se separaron en tres grupos, un control y dos con tratamientos pregerminativos: a) escarificación en ácido sulfúrico concentrado (85%) por 20 min y, b) inmersión durante 12 h en una solución de 6–benzyla–minopurina (Sigma Chemical Co.) a 150 ppm. Esta citocinina incrementó la germinación de semillas de B. penicillata (Nargaraja y Farooqi, 1989). Las semillas del grupo control y las expuestas a la citocinina se desinfectaron con una solución de hipoclorito de sodio al 5%, y luego con sulfato de cobre al 2% (10 min cada uno); las expuestas al ácido no se desinfectaron porque los microorganismos son eliminados por el ácido. Posteriormente se colocaron en cajas de Petri con el medio descrito antes, usando 10 semillas por caja y cinco repeticiones por tratamiento (dos condiciones de almacenamiento X tres tratamientos pregerminativos). Se usó una cámara de germinación con temperatura fluctuante (32 °C con luz y 18 °C en oscuridad, 12/12 h). La germinación se registró y los datos se analizaron como en el primer experimento.
20 °C) en un cuarto en bolsas de papel y el otro en un refrigerador a 5 °C, durante 170 días. Al final de este periodo, las semillas de cada condición de almacenamiento se separaron en tres grupos, un control y dos con tratamientos pregerminativos: a) escarificación en ácido sulfúrico concentrado (85%) por 20 min y, b) inmersión durante 12 h en una solución de 6–benzyla–minopurina (Sigma Chemical Co.) a 150 ppm. Esta citocinina incrementó la germinación de semillas de B. penicillata (Nargaraja y Farooqi, 1989). Las semillas del grupo control y las expuestas a la citocinina se desinfectaron con una solución de hipoclorito de sodio al 5%, y luego con sulfato de cobre al 2% (10 min cada uno); las expuestas al ácido no se desinfectaron porque los microorganismos son eliminados por el ácido. Posteriormente se colocaron en cajas de Petri con el medio descrito antes, usando 10 semillas por caja y cinco repeticiones por tratamiento (dos condiciones de almacenamiento X tres tratamientos pregerminativos). Se usó una cámara de germinación con temperatura fluctuante (32 °C con luz y 18 °C en oscuridad, 12/12 h). La germinación se registró y los datos se analizaron como en el primer experimento.
La germinación en campo se evaluó en semillas de B. bicolor, B. copallifera y B. glabrifolia, que previamente se habían separado mediante flotación y se habían almacenado a temperatura ambiente durante  ocho meses. Se colocaron 10 semillas (sin tratar) en bolsas de malla plástica (18X11 cm), con 13 bolsas por especie por sitio (excepto para B. glabrifolia, con cinco bolsas debido a la disponibilidad de semillas). Las bolsas se enterraron a 5 cm de profundidad a finales de mayo de 2003, en dos sitios: un bosque conservado y uno perturbado cerca de Cuentepec; ambos con exposición noreste. Tres semanas después se registró el porcentaje de germinación. Los resultados se analizaron mediante Análisis de Varianza.
ocho meses. Se colocaron 10 semillas (sin tratar) en bolsas de malla plástica (18X11 cm), con 13 bolsas por especie por sitio (excepto para B. glabrifolia, con cinco bolsas debido a la disponibilidad de semillas). Las bolsas se enterraron a 5 cm de profundidad a finales de mayo de 2003, en dos sitios: un bosque conservado y uno perturbado cerca de Cuentepec; ambos con exposición noreste. Tres semanas después se registró el porcentaje de germinación. Los resultados se analizaron mediante Análisis de Varianza.
RESULTADOS Y DISCUSIÓN
En la primera prueba la germinación de Bursera fagaroides y B. grandifolia fue 0%. En las otras cuatro especies, la capacidad germinativa fue menor a 18%, y no fue afectada por los tratamientos pregerminativos (Cuadro 1). Sólo en B. glabrifolia hubo un incremento en la germinación (14% vs. 5–6%) por la escarificación mecánica. La temperatura tuvo un efecto significativo (Cuadro 1); en todas las especies las semillas en temperatura fluctuante alcanzaron mayores porcentajes de germinación que en constante (Cuadro 2).

Los bajos porcentajes de germinación obtenidos fueron, en parte, resultado de una alta proporción de semillas vanas. En B. grandifolia, B. fagaroides y B. bipinnata el porcentaje de semillas llenas fue muy bajo (Cuadro 3), mientras que en B. copallifera y B. bicolor esta cifra fue superior a 45 %. Los resultados obtenidos por flotacion y rayos X fueron similares, excepto en B. glabrifolia, en la cual la primera probablemente subestimó este porcentaje.

Adicionalmente, una prueba de remojo por 24 h realizada en 10 semillas intactas y 10 escarificadas de B. fagaroides y B. grandifolia mostró que son permeables, pues aumentó el peso tanto de las semillas sin tratar como de las escarificadas, sin diferencias significativas entre ambas, por lo que no existe latencia física (Baskin y Baskin, 2004).
Las semillas de todas las especies presentaron infestación por hongos en los experimentos de germinación, notable en B. grandifolia y menos extensiva en B. bipinnata y B. fagaroides. Los hongos se originaron en las semillas, más que en el medio de propagación, y no pudieron eliminarse con la desinfeccción. Sin embargo, algunas semillas infestadas germinaron.
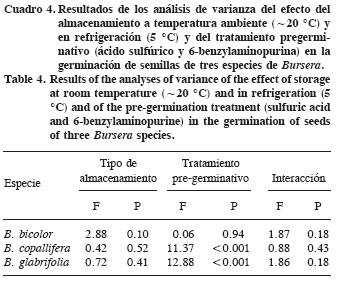
Las condiciones de almacenamiento no hicieron variar significativamente los porcentajes de germinación en las tres especies probadas (Cuadro 4); las semillas pueden ser almacenadas en un cuarto fresco y seco a temperatura ambiente ( 20 °C) al menos por seis meses, sin necesidad de refrigeración. En B. copallifera la citocinina aumentó la germinación, pero no tuvo efecto en B. glabrifolia (Cuadros 4 y 5). La escarificación ácida no afectó a B. copallifera, pero disminuyó la germinación de B. glabrifolia. El porcentaje promedio de germinación de B. bicolor fue 32%, sin diferencias entre tratamientos pregerminativos.
20 °C) al menos por seis meses, sin necesidad de refrigeración. En B. copallifera la citocinina aumentó la germinación, pero no tuvo efecto en B. glabrifolia (Cuadros 4 y 5). La escarificación ácida no afectó a B. copallifera, pero disminuyó la germinación de B. glabrifolia. El porcentaje promedio de germinación de B. bicolor fue 32%, sin diferencias entre tratamientos pregerminativos.

En todas las especies la germinación inició entre 2 y 8 días después de la siembra, y posteriormente se incrementó hasta que, en la mayoría de los casos, se estabilizó entre los días 23 y 27, aunque en B. bicolor, algunas semillas germinaron hasta el día 40 (Figura 1). En B. copallifera la mayoría de las semillas tratadas con la citocinina germinaron entre los días 5 y 15, por lo que esta hormona parece producir una germinación más temprana y sincronizada.

En campo, la mayor germinación correspondió a B. bicolor (32.7%±5.9), seguida por B. glabrifolia (17.8%±4.1) y B. copallifera (13.5%±2.0). Entre sitios, la germinación fue mayor bajo el dosel del bosque conservado que en el perturbado (más abierto), en dos especies (46.2 vs. 19.2% en B. bicolor y 17 vs. 10% en B. copallifera; p=0.023 y p=0.036, respectivamente). La diferencia entre sitios no fue significativa en B. glabrifolia.
Destaca el alto porcentaje de semillas vanas en todas las especies. Este fenómeno explica la escasa germinación encontrada en B. grandifolia, B. fagaroides y B. bipinnata, pero incluso en las otras tres especies la proporción de semillas vanas fue relativamente alta (40–53%, Cuadro 3). Es posible que factores genéticos, como la endogamia, estén relacionados con la producción de semillas vanas y los bajos porcentajes de germinación encontrados en algunas especies (Menges, 1991; Chacoff et al., 2004); estos fenómenos serían relativamente más importantes en B. fagaroides, B. grandifolia y B. bipinnata –con árboles dispersos en la zona de estudio– y menos prevalecientes en B. copallifera y B. glabrifolia, cuyas poblaciones son mucho más grandes en los bosques del NO de Morelos. Estas últimas registraron los mayores porcentajes de semillas llenas (Cuadro 3) y de germinación (Cuadro 5).
Se ha sugerido que es mejor recolectar los frutos de Bursera cuando ya está avanzada su madurez y han perdido el pericarpio (Johnson, 1992); en nuestro caso los de B. grandifolia, y en menor medida los de B. fagaroides, aun tenían un pericarpio de color verdoso. Sin embargo, éste se desprendió durante el periodo de secado en el invernadero.
El incremento en la germinación a temperatura fluctuante en relación a la registrada a temperatura constante (Cuadro 2), puede relacionarse con que las semillas de Bursera permanecen en el suelo durante 5–7 meses desde que son dispersadas (entre noviembre y enero) hasta que germinan (al iniciar las lluvias, mayo–junio). Es común que la germinación a temperatura fluctuante sea mayor que a temperatura constante en muchas especies (Fenner y Thompson, 2005), lo que simula mejor las condiciones naturales.
En general, los porcentajes de germinación obtenidos fueron bajos (Cuadro 5). Se ha reportado una baja germinación en algunas especies tropicales deciduas, incluyendo a B. simaruba, lo que se atribuye a una rápida pérdida de viabilidad de las semillas durante el almacenamiento (Ray y Brown, 1994). En nuestro caso el almacenamiento hasta por 170 días no produjo un decremento notable en la germinación. No se encontró latencia física en las semillas de dos especies, y es poco probable que exista un tipo de latencia generalizado.
Los porcentajes promedio de germinación en condiciones naturales de B. bicolor y B. copallifera fueron similares a los de la germinación en temperatura fluctuante (32.7% y 32% en B. bicolor, 13.5% y 15% en B. copallifera, respectivamente), pero éste no fue el caso en B. glabrifolia, que presentó mayor germinación en condiciones controladas que en el campo (63% y 17.8% respectivamente, Cuadro 5). La mayor germinación de B. copallifera y B. glabrifolia en el sitio más conservado probablemente se deba a que la disponibilidad de agua es mayor que en el sitio perturbado. Diversos autores (Ray y Brown, 1995; Ortiz Pulido y Rico Gray, 2006) indican que la sombra es esencial para la germinación y el establecimiento de plantas en bosques tropicales secos, particularmente de Bursera.
De las tres especies en las que se probó la aplicación exógena de la citocinina, sólo en B. copallifera se produjo un incremento en la germinación, como se ha reportado en B. penicillata, que se cultiva en la India (Nargaraja y Farooqi, 1989). Sin embargo, el papel de las citocininas en el rompimiento de la latencia y la movilización de reservas aun no se conoce bien (Bewley y Black, 1994; Baskin y Baskin, 2001).
La siembra directa de semillas en el campo es un método poco recomendable para la reintroducción de Bursera, sobre todo en los sitios donde el dosel es abierto; la plantación de árboles producidos en vivero parece una mejor alternativa. Sin embargo, en al menos tres de las especies la alta proporción de semillas vanas seguirá siendo una barrera para su propagación, por lo que es necesario realizar estudios de la biología reproductiva del género.
CONCLUSIONES
Las seis especies de Bursera estudiadas presentaron una alta proporción de semillas vanas; en B. fagaroides y B. grandifolia fue cercana al 100%. Bajo condiciones de temperatura fluctuante se incrementó la germinación de las cuatro especies que germinaron (B. bicolor, B. bipinnata, B. copallifera, y B. glabrifolia). La germinación de semillas almacenadas durante seis meses a temperatura ambiente y en refrigeración no difirió. La citocinina benziladenina incrementó la germinación de B. copallifera y la escarificación ácida redujo la de B. glabrifolia. Se recomienda hacer plantaciones y no la siembra directa de semillas de Bursera en los proyectos de repoblación de bosques tropicales secos.
AGRADECIMIENTOS
F. Camacho, P. E. Mendoza, E. Piña, I. Trejo y J. Ulloa participaron en la recolecta de semillas. R. T. Campos, L. López–Esquivel y M. Hernández–Apolinar ayudaron en el trabajo de laboratorio. T. Valverde y dos revisores anónimos hicieron sugerencias útiles que mejoraron el manuscrito original. A la Universidad Nacional Autónoma de México, por financiar los proyectos PAPIIT IN–231802 y SDEI–PTID–02 "Manejo de Ecosistemas y Desarrollo Humano".
LITERATURA CITADA
Andrés–Hernández, A., y D. Espinoza–Organista. 2002 Morfología de plántulas de Bursera Jacq ex L. (Burseraceae) y sus implicaciones filogenéticas. Boletín de la Sociedad Botánica de México 70: 5–12. [ Links ]
Baskin, C. C., and J. M. Baskin. 2001. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination. San Diego, CA, Academic Press. 666 p. [ Links ]
Baskin, C. C., and J. M. Baskin. 2004. A classification system for seed dormancy. Seed Science Research. 14: 1–16. [ Links ]
Bewley, J. D., and M. Black. 1994. Seeds: Physiology of Development and Germination. New York, Plenum Press. 445 p. [ Links ]
Bonfil, C., P. E. Mendoza, and J. Ulloa. 2007. Root and callus development in cuttings of seven species of the genus Bursera. Agrociencia. 41: 103–109. [ Links ]
Chacoff N. P., J. M. Morales y M. Vaquera. 2004. Efectos de la fragmentación sobre la aborción y depredación de semillas en el Chaco Serrano. Biotropica. 36: 109–117. [ Links ]
Fenner, M., and K. Thompson. 2005. The Ecology of Seeds. Cambridge Univ. Press. 250 p. [ Links ]
Johnson, M. B. 1992. The genus Bursera (Burseraceae) in Sonora, Mexico and Arizona, U.S.A. Desert Plants. 10: 126–143. [ Links ]
Landis , T. D., R. W. Tinus, and J. P. Barnett. 1998. The container tree nursery manual. Vol. 6, Seedling propagation. Agriculture Handbook 674. Washington, D.C., USDA Forest Service. 166 p. [ Links ]
Menges E. S. 1991. Seed germination percentage increases with population size in a fragmented prairie species. Conservation Biology. 5: 158–164. [ Links ]
Nargaraja, C., and A. A. Farooqi. 1989. Studies on the seed germination as influenced by various pre–treatments in Bursera. Indian Perfumer. 33: 48–53. [ Links ]
Ortiz–Pulido, R., and V. Rico–Gray. 2006. Seed dispersal of Bursera fagaroides (Burseraceae): the effect of linking environmental factors. The Southwestern Naturalist. 51: 11–21. [ Links ]
Purata S., M. Chibnik, B. Brossi, y A. López. 2004. Figuras de madera de Bursera glabrifolia H.B.K. (Engl.) en Oaxaca, México. In: Alexiades, N. N., and P. Shanley (eds). Productos forestales, medios de subsistencia y conservación. Estudios de caso sobre sistemas de manejo de productor forestales no maderables. CIFOR. América Latina, Indonesia. pp: 415–437. [ Links ]
Ray, G. J., and B. J. Brown. 1994. Seed ecology of woody species in a Caribbean dry forest. Restoration Ecology. 2: 156–163. [ Links ]
Ray, G. J., and B. J. Brown. 1995. Evaluation of tree propagation techniques. Restoration Ecology. 3: 86–94. [ Links ]
Rzedowski, J., R. Medina–Lemos, y G. C. Rzedowski. 2005. Inventario del conocimiento taxonómico, así como de la diversidad y del endemismo regionales de las especies mexicanas de Bursera (Burseraceae). Acta Botanica Mexicana. 70: 85–111. [ Links ]
Trejo, I., and R. Dirzo. 2000. Deforestation of seasonally dry tropical forest: a national analysis in Mexico. Biological Conservation. 94: 133–142. [ Links ]
Vázquez–Yanes, C., A. I. Batis–Muñoz, M. I. Alcocer–Silva, M. Gual–Díaz, y C. Sánchez Dirzo. 1999. Árboles y arbustos potencialmente valiosos para la restauración ecológica y la reforestación. Reporte técnico del proyecto J084. CONABIO–Instituto de Ecología, Universidad Nacional Autónoma de México, México. [ Links ]














