Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.38 México ago. 2014
Desinfección y siembra asimbiótica de semillas de dos especies y una variedad de orquídeas del género oncidium
Disinfection and asymbiotic sowing of orchid seeds
C.E. Billard1, C.A. Dalzotto2, y V.H. Lallana1
1Docentes investigadores Cátedra de Fisiología Vegetal y Laboratorio de Cultivo de Tejidos Vegetales.
2Becario iniciación en la investigación PI-UNER 2144. Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos. Ruta Prov. 11, Km 10.5 (3101). Oro Verde, Paraná, Entre Ríos, Argentina. Correo electrónico: cbillard@fca.uner.edu.ar.
Recibido: 14 agosto 2012.
Aceptado: 19 septiembre 2013.
Resumen
Oncidium es un género de orquídeas nativas de América del Sur, como O. longicornu (A) presente en el SE de Brasil y Argentina y O. bifolium var. bifolium, encontrándose variaciones naturales como O. bifolium de "pétalos amarillos" (B) y O. bifolium var. "federal" (C). En la siembra asimbiótica de semillas de orquídeas, la desinfección es importante para evitar su contaminación en el medio de cultivo. Se buscó ajustar la técnica de desinfección de semillas eliminando la etapa de enjuagues y evaluar la germinación in vitro. Se usó el medio de cultivo semisólido Murashige y Skoog a la mitad de concentración. La desinfección se realizó con hipoclorito de sodio en tres dosis: 0.5%; 1% y 2%. Además, en O. bifolium "pétalos amarillos" se evaluó el efecto del enjuague con agua destilada esterilizada empleando hipoclorito de sodio al 0.5%. Se encontró que la viabilidad promedio de las semillas fue de 98% (prueba de tetrazolio). La germinación para los Oncidium sembrados ocurrió a los 15 días. A los 48 días después de la siembra (dds) la dosis de 2% manifestó diferencia de 39% y 60% en los valores de germinación con respecto a viabilidad en (C) y (B) respectivamente, mientras que en (A) la diferencia fue del 9% y en la dosis de 0.5% fue del 18%. En O. bifolium "pétalos amarillos" a los 49 dds, se visualizó presencia de protocormos blancos (muertos), a los 67 dds su porcentaje fue del 14%, disminuyendo la germinación de un 84.4% a un 73.2% sin el enjuague, mientras que en las semillas enjuagadas no se registraron protocormos blancos. Se recomienda utilizar la concentración de 0.5% de hipoclorito de sodio y realizar enjuagues con agua estéril para garantizar un mayor porcentaje de supervivencia de los protocormos.
Palabras clave: orquídeas epífitas, técnica desinfección, germinación in vitro, viabilidad.
Abstract
Oncidium is a genus of orchids native to South America, as O. longicornu (A) present in SE Brazil and Argentina and O. bifolium var. bifolium, natural variations found O. bifolium of "yellow petals (B) and the "federal" O. bifolium variety (C). In seed planting orchid asymbiotic, disinfection is important to prevent contamination in the culture medium. Was sought to adjust the seed disinfection technique not applying the rinsing stage and evaluate germination in vitro. Murashige and Skoog semisolid medium was used in half concentration. Sodium hypochlorite was used to disinfect seeds in three doses: 0.5%, 1% and 2%. Also in O. bifolium "yellow petals", the effect of rinsing with sterile distilled water using sodium hypochlorite 0.5%. Was found the average viability of the seeds was 98% (tetrazolium test). Germination for Oncidium seeded occurred at 15 days. At 48 days of sowing time the 2% dose of said difference of 39% and 60% germination values with respect to viability in (C) and (B) respectively, while (A) difference was 9% and 0.5% dose was 18%. In O. bifolium "yellow petals" at 49 days of sowing time, visualized protocorms presence of white (dead), at 67 days their percentage was 14%, decreasing the germination of 84.4% to 73.2% without rinsing, while the seeds rinsed were no registered white protocorms. Is recommend concentration of 0.5% sodium hypochlorite and perform sterile water rinses to ensure a higher percentage of survival of protocorms.
Key words: epiphytic orchids, disinfection technique, in vitro germination, viability.
Introducción
Oncidium, es un género de orquídeas nativas de América, con más de 600 especies que habitan desde el sur de los Estados Unidos hasta Argentina, creciendo desde el nivel del mar hasta 4 000 m.s.n.m. (Freuler, 2003). En Argentina se ha reportado la presencia de 280 especies de las cuales 37.5% son epifitas y 62,5% terrestres (Johnson, 2001; Freuler, 2003).
Oncidium bifolium Sims. var. bifolium es una orquídea epífita nativa de Argentina, que crece en toda la zona litoral y centro norte del país (Cellini et al., 2009), principalmente lo largo de los cursos de agua de los arroyos y el delta del Paraná. Esta orquídea presenta variaciones en el tamaño de la flor y pigmentación de los pétalos, amarillos con irregulares bandas transversales castañas sobre los sépalos y pétalos Jonson (2001), existen algunas formas naturales con pétalos totalmente amarillos (O. bifolium "pétalos amarillos") y otros de color rojo purpúreo uniforme. Esta última hallada en la provincia de Entre Ríos ha sido denominada O. bifolium var. "federal" (fig. 1).

O. longicornu Mutel es una especie epífita, se encuentra distribuida por los estados del SE de Brasil y Argentina. Se diferencia de otros Oncidium por tener sus sépalos parduscos con los bordes y la base amarilla y los pétalos espatulados con bordes ondulados amarillos con extensas manchas castañas y su labelo amarillo limón (Johnson, 2001).
Las semillas de orquídeas se caracterizan por ser muy pequeñas (1.0-2.0 mm de largo y 0.5-1.0 mm de ancho), carecen de endosperma, presentan sólo una testa y un embrión inmaduro (Pierik, 1990; Arditti y Ernst, 1993) y se produce en grandes cantidades por cápsulas, por ejemplo, un fruto maduro de Oncidium bifolium Sims, puede contener hasta 1 178 100 semillas (Lallana et al., 2010).
La germinación natural de estas semillas requiere de una relación obligada con hongos micorríticos, pues al carecer de un endosperma el embrión obtiene sus nutrientes a través de esa asociación (Arditti, 1984). Esta relación puede ser un factor limitante en los programas de conservación ex situ o para orquídeas o en la propagación de estas especies o sus híbridos con fines comerciales.
Mediante las técnica de cultivo in vitro de semillas es posible su germinación y desarrollo del embrión en ausencia del hongo, sustituyendo su acción por un medio de cultivo nutritivo; a este tipo de germinación se la conoce como germinación asimbiótica (Pierik, 1990; Fay y Clemente, 1997). Debido a ello, se han desarrollado metodologías de germinación asimbiótica bajo condiciones in vitro (Arditti y Ernest, 1993; Flachsland et al., 1996; Kalimuthu et al., 2007; Flores-Escobar et al., 2008; Pedroza-Manrique, 2009).
Uno de los principales problemas que se presentan al usar estas técnicas es la contaminación fúngica del medio de cultivo, por ello se debe implementar una etapa de desinfección de las semillas la cual básicamente consiste en someter las semillas a una solución con hipoclorito de sodio o calcio y lavado con agua destilada (Mweetwa et al., 2008; McKendrick, 2000).
En la germinación in vitro de las semillas de orquídeas se han descrito cuatro etapas (Mitchell, 1989): crecimiento del embrión (protocormo) y ruptura de testa (etapa 1), desarrollo del protocormo y aparición de rizoides (etapa 2), crecimiento rápido del protocormo y desarrollo de una yema apical (etapa 3), por ultimo, aparición de hojas y el desarrollo de raíces (etapa 4).
El objetivo de este trabajo fue ajustar la técnica de desinfección de semillas de orquídeas eliminando la etapa de enjuagues con agua estéril y evaluar la germinación in vitro de dos especies y una variedad.
Material y métodos
Experimento 1
Se trabajó con semillas de dos especies y una variedad de orquídeas del género Oncidium (O. longicornu Mutel; O. bifolium "pétalos amarillos"; O. bifolium var. "federal") a partir de frutos cosechados en enero 2011 de plantas cultivadas en la ciudad de Paraná, provincia Entre Ríos (Argentina), en el mes de enero de 2011 (tabla 1). Las muestras identificadas como (A) y (B), provinieron de un cultivador particular y la (C) de un vivero especializado de la ciudad de Paraná (tabla 1).

Los frutos fueron conservados a baja temperatura (4-5°C) en sobres de papel durante 15 días y al comenzar su dehiscencia se procedió a cortar sus extremos con bisturí y recoger las semillas en cápsulas plásticas con tapa y conservarlos a la misma temperatura arriba mencionada hasta el momento de su siembra.
Se evaluó la viabilidad de las semillas mediante la prueba de tetrazolio. Se tomó una alícuota de 2 a 4 mg de semillas las que se colocaron 24 h en imbibición, luego se extrajo el agua y se agregó solución de 2,3,5 trifenil de tetrazolium al 0.5 %, incubando en oscuridad a 33 °C durante 24 h (Singh, 1981, Lallana y García, 2012). El recuento bajo lupa binocular se hizo en cajas de Petri, colocando debajo de la caja una cuadrícula (1 x 1 cm) y contando cinco cuadros al azar. Se consideraron semillas viables aquellas que presentaban una coloración que variaba de rosado a rojo oscuro; y no viables las semillas blancas o sin tinción con embrión visible. Los datos se expresaron en porcentaje de semillas viables.
El medio de cultivo empleado fue MS (Murashige y Skoog, 1962), el cual ha sido utilizado con éxito en el cultivo in vitro de orquídeas (Flachsland et al., 1996; Billard y Lallana, 2008, 2009; Lallana y Billard 2009; Lallana et al., 2010). Este medio fue suplementado con 30 g/L de sacarosa, el pH del medio de cultivo se ajustó a 5,6-5,8 previo a la adición de 5 g/L de Agar Agar Britania. El medio de cultivo se esterilizó en autoclave a 121 °C y 1 kg cm2 de presión durante 15 min y distribuidos en cantidades de 10 mL en cajas de Petri de vidrio de 50 x 15 mm.
La siembra y desinfección de las semillas se efectuó en cámara de flujo laminar horizontal. Se procedió a la desinfección de las mismas, teniendo en cuenta su agitación en la solución desinfectante propuesto por Mweetwa et al., (2008), quien utiliza un agitador vortex y el empleo de una jeringa de 5 mL para la desinfección y posterior siembra en el medio de cultivo esterilizado (McKendrick, 2000). Para ello se tomaron dos alícuotas de semillas (4 a 10 mg aproximadamente), con una espátula metálica esterilizada, se colocaron en tubos de ensayo de 70 mm de altura y 25 mm de diámetro con 5 mL de solución desinfectante de hipoclorito de sodio comercial a tres concentraciones (tratamientos, T): T1 0.5%; T2 1%; T3 2% con el agregado de Tween 20 (0.1%) como tensioactivo. La solución con semillas se colocó en un agitador orbital de Kline (Vicking) a 225 rpm, en reemplazo del agitador vortex, durante 7 min y luego se dejó reposar por 8 min. En la cámara de flujo laminar con una jeringa de 5 mL, se extrajeron 3 mL de solución, en el extremo de ésta se colocaron tres capas de tela de nailon y la aguja y se eliminó el excedente de solución quedando retenidas en la tela unas pocas semillas; se retiraron la aguja y la tela, luego se esparció 0.5 mL de la solución con semillas sobre el medio de cultivo en las cajas de Petri.
Inmediatamente cada caja de Petri fue tapada y cubierta con película PVC y colocada en cámara de crecimiento a una temperatura de 24 ± 1°C y un fotoperíodo de 16 h, con luz grow lux. Por cada especie y la variedad se realizaron tres repeticiones, donde cada repetición correspondió a una caja de Petri, siendo ésta la unidad experimental.
A los 6, 15, 27 y 48 días después de la siembra (dds) se evaluaron: registro de protocormos en sus distintas etapas de desarrollo (Mitchell, 1989), contaminación de los tratamientos y a los 48 dds el porcentaje de germinación sobre tres cuadrículas de 10 mm de lado dibujadas sobre la base de las cajas de Petri. La germinación de las semillas de Oncidium se consideró cuando el embrión aumento su tamaño, llegando a romper la testa.
Experimento 2
Para ajustar el procedimiento del ensayo anterior se llevó a cabo un segundo experimento con la especie O. bifolium "pétalos amarillos", con las mismas semillas almacenadas a baja temperatura (4-5°C), donde se evaluó el efecto del enjuague con agua destilada esterilizada en la etapa de desinfección de las semillas propuesto por McKendrick (2000), se empleó una dosis de hipoclorito de sodio de 0.5%. Los tratamientos fueron tres enjuagues (T1) y sin enjuague (T2). La cuantificación de la germinación se efectuó siguiendo las fórmulas propuestas por Arditti modificado por Pierik et al. (1988) y Menchaga (2011):
porcentaje de germinación (%G)
100 x [ (b+c+d)]/ [a+b+c+d]
índice de germinación (IG)
10(1b+2c+3d)/ a+b+c+d
Las letras a, b, c y d indican la frecuencia de cada etapa de crecimiento y desarrollo del embrión.
Por tanto, a = etapa no germinativa; b = el embrión crece o se hincha sin romper la cubierta; c = el embrión emerge parcialmente de la cubierta seminal; d = el embrión emerge totalmente de la cubierta seminal.
Como indican Pierick et al. (1988), en esta forma de evaluación el índice de germinación se deriva del porcentaje de cada etapa de crecimiento y desarrollo del embrión, y nos da una idea tanto de la velocidad germinativa, como de la presencia y proporción de cada una de las etapas de desarrollo inicial, ya que a mayor IG mayor presencia de las etapas germinativas más avanzadas en el desarrollo.
Se empleo un diseño al azar con dos tratamientos (con y sin enjuague en agua destilada esterilizada) y 10 repeticiones, cada repetición correspondió a una caja de Petri con tres submuestras de 10 mm2. El porcentaje de germinación y el índice germinativo se evaluaron a los 14, 29, 49 y 67 dds y se analizaron estadísticamente. Para determinar si los valores de germinación se distribuían normalmente se aplicó una prueba de normalidad (Shapiro-Wilks Modificado). Posteriormente se efectuó un análisis de varianza y la prueba de Duncan para comparar medias con un nivel de significación del 95% (p ≤ 0.05) utilizando el software InfoStat (2008).
Resultados y discusión
Experimento 1
La viabilidad para O. longicornu, O. bifolium "pétalos amarillos" y O. bifolium var. "federal" fue 96, 98, y 99%, respectivamente. Estos valores son similares a los reportados para semillas del género Oncidium dos meses después de haber sido cosechadas (Lallana y García, 2012), en la cual la viabilidad se reduce al 56% después de un almacenamiento en frío de 15 meses.
No se registró contaminación en las semillas ni en el medio de siembra en ninguno de los tratamientos de desinfección de las tres orquídeas.
La germinación asimbiótica para las dos especies y la variedad de Oncidium ocurrió a los 15 días. En general se observaron valores altos del coeficiente de variación del ensayo, debido a la agregación de las semillas en las cuadrículas de conteo, derivado de la cantidad y del pequeñísimo tamaño de las mismas, lo cual hace improbable asegurar una cantidad definida y distribución uniforme en las cajas de Petri. El número medio y el desvío estándar de semillas por cuadrícula fue de 21±20, 24±47 y 31±36, para las muestras O. bifolium "pétalos amarillos", O. longicornu y O. bifolium var. "federal", respectivamente. Dado la alta variabilidad hallada en los valores entre las cuadrículas de conteo, los datos no respondieron a una distribución de tipo normal, por lo cual se presentan los valores medios de germinación con su desvío estándar (fig. 2).
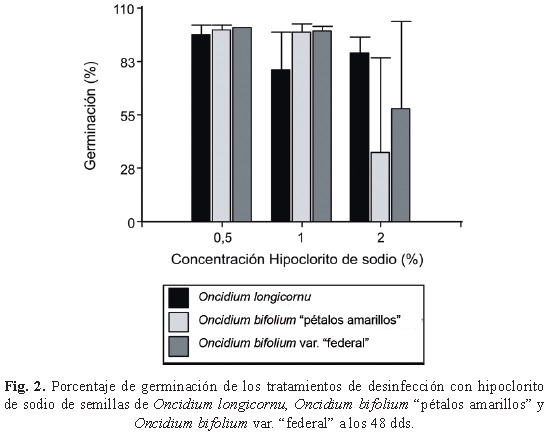
La evolución del desarrollo a través del tiempo según lo propuesto por Mitchell (1989) fue para O. longicornu a los seis dds las semillas se presentaron en las etapas 0 y 1; a los 15 y 27 dds para los T1 y T2 evolucionaron a protocormos verdes y en el T3 manifestaron protocormos verdes y semillas en etapa 0; a los 48 dds en los tres tratamientos los protocormos desarrollaron hasta la etapa 3, mientras que en el T3 se presentaron las etapas 0, 2 y 3.
En O. bifolium "pétalos amarillos", a los 6dds se presentaron semillas sin germinar y etapa 1; a los 15 dds se visualizaron protocormos verde pálidos; a los 27 dds todos los tratamientos estaban en etapa 2, además en el T3 los protocormos se visualizaron de color verde claro y algunos traslúcidos; a los 48 dds en T1 y T2 los protocormos evolucionaron a la etapa 3 de color verde; en el T3 tenían escaso desarrollo (etapa 2) de color amarillo y transparentes, sólo unos pocos verde oscuros.
Para la var. "federal" de O. bifolium a los seis dds el material sembrado estaba en etapa 0 y 1, a los 15 dds los protocormos en T1 y T2 estaban en la etapa 2 mientras que en T3 los protocormos estaban verde claro (etapa 2) y algunos transparentes, además de presentar semillas sin germinar; a los 48 dds en T1 y T2 los protocormos verdes estaban en etapa 3 y en T3 desarrollaron hasta las etapas 2 y 3 y en una de las repeticiones todas las semillas no habían evolucionado.
En general se puede decir que a los seis dds las dos especies y la variedad de Oncidium se observaron semillas con crecimiento del embrión y ruptura de la testa (etapa 1); a los 15dds el estadío de desarrollo correspondió a la etapa 2 (desarrollo de protocormo y aparición de rizoides). A los 27 dds en todos los casos permanecían en la etapa de desarrollo 2; mientras que a los 48 dds la mayoría de los protocormos se encontraban en la etapa 3 (crecimiento rápido de protocormo y desarrollo de una yema apical). Se encontraron diferencias en cuanto al color de los protocormos según los tratamientos con hipoclorito de sodio, la concentración de 2% evidenció un color amarillo, (muerto) y estructura transparente, viéndose afectada en mayor proporción el Oncidium bifolium "pétalos amarillos".
Experimento 2
En el segundo ensayo con O. bifolium "pétalos amarillos", a los 49 dds se observó en el tratamiento sin enjuague, la presencia de protocormos blanquecinos; a los 67 dds el porcentaje de protocormos blancos (muertos) fue de 14%, mientras que el porcentaje de semillas germinadas disminuyó 84.4% a 73.2%. En el tratamiento con enjuague no se registraron protocormos blancos y los datos de germinación respondieron a una distribución de tipo normal. Se encontraron diferencias significativas (p≤ 0,05) en la germinación entre los dos tratamientos desde el momento en que se registraron los protocormos blancos (49 dds) (fig. 3).

A los 48 días desde la siembra del experimento 1 utilizando 0.5% de hipoclorito de sodio no se observaron protocormos blancos, mientras que en el experimento 2 si se visualizaron éstos a partir de los 49 dds en una cantidad que creció más a los 67 dds en comparación con el tratamiento donde se realizó los enjuagues con agua destilada esterilizada.
El índice germinativo (IG) fue en aumento a medida que transcurrían los días después de la siembra (fig. 4). A los 14 y 29 dds no se encontraron diferencias estadísticamente significativas, sí a los 49 y 67 dds donde el IG del tratamiento sin enjuague (T2) fue menor en ambas observaciones respecto al T1 con enjuague (fig. 4), observando la presencia de protocormos blancos (muertos).

Álvarez-Pardo et al., 2006, encontraron que el tiempo y la dosis de desinfección afecta el porcentaje de germinación de las semillas de O. pumilum Lindl respecto al porcentaje de su viabilidad; en donde disminuyó en un 29% con respecto a la viabilidad de la semillas cuando éstas fueron sometidas a una dosis de 0.4% de cloro activo durante 15 min, mientras que para la misma dosis durante 5 min no afectó a la germinación; y para una dosis de 0.8% la germinación disminuyó significativamente para los diferentes tiempos de exposición de la solución desinfectante. En todos los casos habían efectuado tres enjuagues de las semillas con agua estéril. También Vasudevan y Van Staden (2010) evaluaron el efecto del hipoclorito de sodio en tres concentraciones y dos tiempos de desinfección y cuatro medios de cultivo en una orquídea epífita Ansellia africana Lindl.; encontrando a los 56 dds, que la mejor combinación en la desinfección de las semillas fue la utilización de 1.75% de hipoclorito de sodio durante 40 min independientemente de los medios de cultivo.
Dalzotto et al. (2013) hallaron que las semillas de Oncidium bifolium conservadas en heladera (4-5°C), mantienen su viabilidad por más de dos años y que concentraciones mayores de 0.1% de hipoclorito de sodio afectan significativamente la prueba de viabilidad de las semillas. En el caso de dosis de 0.5% de hipoclorito de sodio, la disminución de viabilidad encontrada fue de 20%, respecto al testigo y al tratamiento 0.1% de hipoclorito de sodio.
Varios protocolos para desinfectar semillas de orquídeas emplean solución de hipoclorito de sodio, por ser un tratamiento simple y económico (Pierik, 1990; McKendrick, 2000; Rodriguez et al., 2005; Álvarez-Pardo et al., 2006; Flores-Escobar et al., 2008; Vasudevan y Van Staden, 2010). Álvarez-Pardo et al., 2006, resaltan la importancia de emplear solución desinfectante de reciente preparación y de composición química conocida, seguido por varios enjuague con agua estéril.
Conclusiones
La concentración de 0.5% de hipoclorito de sodio no afectó la germinación in vitro de las especies estudiadas hasta los 48 días después de sembrados. Concentraciones mayores disminuyen la germinación.
En O. bifolium "pétalos amarillos", a partir de los 49 días después de la siembra, en el tratamiento sin enjuague, se evidenciaron protocormos de color blanco, no así en el tratamiento con enjuague donde los protocormos se desarrollan normalmente.
El realizar tres enjuagues con agua estéril, en la etapa de desinfección de las semillas, favorece un mayor porcentaje de supervivencia de los protocormos.
Agradecimientos
El presente trabajo fue realizado en el marco del Proyecto PID-UNER 2144 financiado por la Universidad Nacional de Entre Ríos. Se hace un reconocimiento a la ingeniera agrónoma Luz F. García por los ensayos de viabilidad en semillas, y a los revisores anónimos por sus aportes y sugerencias que mejoraron el manuscrito final.
Literatura citada
Álvarez-Pardo, V.; A. Ferreira, y V. Nunes, 2006. "Seed disinfestations methods in vitro cultivation of epiphyte orchids from Southern Brazil". Hort. Bras., 24: 217-220. [ Links ]
Arditti, J., 1984. Orchid Biology: Reviews and perspectives III. Cornell University Press. Ithaca, USA. 432 pp. [ Links ]
Arditti, J., y R. Ernst, 1993. Micropropagation of Orchids. John Wiley & Sons, New York. USA. 640 pp. [ Links ]
Billard, C.E., y V. H. Lallana, 2008. "Germinación y desarrollo in vitro de Laelia lundii Rchb. f". Resúmenes de ponencias pág.12. 74° Reunión de Comunicaciones Científicas. Instituto Nacional de Limnología. Ciudad Universitaria Paraje El Pozo s/n Santa Fe, Argentina. [ Links ]
Billard, C.E., y V.H. Lallana, 2009. "Aclimatación de plantas de orquídeas obtenidas por germinación in vitro". Resúmenes de ponencias pág. 18. VI Reunión de Comunicaciones Científicas y técnicas y IV de Extensión. Facultad de Ciencias Agropecuarias-UNER. Oro Verde. [ Links ]
Cellini, J.M., L. Salomon, R. García, L. Cellini, y M. Sánchez, 2009. "Límite sur del área de distribución de Oncidium bifolium Sims". Bol. Soc. Arg. deBot., 44 (suplemento): 83. [ Links ]
Dalzotto, C.A.; F.L. García, y V.H. Lallana (2013). "Efecto del pretratamiento con hipoclorito de sodio en la prueba de viabilidad de semillas de Oncidium bifolium Sims". I Congreso Brasilero de Producción de Orquídeas. Fortaleza, Brasil. 05 al 10 de marzo de 2013. Resumen expandido. p. 42-44. Edición CD-ROM (Adobe Acrobat Document, 8178 kb). [ Links ]
Fay, M., y M. Clemente, 1997. "Aplicación de las técnicas de cultivos de tejidos en la propagación y conservación de especies amenazadas". Monografía Jardín Botánico. Córdoba, 5: 43-50. [ Links ]
Flachsland, E., G. Terada, H. Rey, y L. Mroginski, 1996. "Medios de cultivo para la germinación in vitro de 41 especies de orquídeas". FACENA, 12: 93-100. [ Links ]
Flores-Escobar, G.; J.P. Legaria-Solano, I. Gil-Vásquez, y M.T. Colinas-León, 2008. "Propagación in vitro de Oncidium stramineum Lindl. Una orquídea amenazada y endémica de México". Rev. Chap. Serie Hort., 14(3): 347-353. [ Links ]
Freuler, M.J., 2003. 100 Orquídeas Argentinas. Albatros. Buenos Aires. 128 pp. [ Links ]
InfoStat, 2008. InfoStat, versión 2008. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
Johnson, A.E., 2001. Las orquídeas del Parque Nacional de Iguazú. L.O.L.A., Buenos Aires, Argentina, 296 pp. [ Links ]
Kalimuthu, K.; R. Senthilkumar, y S. Vijayakumar, 2007. "In vitro micro-propagation of orchid, Oncidium sp. (Dancing Dolls)". Afr. Jour. of Biot., 6(10): 1171-1174. [ Links ]
Lallana, V.H., y C.E. Billard, 2009. "Propagación de cuatro especies y tres híbridos de orquídeas por técnicas de cultivo "in vitro" hasta la etapa de aclimatación". Libro de Resúmenes. V Jornada de Comunicación de Producciones Académicas y Científicas en Biología-Facultad de Ciencia y Tecnología-UADER. Paraná. p. 40 (CD-Rom). [ Links ]
Lallana, V.H., C.E. Billard, y L.M. Klug, 2010. "Germinación y desarrollo de plántulas in vitro de Oncidium bifolium Sims var. bifolium (Orchidaceae)". Libro de resúmenes, pp. 272-274. En: V Congreso Argentino de Floricultura y Plantas Ornamentales. Comp. por Claudia Gallardo y Elena Gagliano. 1ra. Ed. - Paraná: Universidad Nacional de Entre Ríos. [ Links ]
Lallana, V.H., y F.L. García, 2012. "Conservación de semillas de orquídeas y estudio de su viabilidad en el tiempo". Revista Análisis de Semillas, 6(23): 58-61. [ Links ]
Mitchell, R., 1989. "Growing hardy orchids from seeds at Kew". Plantsman, 11: 152-169. [ Links ] En Verdugo, G, J., Marchant, M. Cisternas, X. Calderón y Peñaloza, P., 2007. "Caracterización morfométrica de la germinación de Chloraea crispa Lindl. (Orchidaceae) usando análisis de imagen". Gayana Bot., 64(2): 232-238. [ Links ]
Mc Kendrick, S., 2000. "Manual para la germinación in vitro de orquideas". Disponible en www.ceiba.org/documents/CFTCpropman(SP).pdf. [Consulta: 01/09/11] [ Links ].
Menchaga, G.R., 2011. "Germinación in vitro de híbridos de Vanilla planifolia y V. pompona. In vitro germination of Vanilla planifolia and V. pompona hybrids". Rev. Colom. de Biot. XIII. 1: 80-84. [ Links ]
Murashige, T., y F. Skoog, 1962. "A revised medium for rapid growth and bioassays with tobacco tissue culture". Phy. Plant., 15: 473-497. [ Links ]
Mweetwa, A.M.; G.E. Welbaum, y D. Tay, 2008. "Effects of development, temperature, and calcium hypochlorite treatment on in vitro germinability of Phalaenopsis seeds". Sci. Hort., 117: 257-262. [ Links ]
Pedroza-Manrique, J. A., 2009. "Efecto del carbón activado, ácido indolacético (AIA) y bencil amino purina (BAP) en el desarrollo de protocormos de Epidendrum elongatum Jacq bajo condiciones 'in vitro'". Rev. Colomb. Biotecnol., 11(1): 17-32. [ Links ]
Pierik, R.L.; P.A. Sprenkels, y Q.C. van der Meyrs, 1988. "Seed germination and further development of planteelets of Paphiopedilum cilioare in vitro". Sci. Hort., 34: 139-153. [ Links ]
Pierik, R.L.M., 1990. "Cultivo in vitro de las plantas superiores". Mundi Prensa, pp. 301. Madrid. [ Links ]
Rodríguez, L.; R. Gonzales, A. Díaz, E. Fajardo, E. Sánchez, J. Hernández, M.A. Castañeira, G. de La Cruz, y J. Gonzales, 2005. "Producción y recuperación de orquídeas silvestres cubanas". Disponible en: www.dama.gov.co [Consulta: 01/09/11] [ Links ].
Singh, F., 1981. "Differential staining of orchid seeds for viability testing". American Orchid Society Bulletin, 50: 416-418. [ Links ]
Vasudevan, R., y J. Van Staden, 2010. "In vitro asymbiotic seed germination and seedling growth of Ansellia africana". Lindl. Sci. Hort., 123: 496-504. [ Links ]














