Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.14 no.3 Chapingo sep./dic. 2008
Propagación in vitro del 'Maguey bruto' (Agave inaequidens Koch), una especie amenazada de interés económico
In vitro propagation of 'Maguey bruto' (Agave inaequidens Koch), an endangered species with economical interest
F. Aureoles–Rodríguez1*, J. L. Rodríguez–de la O2, J. P. Legaria–Solano2, J. Sahagún–Castellanos2 y M. G. Peña Ortega2
1 Universidad Autónoma Agraria "Antonio Narro". Unidad Saltillo. Departamento de Horticultura. Buenavista, Saltillo, Coahuila. México. C. P. 25315. Correo–e: fabyaureoles@yahoo.com.mx. (*Autor responsable).
2 Departamento de Fitotecnia, Universidad Autónoma Chapingo. Km. 38.5 Carretera México–Texcoco. Chapingo, Estado de México, C. P. 56230. México.
Recibido: 9 de noviembre, 2007
Aceptado: 28 de marzo, 2008
Resumen
El 'Maguey bruto' (Agave inaequidens Koch) es una especie silvestre poco estudiada que se encuentra amenazada y se utiliza para la elaboración de la bebida alcohólica "Raicilla". Con la finalidad de propagar in vitro la especie, se evaluaron diferentes tipos de explantes, tipos y concentraciones de reguladores de crecimiento y concentraciones de sales inorgánicas Murashige y Skoog (1962), así como, diferentes tamaños de planta y cantidades de raíz. El análisis de datos detectó diferencia estadística significativa (P≤0.05) entre los efectos de los niveles de algunos factores y algunas interacciones. Las secciones de tallo formaron hasta 72 brotes en ocho semanas; la concentración de 3.0 mg·litro–1 de 6–benciladenina (BA) produjo una mayor longitud y número de brotes con 6.39 mm y 2.02, respectivamente; las concentraciones de BA, Kinetina (Kin) y 6–γ,γ–dimethylallylamino purina (2ip) produjeron una amplia variedad de respuestas; el tamaño grande de plantas en un medio con sales MS al 100% de su concentración sin reguladores, produjo mayor número y longitud de raíces en menor tiempo, y las plantas de longitud mayor a 4.0 cm con más de dos raíces presentaron una sobrevivencia del 100%.
Palabras clave: raicilla, bebida alcohólica, citocininas, cultivo in vitro.
Abstract
'Maguey bruto' (Agave inaequidens Koch) is a wild, little studied endangered species. It is used to make the alcoholic spirit "Raicilla". To develop a method for reproduction to increase the population, several explants, concentrations of hormone, inorganic Murashige and Skoog (1962) salts, plant sizes and root conditions were evaluated in vitro. Some variables showed statistical significance. The stem sections formed 72 shoots in 8 weeks; the concentration of 3.0 mg·liter–1 of 6–benziladenine (BA) produced an increase in length and number of shoots (6.39 mm and 2.02 respectively). The concentration of BA, kinetin (Kin) and 6–γ,γ–dimethylallylamino purine (2ip) produced a wide variety of responses: larger plants in a medium with MS salts at 100% concentration produced more and larger roots in less time, and 100% of the plants larger than 4.0 cm with more than 2 roots survived.
Key words: raicilla, alcoholic spirit, cytokinins, tissue culture.
INTRODUCCIÓN
En la región Oeste del estado de Jalisco se produce la bebida alcohólica "Raicilla", producto de un proceso de destilación que se conoce desde la época Colonial. La producción de raicilla fue hasta el año 2000 una práctica ilegal, por ello su producción aún es artesanal. Un estudio reciente estima que se obtienen entre 20 y 25 mil litros al año y en un futuro muy próximo este volumen puede incrementarse notablemente.
La materia prima para la elaboración de la raicilla se obtiene de dos especies silvestres de agave. Una de ellas es Agave inaequidens Koch ('Maguey bruto' o 'Lechuguilla') que se puede encontrar distribuida desde las zonas montañosas del estado de Jalisco hasta Morelos y el Distrito Federal (Gentry, 1982; Anónimo, 2003).
Algunos productores y empresarios están conscientes del enorme potencial de la bebida pero se están enfrentando al gran problema de que no hay planta para procesar. Como la raicilla tiene una calidad similar a la del tequila y a la del mezcal, ha sido objeto de depredación; un ejemplo de ello se presentó en el periodo de 1999 a 2001, en que, ante la escasez y encarecimiento de A. tequilana (para la industria tequilera) muchos intermediarios arrasaron con otros tipos de agave (Anónimo, 2003). Otro de los problemas que presenta esta especie ocurre en su multiplicación, que se realiza mediante hijuelos (estolones), bulbilos o semillas (Madrigal y Díaz, 1991). Una planta adulta de agave generalmente forma 1 a 2 hijuelos al año y cuando llega a formar semillas, éstas no son viables en su totalidad o no germinan por exponerse a condiciones ambientales adversas. Una planta para madurar demora entre 8 y 27 años, y ocasionalmente, no llega a esta etapa por la incidencia de plagas y enfermedades o por cosecharse antes de tiempo (Gentry, 1982; Granados, 1993; Melda y Ruíz, 2004).
Una de las estrategias que permite el rescate, la conservación y multiplicación de especies amenazadas o en peligro de extinción es el empleo del cultivo in vitro de células y tejidos vegetales. Esto se ha demostrado en trabajos de investigación como el realizado con Agave parrasana Berger (Santacruz et al., 1999) en que, gracias a estas técnicas, se logró micropropagar exitosamente. En otras especies de agave que aún no se encuentran amenazadas o en peligro de extinción como: A. cantala Rob. (Binh et al., 1990), A. fourcroydes Lem. (Robert et al., 1987; Binh et al., 1990), A. schidigera, A. sisalana Perrine (Binh et al., 1990; Das 1992), A. victoria–reginae Moore (Rodríguez y Acosta, 1996), Agave arizonica Gentry (Powers y Backhaus, 1989), A. salmiana Otto ex. Sal y A. mapisaga Trel. (Melda y Ruíz, 2004) estas técnicas se han aplicado exitosamente.
Bajo este contexto, el objetivo del trabajo fue evaluar el efecto de diferentes explantes, concentraciones de reguladores de crecimiento y sales inorgánicas MS; tamaños de planta y cantidades de raíz, en la propagación in vitro de A. inaequidens Koch.
MATERIALES Y MÉTODOS
Obtención del material vegetal, obtención de explantes y desinfectación
El material vegetal utilizado para la investigación se obtuvo de una colecta de plantas de A. inaequidens Koch de tres años de edad en la comunidad de Santiago de Pinos municipio de San Sebastián del Oeste, Jalisco. Las plantas se llevaron a un invernadero en la Universidad Autónoma Chapingo, donde se establecieron en macetas y se desinfectaron aplicando en el riego fungicida y bactericida de tipo sistémico. Para obtener explantes, se eliminaron de las plantas las hojas viejas y raíces dejando sólo la "piña" (cuerpo central de la planta) de la cual se aislaron las yemas axilares y el tejido del tallo. Los explantes obtenidos se lavaron y desinfectaron cuidadosamente con agua, jabón, tween 60 y agua estéril. Posteriormente se sumergieron durante 3 min en alcohol al 70%, luego en hipoclorito de sodio al 10% durante 3 a 5 min y, por último, en antioxidante (150 mg·litro–1 de ácido cítrico y 100 mg·litro–1 de ácido ascórbico) durante 5 min. El tejido del tallo después del tratamiento anterior fue cortado en discos de aproximadamente 3 a 4 mm de grosor.
Establecimiento in vitro
Los explantes fueron sembrados en frascos de 5.5 x 6.8 cm en un medio formulado con sales MS y con 80 mg·litro–1 de sulfato de adenina, 0.40 mg·litro–1 de tiamina, 100 mg·litro–1 de mio–inositol, agar al 0.7% (p/v) y azúcar al 3% p/v. Como reguladores de crecimiento se utilizaron 0.3 mg·litro–1 de ácido indolbutírico (AIB) y 10 mg·litro–1 de BA, y el pH fue ajustado a 5.7 ± 0.1. Los explantes permanecieron en un área de incubación por un periodo de 8 a 27 semanas, con un fotoperiodo de 16 h luz y 8 h oscuridad, una temperatura de 26 ± 2 °C y una intensidad lumínica de 10 a 15 μmol·m–2·s–1.
Todos los medios de cultivo, los instrumentos de disección y otros materiales de vidriería fueron esterilizados en una autoclave a una temperatura de 121 °C y una presión de 1.5 kg·cm–2 (20 lb·pie–1); los medios de cultivo fueron esterilizados durante 25 min y los instrumentos de disección y materiales de vidriería durante 45 min.
Multiplicación
En esta etapa se realizaron dos experimentos: el primero, con el fin de promover el desarrollo individual de brotes obtenidos en el establecimiento, para ello se utilizaron brotes o propágulos de 1.0 a 2.0 cm que fueron sembrados en un medio con las sales MS y con 80 mg·litro–1 de sulfato de adenina, 0.40 mg·litro–1 de tiamina y 100 mg·litro–1 de mio–inositol; como regulador de crecimiento se utilizaron cinco diferentes concentraciones de BA (0.0, 0.1, 1.0, 3.0, y 10.0 mg·litro–1). La siembra se realizó en tubos de ensaye de 15 x 150 mm con 15 ml de medio, según el diseño experimental completamente al azar con 11 repeticiones. La unidad experimental fue un tubo de ensaye con dos brotes o propágulos. Las variables evaluadas fueron altura de plántula, número de hojas y vigor. Éste fue evaluado visualmente, dando valores de 1 a 3, con base en el color y presencia de tejido sano; a brotes de color brillante o vivaz y sin tejido dañado se les asignó el 3, mientras que a la presencia de tejidos débiles y de coloración oscura, el valor asignado fue el 1.
En el segundo experimento, se sembraron brotes con poda de hojas en tubos de ensaye con un medio con sales MS y con vitaminas WS (Wetmore y Sorokin, 1955) y 60 mg·litro–1 de sulfato de adenina. Como reguladores de crecimiento se utilizaron las citocininas BA, Kin y 2ip en las concentraciones de 3.0 y 10.0 mg·litro–1. El diseño experimental utilizado fue un completamente al azar con arreglo factorial 3 x 2 y 12 repeticiones. Las variables evaluadas fueron: altura de plántula, número de hojas, número de brotes, plántulas con formación de estructura globular o con raíz. Las dos últimas variables se evaluaron calculando el porcentaje de repeticiones con este tipo de estructuras.
La intensidad lumínica manejada en los dos experimentos anteriores fue de 20 a 30 μmol·m–2·s–1.
Enraizamiento
Para promover el enraizamiento se probaron tres medios de cultivo y tres tamaños de planta. Uno de los medios se formó con las sales inorgánicas MS al 100% de su concentración, otro con las sales MS al 100% de su concentración + 0.3 mg de 2ip, y el tercero con las sales MS al 50% de su concentración. Los tamaños de planta estudiados fueron: planta chica (0.8 a 2.8 cm), planta mediana (2.9 a 3.7 cm) y planta grande (3.8 a 6.8 cm). Además de los tratamientos, en el medio de cultivo se adicionaron como suplementos 60 mg·litro–1 de sulfato de adenina, vitaminas WS, 3% (p/v) de azúcar y agar al 0.7% (p/v) y el pH fue ajustado a 5.7 ± 0.1. El diseño experimental utilizado fue un completamente al azar con arreglo factorial 3 x 3 con 10 repeticiones. Las variables evaluadas fueron número y longitud de raíces. La intensidad lumínica fue de 50 μmol·m–2·s–1.
Transferencia a sustrato e invernadero
Las plantas enraizadas del cultivo in vitro fueron sembradas en vasos de unicel con una mezcla de sustrato compuesta de peat moss (60%) y perlita (40%) en un invernadero. Para aclimatar las plantas, las macetas fueron colocadas en bolsas de plástico que fueron cerradas herméticamente por un periodo de tres semanas. En la última, las bolsas se abrieron poco a poco hasta retirarlas completamente. Los tratamientos se formaron utilizando los tamaños de planta: chico (2.5 cm), mediano (4.0 cm) y grande (6.4 cm), y dos condiciones de raíz: poca (2 a 5 raíces) o mucha (7 a 9 raíces). La variable evaluada fue porcentaje de sobrevivencia, que se obtuvo contabilizando el número de plantas vivas. La unidad experimental fue una planta y el número de repeticiones fue 10.
Análisis estadísticos
En este trabajo de investigación los datos de los diseños experimentales antes descritos fueron sometidos al análisis de varianza (P≤0.05) y a comparaciones de medias (Tukey P≤0.05) utilizando el paquete computacional SAS versión 8 (Universidad Complutense de Madrid, 2004).
RESULTADOS Y DISCUSIÓN
Establecimiento in vitro
Por carecer de información sobre el manejo in vitro del 'Maguey Bruto' (A. inaequidens Koch), la estrategia experimental para promover la brotación de forma directa (sin formación de callo) fue probar diferentes tipos de explante para evaluar las respuestas morfogenéticas in vitro utilizando yemas axilares y secciones de tallo. Las secciones de tallo presentaron brotación múltiple después de ocho semanas, llegando a formar u obtener hasta 78 brotes (Figura 1a). Por su parte, las yemas axilares en 27 semanas formaron alrededor de 54 brotes. Robert et al. (1987) y Das (1992) reportaron la formación directa de brotes adventicios de agave utilizando tejido de tallo. Mientras que Binh et al. (1990) obtuvieron lo mismo utilizando tejido meristemático. Lo anterior sugiere que cuando se pretenda establecer el cultivo in vitro de una especie nueva de agave, se debe partir con la siembra de estos tipos de tejido.

Multiplicación
En el experimento donde se probaron cinco concentraciones de BA en el medio de cultivo para promover el desarrollo individual de los brotes de A. inaequidens Koch, se encontró significancia estadística (P≤0.05) en las variables altura de planta y número de hojas. Los resultados de este experimento indican que los tratamientos probados incrementaron el tamaño de planta y el número de hojas, las mejores respuestas estadísticas se encontraron con las concentraciones de 1.0 y 3.0 mg·litro–1 de BA (Cuadro 1). Los brotes adquirieron la forma característica de roseta aunque no incrementaron estadísticamente su vigor (Cuadro 1 y Figura 1b). Jankiewicz (2003) menciona que las citocininas generan cambios morfológicos en los tejidos cultivados in vitro, resultado del estímulo de la actividad mitótica celular, lo que genera brotación, y explica los resultados obtenidos. En esta parte del trabajo de investigación se presentó brotación pero fue difícil determinar el número exacto de brotes porque presentaron una forma similar a las hojas en su inicio. Aún con ello, los tratamientos con BA propiciaron la formación de 1 a 2 brotes en las plantas más vigorosas. Santacruz et al. (1999) en A. parrasana y Das (1992) en A. sisalana también promovieron la brotación cuando adicionaron en el medio de cultivo la citocinina BA en diferentes concentraciones.

En el análisis de varianza del experimento en que se probaron tres tipos de citocininas en dos concentraciones, se observó significancia estadística (P≤0.05) en las variables estudiadas. Se observó que la interacción de los reguladores de crecimiento y las concentraciones afectaron las variables altura de planta y el número de hojas. Los valores más altos para la variable altura de planta se encontraron con 3.0 mg·litro–1 de Kin, mientras que para la variable número de hojas los valores más altos se encontraron con 3.0 mg·litro–1 de BA y 10.0 mg·litro–1 de Kin. La variable número de brotes únicamente resultó afectada por la concentración de los reguladores, los valores más altos se encontraron con la concentración de 10.0 mg·litro–1 independientemente del tipo de regulador (Cuadro 2). También, la aplicación de tratamientos propició la formación de estructuras globulares (Figura 1c) y la formación de raíz (Cuadro 3 y Figura 1d). Por otra parte, se determinó que A. inaequidens Koch crece y se desarrolla mejor en tubos de ensaye. En recipientes más anchos como los frascos de 5.5 x 6.8 cm se favorece el crecimiento de hojas alteradas morfológicamente, y conforme van creciendo separan a la planta del medio de cultivo evitando con ello el correcto suministro de nutrientes in vitro.

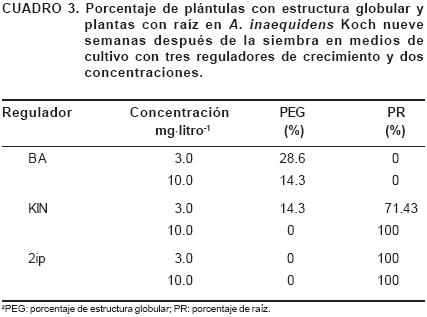
Las estructuras globulares consideradas como formas preliminares de una brotación múltiple, se formaron en la base de las plántulas y con un medio de cultivo con sales MS al 100% + 1.0 mg·litro–1 de BA y con vitaminas WS se propició la diferenciación y obtención de nuevos brotes, ocasionando con ello un incremento muy alto en la producción de plantas. Como el objetivo de la investigación fue la preservación, se dio preferencia a la multiplicación por vía directa y no se consideró esta posibilidad como una estrategia de multiplicación porque hay riesgo de obtener nuevas variantes. Robert et al. (1987) reportaron también la presencia de callo altamente caulogénico en A. fourcroydes, Lem., el cual, en un medio de cultivo adecuado, pudo diferenciar y formar nuevos brotes incrementando exponencialmente la producción.
Con relación a la formación de raíz, se tiene conocimiento de que las citocininas inhiben la formación y el crecimiento de raíces (Salisbury y Ross, 1994; Kende y Zeevaart, 1997; Jankiewicz, 2003). Sin embargo, en este experimento, esto se cumplió sólo con el regulador BA y no con Kin y 2ip. Pareciera que estos dos últimos reguladores fueron responsables de la formación y crecimiento de raíces, pero es posible que éstos produjeron un efecto nulo, y la formación y crecimiento de raíz que se presentó, fue resultado de la presencia de auxinas generadas por la misma planta ya que éstas se han reportado como promotoras de la formación y crecimiento de raíces (Salisbury y Ross, 1994; Kende y Zeevaart, 1997; Jankiewicz, 2003).
Enraizamiento
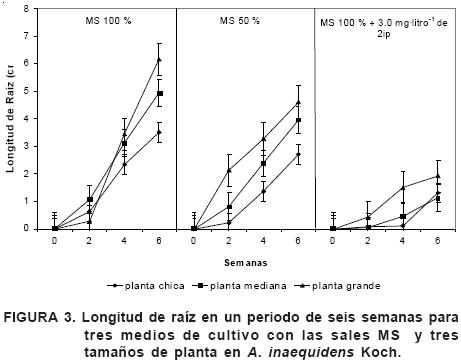
Para propiciar la formación de raíz in vitro en diferentes especies de agave, se han utilizado medios de cultivo con bajas concentraciones de sales MS y AIB (Enríquez et al., 2005). También se han utilizado medios con sales MS al 100% de su concentración y sin reguladores de crecimiento (Binh et al., 1990; Rodríguez y Acosta, 1996; Santacruz et al., 1999). En el análisis de este experimento se encontró significancia estadística (P≤0.05) en los factores medio de cultivo y tamaño de planta (Cuadro 4), la interacción medio de cultivo x tamaño de planta no mostró significancia estadística (P≤0.05). El incremento en el número de raíces en función del tiempo, expresado en tamaño de planta y tipo de medio de cultivo es considerable; los tamaños mediano y grande se comportaron estadísticamente de forma similar siendo el más favorecido el grande (Figura 1e). Por el contrario, el chico difiere estadísticamente de los otros dos y se ve menos favorecido, especialmente con los medios MS al 50% y MS al 100% + 3.0 mg·litro–1 de 2ip (Figuras 2 y 3). Todos los tamaños de plantas con el tratamiento MS al 100% + 3.0 mg·litro–1 de 2ip formaron raíces menos numerosas y más cortas, a diferencia de lo que produjeron los tratamientos sin regulador.


Transferencia a sustrato
En la transferencia a sustrato, los resultados mostraron que sólo las plantas chicas con pocas raíces no produjeron el 100% de sobrevivencia (Cuadro 5, Figura 1f). Das (1992) en A. sisalana Perrine reportó un rango de sobrevivencia del 70 a 80% y Robert et al. (1987) en A. fourcroides Lem. encontraron una sobrevivencia del 95%. Lo anterior sugiere que los agaves en general no presentan mayor problema para transferirse a sustrato e invernadero. En el experimento se observó que la sobrevivencia de plantas de tamaño superior a 4 cm y con más de dos raíces fue del 100%. Por otra parte, las plantas con hojas alargadas y delgadas después de la transferencia a sustrato formaron con el tiempo hojas normales. Definir el tamaño de planta y cantidad de raíz que favorecen la sobrevivencia de las plantas A. inaequidens Koch, permite determinar el tiempo que éstas deben permanecer en incubación en las diferentes etapas del cultivo in vitro y reducir costos y tiempo si se realiza una producción comercial.

CONCLUSIONES
Se logró propagar in vitro la especie A. inaquidens Koch, para ello se obtuvieron brotes de secciones de tallo y yemas axilares, las secciones de tallo formaron hasta 72 brotes. También se promovió el desarrollo de plantas utilizando diferentes concentraciones de BA, la concentración de 3.0 mg·litro–1 incrementó la altura de brotes y la formación de nuevas hojas. Los reguladores BA, Kin y 2ip en las concentraciones de 3 y 10 mg·litro–1 generaron gran variedad de respuestas que van, desde una mayor altura de planta, más hojas y brotes, hasta la presencia de estructuras globulares y raíz. Así mismo, se encontró que el tamaño de planta y el medio de cultivo afectan el enraizamiento de las plantas. Por último, las plantas de longitud mayor a 4.0 cm con más de dos raíces presentaron una sobrevivencia del 100%.
AGRADECIMIENTOS
Al CONACYT por financiar los estudios de postgrado de Fabiola Aureoles Rodríguez, primera autora; al Sr. Gustavo Fragoso Cibrián de la comunidad de Santiago de Pinos municipio de San Sebastián del Oeste Jalisco, por otorgar el material vegetal y a la Biol. Lilian López Chávez por contribuir en la identificación de la especie.
LITERATURA CITADA
ANÓNIMO. 2003. La raicilla se niega a perder su imagen cerril. CientoUno 576: 7–8. [ Links ]
BINH, L. T.; MUOI, L. T.; OANH, H. T. K.; THANG, T. D.; PHONG, D. T. 1990. Rapid propagation of agave by in vitro tissue culture. Plant Cell, Tissue and Organ Culture 23: 67–70. [ Links ]
DAS, T. 1992. Micropropagation de Agave sisalana. Plant Cell, Tissue and Organ Culture 31: 253–255. [ Links ]
ENRÍQUEZ, V. J. R.; CARRILLO, C. G.; RODRÍGUEZ DE LA O, J. L. 2005. Sales inorgánicas y ácido indolbutírico en el enraizamiento in vitro de brotes de Agave angustifolia. Revista Fitotecnia Mexicana 28: 175–179. [ Links ]
GENTRY, H. S. 1982. Agaves of Continental North America. The University of Arizona Press. Tucson, Arizona. pp. 340–344. [ Links ]
GRANADOS, S. D. 1993. Los Agaves en México. Universidad Autónoma Chapingo. Chapingo, México. 252 p. [ Links ]
JANKIEWICZ, L. S. 2003. Reguladores de crecimiento, desarrollo y resistencia en plantas. Propiedades y acción. Ed. Mundi–Prensa. México, D. F. 487 p. [ Links ]
KENDE, H. ; ZEEVAART, D. J. A. 1997. The five "classical" plant hormones. Plant Cell 9: 1197–1210. [ Links ]
MADRIGAL, S. X.; DÍAZ, B. O. 1991. Un caso teratológico de fasciación en A. inaequidens C. Koch (Amaryllidaceae) en la cuenca de Pátzcuaro, Michoacán, México. Acta Botánica Mexicana 15: 65–70. [ Links ]
MELDA B. G.; RUÍZ, M. L. 2004. Comparación del crecimiento de magueyes pulqueros (Agave salmiana Otto ex. Salm y Agave mapisa–ga Trel.) bajo esquemas de propagación in vitro y condiciones de invernadero. Biología Scripta Maqueda 1: 1–6. [ Links ]
MURASHIGE, T.; SKOOG, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473–497. [ Links ]
POWERS, E. D.; BACKHAUS, R. 1989. In vitro propagation of Agave arizonica Gentry and Weber. Plant Cell, Tissue and Organ Culture 16: 57–60. [ Links ]
ROBERT, M. L.; HERRERA, J. L.; CONTRERAS, F.; SCORER, K. L. 1987. In vitro propagation of Agave fourcroydes Lem. (Henequén). Plant Cell, Tissue and Organ Culture 8: 37–48 [ Links ]
RODRÍGUEZ G., B.; ACOSTA, D., B. 1996. Somatic embriogenesis of Agave victoria–reginae Moore. Plant Cell. Tissue and Organ Culture. 46: 85–87. [ Links ]
SALISBURY, B. F.; ROSS, W.C. 1994. Fisiología vegetal. Ed. Iberoamericana. México. 759 p. [ Links ]
SANTACRUZ R., F.; GUTIÉRREZ, H.; RODRÍGUEZ, B. 1999. Efficient in vitro propagation of Agave parrasana Berger. Plant Cell, Tissue and Organ Culture 56: 163–167. [ Links ]
UNIVERSIDAD COMPLUTENSE DE MADRID. 2004. Curso de introducción a la programación SASÒ V8. Servicios informáticos de apoyo a docencia e investigación. Apoyo a investigación. España. 74 p. [ Links ]
WETMORE, R. H.; SOROKIN, S. 1955. On the differentiation of xylem. Journal of the Arnold Arboretum 36: 305–317. [ Links ]














