Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.2 Ciudad de México abr./jun. 2000
Investigación
Síntesis y caracterización de oligosilanos complejos en el sistema pentametilciclopentadienil dicarbonilo de fierro: [η5-C5(CH3)5]Fe(CO)2Sin(Sin = SiMe3; Si2Me5; Si3Me7; y 2-Si3Me7)
Francisco Cervantes-Lee, Ramesh N. Kapoor and Keith H. Pannell
Department of Chemistry, University of Texas at El Paso, El Paso TX 79968-0513, (USA).
Recibido el 4 de febrero del 2000.
Aceptado el 4 de abril del 2000.
Resumen
En este trabajo se presentan la síntesis y caracterización por resonancia magnética nuclear de protón, carbono-13 y silicio-29, así como por espectroscopía infrarroja y cristalografía de rayos-X de los complejos en el sistema [η5-C5(CH3)5]Fe(CO)2Sin (Sin = SiMe3; Si2Me5; Si2Me7 y 2-Si3Me7). Se compara la geometría molecular de estos complejos con estructuras similares en el sistema indenil dicarbonilo de fierro. Se encontró que el mayor poder donador de densidad electrónica y mayor tamaño del grupo pentametilciclopentadienil respecto al indenil no son factor determinante en la naturaleza del enlace Fe-Si en estos compuestos.
Palabras clave: Síntesis, metales de transición, geometría molecular, complejos de fierro, organosilicio.
Abstract
Complexes of the general type [η5-C5(CH3)5]Fe(CO)2Sin (Sin = SiMe3; Si2Me5; Si2Me7 and 2-Si3Me7) have been synthesized and characterized via 1H 13C, 29Si NMR, infrared spectroscopy and X-ray crystallography. The molecular geometry of these complexes is compared to that of the corresponding analogs in the indenyliron dicarbonyl system. It was found that the higher electron density donor capacity and larger size of the [η5-C5(CH3)5] group compared to those of [η5-C9H7] do not influence significantly the nature of the Fe-Si bond.
Key Words: Synthesis, transitions metals, molecular geometry, iron complexes, organosilicon.
A la memoria de Jacobo Gómez-Lara
Introducción
El estudio de complejos de metales de transición con silanos es un campo de interés en la química organometálica, dada la posibilidad de acción catalítica de los metales de transición en reacciones de hidrosilación y de formación de enlaces Si-Si en compuestos organosilicicos [1,2]. La naturaleza del enlace entre el silicio y el correspondiente metal de transición ha sido estudiada extensivamente, con particular énfasis en el grado de carácter ϖ como resultado de la interacción entre los orbitales nd completos del metal y los orbitales 3d vacíos en el silicio.
Entre las series más estudiadas están las de ferrosilanos, en particular cyclopentadienil dicarbonilos [3] y, más recientemente, indenil dicarbonilos [4]. En esta última serie se hace un estudio comparativo entre diferentes dicarbonilos y sus correspondientes análogos, con uno de los carbonilos reemplazado por trifenilfosfina, concluyéndose que el mayor poder donador de densidad electrónica de la trifenilfosfina no resultaba en incremento del carácter p del enlace Fe-Si.
En un esfuerzo por contribuir al estudio de este tipo de compuestos de organosilicio, se han sintetizado cuatro nuevos complejos, [η5-C5(CH3)5]Fe(CO)2SiMe3 (1), [η5-C5(CH3)5]Fe (CO)2Si2Me2SiMe2 (2), [η5-C5(CH3)5]Fe(CO)2SiMe2SiMe2 SiMe3 (3) y [η5-C5(CH3)5]Fe(CO)2SiMe(SiMe3)2 (4), tres de ellos (2, 3 y 4) en forma cristalina de calidad aceptable para estudios estructurales por difracción de rayos-X que permiten su comparación con compuestos análogos en la literatura [4].
Experimental
a. Reactivos
Todas las manipulaciones se realizaron bajo atmósfera de argón y usando solventes secos y libres de oxígeno. [(η5-C5 (CH3)5)Fe(CO)2]2 se compró a Strem Chemicals, New Buryport, MA. La silica gel grado reactivo (60-200 mallas, grado 950) se obtuvo de MCB Reagents Gibbstown, NJ.
b. Equipo
Los espectros infrarrojos fueron obtenidos en solución en hexano usando un espectrofotómetro de rejilla Perkin-Elmer 580B. Para la obtención de espectros de Resonancia Magnética Nuclear se utilizó un espectrómetro Bruker de 200 MHz. La determinación de las estructuras cristalinas se realizó en un difractómetro Nicolet para monocristales acoplado a una computadora DEC Microvax II. Los análisis químicos fueron realizados por Galbraith Laboratories de Knoxville, TN.
c. Técnicas de síntesis
La síntesis del complejo [η5-C5(CH3)5]Fe(CO)2Si2Me5 como procedimiento sintético típico se describe a continuación:
En un matraz redondo de 250 mL con conexión al vacío se pusieron 5 mL de mercurio y 0.3 g de sodio metálico recién cortado. A esta amalgama se le agregaron 1.5 g (3.0 mmoles) de [(η5-C5(CH3)5)Fe(CO)2]2 en 50 mL de tetrahidrofurano (THF). Después de 24 h de reacción con agitación constante se observó un cambio de color y el espectro infrarrojo de la mezcla indicó la formación del anión [η5-C5(CH3)5]Fe(CO)2-de acuerdo a Pannell y Jackson [5].
El exceso de amalgama se extrajo por la conexión al vacío y enseguida se agregó una solución de 1.2 g (7 mmoles) de ClSi2Me5 en 5 mL de THF con agitación continua y enfriamiento en un baño de hielo. La solución se mantuvo en agitación durante 2 h. Después de este lapso se confirmó por espectroscopía infrarroja la desaparición del anión. El solvente se removió por succión y el sólido resultante se disolvió en 50 mL de una mezcla 8:2 v/v de hexano y cloruro de metileno. La solución se concentró hasta un volumen de 5 mL y se transfirió a una columna de silica gel de 2.5 × 15 cm. y se colectó la banda amarilla resultante de la extracción con hexano. Después de eliminar el solvente y de recristalizar en hexano, se obtuvieron 0.95 g, 45% de [η5-C5(CH3)5]Fe(CO)2Si2 Me5 en forma de cristales amarillos.
Tratamiento fotoquímico de [η5-C5(CH3)5]Fe(CO)2SiMe2 SiMe2SiMe3. Una solución de 0.5 g (1.14 mmoles) de [η5-C5(CH3)5]Fe (CO)2SiMe2SiMe2SiMe3 en benceno contenida en un tubo de cuarzo se irradió con una lámpara Hanovia de presión media y 450 Watts a una distancia de 5 cm. El monitoreo de la reacción por RMN de 29Si mostró que ésta era completa después de 4 h con la desaparición del compuesto lineal y la formación del correspondiente isómero ramificado. El solvente fue extraído por succión y el residuo se disolvió en la mínima cantidad posible de una mezcla 1:1 v/v de hexano y cloruro de metileno. La solución se transfirió a una columna de silica gel de 1.5 × 12 cm y se extrajo con hexano, sólo una banda amarilla produjo un sólido cristalino (0.45 g, 90%) de [η5-C5(CH3)5] Fe(CO)2SiMe(SiMe3)2.
d. Estudio cristalográfico
Se determinó la estructura cristalina, y por lo tanto molecular, de los complejos 2, 3 y 4. En los tres cristales estudiados la colección de datos de difracción se llevó a cabo a temperatura ambiente. Se usó un difractómetro Nicolet R3m/V de cuatro círculos para monocristales con monocromador de grafito y radiación Mo Kα (λ = 0.71073 Å). Se usó un barrido en ω con velocidad variable (mayor para las reflexiones intensas y menor para las débiles) en un rango de 3.5 < 2 ϑ > 45°.
Las intensidades de tres reflexiones intensas seleccionadas como referencia se midieron cada 100 reflexiones y éstas no mostraron deterioro de los cristales estudiados. En los casos de 2 y 3 se aplicó una corrección semiempírica por efectos de absorción, resultando factores de corrección de transmisión Min/Max de 0.588/0.646 y 0.209/0.234, respectivamente.
Los programas de cómputo utilizados para solución y refinamiento de las estructuras son parte del paquete cristalográfico SHELEXTL PLUS versión 4.3 (1988) de Nicolet.
Todas las estructuras se resolvieron por el método de Patterson usando los átomos pesados. El refinamiento se hizo por ajuste de mínimos cuadrados mediante el método de matriz completa. El parámetro minimizado fue ∑ w(Fo - Fc)2 con w−1 = σ2(F) + gF2. Todos los átomos diferentes de hidrógeno se refinaron con parámetros térmicos anisotrópicos. Los átomos de hidrógeno se generaron en posiciones idealizadas de acuerdo a la geometría de las moléculas y se les asignó un coeficiente térmico isotrópico común de 0.08 Å3 y una distancia C-H de 0.96 Å. Los parámetros cristalográficos para la colección de datos, la solución y el refinamiento de cada estructura se resumen en la tabla 2.
Resultados y discusión
La síntesis de los compuestos 1, 2 y 3 se hizo siguiendo el procedimiento normal de eliminación salina, ecuación (1) [6].

La formación de 4 se logró mediante la irradiación de 3.
La característica química típica de los oligosilil derivados del sistema [η5-C5H5)Fe(CO)2] es la pérdida fotoquímica de sililenos, así como sus rearreglos, que dependen de la longitud de la cadena, ecuaciones (2) y (3) [7].
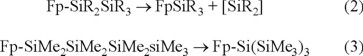
Ambas reacciones ocurren vía intermediarios ferrosilil(silileno), (η5-C5H5)Fe(CO)(SiR3)(=SiR2), formados por una reacción de α-eliminación subsecuente a la expulsión de CO. Los intermediarios sufren migraciones 1,3-alquil, -aril, y/o -silil que resultan en la química observada, esquema 1:
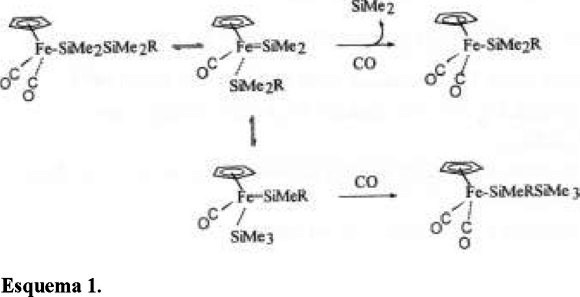
Es obvio que el tratamiento fotoquímico del trisilano lineal 3 resulta en buenos rendimientos de 4 sin eliminación adicional de SiMe2. Este resultado contrasta con el del complejo análogo (η5-C5H5)Fe(CO)2SiMe2SiMe2SiMe3, en el que la eliminación de SiMe2 continúa para formar FpSiMe2SiMe3 y finalmente FpSiMe3 [8]. Es claro que el tamaño del ligando pentametilciclopentadienil impide que la química de eliminación prosiga.
Los datos analíticos y espectroscópicos correspondientes a los nuevos compuestos se reportan en la tabla 1. En la tabla 2 se resumen los parámetros cristalográficos de las determinaciones estructurales. Las estructuras moleculares de los complejos 2, 3 y 4 con el correspondiente esquema de numeración atómica se ilustran en las Figs. 1, 2 y 3. Las coordenadas atómicas se reportan en las tablas 3, 4 y 5 respectivamente para 2, 3 y 4. Longitudes de enlace y ángulos de enlace de particular interés se resumen en la tabla 6.


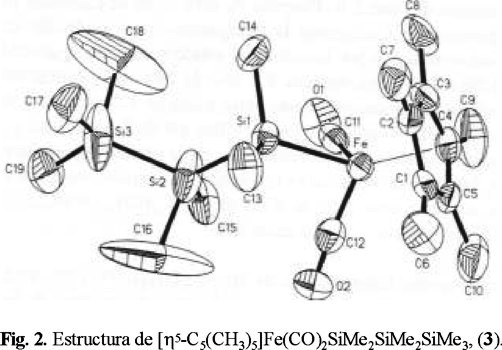


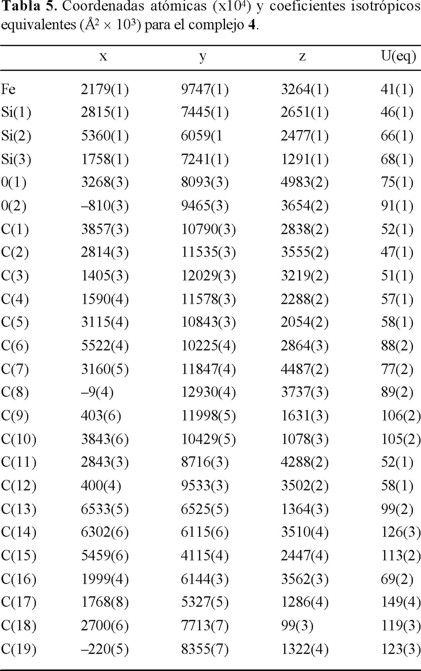
Considerando los datos de la tabla 6 puede verse que los valores de las longitudes y los ángulos de enlace son similares a las de los correspondientes análogos en el sistema indenil dicarbonilo de fierro y, al igual que en éstos, no indican un grado apreciable de carácter ϖ en el enlace Fe-Si ya que los valores en el caso de las longitudes de enlace (2.343-2.380 Å) son significativamente mayores que los de los enlaces Fe-Si con un considerable carácter ϖ (2.280-2.294 Å) como los reportados en complejos de tetracarbonilo de Fierro [9]. Por otra parte, el alargamiento del enlace Fe-Si en 4 respecto al enlace equivalente en 2 está de acuerdo con la tendencia de dicho enlace a elongarse conforme el volumen del grupo en posición β al átomo de Fe aumenta. Como ocurre en III(a), Fe-Si = 2.365 Å un ejemplo adicional es el caso de (η5-C5H5) Fe(CO2SiPh(SiPh(SiMe3)2 con Fe-Si promedio de 2.360 Å [3(i)].
Conclusiones
En suma, en el sistema LFe(CO)2Sin, la substitución de L = indenil por L = pentametilciclopentadienil no es suficiente para provocar un grado apreciable de carácter ϖ en el enlace Fe-Si.
Referencias
1. Para una revisión de la química del silicio con metales de transición véase: (a) Aylett, B. J. Adv. Inorg. Chem. Radiochem. 1982, 25, 1. [ Links ] (b) Pannell, K. H. in Silicon Compounds Register and Review; Anderson, R.; Arkles, B.; Larson, G. L., Eds. Petrarch Systems, Bristol, PA, 1987, Vol. 4, p. 32. [ Links ] (c) Tilley, D.J. in Chemistry of the Functional Groups: Chemistry of Organosilicon Compounds; Patai, S.; Rappaport, Z. Eds., Wiley, New York, 1989. [ Links ]
2. Para una revisión sobre hidrosilacion véase: (a) Lukevics, E.; Belyakova, Z. V. J. Organomet. Chem. Libr. 1977, 5, 1. [ Links ] (b) Harrod, J. F.; Chalk, A.J. in Organic Synthesis via Metal Carbonyls, Wender, I.; Pino, P. Eds., Wiley-Interscience, New York, 1977. [ Links ] (c) Speier, J. L. Adv. Organomet. Chem. 1979, 17, 407. [ Links ]
3. (a) Honle, W.; von Schering, H.G. Z. Anorg. Allg. Chem. 1980, 464, 129. [ Links ] (b) Drahnak, T.J.; West, R.; Calabrese, J. C. J. Organomet. Chem. 1980, 198, 55. [ Links ] (c) Holmes-Smith, R. D.; Stobart, S. R.; Atwood, J. L.; Hunter, W. E. J. Chem. Soc., Dalton Trans. 1982, 2461. [ Links ] (d) Parkanyi, L.; Pannell, K. H.; Hernández, C. J. Organomet. Chem. 1983, 252, 127. [ Links ] (e) Schubert, U.; Kraft, G.; Walther, E. Z. Anorg. Allg. Chem. 1984, 519, 96. [ Links ] (f) Ries, W.; Albright, T. A.; Silvestre, J.; Bernal, I.; Malisch, W.; Burschke, C. Inorg. Chim. Acta 1986, 111, 119. [ Links ] (g) Parkanyi, L.; Hernández, C.; Pannell, K. H. J. Organomet. Chem. 1986, 301, 145. [ Links ] (h) Pannell, K. H.; Cervantes, J.; Parkanyi, L.; Cervantes-Lee, F. Organometallic 1990, 9, 859. [ Links ] (i) West, R.; Pham, E. K. J. Organomet. Chem. 1991, 402, 215. [ Links ]
4. Pannell, K. H.; Lin, S. H.; Kapoor, R. N.; Cervantes-Lee, F.; Piñon, M.; Parkanyi, L. Organometallics 1990, 9, 2454. [ Links ]
5. Pannell, K. H.; Jackson, D. J. Amer. Chem. Soc. 1976, 98, 4443. [ Links ]
6. King, R. B.; Pannell, K. H. Z. Naturforsch, 1969, 23b, 262. [ Links ]
7. Sharma, H. K.; Pannell, K. H. Chem. Rev. 1995, 95, 1351. [ Links ]
8. Hernández, C.; Sharma, H.K.; Pannell, K.H. J. Organomet. Chem., 1993, 462, 259. [ Links ]
9. Leis, C.; Wilkinson, D. L.; Handwerker, C.; Zybill, C.; Muller, G. Organometallics 1992, 11, 514. [ Links ]




![New Palladium(II) Tetraorganodichalcogenoimido Diphosphinates. Crystal and Molecular Structure of Pd[(SPMe2)2N]2 and cis-Pd[(OPPh2)(SPMe2)N]2](/img/es/prev.gif)
2 con L = NH(CH2)2NH2, NH(CH2)4NH2, NH(CH2)12NH2, NHC14H6(O2)NH2](/img/es/next.gif)








