ANTECEDENTES
La preeclampsia afecta del 2 al 8% de los embarazos en el mundo y es causa principal de morbilidad y mortalidad materna y perinatal.1 En México es causa de muerte materna a pesar del control prenatal regular.2 Las dosis bajas de aspirina iniciadas a las 16 semanas de gestación, o antes, son una profilaxis eficaz en embarazos de alto riesgo.3 Debido a que el alcance por historia clínica es bajo4 se desarrollaron pruebas de múltiples marcadores5,6,7 con mejor rendimiento que las guías clínicas.8 La efectividad de la prescripción de aspirina profiláctica, con base en un tamiz temprano de preeclampsia, se reconoció recientemente9 y fue adoptada por la Federación Internacional de Ginecoobstetricia (FIGO).10
El rendimiento de estas pruebas ha resultado subóptimo en poblaciones diferentes de las que originaron el modelo,11 excepto cuando los marcadores se adaptan a la población diana.12
Uno de estos algoritmos, ampliamente distribuido por su gratuidad, es el de la Fundación de Medicina Fetal de Londres, Reino Unido.5,6,13 Su versión más reciente: FMF 4.0 (2018)14 se liberó en marzo 2019 y cuenta con al menos 299 usuarios registrados en México (https://fetalmedicine.org/lists/map/certified/Ut); sin embargo, no se incluyó población mexicana en su creación ni se ha publicado la validación adecuada. El reporte de Acosta-Alfaro L y su grupo15 no se basó en este modelo, no indica si se adaptó a la población diana y su conclusión contiene un error tipo II, por una muestra insuficiente.
El objetivo de este estudio fue: validar el rendimiento de la calculadora de la Fundación de Medicina Fetal 4.0 adaptada a población mexicana.
MATERIALES Y MÉTODOS
Estudio observacional y prospectivo efectuado en una cohorte previamente descrita en sus orígenes16 para estudios perinatales en un Centro y Laboratorio de Medicina Fetal de la Ciudad de México. El reclutamiento de la cohorte se amplió de enero de 2012 a diciembre 2019.
Criterios de inclusión: embarazos con feto único, con vitalidad y longitud corona-cauda entre 45 y 84 mm (11+1 a 14+1 semanas de gestación), con datos completos para el estudio y que se haya registrado el nacimiento de recién nacido sano, vivo o muerto, con 24 semanas de gestación o más. Criterios de exclusión: embarazos con defectos cromosómicos, no cromosómicos y los que finalizaron el embarazo antes de las 24 semanas.
La historia clínica se obtuvo por cuestionario autoadministrado, verificado por interrogatorio y codificado operativamente conforme a los lineamientos de la Fundación de Medicina Fetal.17 El peso y estatura de las madres se obtuvieron con una báscula y estadímetro clínicos convencionales, analógicos y calibrados.
Las semanas de gestación se establecieron por longitud corona-cauda por ecografía, conforme al método de Robinson corregido por Loughna P y su grupo.18
La presión arterial se midió de acuerdo con el método estandarizado por la Fundación de Medicina Fetal,19 adoptado por la Federación Internacional de Ginecología y Obstetricia (FIGO),10congruente con las recomendaciones internacionales actuales.20 Requirió el uso forzoso del brazalete mediano único (22 a 23 cm) proporcionado con cada dispositivo para todas las embarazadas; los de otros calibres no están disponibles en el mercado local y se asumió la corrección del sesgo braquial21 al incluir el peso de la madre en el modelo adaptado.22
Los dispositivos electrónicos automáticos fueron de la marca Omron® (Japón), modelo HEM-7121 que cumple con el requisito 510(k) de la FDA y se calibraron periódicamente durante el estudio. El personal encargado de las mediciones se capacitó y supervisó constantemente. La presión arterial media se obtuvo del promedio de las últimas dos lecturas estables en ambos brazos, de acuerdo con el método estandarizado original.19
Para la medición del índice de pulsatilidad medio de las arterias uterinas se utilizaron ecógrafos marca Voluson (GE Healthcare Technologies®) modelos E10, E6, S8, 730 Expert, Logiq P5 y Logiq 3 Expert. Todos con transductores transabdominales y transvaginales multifrecuencia, con mantenimiento preventivo constante. Los exámenes los practicaron dos operadores certificados y auditados periódicamente (fetalmedicine.org) siguiendo la metodología estandarizada.23
La medición de la proteína plasmática A asociada al embarazo se efectuó en analizadores automatizados, calibrados y controlados, basados en inmunoensayos ultrasensibles y aprobados por la Fundación de Medicina Fetal, a saber: BRAHMS Kryptor compact PLUS (ThermoFisher®) por emisión amplificada de criptato resuelta en tiempo; Cobas e411 (Roche®) por electroquimioluminiscencia; y DELFIAXpress (PerkinElmer®) emisión amplificada de europio resuelta en tiempo.
Las muestras fueron de suero extraído de la sangre venosa periférica (braquial), procurando la estabilidad del analito24 y la validez temporal.25
El desenlace de cada embarazo se obtuvo del acta de nacimiento, defunción, de alumbramiento, del expediente clínico o por anamnesis de la paciente al regresar al centro por nuevo embarazo. El diagnóstico clínico de preeclampsia se corroboró a partir de los registros médicos disponibles, con base en los criterios de la International Society for the Study of Hypertension in Pregnancy (ISSHP).26 El personal encargado de recolectar los desenlaces de los embarazos estuvo cegado a los datos registrados a las 11 a 14 semanas de gestación. El desenlace preeclampsia se categorizó presente o ausente al momento del parto, en consideración al concepto de riesgos en competencia,27 por lo que la categoría preeclampsia ausente puede o no incluir otros desenlaces perinatales adversos pero que no fueron el objetivo de este estudio.
Calculadora FMF
Debido a que el módulo Astraia® (Alemania) solo admite personalización para proteína plasmática A asociada al embarazo, fue necesario codificar el algoritmo FMF 4.014 en una hoja de Excel® para el propósito. La plantilla y el código de programación son propiedad del Centro y Laboratorio de Medicina Fetal e incluye los siguientes cálculos sobre la base de datos:
El riesgo a priori se estableció por historia clínica.17
Los valores de cada marcador se estandarizaron en múltiplos de la mediana (MoM) de acuerdo con las medianas específicas de la población. Estos valores de referencia se publicaron para la presión arterial media22 y para proteína plasmática A asociada al embarazo.25,28 Los valores de referencia para el índice de pulsatilidad medio de las arterias uterinas son propiedad del Centro y Laboratorio de Medicina Fetal, en espera de próxima publicación.
Los valores de los múltiplos de la mediana esperados en embarazos afectados con el desenlace de interés se calcularon con la configuración centrada a menos de 37 semanas de parto con preeclampsia (v. líneas de regresión).13
Se calculó la función de densidad de probabilidad normal multivariante de los tres marcadores en cada sujeto de estudio, con base en los log10 (múltiplos de la mediana) esperados por desenlace y las matrices de covarianza para cada desenlace (v. configuración del algoritmo).13
El cociente de probabilidad para cada sujeto de estudio se calculó a partir de las propias densidades de probabilidad de afectado y no afectado, para aplicarse al riesgo a priori y así obtener la probabilidad bayesiana posprueba.
Una explicación más detallada del modelo en el que se basa este algoritmo puede encontrarse en el documento recientemente publicado por sus desarrolladores.29
Análisis estadístico
Se evaluó el rendimiento de la calculadora como modelo predictivo,30 siguiendo la configuración recomendada por los desarrolladores:14 se centraron los cálculos para preeclampsia antes de las 37 semanas y se utilizó la probabilidad bayesiana obtenida posprueba como clasificador para discriminar el desenlace preeclampsia al parto menor a 37 semanas como preeclampsia global. El estadístico principal de este estudio fue el área bajo la curva de característica receptor-operador30 con una hipótesis nula centrada en un rendimiento de 0.500, equivalente a un rendimiento nulo para la calculadora.
A manera de exploración se describe la distribución de los múltiplos de la mediana sin el desenlace preeclampsia y se inspeccionan las líneas de regresión de múltiplos de la mediana en afectados por semanas de gestación al parto por preeclampsia, comparándolas con el modelo hipotético13,14 mediante la t de Student para coeficientes31.
Se exploró la representatividad de las probabilidades posprueba del modelo por inspección de su curva de calibración.32
Se probaron los supuestos de normalidad, linealidad y homocedasticidad para decidir aplicar estadísticos paramétricos, no paramétricos o transformar las variables para análisis.
El nivel de significación fue α = 0.05 para las pruebas estadísticas del valor p.
El tamaño de la muestra se basó en una frecuencia del 5.4% para preeclampsia en la Ciudad de México33 y una sensibilidad del 49.43% para la misma prueba adaptada a otra población.12 Así, para un error marginal máximo (EMM) del 15% se calculó34 un mínimo de 43 sujetos con preeclampsia, una muestra total de 790 sujetos consecutivos de la cohorte. Se prefirió el cálculo de muestra con base en la tasa de detección y no sobre el AUC-ROC, porque ésta requiere una cantidad menor12,34 (267 observaciones consecutivas con 14 sujetos con preeclampsia).
La base de datos se creó con los programas Astraia® (Alemania) y Excel® y es propiedad del Centro y Laboratorio de Medicina Fetal. El análisis estadístico se llevó a cabo en el programa Excel® con licencia vigente, los códigos de programación son propiedad del Centro y Laboratorio de Medicina Fetal.
El ensayo fue aprobado por los comités Científico y de Bioética de la sede, apegándose a la Declaración de Helsinki de la Asociación Médica Mundial para las investigaciones médicas en seres humanos y todos los sujetos dieron su consentimiento para participar en la cohorte.
RESULTADOS
La incidencia de preeclampsia en esta cohorte fue de 54 casos en 1078 embarazadas (5.0%. IC95%: 3.8-6.2). Se contaron 147 (13.6%) nacimientos antes de las 37 semanas; fueron 29 de 54 (53.7%) por preeclampsia y 118 de 1024 (11.5%) sin preeclampsia (p < 0.001, exacta de Fisher). La incidencia de preeclampsia entre los nacimientos prematuros fue de 29 de 147 (19.7%. IC95%: 13.9-25.6). Las características maternas al ingreso a la cohorte, por grupo de desenlace, se especifican en el Cuadro 1.
Cuadro 1 Características de las madres al ingreso a la cohorte por grupo de desenlace (n = 1078)
| Variables | Sin preeclampsia n = 1024 | Preeclampsia n = 54 | valor p |
|---|---|---|---|
| Edad de la madre (años)a | 33.0 (30.3; 35.8) | 34.3 (31.7; 37.9) | 0.028* |
| Peso de la madre (kg)a | 61.5 (55.5; 68.5) | 63.6 (58.1; 71.8) | 0.062 |
| Talla de la madre (cm)a | 160.3 (156.0; 164.5) | 161 (159.0; 164.5) | 0.183 |
| Índice de masa corporala | 23.9 (21.8; 26.7) | 24.1 (23.0; 37.9) | 0.110 |
| Semanas de embarazoa | 12.7 (12.3; 13.3) | 12.7 (12.0; 13.1) | 0.119 |
| Etniab | 0.746 | ||
| Caucásico/hispano | 875 (85.4) | 47 (87) | |
| Afrocaribeño | 3 (0.3) | - | |
| Surasiático | 4 (0.4) | - | |
| Este asiático | 27 (2.6) | - | |
| Otro, mixto | 115 (11.2) | 7 (13.0) | |
| Concepciónb | < 0.001* | ||
| Espontánea | 931 (90.9) | 42 (77.8) | |
| Fertilización in vitro | 55 (5.4) | 11 (20.4) | |
| Inductores de la ovulación | 38 (3.7) | 1 (1.9) | |
| Hábito de fumarb | 0.904 | ||
| Fumadora | 19 (1.9) | 1 (1.9) | |
| Dejó de fumar | 115 (11.2) | 5 (9.3) | |
| No fuma | 890 (86.9) | 48 (88.9) | |
| Paridadb | < 0.001* | ||
| Nulípara | 712 (69.5) | 44 (81.5) | |
| Paridad sin preeclampsia | 298 (29.1) | 2 (3.7) | |
| Paridad con preeclampsia previa | 14 (1.4) | 8 (14.8) | |
| Historia médicab, c | 0.003* | ||
| Hipertensión crónica | 7 (0.7) | 3 (5.6) | |
| Lupus eritematoso sistémico | 1 (0.1) | - | |
| Síndrome antifosfolipídico | 7 (0.7) | - | |
| Antecedente familiar de preeclampsiab | 14 (1.4) | 5 (9.3) | < 0.001* |
Las comparaciones entre los grupos de desenlace se realizaron mediante la prueba chi cuadrado o exacta de Fisher para variables categóricas y la U de Mann-Whitney para variables continuas. a: mediana (IQ). b: n (%). c: no hubo embarazadas con diabetes mellitus en ninguno de los grupos de desenlace. *: estadísticamente significativo.
La exploración de la distribución de los marcadores en el grupo de parto sin preeclampsia se expone en la Figura 1. Los valores centrales fueron: presión arterial media = 0.988 MoM, IPm = 1.040 MoM, y proteína plasmática A asociada al embarazo = 0.982 MoM.
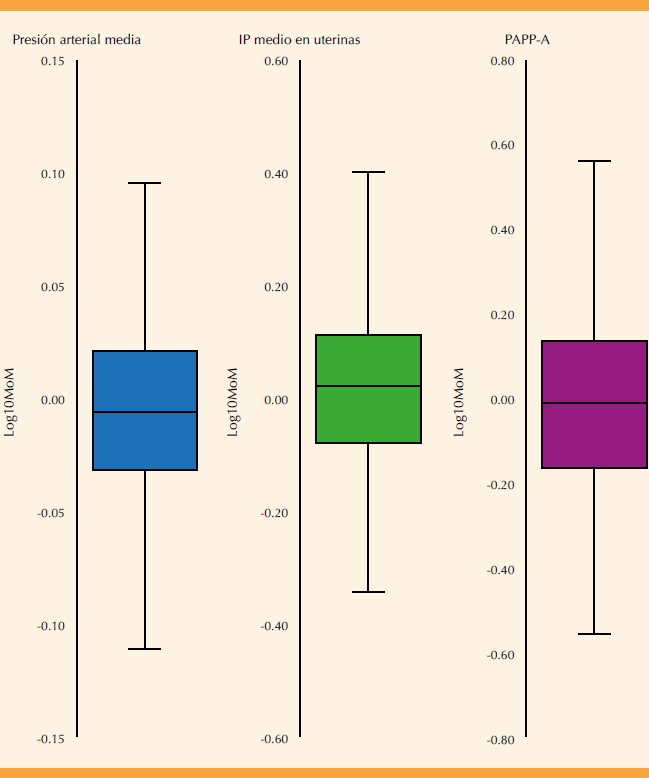
Figura 1 Distribución de los marcadores transformados en logaritmo base 10 de los múltiplos de la mediana (MoM) en el grupo sin preeclampsia (n = 1024) en gráficos de caja y bigote. IP = índice de pulsatilidad. PAPP-A asociada al embarazo = proteína plasmática A del embarazo.
La distribución de los múltiplos de la mediana por semanas de gestación al parto por preeclampsia se encuentra en la Figura 2 con las líneas de regresión hipotéticas y las propias de la cohorte. La línea local de la presión arterial media no resultó significativamente diferente de la hipotética (pendiente p = 0.484 e intersección p = 0.788). La línea local del índice de pulsatilidad medio de las arterias uterinas solo tuvo diferencia estadísticamente significativa con la hipotética en su pendiente (p = 0.046), pero no en su intersección (p = 0.545). La línea local de proteína plasmática A asociada al embarazo resultó significativamente diferente en pendiente e intersección (p < 0.001).
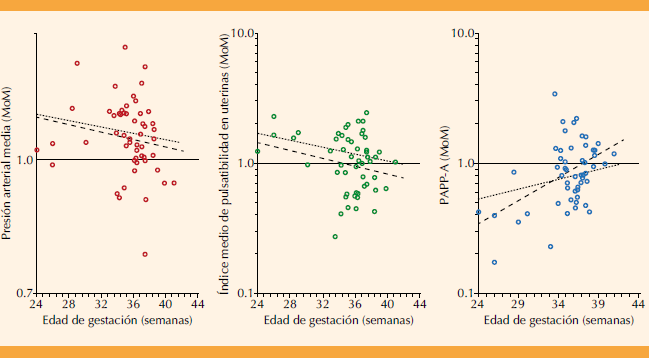
Figura 2 Distribución de los múltiplos de la mediana (MoM) por semanas de gestación al parto por preeclampsia (o, n = 54). Línea de regresión local (- -) versus la hipotética13 (…). La línea horizontal (_) se refiere a 1.0 MoM. PAPP-A: proteína plasmática A del embarazo.
El AUC-ROC fue de 0.784 (0.712; 0.856) para preeclampsia antes de las 37 semanas y de 0.807 (0.762; 0.852) para preeclampsia global; ambas se grafican en la Figura 3. A una tasa fija del 10% de falsos positivos, la detección global de preeclampsia fue de 48.1% (36.0; 60.3) con un punto de corte de 1 en 63. Para preeclampsia antes de las 37 semanas, a una tasa fija del 10% de falsos positivos, la detección fue de 38.9% (24.4%; 53.4%) con un punto de corte de 1 en 40.
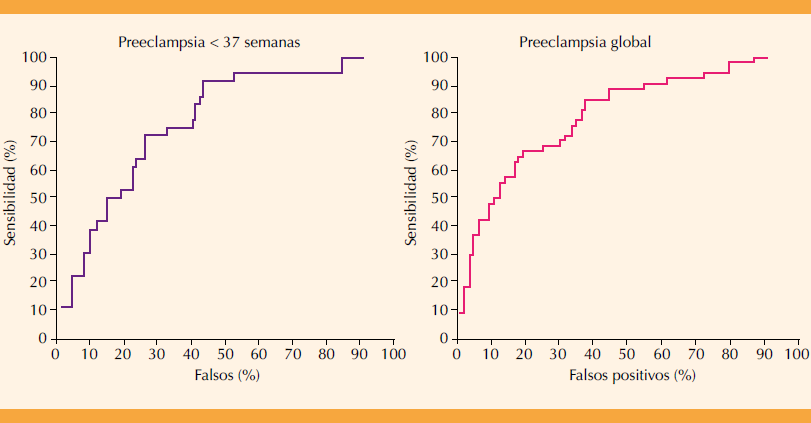
Figura 3 Curvas de característica receptor-operador ROC para preeclampsia antes de las 37 semanas (izquierda, n = 29/147) y preeclampsia global (derecha, n = 54/1078).
La línea de calibración se explora en la Figura 4.
DISCUSIÓN
El rendimiento de la calculadora FMF 4.0 ajustada a la población local resultó estadísticamente significativo porque los intervalos de confianza de las áreas bajo la curva no incluyen el valor 0.500 rechazándose la hipótesis nula. A diferencia de Acosta-Alfaro y su grupo,15 se concluye que el algoritmo es útil y que el poder del efecto pudo comprobarse debido a un tamaño de muestra debidamente calculado.
Este rendimiento significativo fue adecuado para preeclampsia global porque el IC95% del AUC-ROC observado incluyó el valor 0.773 esperado;14 sin embargo, el rendimiento para preeclampsia antes de las 37 semanas, aunque significativo, resultó menor al esperado porque el IC95% del AUC-ROC observado no alcanzó al valor 0.896 esperado.14 Justo la tasa de detección para preeclampsia global fue la esperada12 a 10% de falsos positivos, salvo que a un punto de corte diferente (1 en 63 versus 1 en 93). Para preeclampsia antes de las 37 semanas fue menor a la esperada;12 para conseguirla a un punto de corte de 1 en 90 sería a expensas de una tasa mayor de falsos positivos de 23.4% (10.9%; 36.0%). Ya se conocía el rendimiento subóptimo para las pruebas de tamiz de preeclampsia en poblaciones diferentes de la que originó el modelo;11 sin embargo, para esta calculadora específica y en otro país, se reportó un rendimiento adecuado con solo adaptar los marcadores a la población diana.12 En nuestra población, aun adaptando los marcadores, el rendimiento de la calculadora fue discrepante para preeclampsia pretérmino y global. Este hallazgo amerita investigación adicional; por ejemplo, evaluar el efecto de la prescripción de dosis bajas de aspirina antes y después de la prueba. Lo anterior surge por dos motivos: 1) se sabe que las dosis bajas de aspirina antes de la prueba tienden a mejorar el índice de pulsatilidad medio de las arterias uterinas y proteína plasmática A asociada al embarazo;352) las dosis bajas de aspirina previenen la preeclampsia antes del término, pero no al término.9
Una limitante de este estudio fue que no se investigó el efecto de la toma de aspirina antes o después de la prueba, por lo que será motivo de estudios futuros. Otra hipótesis de los autores acerca de este rendimiento discordante surge de la exploración de las líneas de regresión de los marcadores por semanas de gestación al parto con preeclampsia, ya que hubo diferencia significativa para el IP medio de las arterias uterinas y para proteína plasmática A asociada al embarazo. Se requiere mayor cantidad de sujetos con el desenlace de interés para precisar estos efectos y poder adaptar, también, este componente de la calculadora a la población local. En opinión de los autores, la adaptación de calculadoras similares a poblaciones diferentes de la que originó el modelo deberá considerar no solo hacerlo con los valores de referencia poblacionales de los marcadores, sino también con los valores de referencia en el grupo de las afectadas. Se justifican investigaciones futuras.
La calibración explorada resulta subóptima; los autores proponen dos explicaciones hipotéticas: 1) nuestra cohorte podría tener sesgo poblacional para embarazos de alto riesgo; 2) el modelo del riesgo a priori por historia podría subestimar la prevalencia real de la enfermedad en nuestra población porque no estuvo representada en el estudio original. Lo anterior justifica desarrollar el modelo local para probabilidad a priori de preeclampsia por riesgos en competencia.27,29
CONCLUSIONES
La calculadora FMF 4.0 adaptada a población mexicana tuvo rendimiento estadísticamente significativo, por lo que se concluye válida. Este rendimiento fue menor al esperado para preeclampsia antes de las 37 semanas, pero adecuado para preeclampsia global. Deberá investigarse, por ejemplo, el efecto de la toma de aspirina profiláctica antes o después de la prueba. Será óptimo desarrollar la calculadora local, generando el propio modelo de riesgos en competencia.











 nueva página del texto (beta)
nueva página del texto (beta)



