ANTECEDENTES
La hiperestimulación ovárica controlada es un factor decisivo para el éxito de las técnicas de reproducción asistida porque permite el reclutamiento y crecimiento de múltiples ovocitos maduros, con la finalidad de obtener una cantidad de embriones suficiente para transferirse y lograr un recién nacido vivo.
En los ciclos de reproducción asistida, principalmente de fertilización in vitro (FIV) e inyección intracitoplasmática de espermatozoides (ICSI), la maduración final de los ovocitos se consigue, de manera rutinaria, con la administración de gonadotropina coriónica humana (hCG), que simula el pico de LH en los diferentes protocolos de hiperestimulación ovárica controlada.1
En 1990, Gonen y sus colaboradores fueron los primeros en administrar el agonista de hormona liberadora de gonadotropinas (GnRH) como inductor de la maduración de ovocitos. Este inductor de la ovulación es capaz de aumentar, simultáneamente, la concentración de FSH y LH, similar a la oleada hormonal que se observa durante el ciclo menstrual normal. La FSH incrementa la concentración de receptores de LH en las células de la granulosa, indispensables para la correcta maduración ovocitaria. 2,3
El reemplazo de hCG por agonistas de GnRH es benéfico en pacientes con riesgo de síndrome de hiperestimulación ovárica, pues disminuye la secreción de sustancias vasoactivas (factor de crecimiento endotelial vascular [VEGF]) y el tiempo de acción, que en el caso de hCG es superior a 6 días. 4,5
A pesar de las ventajas de la inducción de la ovulación con agonistas de GnRH, se ha observado disminución de la tasa de implantación e incremento de la de aborto, pues se considera que produce una rápida luteólisis, lo que altera la fase lútea, comparada con la administración de hCG. Para resolver este problema se ha establecido el protocolo de altas dosis de progesterona sola o combinada con estrógeno en la fase lútea, o la congelación de toda la cohorte embrionaria para su posterior transferencia. 6
El protocolo de doble inducción de la maduración con agonista de GnRH (dual trigger) además de dosis bajas de hCG para el rescate de la fase lútea aumenta las tasas de embarazo, sin provocar los riesgos del síndrome de hiperestimulación ovárica. El tratamiento consiste en la administración de 4 mg de acetato de leuprolide y 1000-2500 UI de hCG, 34 a 36 horas antes de la captura ovocitaria de manera simultánea; no obstante, esta técnica está en perfeccionamiento. 3
Los primeros trabajos que evaluaron el agonista de GnRH reportaron, como resultado secundario, el aumento de ovocitos capturados en metafase 2 (M2), que dio pie al estudio de su efecto en las células foliculares. Fue así como se estableció el protocolo de “doble disparo (doubble trigger)” a la administración conjunta de agonista de GnRH y hCG con diferentes horarios de aplicación para la inducción de la ovulación. El fundamento fisiológico se asocia con las ventajas del agonista de GnRH, que incrementa la concentración endógena de FSH a la par de LH, con funciones importantes en la maduración, y aumento en las tasas de recuperación y fertilización de ovocitos. 6,7Así se creó una nueva modalidad de tratamiento para pacientes con alta proporción de ovocitos inmaduros por número de ovocitos recuperados. El protocolo consiste en la administración de agonista de GnRH y hCG, 40 y 34 horas previas a la recolección de ovocitos, respectivamente. De esta forma, la oleada de FSH funciona como un “doble activador” en las células de la granulosa y, posteriormente, el efecto de hCG completa el potencial de activación. 8
Con base en lo anterior, el objetivo de este estudio fue: evaluar el efecto del doble disparo en pacientes con un ciclo previo con menos de 65% de ovocitos maduros respecto de los ovocitos capturados, en una población con respuesta normal a la inducción de la ovulación con hCG recombinante o urinaria.
MATERIALES Y MÉTODOS
Estudio de cohorte, prospectivo, llevado a cabo en pacientes con diagnóstico de infertilidad, en tratamiento con fertilización in vitro, evaluadas en el Centro Mexicano de Fertilidad (Hospital Ángeles Lomas) entre 2017 y 2019. Criterios de inclusión: mujeres en tratamiento con fertilización in vitro; concentración de marcadores de reserva ovárica dentro de los parámetros normales, en cuyo ciclo previo convencional con esquema de antagonista e inducción de la ovulación con hCG tuvieron respuesta ovárica subóptima y captura ovocitaria menor de 65% en fase M2. Posteriormente se les realizó un segundo ciclo con el mismo esquema de gonadotropinas e inducción de la ovulación con doble disparo (acetato de triptorelina 1 mg + 5000UI de hCG urinaria 40 y 34 horas previas a la captura). Criterios de exclusión: pacientes con expediente incompleto, quienes tuvieron doble disparo con esquema de gonadotropinas diferente al previo con hCG; pacientes que recibieron doble disparo con agonistas diferentes a triptorelina o hCG recombinante o esquemas de hiperestimulación ovárica controlada con protocolo largo con agonistas de GnRH.
Se analizaron las variables de edad, índice de masa corporal, concentración de FSH y recuento folicular antral basal; determinación de los valores de LH, progesterona y estradiol el día de la inducción de la ovulación; días de estimulación y total de dosis de gonadotropinas (UI). Como resultados primarios se evaluaron: cantidad de ovocitos capturados, cantidad de ovocitos en fase M2 y porcentaje de maduros.
Procedimiento
Estimulación ovárica: se inicia en el segundo o tercer día del ciclo menstrual, con esquema de antagonista con FSH-r/LHr o menotropinas altamente purificadas. La dosis inicial se determina por las características basales de la paciente, incluidas la edad, el índice de masa corporal y el conteo de folículos antrales. El seguimiento folicular se lleva a cabo por ultrasonido transvaginal y administración de estradiol, y el ajuste de la dosis se efectúa según la respuesta ovárica.
La inducción de la ovulación se efectuó con la identificación de 3 folículos con diámetro mayor de 17 mm. El grupo 1 recibió: HCG-r (Ovidrel® de 250 mcg; Merck-Serono) o HCG-u (Choragon 5000 UI; Ferring) 34 h previas a la captura de ovocitos. Al grupo 2 (“doble disparo”) se le aplicaron 0.1 mg/mL de acetato de triptorelina (Gonapeptyl daily®; Ferring) + 5000 UI de hCG (Choragon; Ferring) urinaria, 40 y 34 h previas a la captura.
La captura folicular se efectuó con guía ultrasonográfica, con inseminación de los ovocitos obtenidos por fertilización in vitro convencional o inyección citoplasmática de espermatozoides (ICSI), 4 a 6 horas posteriores a su recuperación y evaluación 18 horas más tarde. En el día 3 y 5 del desarrollo embrionario se lleva a cabo la transferencia con catéter blando de Cook (Echotip) y guía ultrasonográfica. La determinación de la subunidad beta de hCG se efectúa 14 días después de la transferencia. Se considera positivo el valor mayor de 100 mUI/mL.
Para el análisis estadístico se utilizó el programa Statistic Package for Social Sciences (SPSS INC, Chicago, Illinois) de IBM, versión 23. Las variables continuas se reportan con media y desviación estándar, y las categóricas con frecuencias y porcentajes. Se implementó la t de Student o U de Mann Whitney para la evaluación de las diferencias de medias según la distribución de cada variable, y χ2 para diferencia de proporciones entre ambos grupos.
RESULTADOS
Se registraron 34 pacientes, en cada una se efectuaron 2 ciclos de inducción de la ovulación (68 ciclos). En cuanto a los parámetros demográficos, se observó una muestra homogénea en edad, IMC y concentraciones hormonales basales. Sin embargo, no se encontró significación estadística al comparar la edad (p = 0.6). (Cuadro 1) Al analizar ambas muestras no se observaron diferencias estadísticamente significativas en las concentraciones de progesterona y LH el día de la inducción de la ovulación. No obstante, hubo aumento en las concentraciones de estradiol en el ciclo previo en las pacientes del grupo 1 versus grupo 2 de doble disparo, sin diferencias estadísticamente significativas.
Cuadro 1 Características demográficas de la población de estudio
| Características | Grupo 1 (hCG) (n = 34) | Grupo 2 (hCG + triptorelina) (n = 34) | p |
| Edad (años) | 35.6 ± 4.8 | 36.1± 4.8 | 0.6 |
| IMC (kg/m2) | 23.2 ± 3.6 | 23.4 ± 4.0 | 0.8 |
| FSH basal (mUI/mL) | 7.0 ± 1.9 | 7.1 ± 2.1 | 0.8 |
| LH el día de la captura (mUI/mL) | 3.8 ± 3.8 | 2.4 ± 1.9 | 0.06 |
| Progesterona el día de la captura (ng/mL) | 1.7 ± 0.8 | 1.9 ± 0.8 | 0.2 |
| Pico de estradiol (pg/mL) | 2132 .6 ± 1987.2 | 1919 .8 ± 1101.0 | 0.5 |
| Días de estimulación | 10.2 ± 1.4 | 10.7 ± 1.1 | 0.7 |
| Grosor endometrial (cm) | 10.2 ± 2.3 | 10.4 ± 2.4 | 0.7 |
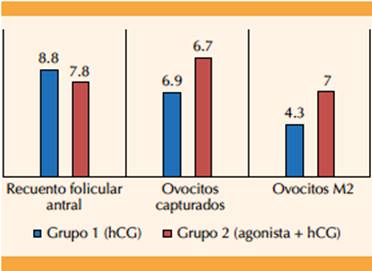
Al evaluar los resultados primarios se encontraron diferencias significativas en la cantidad de ovocitos capturados (p < 0.003) a favor del grupo 2 (doble disparo) versus grupo 1 (9.7 ± 5.6 vs 6 ± 5.0). (Cuadro 2) Es decir, 4.1 ovocitos más a expensas de concentraciones más altas de estradiol al momento de la inducción.
Cuadro 2 Resultados comparativos
| Características | Grupo 1 (hCG) (n = 34) | Grupo 2 (hCG + triptorelina) (n = 34) | p |
| Conteo de folículos antrales | 8.85 ± 4.8 | 7.88 ± 3.9 | 0.3 |
| Folículos totales el día del disparo | 14.0 ± 7.9 | 13.47 ± 7.0 | 0.7 |
| Folículo mayor de 17 mm | 5.18 ± 3.1 | 5.0 ± 3.1 | 0.8 |
| Dosis (unidades) | 2757 ± 688 | 2750 ± 604 | 0.9 |
| Ovocitos capturados | 6.9 ± 5.0 | 9.7 ± 5.6 | 0.03* |
| Porcentaje de ovocitos maduros | 65.4 ± 21.3 | 74.6 ± 20.2 | 0.07 |
| Ovocitos en metafase 2 | 4.3 ± 3.4 | 7.0 ± 4.0 | 0.005* |
El porcentaje de ovocitos maduros no tuvo significación estadística (p = 0.07) al comparar ambos grupos; sin embargo, se observó una tendencia importante a favor del grupo 2 (65.4 ± 21.3 vs 74.6 ± 20.2). Respecto a la cantidad de ovocitos maduros (M2), se encontró significación estadística (p < 0.005) en el grupo 2, con una diferencia de 4.3 ± 3.4 vs 7.0 ± 4.0 ovocitos M2. Figuras 1y2
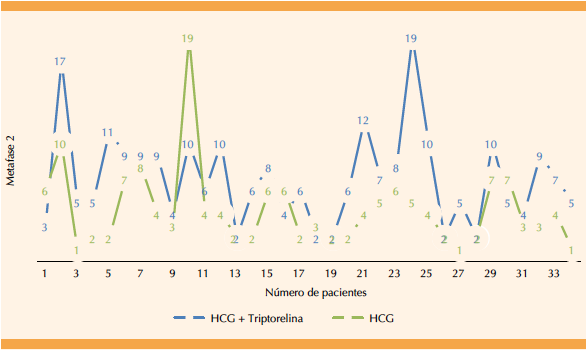
Figura 2 Cantidad de ovocitos en metafase 2 obtenidos en la misma paciente (comparación de ambos grupos).
En los desenlaces secundarios no se observó significación estadística respecto de la cantidad de folículos mayores de 17 mm (5.18 ± 3.1 vs 5.0 ± 3.1; p = 0.8) ni de las concentraciones de estradiol (p = 0.5) al momento de la aplicación del inductor de maduración ovocitaria. Las dosis totales administradas de gonadotropinas fueron similares en ambos grupos (2757 ± 688 vs 2750 ± 604; p = 0.9). Cuadro 2
Al evaluar la relación entre la cantidad de folículos antrales y ovocitos capturados FORT (Follicular output rate) se observó una respuesta subóptima en el grupo 1, que no se presentó en el grupo de doble disparo. Figura 3
DISCUSIÓN
La inducción de la ovulación se lleva a cabo con una sola aplicación de hCG; actualmente se ha demostrado que el protocolo con agonista de GnRH representa una estrategia viable y segura para prevenir el síndrome de hiperestimulación ovárica e inducir la ovulación de manera más fisiológica, al adicionar un pico de LH y generar mayor cantidad de ovocitos maduros.
Griffin y su grupo de estudio1 reportaron el beneficio del doble disparo en pacientes con más de 25% de ovocitos inmaduros capturados y observaron que en la segunda estimulación obtenían mayor porcentaje de maduración. Otro estudio reciente evaluó el mismo efecto en pacientes con porcentaje menor de 55% de ovocitos maduros, con aumento de ovocitos capturados en fase M2 y mayor cantidad de embriones transferidos, con significación estadística en el grupo que recibió doble disparo versus solo hCG. Ambas investigaciones son las únicas que han evaluado el efecto del doble disparo en la misma paciente. 1,9
De acuerdo con estas investigaciones, nuestra cohorte consistió en mujeres que en un ciclo de estimulación convencional con gonadotropinas e inducción de la ovulación solo con hCG tuvieron menos 65% de ovocitos capturados en fase M2, con el segundo ciclo aplicando el doble disparo. Una de las ventajas del estudio fue que se aplicó el mismo esquema de gonadotropinas en las mismas pacientes y solo se modificó la inducción de la ovulación, de modo que la población de estudio es homogénea (Cuadro 1), se evita el sesgo de la hiperestimulación ovárica controlada y, por lo tanto, puede afirmarse que el aumento de ovocitos maduros obtenidos con el doble disparo es directamente proporcional a su aplicación en la inducción de la ovulación.
Como dato particular de este estudio, a pesar de tratarse de una población con marcadores que denotaban una buena reserva ovárica por las concentraciones de FSH basales y el recuento folicular antral al inicio de la estimulación, además de las concentraciones de estradiol el día de la inducción de la ovulación y el seguimiento folicular normal, el resultado es deficiente al momento de la captura y el porcentaje de ovocitos maduros es menor de 65%. En las mujeres que se espera una respuesta normal, en realidad se obtiene una cantidad de ovocitos subóptima, que reduce las tasas de éxito actuales. Cuadro 2
Al aplicar a estas pacientes el doble disparo se encontró ventaja en la cantidad de ovocitos capturados (9.7 vs 6.9) y de ovocitos en fase M2 (7 vs 4.3), ambos estadísticamente significativos. Estos resultados se ven reflejados con una tendencia clara hacia el aumento del porcentaje de ovocitos capturados en fase M2 (74 vs 65), evitando así el resultado subóptimo registrado en el primer ciclo de hiperestimulación ovárica controlada. Figura 3
Un punto importante de este estudio es que la comparación de ambos grupos de inducción de la ovulación se llevó a cabo en la misma paciente, con un ciclo previo con resultado deficiente, con la sola administración de hCG versus un nuevo ciclo con doble estimulación. Esto permitió que la población fuera homogénea y, aún con una cantidad reducida de pacientes, los desenlaces son relevantes. Esta investigación es la única reportada hasta el momento en México y una de los más grandes en la bibliografía universal en pacientes con doble disparo, antecedente de un ciclo previo con solo hCG y baja cantidad de ovocitos maduros.
Por lo tanto, este método combina la ventaja de la prolongación del tiempo entre la activación de la ovulación y la captura de ovocitos, además de la inducción simultánea con el aumento de FSH, que contribuye a eliminar posibles fallas en la función de las células de la granulosa, maduración meiótica o expansión del cúmulo, que se traducen en mejores desenlaces.
CONCLUSIONES
A mayor cantidad de ovocitos maduros capturados mayor cantidad de embriones disponibles para la transferencia, lo que representa un aumento de recién nacidos vivos posterior al tratamiento de reproducción asistida. La técnica de doble disparo se ha extendido en pacientes con respuesta reproductiva subóptima o deficiente, con proporción elevada de ovocitos inmaduros. La combinación de acciones de LH, FSH y GnRH puede ser benéfica para aumentar la maduración de ovocitos en pacientes con antecedente de infertilidad (captura ovocitaria con bajo porcentaje de ovocitos maduros). La técnica de doble disparo es valiosa para el tratamiento de pacientes con deficiente captura de ovocitos, aún con desarrollo folicular normal y concentraciones de estradiol adecuadas y óptimas de hCG el día de la captura. Se requieren estudios prospectivos de gran tamaño para dilucidar la recomendación mencionada de la técnica de “doble disparo”.











 nueva página del texto (beta)
nueva página del texto (beta)