ANTECEDENTES
El síndrome del espejo se caracteriza por asociar hidrops fetal, edema en la madre y placentario. Este cuadro clínico también se denomina: síndrome de Ballantyne, triple edema, pseudotoxemia, gestosis aguda del segundo trimestre, toxemia gestacional e hidrops materno.1,2,3
Si bien la incidencia de síndrome de Ballantyne en China es de 0.0154%4 la casuística reportada en el mundo es limitada. Los casos leves no suelen diagnosticarse o se diagnostican como cuadro de preeclampsia. 5 El riesgo de hidrops fetal se estima en 1 por cada 3000 embarazos y de estos solo 29% tendrán síndrome del espejo.2,6
METODOLOGÍA
Se efectuó una búsqueda bibliográfica en PubMed de los artículos publicados en inglés y español con las siguientes palabras clave (Mesh): síndrome de Ballantyne, síndrome del espejo, triple edema, pseudotoxemia, hidrops materno y gestosis aguda del segundo trimestre. La última búsqueda se llevó a cabo en noviembre de 2018. De los 112 artículos encontrados se seleccionaron las revisiones bibliográficas del tema y los casos clínicos que reportaban datos novedosos no publicados.
Este reporte de caso tiene como propósito dar a conocer el síndrome de Ballantyne para que se sospeche en casos de edema materno, en el contexto de hidrops fetal. En muchas ocasiones se diagnostica erróneamente como preeclampsia, pero su evolución y pronóstico son diferentes.
CASO CLÍNICO
Paciente de 29 años, con dos embarazos y partos en curso del tercer embarazo, talla de 157 cm, peso previo al embarazo de 53 kg, procedente de China, grupo y Rh 0 positivo, sin enfermedades conocidas, cirugías ni alergias.
El segundo embarazo se interrumpió a las 29 semanas debido a: 7
Hidrops fetal: con ascitis y edema subcutáneo
Edema placentario
Edema materno generalizado: sobre todo en las extremidades inferiores y en el abdomen con un incremento ponderal de 7 kg en 1 semana y equilibrio hídrico negativo superior a un litro diario.
La paciente refería oliguria y disnea y en la ecografía se diagnosticó polihidramnios. El estudio descartó una infección perinatal, no se encontraron malformaciones ecográficas y el estudio genético, después de la amniocentesis, resultó normal. Se estableció el diagnóstico de síndrome de Ballantyne e hidrops fetal no-inmunitario. El embarazo finalizó a las 30 semanas, luego de un parto eutócico, con buena evolución feto materna posterior. Nació una niña de 2100 g, con Apgar 8,8 al primero y cinco minutos, pH del cordón umbilical 7.36 sin que pudiera determinarse el origen del hidrops.
El tercer embarazo se inició con control tardío, a las 14 semanas; se le practicó el tamizaje triple de aneuploidías del segundo trimestre para trisomías 21 y 18, con reporte de bajo riesgo. Las ecografías tomadas a las 14 y 20 semanas no mostraron alteraciones morfológicas. La prueba de O´Sullivan, en el segundo trimestre, se reportó con alteraciones; por esto se solicitó una sobrecarga oral con 100 g de glucosa, con reporte de diabetes gestacional y sin requerir tratamiento con insulina. El hemograma, bioquímica, TSH y Coombs indirecto del segundo trimestre no mostraron alteraciones. Las serologías mostraron ausencia de inmunidad frente a rubeola y negatividad para toxoplasmosis, VIH, lues y virus hepatitis B.
La ecografía de control a las 26 semanas reportó: PFE 1500 g (mayor de p95), ILA = 24, placentomegalia, ventriculomegalia unilateral de 12 mm, ascitis, imágenes ecogénicas intrahepáticas sugerentes de calcificaciones incipientes y cervicometría de 30 mm (Figuras 1y2). Las nuevas serologías descartaron que hubiera un cuadro de infección fetal (Cuadro 1). En los controles ecográficos semanales se encontró aumento progresivo del líquido amniótico e hidrops fetal a las 28 semanas, y normalización de la ventriculomegalia detectada inicialmente. El ecocardiograma mostró que el funcionamiento y la anatomía cardiaca eran normales. El Doppler de las arterias uterinas, arteria umbilical y arteria cerebral media no mostró alteraciones. Se indicó maduración pulmonar domiciliaria a las 28 + 3 semanas de gestación.
Cuadro 1 Serologías solicitadas a las 26 semanas
| Serología | IgG | IgM |
| Sarampión | + | - |
| Virus varicela Zoster | + | - |
| Virus herpes simple | + | - |
| Virus Epstein Barr | - | - |
| Citomegalovirus | + | - |
| Parvovirus B19 | - | - |
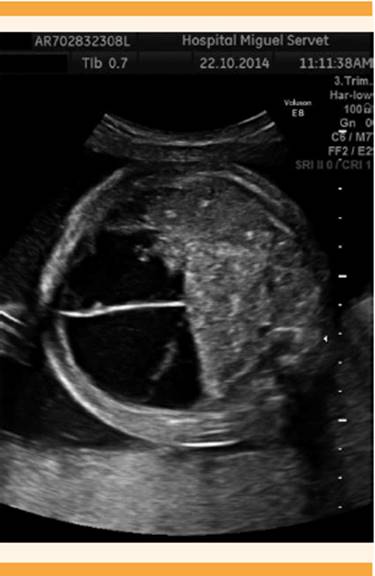
A las 29 + 3 semanas la paciente fue llevada a urgencias debido al edema generalizado, disnea y dolor en el fondo uterino; se decidió su hospitalización. Se objetivó edema maleolar, palpebral y facial con tensión arterial normal. El aumento de peso a partir del inicio del embarazo fue de 19 kg, 3 de ellos en la última semana. La ecografía reportó longitud cervical de 16 mm, ILA = 45 mm, placenta de 6 cm de grosor, ascitis y edema subcutáneo a nivel abdominal fetal de 7 mm (Figura 3). La ecocardiografía mostró insuficiencia triscuspídea leve y ligera cardiomegalia. El Doppler fetal se reportó normal; diagnóstico: síndrome del espejo.
La hemoglobina se reportó en 11.4 g/dL y el hematocrito en 35.7%; el resto del hemograma y la bioquímica no mostraron alteraciones. El sedimento de orina reportó proteinuria de 0.10 g/L, abundantes cuerpos cetónicos y ausencia de leucocitos. El perfil hepático resultó normal y las serologías permanecieron sin alteraciones. La paciente no había tenido control glucémico domiciliario. En la ecografía se advirtió un acortamiento cervical, con 12 mm de longitud efectiva y se observaba embudización. Se inició tratamiento tocolítico con atosibán y se practicó un amniodrenaje 24 horas después, a las 29 + 5 semanas, por polihidramnios sintomático. Se extrajeron 1300 cc de líquido amniótico claro. En el estudio microbiológico del líquido no se encontraron agentes infecciosos y se envió una muestra para estudio de cariotipo y CGH-Array con resultado normal, 46 cromosomas XY. En el registro cardiotocográfico no se objetivó dinámica uterina y el feto permanecía reactivo.
Después de 24 horas del drenaje del líquido amniótico se produjo la rotura de la bolsa amniótica, y se inició el protocolo de tratamiento antibiótico profiláctico. Los análisis de sangre no reportaron signos de infección y la PCR fue de 0.37 mg/L. Disminuyeron la disnea y oliguria y se inició el tratamiento con heparina de bajo peso molecular a la dosis profiláctica.
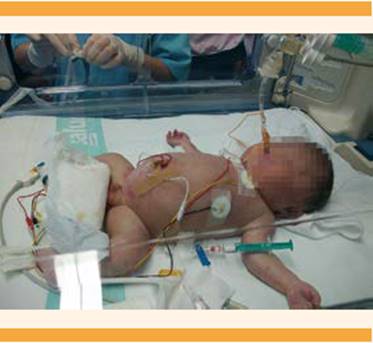
Después de 8 días de haber drenado el líquido el ILA se incrementó a 50 cm. Se inició el trabajo activo de parto, pese a reiniciar el tratamiento con atosibán y el tacto vaginal objetivó una dilatación de 2 cm. También se inició el tratamiento con sulfato de magnesio para neuroprotección fetal y se administró una dosis de refuerzo de 12 mg de betametasona intramuscular para la maduración pulmonar. A las 31 semanas nació un varón de 3200 g, Apgar de 2, 6 y 8 al primero, quinto y 10 minutos, y pH del cordón umbilical de 7.30. El neonato requirió intubación orotraqueal al nacimiento. El estudio anatomopatológico de la placenta reportó peso de 2010 g e importante edema vellositario. Figura 4
La exploración del neonato efectuada minutos después del parto objetivó criptorquidia y el aspirado del líquido ascítico mostró un tinte meconial; por esto se diagnosticó: peritonitis meconial intraútero (Figura 5). En la laparotomía exploradora realizada en las primeras horas de vida se encontró una perforación intestinal de gran tamaño (20 cm de longitud) a la altura de la válvula ileocecal, con gran colección en torno del mesogastrio, de paredes calcificadas y detritus internos, intensa fibrosis, bridas amnióticas y leve isquemia intestinal. Fue necesario formar un estoma en la pared abdominal, a nivel del íleon que, posteriormente, en otra intervención, se revirtió mediante la unión de ambos extremos de intestino. Debido a la fuga de la anastomosis se reintervino en cinco ocasiones, con múltiples resecciones intestinales. El estudio anatomopatológico demostró una perforación ileal múltiple, con ausencia congénita de la muscular propia intestinal de distribución multifocal. La evolución neonatal fue tórpida y fue dada de alta del hospital a los tres meses.
Durante el puerperio inmediato la madre refirió la desaparición progresiva y completa de los síntomas, se dio de alta del hospital a las 48 horas después del parto.
DISCUSIÓN
El caso aquí reportado es el primero registrado en la bibliografía nacional de síndrome de Ballantyne, repetido dos veces en la misma paciente y el único con hidrops secundario a peritonitis meconial. Hasta el año 2010 se habían descrito 56 casos3 y después de la revisión de Allarakia y su grupo, en 2017, la cantidad ascendió a 113. En los casos publicados previamente, la edad media al diagnóstico fue de 27 semanas (16-39 semanas) y en la mitad de los casos el hallazgo de hidrops se acompañó, simultáneamente, de síntomas maternos; los más frecuentes fueron: ganancia ponderal y edema, seguidos de hipertensión. Los principales tratamientos ofrecidos para mejorar la supervivencia fetal fueron: tratamiento médico e intervencionista feto-materno para mejorar el estado fetal (28.3%) (transfusiones maternas o fetales intrauterinas, tratamiento del STFF o cirugía fetal), cesárea (19.5%) e inducción del parto (12.4%). La tasa de supervivencia fetal fue de 32.74% (n = 37/113), con muerte espontánea intrauterina en 57.89% de los casos. 7
Este síndrome suele aparecer al final del segundo trimestre o al inicio del tercero, casi siempre antes de las 30 semanas.7,8 A pesar de ello existen casos descritos desde la semana 16 de gestación hasta la 39 e, incluso, durante el puerperio inmediato. 3
La morbilidad materna es elevada, pero en los casos publicados no se han descrito casos de mortalidad y la recuperación materna suele suceder en pocos días después el parto. La causa que genere el hidrops condicionará, en muchos casos, el pronóstico fetal, cuya mortalidad puede alcanzar 67.26%.3,7
Edema fetal, placentario y materno
El hidrops fetal implica la acumulación de cantidades anormales de líquido en, al menos, dos áreas corporales que resultan en: ascitis, hidrotórax, derrame pericárdico, edema subcutáneo o cerebral. En el caso aquí comunicado se diagnosticó ascitis y edema subcutáneo fetal.
Se ha observado una relación entre el comienzo temprano, la severidad del hidrops y el estado materno, con agravamiento de los síntomas de la madre después del empeoramiento del cuadro fetal.2,4,5 Las gestaciones afectadas por hidrops fetal suelen asociar incremento del líquido amniótico, que puede implicar sobredistensión uterina, con acortamiento cervical o ruptura prematura de membranas. 6 Puede tratarse mediante drenaje, como sucedió en el caso aquí comunicado, después de diagnosticar polihidramnios, aunque la indicación principal deben ser los síntomas que experimenta la madre.
Se han descrito numerosas causas de hidrops fetal asociadas con el síndrome: isoinmunización Rh, síndrome de transfusión feto-fetal en gestaciones múltiples, infecciones virales (Parvovirus B19, Coxsackie-B virus, CMV), malformaciones (anomalía de Ebstein, estenosis aórtica), enfermedades fetales (aneurisma de la vena de Galeno, trombocitopenia, eritroblastosis), tumores placentarios o fetales (teratoma sacrococcígeo, corioangioma placentario), enfermedades fetales (arritmias fetales, talasemia, leucemia), alteraciones genéticas (trisomía 13, triploidías) y molas parciales. 9
El estudio del hidrops fetal de causa no inmunitaria debe incluir las siguientes pruebas:
Historia clínica que incluya control de la tensión arterial
Ecografía morfológica detallada, Doppler y ecocardiografía fetal
Serologías de la madre
Estudio genético fetal, con cariotipo y CGH-Array en el líquido amniótico
Cultivo del líquido amniótico
Estudio postnatal de la placenta
En caso de óbito fetal, la necropsia puede aportar información.
A pesar del desarrollo del diagnóstico prenatal, en los últimos años incluso en 50% de los casos se desconoce la causa del hidrops fetal no-inmunitario.2,10
La hiperplacentosis asocia un incremento del peso placenta-peso fetal, vellosidades coriónicas edematosas, hiperactividad e inmadurez del trofoblasto11 y espesor placentario mayor de 4-5 cm. 4 La placenta descrita en nuestro caso alcanzó un grosor máximo de 7 cm. El estudio morfológico de estas placentas describe hidrops, degeneración, congestión, áreas isquémicas con abundantes depósitos de fibrina, infiltración por células inflamatorias y persistencia de células citotrofoblásticas de Langhans. Se ha propuesto que las vellosidades edematosas pueden reducir el espacio intervelloso y afectar el flujo sanguíneo en este sitio, con la consiguiente reducción del suministro de oxígeno fetal.8,12 Estas características, junto con el incremento de la producción de βhCG y renina placentarias, no son exclusivas de este síndrome y no deben ser un criterio diagnóstico pero ayudan a conocer la patogénesis de esta patología.4,8,12
La clínica materna asociada a este síndrome incluye:3,7
Edema en la madre: principal motivo de consulta. Existe rápida ganancia ponderal en un corto periodo (84-89.3%)13
Distensión uterina
Hipertensión arterial (60%), que suele ser leve
Anemia leve y hemodilución (46.4-51.3%), no relacionadas con la ferropenia.
Alteraciones del laboratorio:
Proteinuria 20-56%, que puede alcanzar rango nefrótico14
Elevación del ácido úrico y de las concentraciones de creatinina (20-25%)
Elevación de las enzimas hepáticas (19.4-19.6%)
Trombopenia (7.1-8.8%)
Hipoproteinemia
Oliguria, con frecuencia resistente a los diuréticos (15-16.1%)
Cefalea y alteraciones visuales (14.3%)
Edema pulmonar (21.4%)
Prurito generalizado y lesiones cutáneas
Otros: desprendimiento de retina, convulsiones
La clínica materna descrita en nuestra paciente asoció edema generalizado, sobre todo facial, palpebral y maleolar, disnea, distensión uterina con polihidramnios y oliguria. Sin embargo, no se objetivó hipertensión arterial ni proteinuria significativa, signos casi siempre asociados con este síndrome.
La bibliografía consultada describe un intervalo medio desde la aparición del hidrops hasta el inicio de la clínica materna de 11 días.5,7 Aunque existen casos publicados en los que este periodo alcanza varias semanas o, incluso, los síntomas de la madre preceden a los del feto. La secuencia de presentación no parece tener repercusión en la mortalidad perinatal.4,7
Etiopatogenia
La etiopatogenia del síndrome del espejo se desconoce. Se sospecha que la placenta produce “agentes tóxicos” que originan la retención de líquidos.15,16 Existe hiperactividad persistente del sincitiotrofoblasto, con elevadas concentraciones de βhCG, incremento de la renina placentaria de hasta 10 veces su valor y del flujo placentario. 2,11,17 Las elevadas concentraciones de renina, a su vez, incrementan la producción de aldosterona en la madre, asociada con retención de líquidos. Está descrito que la elevación de las concentraciones de factores antiangiogénicos placentarios, como la sEnd (endoglina soluble) y el sFLT-1 (soluble fms-like tyrosine kinase) también conocido como sVEGFR-1 (soluble vascular endotelial growth factor receptor-1), relacionado con la permeabilidad vascular y disminución de factores angiogénicos como el PIGF (free placental growth factor) y del VEGF (vascular endothelial growth factor), que implica un estado antiangiogénico. 3,7,8,12,13,18,19,)
Diagnóstico diferencial
Ante la elevada incidencia de hipertensión arterial en el síndrome de Ballantyne y la posible aparición de otros síntomas, también asociados con los estados hipertensivos del embarazo (proteinuria, elevación de enzimas hepáticas, trombopenia, cefalea, fotopsias, oliguria), es preciso establecer el diagnóstico diferencial (Cuadro 2). El síndrome del espejo, por definición, se asocia con hidrops fetal, por lo que su ausencia descartaría el cuadro.
Cuadro 2 Diagnóstico diferencial entre síndrome del espejo y preeclampsia
| Síndrome del espejo | Preeclampsia | Características comunes |
| · Hemodilución y anemia · Hidrops fetal · Hiperplacentosis · Polihidramnios · Prurito generalizado · Lesiones cutáneas vesiculosas · Aumento de la βhCG |
· Hemoconcentración · Endoteliosis glomerular · Hipoplacentosis · Oligoamnios |
· Edema materno · Hipertensión · Proteinuria · Elevación de enzimas hepáticas · Trombopenia · Cefalea · Alteraciones visuales · Edema pulmonar · Aumento de sFLT-1 · Disminución del PIGF |
La preeclampsia se vincula con hemoconcentración y elevación del hematocrito sanguíneo. El síndrome de Ballantyne se asocia con: anemia leve, hemodilución sanguínea, descenso de la hemoglobina y el hematocrito, debido al elevado volumen sanguíneo a su vez relacionado con la elevación de las concentraciones séricas de vasopresina, ya de por sí elevadas en las embarazadas, y el factor atrial natriurético. 2,3,8 El prurito generalizado o la aparición de lesiones vesiculosas en la piel se han asociado con síndrome del espejo. 1 En los riñones se ha descrito endoteliosis glomerular en la preeclampsia, hallazgo no apreciado en el síndrome de Ballantyne, por lo que la proteinuria, en caso de existir, suele ser de menor intensidad. 11
La placenta suele tener menor tamaño y numerosas calcificaciones en la preeclampsia, debido al envejecimiento prematuro, ambos sugerentes de menor actividad placentaria o hipoplacentosis. En el síndrome de Ballantyne la placenta se encuentra aumentada de tamaño, edematosa y con elevadas concentraciones de βhCG.11,17 La preeclampsia suele asociarse con oligoamnios y no desaparece hasta finalizar el embarazo, mientras que en el síndrome de Ballantyne suele asociarse con polihidramnios llamativo y puede mejorar si se resuelve el hidrops. 20
El hidrops fetal se relaciona con incremento del riesgo de preeclampsia, por lo que la paciente debe considerarse de riesgo porque ambos procesos pueden superponerse. 21 En nuestro caso, ante la ausencia de hipertensión y proteinuria se descartó, desde el inicio, que se tratara de enfermedad hipertensiva del embarazo.
Tratamiento
Existen dos alternativas terapéuticas: tratamiento del hidrops fetal o finalización de la gestación, independientemente de las semanas de embarazo. No se han efectuado estudios que comparen las diferentes alternativas. El tratamiento eficaz del hidrops o el óbito fetal puede implicar la desaparición de los síntomas en la madre.5,9,20,22
Para la conducta conservadora se han propuesto numerosos tratamientos médicos dirigidos a mejorar la situación de la madre durante el ingreso al hospital: antihipertensivos, sulfato de magnesio, reposo en cama, tocolíticos, antipiréticos, analgésicos y transfusión de sangre. Sin embargo, su efectividad no ha podido demostrarse.
El control de estas embarazadas debe ser muy estrecho y la finalización del embarazo debe evaluarse de manera individualizada en función de la evolución materna y fetal. 8
La opción de finalización del embarazo es el parto debido al riesgo de celulitis secundaria y dificultad para la cicatrización de la herida quirúrgica, como consecuencia de la edematización de los tejidos.20,23 Ante el empeoramiento del estado de la madre y del feto es posible que se requiera inducir el parto. El intervalo medio a partir del diagnóstico del síndrome y la finalización del embarazo suele ser de 4.5 días, aunque hay casos descritos, incluso de 26 días. 5 En nuestro caso este intervalo fue de 14 días, y finalizó en un parto eutócico debido al inicio de trabajo de parto después de la amniorrexis. Con la finalización del embarazo los síntomas de la madre suelen desaparecer entre 2 y 9 días.3,4,5,7,23
La peritonitis meconial sobreviene después de una perforación intestinal intrauterina y sus hallazgos ecográficos son muy heterogéneos. 24 El caso clínico tuvo una evolución tortuosa debido al gran tamaño de la perforación intestinal (20 cm) y las complicaciones derivadas de la fuga de la anastomosis intestinal.
Este caso es el primero de la bibliografía publicada en el que se describe un síndrome de Ballantyne recidivante en la misma paciente. El riesgo de recidiva no se ha estudiado debido a la baja incidencia del hidrops fetal. Ante el hallazgo del defecto en la pared muscular intestinal podría tratarse de un cuadro similar de menor severidad en su hermana mayor responsable del hidrops fetal, aunque este estudio no se ha llevado a cabo debido a la buena evolución del primer caso.
Ante el diagnóstico de síndrome de Ballantyne es recomendable efectuar el estudio completo del hidrops fetal y mantener un estricto control de la tensión arterial de la madre. Los estudios de laboratorio que incluyan hemograma, bioquímica, proteinuria y control de las enzimas hepáticas son indispensable para establecer el diagnóstico diferencial correcto con la preeclampsia. En nuestro caso se practicó el estudio completo de hidrops fetal y se descartó la preeclampsia con base en los datos analíticos. En el Cuadro 2 se describen las características comunes del síndrome de Ballantyne y de la preeclampsia y los datos clínicos y analíticos que permiten diferenciarlos.
CONCLUSIONES
El síndrome de Ballantyne es infradiagnosticado porque se asocia con hidrops fetal y se caracteriza por el reflejo materno de los síntomas fetales. Debe efectuarse un estudio completo del hidrops fetal para establecer su causa. Para poder establecer el diagnóstico diferencial con preeclampsia es preciso el correcto estudio de los síntomas de la madre que incluya análisis completos y estudio de la función renal.
El tratamiento consiste en finalizar el embarazo o disminuir el hidrops fetal, pero esto siempre dependerá de la función de la gravedad de los síntomas maternos y fetales y las semanas de embarazo, por el elevado riesgo de prematurez.
Su recurrencia no se había estudiada hasta ahora debido a su baja incidencia. El pronóstico para la madre, después de terminar el embarazo, es favorable aunque asociado con elevada morbilidad y mortalidad del feto.
Las limitaciones de este estudio son, principalmente, la poca cantidad de casos publicados que impide describir su incidencia con exactitud, y el desconocimiento del síndrome que existe en el área médica. Debido a ello no todos los casos de este síndrome se diagnostican, circunstancia que limita que puedan establecerse criterios diagnósticos universales. Muchas veces se diagnostica como preeclampsia porque en ambos casos puede haber hipertensión y proteinuria. Del mismo modo, al no conocerse claramente su etiología, resulta difícil de prever.











 nueva página del texto (beta)
nueva página del texto (beta)