INTRODUCCIÓN
Las diatomeas (Bacillariophyceae) generalmente constituyen el principal componente en la dieta in situ de diversos moluscos bivalvos (García-Domínguez et al., 1994; Boltovskoy et al., 1995; Muñetón-Gómez et al., 2001; Villalejo-Fuerte et al., 2005; Muñetón-Gómez et al., 2010), debido principalmente a que el contenido de las diatomeas es digerido fácilmente, promoviendo un mejor crecimiento y condición fisiológica en los ostréidos (Beukema & Cadee, 1991; Rouillon & Navarro, 2003).
La información sobre la alimentación de ostréidos que aborda aspectos florísticos de diatomeas es escasa y aquellos disponibles adolecen de precisión taxonómica, lo que limita los alcances comparativos. En estudios de laboratorio se ha observado que Magallana gigas Thunberg, 1793 ingiere preferentemente diatomeas bentónicas de los géneros Navicula y Nitzschia (Cognie et al., 2001); asimismo, se ha observado que discrimina por tamaño las diatomeas que ingiere y entre aquellas vivas y muertas (Beninger et al., 2008). Los estudios de alimentación in situ son todavía más escasos, no obstante, son informativos; por ejemplo, Kasim & Mukai (2009) examinaron los contenidos del tracto digestivo de ostiones M. gigas y de almejas Ruditapes philippinarum Adams & Reeve, 1850, registrando que no había diferencias significativas entre lo consumido por ambas especies. Aunado a esto, observaron que las diatomeas bentónicas representaron entre el 70% y 87% del alimento ingerido, además de diatomeas planctónicas y dinoflagelados.
Sobre el ostión de placer Crassostrea corteziensis Hertlein, 1951 solo existe una referencia acerca de su alimentación in situ (Hurtado-Oliva, 2008); esta menciona que el 88% de las especies encontradas en sus contenidos intestinales fueron diatomeas; sin embargo, no se proporcionó una referencia florística.
Para la región costera de Nayarit, el cultivo de C. corteziensis representa una actividad económica importante. Esta se ha realizado de manera artesanal durante los últimos 40 años, i.e., engorda de la semilla capturada del medio natural (Padilla-Lardizabal & Aguilar-Medina, 2014). En los cultivos experimentales, en la mayoría de los casos, las dietas suministradas están constituidas por solo una especie de diatomea y una o más de flagelados (Coutteau & Sorgeloos, 1992). Por otra parte, las microalgas tradicionalmente utilizadas como Dunaliella spp., Phaeodactylum tricornutum Bohlin y Tetraselmis spp. ya han dejado de ser utilizadas debido a su bajo valor nutricional (Ponis et al., 2006). En el caso de diatomeas, Skeletonema costatum (Greville) Cleve, Thalassiosira pseudonana Hasle & Heimdal, Chaetoceros gracilis Pantocsek, C. calcitrans (Paulsen) H. Takano y C. tenuissimus Meunier, aún se utilizan rutinariamente en dietas para el cultivo de moluscos bivalvos (Ponis et al., 2006); no obstante, se ha demostrado la importancia de otros elementos del microfitobentos (Cognie et al., 2001), los cuales podrían enriquecer significativamente la dieta de moluscos bivalvos en cultivo. De acuerdo con esto, se ha iniciado la búsqueda de alternativas (Barillé et al., 2003); en el caso particular de este estudio, se parte de la premisa de que se requieren estudios orientados a conocer primeramente la dieta in situ de las especies a ser cultivadas, i.e., qué taxones forman parte de su alimentación. Al respecto, Kasim y Mukai (2009) observaron que los moluscos bivalvos consumen una mayor proporción de diatomeas en relación con otros grupos algales. La identificación de taxones de diatomeas que conforman parte de la dieta de dichos moluscos promete detectar especies con potencial acuicola que redunden en la mejora del cultivo de ostión. De acuerdo con lo anterior, el objetivo de este trabajo fue determinar la composición de especies de diatomeas que forman parte de la dieta in situ del ostión de placer Crassostrea corteziensis, tanto silvestres, como en cultivos extensivos en humedales estuarinos de Nayarit, México.
MATERIALES Y MÉTODOS
Área de estudio. El estero Camichín y la laguna La Palicienta se localizan en el municipio de Santiago Ixcuintla, Nayarit y forman parte de la Reserva de la Biosfera Marismas Nacionales, en la región noroccidental de México. Estos sistemas pertenecen a la cuenca mareal Mexcaltitán-Camichín; son humedales de flujo estuarino que reciben flujos mareales, fluviales y freáticos, drenan hacia la boca sus llanuras palustres intermareales (Fig. 1). El clima es cálido subhúmedo; el periodo de lluvias abarca de mayo a octubre y las mayores precipitaciones ocurren entre agosto y octubre (960 - 1,396 mm); mientras que secas comprende de noviembre a abril (De la Lanza-Espino et al., 1996). El intervalo de temperatura ambiente es de 22 28 ºC (INEGI, 2009), mientras que en el agua alcanza en promedio 28.3 ± 2.7 °C con máximo de 32.3 °C y mínimo de 23 °C; la salinidad tiene variaciones entre 4.3 ups (primavera) y 35.1 ups (invierno) con un promedio de 25.8 ± 9.7 ups (Zambrano-Soria, 2015).
Sustratos Se seleccionaron tres sustratos sobre los que se fija y crece C. corteziensis. El primer sustrato lo conformaron las sartas suspendidas, utilizadas para el cultivo extensivo; estas se componen por 25 a 30 conchas madre de ostión o de almeja, unidas con hilo de polietileno que se colocan en zonas cuya profundidad impide que los ostiones toquen el fondo durante la bajamar. Los otros dos sustratos son donde C. corteziensis se fija de manera natural, a saber, raíces de Rhizophora mangle Linnaeus y sedimentos.
Recolección de muestras
Sitios de muestreo. Se seleccionaron tres sitios con base en la presencia de C. corteziensis silvestres y en cultivo extensivo (Fig. 1). El primer sitio fue denominado Estero y se ubicó en el estero Camichín que forma parte de la desembocadura del río Santiago (21.7475 N,-105.4950 O). El segundo sitio fue denominado Canal y se ubicó en un canal artificial que conecta el norte del estero Camichín con el Océano Pacífico (21.8100 N, -105.5246 O); ambos reciben aportes de agua dulce provenientes del río San Pedro y del medio marino. El tercer sitio se denominó Laguna y se localizó en la laguna La Palicienta (21.8015 N, -105.5211 O); se encuentra rodeada por bosques de R. mangle y hay poco movimiento del agua.
Las muestras de C. corteziensis se recolectaron en noviembre 2013 y marzo y junio de 2014, que corresponden a las temporadas de transición, secas y lluvias, respectivamente. En cada sitio se extrajeron, al azar, cinco especímenes de C. corteziensis por sustrato, sumando 15 por sitio, 45 por fecha de muestreo y 130 en total. En junio, por ser temporada de cosecha, no se obtuvieron especímenes de sartas suspendidas en ningún sitio. Los ostiones fueron puestos en una hielera sobre una cama de hielo y transportados para su procesamiento en el laboratorio.
Trabajo de laboratorio. Cada especimen de C. corteziensis fue disectado desde la boca hasta el ano para extraer el aparato digestivo; este se preservó en alcohol a 96° GL hasta su procesamiento final. Para la obtención y limpieza de diatomeas, el aparato digestivo de cada ostión fue procesado de acuerdo con la técnica de Siqueiros-Beltrones & Voltolina (2000), la cual tuvo por objeto eliminar la materia orgánica, dentro y fuera de la frústula, tanto de las diatomeas, como la propia del ostión. Debido a la alta cantidad de materia orgánica que presentó el aparato digestivo de C. corteziensis, la técnica fue modificada utilizando una mezcla de ácido sulfúrico, ácido nítrico y alcohol comercial en una proporción 3:2:1, ajustando según la cantidad de materia orgánica presente en cada aparato digestivo. La muestra oxidada se dejó reposar durante 24 horas y se lavó sucesivamente con agua destilada hasta alcanzar un pH mínimo de 6; del material resultante se tomó una submuestra con la cual se realizaron montajes permanentes utilizando resina de alto índice de refracción (Pleurax, IR= 1.7). Para cada muestra se realizaron dos montajes; estos fueron observados en un microscopio Carl Zeiss AxioLab A1 con contraste de fases, fototubo y cámara digital integrada (Cannon EOS 6D). En cada montaje se realizaron recorridos paralelos de un lado a otro del cubreobjetos; durante dichos recorridos se identificaron las diatomeas observadas. Los mejores especímenes de diatomeas fueron fotografiados para elaborar un catálogo iconográfico de referencia.
Las diatomeas se identificaron con base en la morfología de la frústula, principalmente en vista valvar, hasta la mínima categoría taxonómica posible. Como parte del proceso de identificación se obtuvieron datos morfométricos de cada taxón. Para la identificación se utilizaron los trabajos de Al-Kandari et al. (2009), Desikachary et al. (1987), Desikachary & Prema (1987), Desikachary (1988, 1989), Foged (1975, 1978, 1984), Hernández-Almeida (2005), Hustedt (1930, 1955, 1959, 1961-1966), Krammer & Lange-Bertalot (1991a, b), Krammer & Lange-Bertalot (1997a, b), López-Fuerte et al. (2010), Moreno et al. (1996), Ohtsuka (2005), Park et al. (2012), Peragallo & Peragallo (1908), Ricard (1987), Schmidt et al. (1874-1959), Siqueiros-Beltrones (2002), Stidolph et al. (2012) y Witkowski et al. (2000). La lista taxonómica fue construida con base en la clasificación de Round et al. (1990) y las actualizaciones nomenclaturales se realizaron con base en Guiry & Guiry (2017).
Procesamiento de datos.
La frecuencia de los taxones de diatomeas se calculó en función de su aparición en cada una de las muestras revisadas. La comparación de porcentajes de especies bentónicas y planctónicas entre meses, sitios y sustratos se realizó mediante pruebas de independencia; en aquellos casos en donde se observaron diferencias signficativas se utilizaron pruebas a posteriori con la corrección de Yates (Glantz, 2006). En el caso de la riqueza, se calcularon la mediana y el intervalo de confianza para cada uno de los factores que se eligieron. En aquellos casos en donde hubo indicios de diferencia entre los factores se utilizó la prueba de Kruskal Wallis; las comparaciones a posteriori se realizaron mediante la prueba ajustada de Bonferroni (Glantz, 2006). Todas las pruebas se realizaron con el paquete estadístico SPSS v.24 (IBM).
RESULTADOS
Los contenidos intestinales de Crassostrea corteziensis redituaron 212 taxones de diatomeas pertenecientes a 88 géneros, 50 familias y 29 órdenes (Tabla 1). Imágenes de especímenes representativos se muestran en las figuras 3-88. Los géneros con mayor riqueza de especies fueron Nitzschia (27), Navicula (19), Coscinodiscus (11), Amphora (8) y Tryblionella (7); estos en conjunto representaron 34% de la riqueza total.
Tabla 1 Taxones de diatomeas y su frecuencia en contenidos intestinales de Crassostrea corteziensis Hertlein, 1951. La clasificación se presenta de acuerdo con Round et al. (1990)
| Taxones | Frecuencia en % | Hábitat |
| Phyllum Bacillariophyta Karsten | ||
| Clase Bacillariophyceae Haeckel | ||
| Orden Bacillariales Hendey | ||
| Familia Bacillariaceae Ehrenberg | ||
| Bacillaria socialis (W. Gregory) Ralfs | 77 | Bentónica |
| Cymatonitzschia marina (F.W Lewis) Simonsen (Fig. 49) | 12 | Bentónica |
| Fragilariopsis sp. 1 | 27 | Bentónica |
| Hantzschia virgata (Roper) Grunow | 11 | Bentónica |
| Nitzschia amabilis H. Suzuki | 38 | Bentónica |
| Nitzschia brittoni Hagelstein (Fig. 59) | 15 | Bentónica |
| Nitzschia cf. debilis (Arnott ex O’Meara) Grunow (Fig. 57) | 42 | Bentónica |
| Nitzschia cf. fusiformis Grunow | 4 | Bentónica |
| Nitzschia cf. pellucida Grunow | 4 | Bentónica |
| Nitzschia clausii Hantzsch (Fig. 56) | 19 | Bentónica |
| Nitzschia compressa var. vexans (Grunow) Lange-Bertalot (Fig. 52) | 7 | Bentónica |
| Nitzschia dissipata (Kützing) Rabenhorst | 31 | Bentónica |
| Nitzschia distans W. Gregory | 38 | Bentónica |
| Nitzschia elegantula Grunow | 23 | Bentónica |
| Nitzschia filiformis (W. Smith) Van Heurck (Fig. 53) | 35 | Bentónica |
| Nitzschia frustulum (Kützing) Grunow (Fig. 55) | 88 | Bentónica |
| Nitzschia gracilis Hantzsch | 46 | Bentónica |
| Nitzschia hadriatica Lange-Bertalot | 11 | Bentónica |
| Nitzschia lanceolata var. minor (Grunow) H. Peragallo & M. Peragallo | 46 | Bentónica |
| Nitzschia ligowskii Lange-Bertalot, Kociolek & Brzezinska (Fig. 60) | 88 | Bentónica |
| Nitzschia martiana (C. Agardh) Schütt | 19 | Bentónica |
| Nitzschia obtusa W. Smith (Fig. 54) | 31 | Bentónica |
| Nitzschia perminuta (Grunow) M. Peragallo (Fig. 58) | 38 | Bentónica |
| Nitzschia perspicua Cholnoky | 69 | Bentónica |
| Nitzschia reversa W. Smith | 38 | Bentónica |
| Nitzschia sigma (Kützing) W. Smith | 35 | Bentónica |
| Nitzschia sigmaformis Hustedt | 42 | Bentónica |
| Nitzschia sp.1 | 8 | Bentónica |
| Nitzschia sp.2 | 8 | Bentónica |
| Nitzschia sp.3 | 27 | Bentónica |
| Nitzschia sp.4 | 19 | Bentónica |
| Tryblionella coarctata (Grunow) D.G. Mann (Fig. 51) | 96 | Bentónica |
| Tryblionella compressa (Bailey) Poulin (Fig. 40) | 58 | Bentónica |
| Tryblionella granulata (Grunow) D.G. Mann (Fig. 41) | 31 | Bentónica |
| Tryblionella hungarica (Grunow) Frenguelli | 50 | Bentónica |
| Tryblionella hyalina (Amossé) T. Ohtsuka (Fig. 42) | 27 | Bentónica |
| Tryblionella lanceola (Grunow) (Fig. 50) | 46 | Bentónica |
| Tryblionella victoriae Grunow (Fig. 46) | 8 | Bentónica |
| Orden Cocconeidales E.J. Cox | ||
| Familia Achnanthidiaceae D.G. Mann | ||
| Achnanthidium exiguum (Grunow) Czarnecki | 8 | Bentónica |
| Karayevia amoena (Hustedt) Bukhtiyarova | 7 | Bentónica |
| Karayevia rostrata (Hustedt) Kulikovskiy & Genkal | 1 | Bentónica |
| Planothidium hauckianum (Grunow) Bukhtiyarova | 15 | Bentónica |
| Familia Cocconeidaceae Kützing | ||
| Cocconeis diruptoides Hustedt (Fig. 7) | 23 | Bentónica |
| Cocconeis placentula var. euglypta (Ehrenberg) Grunow | 31 | Bentónica |
| Cocconeis scutellum Ehrenberg | 27 | Bentónica |
| Orden Cymbellales D.G. Mann | ||
| Familia Anomoeoneidaceae D.G. Mann | ||
| Staurophora salina (W. Smith) Mereschkowsky | 11 | Bentónica |
| Familia Cymbellaceae Kützing | ||
| Cymbella turgidula Grunow (Fig. 37) | 8 | Bentónica |
| Familia Gomphonemataceae Kützing | ||
| Gomphoneis cf. clevei (Frickle) Gil | 11 | Bentónica |
| Gomphonema cf. lagenula Kützing (Fig. 31) | 4 | Bentónica |
| Gomphonema saprophilum (Lange-Bertalot & Reichardt) Abraca, R. Jahn, J. Zimmermann & Enke | 4 | Bentónica |
| Orden Lyrellales D.G. Mann | ||
| Familia Lyrellaceae D.G. Mann | ||
| Lyrella clavata var. caribaea Cleve (Fig. 32) | 1 | Bentónica |
| Petroneis arabica (Grunow ex Schmidt) D.G. Mann (Fig. 8) | 2 | Bentónica |
| Orden Mastogloiales D.G. Mann | ||
| Familia Achnanthaceae Kützing | ||
| Achnanthes bergii Cleve-Euler (Fig. 5) | 15 | Bentónica |
| Achnanthes curvirostrum J. Brun (Fig. 6) | 35 | Bentónica |
| Achnanthes longipes C. Agardh | 3 | Bentónica |
| Achnanthes pseudogroenlandica Hendey (Fig. 3) | 3 | Bentónica |
| Achnanthes separata Hustedt ex Simonsen (Fig. 4) | 3 | Bentónica |
| Achnanthes sp. 1 | 3 | Bentónica |
| Achnanthes sp. 2 | 3 | Bentónica |
| Achnanthes sp. 3 | 3 | Bentónica |
| Orden Fragilariales P.C. Silva | ||
| Familia Fragilariaceae Kützing | ||
| Odontidium hyemale (Roth) Kützing | 65 | Bentónica |
| Synedra affinis var. gracilis Grunow | 23 | Bentónica |
| Synedra goulardii Brébisson ex Cleve & Grunow (Fig. 43) | 12 | Bentónica |
| Synedra tabulata var. obtusa Pantocsek | 12 | Bentónica |
| Familia Staurosiraceae Medlin | ||
| Pseudostaurosira brevistriata (Grunow) D.M. Williams & Round | 11 | Bentónica |
| Staurosirella pinnata (Ehrenberg) D.M. Williams & Round | 4 | Bentónica |
| Orden Licmophorales Round | ||
| Familia Licmophoraceae Kützing | ||
| Licmophora gracilis (Ehrenberg) Grunow (Fig. 44) | 11 | Bentónica |
| Familia Ulnariaceae E.J. Cox | ||
| Catacombas gaillonii (Bory) D.M. Williams & Round | 4 | Bentónica |
| Tabularia tabulata (C. Agardh) Snoeijs | 69 | Bentónica |
| Ulnaria ulna var. ulna (Nitzsch) Compère | 4 | Bentónica |
| Orden Naviculales Cleve | ||
| Familia Amphipleuraceae Grunow | ||
| Frustulia sp. 1 | 4 | Bentónica |
| Frustulia weinholdii Husted (Fig. 21) | 11 | Bentónica |
| Halamphora coffeaeformis C. Agardh) Levkov (Fig. 38) | 88 | Bentónica |
| Halamphora costata (W. Smith) Levkov | 15 | Bentónica |
| Halamphora cuneata (Cleve) Levkov | 15 | Bentónica |
| Halamphora cymbifera (Gregory) Levkov (Fig. 34) | 57 | Bentónica |
| Familia Berkeleyaceae D.G. Mann | ||
| Parlibellus hagelsteinii Cox (Fig. 22) | 12 | Bentónica |
| Parlibellus rhombicula (Hustedt) Witkowski | 12 | Bentónica |
| Parlibellus sp. 1 | 12 | Bentónica |
| Familia Diadesmidaceae D.G. Mann | ||
| Luticola mutica (Kützing) D.G. Mann (Fig. 23) | 31 | Bentónica |
| Luticola ventricosa (Kützing) D.G. Mann | 8 | Bentónica |
| Familia Diploneidaceae D.G. Mann | ||
| Diploneis caffra (Giffen) A. Witkowski, H. Lange-Bertalot & D. Metzeltin (Fig. 27) | 62 | Bentónica |
| Diploneis cf. dimorpha Hustedt | 58 | Bentónica |
| Diploneis gruendleri (Schmidt) Cleve (Fig. 29) | 15 | Bentónica |
| Diploneis smithii (Brébisson) Cleve (Fig. 30) | 50 | Bentónica |
| Diploneis weissflogii (A.W.F. Schmidt) Cleve (Fig. 28) | 96 | Bentónica |
| Familia Entomoneidaceae Reimer | ||
| Entomoneis alata (Ehrenberg) Ehrenberg | 85 | Bentónica |
| Familia Naviculaceae Kützing | ||
| Chamaepinnularia sp. 1 | 8 | Bentónica |
| Chamaepinnularia sp. 2 | 8 | Bentónica |
| Cymatoneis cf. margarita A. Witkowski (Fig. 14) | 4 | Bentónica |
| Gyrosigma balticum (Ehrenberg) Rabenhorst | 40 | Bentónica |
| Gyrosigma fasciola (Ehrenberg) J.W. Griffith & Henfrey | 3 | Bentónica |
| Gyrosigma peisonis (Grunow) Hustedt | 1 | Bentónica |
| Gyrosigma eximium (Thwaites) Cleve (Fig. 9) | 2 | Bentónica |
| Gyrosigma sp. 1 | 1 | Bentónica |
| Haslea duerrenbergiana (Hustedt) F.A.S. Sterrenbrug | 35 | Bentónica |
| Haslea ostrearia(Gaillon) Simonsen | 3 | Bentónica |
| Hippodonta linearis ((Østrup) Lange-Bertalot, Metzeltin & Witkowski (Fig. 17) | 5 | Bentónica |
| Mayamea cf. recondita(Hustedt) Lange-Bertalot | 4 | Bentónica |
| Navicula abunda Hustedt | 19 | Bentónica |
| Navicula agnita Hustedt | 69 | Bentónica |
| Navicula cf. johanrossii Giffen(Fig. 11) | 27 | Bentónica |
| Navicula cf. paul-schulzii A. Witkowski & H. Lange-Bertalot | 23 | Bentónica |
| Navicula cf. subinflatoides Hustedt | 4 | Bentónica |
| Navicula cf. transistantioides Foged | 35 | Bentónica |
| Navicula flanatica Grunow (Fig. 13) | 85 | Bentónica |
| Navicula microdigitoradiata Lange-Bertalot (Fig. 15) | 19 | Bentónica |
| Navicula normaloides Cholnoky (Fig. 18) | 50 | Bentónica |
| Navicula perminuta Grunow (Fig. 16) | 92 | Bentónica |
| Navicula phylleptosoma Lange-Bertalot (Fig. 10) | 50 | Bentónica |
| Navicula platyventris Meister (Fig. 24) | 46 | Bentónica |
| Navicula rostellata Kützing (Fig. 25) | 4 | Bentónica |
| Navicula sp. 1 | 8 | Bentónica |
| Navicula sp. 2 | 11 | Bentónica |
| Navicula sp. 3 | 4 | Bentónica |
| Navicula sp. 4 | 23 | Bentónica |
| Navicula sp. 5 | 88 | Bentónica |
| Navicula sp. 6 | 27 | Bentónica |
| Pinnunavis cf. yarrensis (Grunow) H. Okuno (Fig. 12) | 8 | Bentónica |
| Seminavis robusta D.B. Danielidis & D.G. Mann (Fig. 33) | 46 | Bentónica |
| Familia Pinnulariaceae D.G. Mann | ||
| Oestrupia sp. 1 | 11 | Bentónica |
| Pinnularia cincta (Ehrenberg) Ralfs | 31 | Bentónica |
| Familia Pleurosigmataceae Mereschkowsky | ||
| Pleurosigma angulatum (J.T. Queckett) W. Smith | 19 | Bentónica |
| Pleurosigma cf. elongatum W. Smith | 23 | Bentónica |
| Pleurosigma diversestriatum F. Meister (Fig. 20) | 54 | Bentónica |
| Pleurosigma intermedium var. mauritiana (Grunow ex Cleve) M. Peragallo (Fig. 19) | 11 | Bentónica |
| Pleurosigma salinarum (Grunow) Grunow | 19 | Bentónica |
| Pleurosigma sp. 1 | 12 | Bentónica |
| Familia Sellaphoraceae Mereschkowsky | ||
| Fallacia forcipata (Greville) Stickle & D.G. Mann | 15 | Bentónica |
| Fallacia litoricola (Hustedt) D.G. Mann (Fig. 26) | 35 | Bentónica |
| Fallacia subforcipata (Hustedt) D.G. Mann | 15 | Bentónica |
| Sellaphora pupula (Kützing) Mereschkowsky | 8 | Bentónica |
| Familia Stauroneidaceae | ||
| Craticula cf. cuspidata (Kützing) Kützing | 31 | Bentónica |
| Orden Rhabdonematales Round & R.M. Crawford | ||
| Familia Grammatophoraceae Lobban & Ashworth | ||
| Grammatophora macilenta W. Smith | 31 | Bentónica |
| Orden Rhaphoneidales Round | ||
| Familia Rhaphoneidaceae Forti | ||
| Delphineis surirella (Ehrenberg) G.W. Andrews (Fig. 39) | 88 | Bentónica |
| Neodelphineis silenda (M.H. Hohn & J. Hellerman) N. Desianti & M. Potapova (Fig. 48) | 100 | Bentónica |
| Orden Rhopalodiales D.G. Mann | ||
| Familia Rhopalodiaceae (Karsten) Topachevs’kyj & Oksiyuk | ||
| Epithemia adnata (Kützing) Brébisson | 15 | Bentónica |
| Epithemia pacifica (Krammer) Lobban & J.S. Park | 11 | Bentónica |
| Rhopalodia musculus (Kützing) Otto Müller (Fig. 36) | 23 | Bentónica |
| Orden Surirellales D.G. Mann | ||
| Familia Surirellaceae Kützing | ||
| Campylodiscus cf. crebrecostatus Greville | 11 | Bentónica |
| Petrodictyon gemma (Ehrenberg) D.G. Mann (Fig. 61) | 15 | Bentónica |
| Surirella armoricana H. Peragallo & M. Peragallo | 35 | Bentónica |
| Surirella fastuosa var. cuneata O. Witt | 12 | Bentónica |
| Tryblioptychus cocconeiformis (Grunow) Hendey (Fig. 45) | 85 | Bentónica |
| Orden Thalassionematales Round | ||
| Familia Thalassionemataceae Round | ||
| Thalassionema nitzschioides var. capitulatum (H.J. Schrader) J.L. Moreno-Ruíz (Fig. 47) | 100 | Bentónica |
| Thalassiothrix sp. 1 | 58 | Bentónica |
| Orden Thalassiophysales D.G. Mann | ||
| Familia Catenulaceae Mereschkowsky | ||
| Amphora ayensuensis Foged (Fig. 35) | 4 | Bentónica |
| Amphora coffeaeformis var. salina (W. Smith) Schönfeldt | 46 | Bentónica |
| Amphora gacialis Ehrenberg | 11 | Bentónica |
| Amphora proteus var. contigua Cleve | 46 | Bentónica |
| Amphora proteus var. kariana Grunow | 38 | Bentónica |
| Amphora sp. 1 | 11 | Bentónica |
| Amphora sp. 2 | 19 | Bentónica |
| Amphora sp. 3 | 11 | Bentónica |
| Clase Bacillariophyta incertae sedis | ||
| Orden Bacillariophyta ordo incertae sedis | ||
| Familia Bacillariophyta familia incertae sedis | ||
| Cosmiodiscus sp. 1 | 12 | Planctónica |
| Clase Coscinodiscophyceae Round & Crawford | ||
| Orden Asterolamprales Round | ||
| Familia Asterolampraceae H.L. Smith | ||
| Asteromphalus flabellatus (Brébisson) Greville | 4 | Planctónica |
| Orden Aulacoseirales R.M. Crawford | ||
| Familia Aulacoseiraceae R.M. Crawford | ||
| Aulacoseira granulata (Ehrenberg) Simonsen (Fig. 62) | 50 | Planctónica |
| Aulacoseira granulata var. angustissima (Otto Müller) Simonsen (Fig. 63) | 42 | Planctónica |
| Orden Coscinodiscales Round & R.M. Crawford | ||
| Familia Aulacodiscaceae (Schütt) Lemmermann | ||
| Aulacodiscus kittonii Arnott ex Ralfs (Fig. 75) | 19 | Planctónica |
| Familia Coscinodiscaceae Kützing | ||
| Coscinodiscus apiculatus Ehrenberg | 27 | Planctónica |
| Coscinodiscus argus Ehrenberg | 11 | Planctónica |
| Coscinodiscus asteromphalus Ehrenberg | 15 | Planctónica |
| Coscinodiscus concinnus Wm. Smith | 4 | Planctónica |
| Coscinodiscus divisus Grunow | 11 | Planctónica |
| Coscinodiscus heteroporus Ehrenberg | 11 | Planctónica |
| Coscinodiscus kuetzingii Schmidt | 12 | Planctónica |
| Coscinodiscus oculus-iridis (Ehrenberg) Ehrenberg (Fig. 82) | 4 | Planctónica |
| Coscinodiscus radiatus Ehrenberg (Fig. 85) | 88 | Planctónica |
| Coscinodiscus rothii (Ehrenberg) Grunow (Fig. 83) | 85 | Planctónica |
| Coscinodiscus subtilis Ehrenberg | 19 | Planctónica |
| Familia Heliopeltaceae H.L. Smith | ||
| Actinoptychus aster Brun | 38 | Planctónica |
| Actinoptychus campanulifer Schmidt | 35 | Planctónica |
| Actinoptychus heliopelta Grunow (Fig. 87) | 4 | Planctónica |
| Actinoptychus senarius (Ehrenberg) Ehrenberg | 23 | Planctónica |
| Familia Hemidiscaceae Hendey ex Hasle | ||
| Actinocyclus cuneiformis (Wallich) F. Gomez, Lu Wang & Senjie Lin | 11 | Planctónica |
| Actinocyclus decussatus D.G. Mann | 4 | Planctónica |
| Actinocyclus normanii (Gregory ex Greville) Hustedt | 15 | Planctónica |
| Actinocyclus octonarius Ehrenberg | 15 | Planctónica |
| Actinocyclus octonarius var. crassus (W. Smith) Hendey (Fig. 74) | 27 | Planctónica |
| Actinocyclus octonarius var. ralfsi (W. Smith) Hendey (Fig. 73) | 4 | Planctónica |
| Actinocyclus subtilis (Gregory) Ralfs | 11 | Planctónica |
| Orden Melosirales R.M Crawford | ||
| Familia Hyalodiscaceae R.M. Crawford | ||
| Podosira stelligera (Bail) Mann | 12 | Planctónica |
| Familia Melosiraceae Kützing | ||
| Melosira moniliformis var. octogona (Grunow) Hustedt | 11 | Planctónica |
| Orden Paraliales R.M. Crawford | ||
| Familia Paraliaceae R.M. Crawford | ||
| Paralia fenestrata Sawai & Nagumo (Fig. 66, 67) | 96 | Planctónica |
| Orden Rhizosoleniales Silva | ||
| Familia Rhizosoleniaceae De Toni | ||
| Pseudosolenia sp. 1 | 4 | Planctónica |
| Clase Mediophyceae Medlin & Kaczmarska | ||
| Orden Anaulales Round & R.M. Crawford | ||
| Familia Anaulaceae (Schütt) Lemmermann | ||
| Eunotogramma laeve Grunow | 54 | Planctónica |
| Orden Biddulphiales Krieger | ||
| Familia Biddulphiaceae R.M. Crawford | ||
| Biddulphia alternans (Bailey) Van Heurck (Fig. 68) | 19 | Planctónica |
| Neohuttonia reichardtii (Grunow) Kuntze (Fig. 64, 65) | 38 | Planctónica |
| Orden Chaetocerotales Round & R.M. Crawford | ||
| Familia Chaetocerotaceae Ralfs | ||
| Bacteriastrum hyalinum Lauder | 4 | Planctónica |
| Bacteriastrum hyalinum var. princeps (Castrachane) J. Ikary | 8 | Planctónica |
| Chaetoceros curvisetus Cleve | 38 | Planctónica |
| Orden Cymatosirales Round & R.M. Crawford | ||
| Familia Cymatosiraceae Hasle, Stosch & Syvertsen | ||
| Plagiogrammopsis vanheurckii (Grunow) Hasle, von Stosch & Syvertsen | 46 | Planctónica |
| Orden Eupodiscales V.A. Nikoleav & D.M. Harwood | ||
| Familia Eupodiscaceae Ralfs | ||
| Cerataulus turgidus (Ehrenberg) Ehrenberg (Fig. 76) | 11 | Planctónica |
| Pleurosira laevis (Ehrenberg) Compère (Fig. 77) | 31 | Planctónica |
| Zygoceros rhombus Ehrenberg | 38 | Planctónica |
| Familia Odontellaceae P.A. Sims, D.M. Williams & M.P. Ashworth | ||
| Odontella aurita (Lyngbye) Agardh (Fig. 72) | 58 | Planctónica |
| Odontella sp. 1 | 12 | Planctónica |
| Familia Parodontellaceae S. Komura | ||
| Trieres chinensis (Greville) Ashworth & E.C. Theriot | 27 | Planctónica |
| Orden Lithodesmiales Round & R.M. Crawford | ||
| Familia Lithodesmiaceae Round | ||
| Ditylum brightwellii (T. West) Grunow | 23 | Planctónica |
| Orden Stephanodiscales Nikolaev & Harwoood | ||
| Familia Stephanodiscaceae I.V. Makarova | ||
| Cyclotella litoralis Lange & Syvertsen (Fig. 78) | 77 | Planctónica |
| Cyclotella meneghiniana Kützing (Fig. 80) | 54 | Planctónica |
| Cyclotella sp. 1 | 73 | Planctónica |
| Cyclotella striata (Kützing) Grunow (Fig. 79) | 100 | Planctónica |
| Cyclotella stylorum Brightwell (Fig. 81) | 4 | Planctónica |
| Lindavia glomerata (H. Bachmann) Adesalu & Julius | 35 | Planctónica |
| Orden Thalassiosirales Glezer & Makarova | ||
| Familia Skeletonemataceae Lebour | ||
| Skeletonema costatum Lange & Syvertsen (Fig. 71) | 85 | Planctónica |
| Familia Thalassiosiraceae M. Lebour | ||
| Cymatotheca minima Voigt (Fig. 70) | 85 | Planctónica |
| Cymatotheca weissflogii (Grunow) Hendey (Fig. 69) | 100 | Planctónica |
| Ehrenbergiulva granulosa (Grunow) Witkowski, Lange-Bertalot & Metzeltin (Fig. 88) | 92 | Planctónica |
| Shionodiscus oestrupii (Ostenfeld) A.J. Alverson, S.H. Kang & E.C. Theriot (Fig. 84) | 100 | Planctónica |
| Thalassiosira decipiens (Grunow ex Van Heurck) E.G. Jørgensen (Fig. 86) | 88 | Planctónica |
| Thalassiosira eccentrica (Ehrenberg) Cleve | 69 | Planctónica |
Las diatomeas pennadas consumidas por C. corteziensis exhibieron variaciones de tamaños entre 7.4-230 µm de largo y 2.82-50.61 µm de ancho; mientras que el tamaño de las formas céntricas varió entre 4.89-123 µm de diámetro.
Del componente bentónico solo Thalassionema nitzschioides var. capitulatum (H.J. Schrader) J.L. Moreno-Ruíz & Licea (Fig. 47) y Neodelphineis silenda (M.H. Hohn & J. Hellerman) N. Desianti & M. Potapova (Fig. 48) se observaron en el 100 % de las muestras; mientras que, del planctónico, Cymatotheca weissflogii (Grunow) Hendey (Fig. 69), Cyclotella striata (Kützing) Grunow (Fig. 79) y Shionodiscus oestrupii (Ostenfeld) A.J. Alverson, S.H. Kang & E.C. Theriot (Fig. 84) mostraron la misma ubicuidad. Por otra parte, 14 taxones se observaron solo durante una temporada (Tabla 2); seis en la época de lluvias, cuando se observaron la mayor parte de ellas.
Tabla 2 Especies de diatomeas observadas en contenidos intestinales de C. corteziensis cuya aparición estuvo restringida a una temporada.
| Especie | Transición | Secas | Lluvias |
| (noviembre) | (marzo) | (junio) | |
| Navicula flanatica (Fig. 13) | • | ||
| Halamphora coffeiformis (Fig. 38) | • | ||
| Delphineis surirella (Fig. 39) | • | ||
| Tryblionella coarctata (Fig. 51) | • | ||
| Nitzschia frustulum (Fig. 55) | • | ||
| Nitzschia ligowskii (Fig. 60) | • | ||
| Aulacoseira granulata (Fig. 62) | • | ||
| Aulacoseira granulata var. angustissima (Fig. 63) | • | ||
| Skeletonema costatum (Fig. 71) | • | ||
| Coscinodiscus rothii (Fig. 83) | • | ||
| Coscinodiscus radiatus (Fig. 85) | • | ||
| Ehrenbergiulva granulosa (Fig. 88) | • | ||
| Thalassiosira decipiens (Fig. 86) | • |
En general, la alimentación in situ de C. corteziensis conformada por diatomeas comprendió 72.6% de formas bentónicas; empero, se detectaron variaciones significativas entre las muestras comparadas por mes (ꭓ2= 15.41, g.l.= 2, p<0.01) y sitio (ꭓ2= 12.47, g.l.= 2, p<0.01), evidenciadas por las pruebas de comparaciones múltiples, las cuales mostraron que en junio la proporción de diatomeas bentónicas y planctónicas fue significativamente menor (ꭓ2= 13.64, g.l. = 1, p<0.01) que en noviembre y marzo. Por otra parte, entre sitios, dicha proporción fue significativamente menor (ꭓ2= 9.88, g.l.=1, p<0.01) en las muestras del estero (Fig. 2) que en las del canal y la laguna. Entre sustratos no se detectaron diferencias.
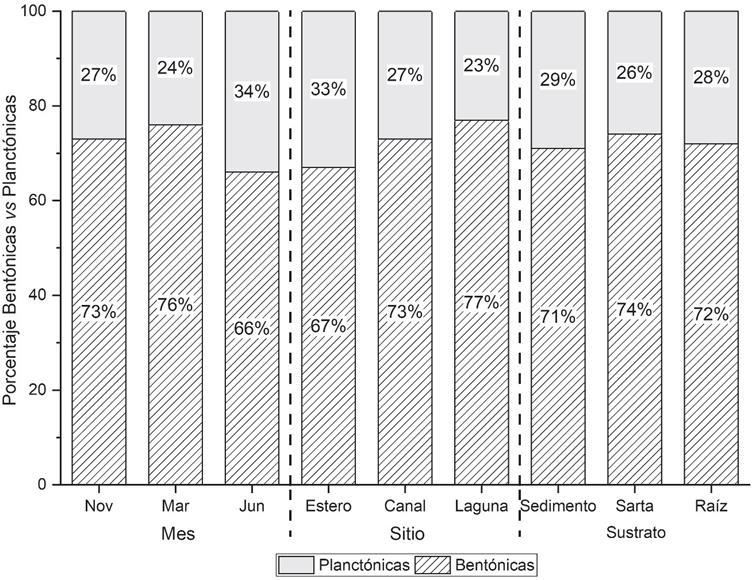
Figura 2 Proporción de especies de diatomeas bentónicas y planctónicas en contenidos intestinales de C. corteziensis por mes, sitio y sutrato.

Figuras 3-60 Diatomeas del contenido intestinal de C. corteziensis. 3) Achnanthes pseudogroenlandica; 4) Achnanthes separata; 5) Achnanthes bergii; 6) Achnanthes curvirostrum; 7) Cocconeis diruptoides; 8) Petroneis arabica; 9) Gyrosigma eximium; 10) Navicula phyllepta; 11) Navicula cf. johanrossii; 12) Pinnunavis cf. yarrensis; 13) Navicula flanatica; 14) Cymatoneis cf. margarita; 15) Navicula microdigitoradiata; 16) Navicula perminuta; 17) Hippodonta linearis; 18) Navicula normaloides; 19) Pleurosigma intermedium var. mauritiana; 20) Pleurosigma diverse-striatum; 21) Frustulia weinholdii; 22) Parlibellus hagelsteinii; 23) Luticola mutica; 24) Navicula platyventris; 25) Navicula rostellata; 26) Fallacia litoricola; 27) Diploneis caffra; 28) Diploneis weissflogii; 29) Diploneis gruendleri; 30) Diploneis smithii; 31) Gomphonema cf. lagenula; 32) Lyrella clavata var. caribaea; 33) Seminavis robusta; 34) Halamphora cymbifera; 35) Amphora ayensuensis; 36) Rhopalodia musculus; 37) Cymbella turgidula; 38) Halamphora coffeaeformis; 39) Delphineis surirella; 40) Tryblionella compressa; 41) Tryblionella granulata; 42) Tryblionella hyalina; 43) Synedra goulardii; 44) Licmophora gracilis; 45) Tryblioptychus cocconeiformis; 46) Tryblionella victoriae; 47) Thalassionema nitzschioides var. capitulatum; 48) Neodelphineis silenda; 49) Cymatonitzschia marina; 50) Tryblionella lanceola; 51) Tryblionella coarctata; 52) Nitzschia compressa var. vexans; 53) Nitzschia filiformis; 54) Nitzschia obtusa; 55) Nitzschia frustulum; 56) Nitzschia clausii; 57) Nitzschia cf. debilis; 58) Nitzschia perminuta; 59) Nitzschia brittoni; 60) Nitzschia ligowskii. Barra de escala de 10 mm excepto para Fig. 18 = 20 µm.
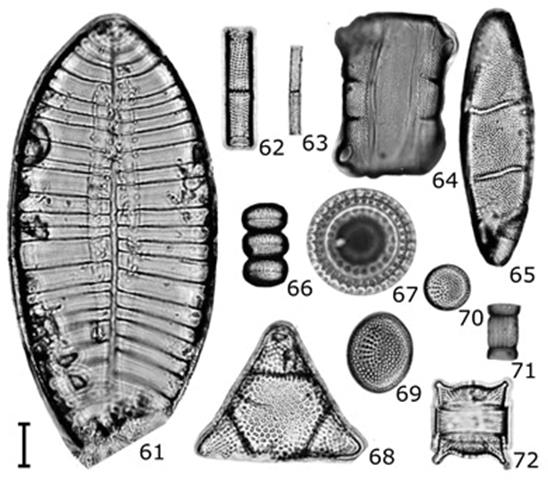
Figuras 61-72 Diatomeas del contenido intestinal de C. corteziensis. 61) Petrodictyon gemma; 62) Aulacoseira granulata; 63) Aulacoseira granulata var. angustissima; 64-65) Neohuttonia reichardtii (64 vista conectiva, 65 vista valvar); 66-67) Paralia fenestrata (66 vista conectiva, 67 vista valvar); 68) Biddulphia alternans; 69) Cymatotheca weissflogii; 70) Cymatotheca minima; 71) Skeletonema costatum; 72) Odontella aurita. Barra de escala = 10 µm.
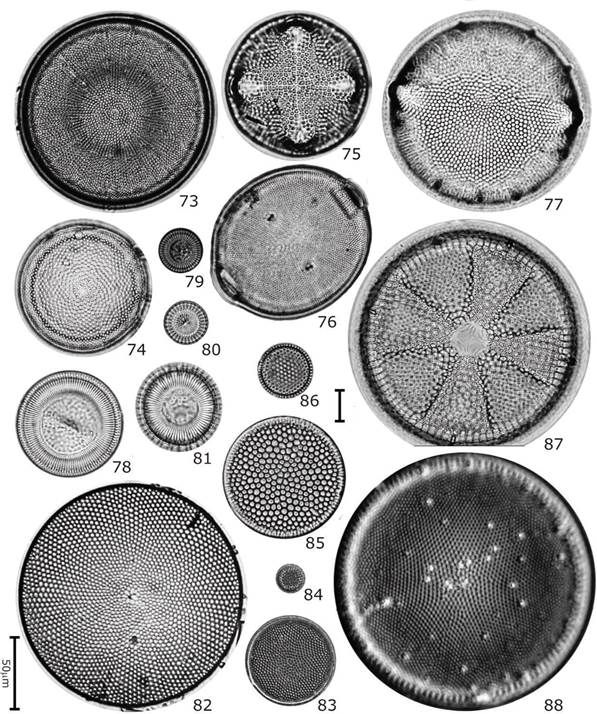
Figuras 73-88 Diatomeas del contenido intestinal de C. corteziensis. 73) Actinocyclus octonarius var. ralfsi; 74) Actinocyclus octonarius; 75) Aulacodiscus kittonii; 76) Cerataulus turgidus; 77) Pleurosira laevis; 78) Cyclotella litoralis; 79) Cyclotella striata; 80) Cyclotella meneghiniana; 81) Cyclotella stylorum; 82) Coscinodiscus oculus-iridis; 83) Coscinodiscus rothii; 84) Shionodiscus oestrupii; 85) Coscinodiscus radiatus; 86) Thalassiosira decipiens; 87) Actinoptychus heliopelta; 88) Ehrenbergiulva granulosa. Barra de escala de 10 mm excepto para Fig. 81 = 50 µm.
La riqueza (S) de diatomeas en contenidos intestinales de C. corteziensis entre meses y sitios variaron entre 133 - 143 y 147 - 152 taxones (Tabla 3), respectivamente. Entre sustratos (“S”) las menores riquezas correspondieron a las muestras de raíces (S=87-103). Asimismo, según el origen de las muestras, la riqueza específica varió entre 41 (estero, raíces, noviembre) y 91 (laguna, sedimentos, junio) con una mediana de 60 ± 15 especies.
Tabla 3 Riqueza específica (“S”) de diatomeas en contenidos intestinales de Crassostrea corteziensis Hertlein, 1951 por sitio, sustrato y temporada (N=5).
| Mes | ||||||
| Sitio | Sustrato | Noviembre (Transición) | Marzo (Secas) | Junio (Lluvias) | “S” Sustrato | “S” Sitio |
| Estero | Sedimento | 51 | 42 | 66 | 100 | 152 |
| Cultivo | 65 | 70 | 64 | 114 | ||
| Mangle | 41 | 50 | 57 | 87 | ||
| Canal | Sedimento | 64 | 76 | 70 | 113 | 147 |
| Cultivo | 65 | 87 | 59 | 118 | ||
| Mangle | 61 | 55 | 48 | 103 | ||
| Laguna | Sedimento | 52 | 53 | 91 | 118 | 149 |
| Cultivo | 87 | 60 | NA | 105 | ||
| Mangle | 59 | 48 | 49 | 103 | ||
| “S” Mes | 143 | 136 | 133 | |||
Entre meses, la mediana de la riqueza específica no mostró variaciones importantes; en noviembre fue de 61 ± 13 (IC [52-65]), en junio de 61 ± 18 (IC [49-81]) y marzo de 55 ± 24 (IC [43-82]); los intervalos de confianza construidos se traslaparon completamente, lo cual indica que no existen diferencias significativas entre dichos valores. Esto mismo ocurrió entre sitios, en donde la mediana en el canal fue de 64 ± 16 (IC [58-70] especies), en la laguna de 56 ± 30 (IC [49-87]) y en el estero de 57 ± 19 (IC [50-65]). Finalmente, entre sustratos la mediana de la riqueza en sartas fue de 65 ± 22 (IC [64-70] especies), en sedimentos de 64 ± 21 (IC [52-70]) y en raíces de mangle de 50 ± 10 (IC [48-57]); en este caso, el intervalo de confianza de la mediana para la riqueza de raíces de mangle se traslapó parcialmente con la de sedimento y fue diferente a la de sartas. La prueba de Kruskal-Wallis (ꭓ2 (2) = 9.669, p< 0.05) corroboró las diferencias estadísticas entre sustratos. Las comparaciones a posteriori mostraron que la riqueza de diatomeas en ostiones de raíces de mangle fue significativamente menor (p< 0.05) que aquellos en sartas y sedimento.
DISCUSIÓN
Este estudio representa una base de conocimiento científico acerca de la alimentación in situ de C. corteziensis y complementa el estudio de Estrada-Gutiérrez et al. (2017) al mostrar una base florística de referencia para los nuevos registros que aportaron dichos autores.
La composición de diatomeas observada en contenidos intestinales de C. corteziensis mostró una elevada riqueza y fue similar a la observada por Hirose et al. (2004), Ohtsuka (2005) y Park et al. (2012) en sedimentos de zonas estuarinas de Japón. Por ejemplo, dichos autores registraron a Neodelphineis silenda, Cyclotella litoralis, Cymatotheca weissflogii, Diploneis smithii y Paralia sulcata; al menos las tres primeras especies se observaron en el 100% de las muestras de contenidos intestinales de C. corteziensis, ello sugiere que la composición de diatomeas observada en el tracto digestivo del ostión en Boca de Camichin, Nayarit es la propia de sedimentos de zonas estuarinas. Así, los resultados de este estudio no solo proporcionan información directa de la alimentación in situ de C. corteziensis, sino también puede considerarse una primera descripción de la taxocenosis de diatomeas del estero Camichín, Nayarit y de ambientes similares de la región.
En cuanto a la composición específica de diatomeas observada en este estudio, fue diferente de aquellas en el contenido intestinal de otras especies de ostréidos, e.g., Hyotissa hyotis (Linné, 1758) (Villalejo-Fuerte et al., 2005) y M. gigasKasim y Mukai (2009). Para H. hyotis los géneros con mayor número de especies fueron Chaetoceros, Rhizosolenia, Thalassionema, Cylindrotheca y Coscinodiscus (Villalejo-Fuerte et al., 2005); casi todos estos de origen planctónico. A pesar de ello, en abundancia dominaron las formas bentónicas. Por otra parte, los especímenes revisados por los autores fueron extraidos en la zona rocosa de una isla, a 10 m de profundidad; por lo que la composición específica fue típica de ambientes oceánicos. Por su parte, la composición de la taxocenosis de diatomeas del contenido intestinal de M. gigas estuvo constituida por especies de Achnanthes, Cocconeis, Grammatophora, Melosira, Navicula, Nitzschia y Paralia (Kasim & Mukai, 2009); dicha composición es de formas típicamente epifitas; en particular es similar a la taxocenosis de diatomeas epifitas observadas sobre el pasto marino Zostera marina (Linnaeus, 1753) por Siqueiros-Beltrones et al. (1987), Kasim & Mukai (2006) y Chung & Lee (2008).
Lo anterior sugiere que la composición de diatomeas en el contenido intestinal de los ostréidos es influenciada por el ambiente particular en donde habitan o son cultivados. Esto confirma las propuestas de Kasim y Mukai (2006) y Siqueiros-Beltrones y Argumedo-Hernández (2012) quienes sostienen que la composición de especies de diatomeas observada en contenidos intestinales de moluscos es representativa de aquellas taxocenosis presentes en su hábitat.
La comparación de la riqueza específica se dificulta dada la influencia que tienen el tamaño de muestra y el enfoque particular de cada estudio. No obstante, resalta que la riqueza en contenidos intestinales de C. corteziensis (S=212) fue mayor que la observada para otros ostréidos. Por ejemplo, Villalejo-Fuerte et al. (2005) registraron 11 géneros en contenido intestinal de Hyotissa hyotis Linné, 1758, mientras que Kasim y Mukai (2009) anotaron 66 especies en M. gigas; pero debe considerarse que en ambos estudios el enfoque fue cuantitativo, lo que limita el registro de la riqueza. Por otra parte, la riqueza específica que se observó es similar a la obtenida en sedimentos de manglar del noroeste mexicano, v.gr., en B.C.S., Siqueiros-Beltrones y Sánchez-Castrejón (1999) obtuvieron 230 taxones de diatomeas en el manglar de la laguna de Balandra, Siqueiros-Beltrones et al. (2005) observaron 177 especies en Bahía Magdalena y Siqueiros-Beltrones et. al. (2017) registraron 232 especies en laguna de Guerrero Negro. De acuerdo con lo anterior, los contenidos intestinales de C. corteziensis no son solo representativos de la composición específica de su hábitat, sino también de la riqueza específica.
Las diatomeas ingeridas por C. corteziensis fueron mayormente de origen bentónico (72.6%), lo cual coincide con lo observado en otras especies de bivalvos filtradores como Chione gnidia Broderip & Somwerby, 1829, C. undatella G. B. Sowerby I, 1835, C. californiensis Broderip, 1835 (García-Domínguez et al., 1994), Corbicula fluminea O.F. Müller, 1774 (Boltovskoy et al., 1995), Anadara tuberculosa Broderip, 1833 (Muñetón-Gómez et al., 2010), R. philippinarum y M. gigas (Kasim & Mukai, 2009).
La mayor proporción de especies bentónicas en contenidos intestinales de C. corteziensis puede estar relacionada con el tipo de sedimentos (MacIntyre et al., 1996), la acción del viento, turbulencia, corrientes de marea (De Jonge, 1985; De Jonge & Van Beusekom, 1995) y la abundancia de la macrofauna (MacIntyre et al., 1996). La combinación de estos factores ocasiona la suspensión de diatomeas bentónicas en la columna de agua o ticoplancton (fitoplancton de oportunidad); De Jonge & Van Beusekom (1995), en sistemas estuarinos en donde ocurren los fenómenos de suspensión, las diatomeas bentónicas pueden llegar a contribuir entre el 50% y 60 % de la biomasa en la columna de agua, quedando disponibles como alimento para organismos filtradores. Esto último confirma la importancia trófica del microfitobentos en sistemas estuarinos (Delgado, 1989; MacIntyre et al., 1996; Underwood & Kromkamp, 1999) y su contribución en la alimentación de moluscos filtradores (Dupuy et al., 2000; Kasim & Mukai, 2006).
Por otra parte, la menor proporción de diatomeas bentónicas con respecto a las plactónicas observadas durante junio (lluvia) en el estero (boca del estero), sugiere una relación entre ambos factores, ya que tanto la biomasa como la composición de fitoplancton de los estuarios esta controlada por las descargas de los ríos (Cloern et al., 1983). Así, el efecto de las descargas fluviales sobre la composición específica y por ende de la proporción bentónicas-planctónicas, fue evidenciado por presencia de diatomeas planctónicas como: Aulacoseira granulata (Ehrenberg) Simonsen (Fig. 62), A. granulata var. angustissima (O. Müller) Simonsen (Fig. 63), Coscinodiscus rothii (Ehrenberg) Grunow (Fig. 83), C. radiatus Ehrenberg (Fig. 85), Thalassiosira decipiens (Grunow ex Van Heurck) E.G. Jørgensen (Fig. 86) y Ehrenbergiulva granulosa (Grunow) Witkowski (Fig. 88); estas solo se presentaron en el contenido intestinal de C. corteziensis durante la temporada de lluvia (junio). Tanto A. granulata como A. granulata var. angustissima son típicas de ambientes continentales (Sala et al., 1997); y de acuerdo con lo observado por Wang et al. (2009), la mayor abundancia de A. granulata se registra en los meses más cálidos y con menor salinidad, lo que coincide con este estudio (A. granulata var. angustissima es una variación morfológica del ciclo de vida de A. granulata (Kilham & Kilham, 1975).
Por otra parte, en raíces de mangle los ostiones enfrentan una alta competencia por espacio y alimento (Chavarin Martínez, 2010); además, están expuestos a desecación por los cambios en el nivel de marea, lo cual no ocurre con los ostiones en los otros sustratos. Esto podría explicar porqué en contenidos intestinales de C. corteziensis en raíces de mangle hubo menor riqueza que en especímenes de fondo y de sartas suspendidas; empero, es necesario realizar los estudios ex profeso para poder sustentar esta suposición.
En este estudio, Neodelphineis silenda (Fig. 48) y Cymatotheca weissflogii (Fig. 69) fueron de las especies más frecuentes en contenidos intestinales de C. corteziensis. Estas especies también se han observado abundantemente en el fitoplancton y en sedimentos de estanques de camarón de una granja ubicada en esteros de Teacapán, Sinaloa (Siqueiros-Beltrones & Acevedo-González, 2010). Asimismo, se han observado en sistemas estuarinos de Japón (Hirose et al., 2004; Ohtsuka, 2005; Sar et al., 2010; Park et al., 2012) en donde se cultiva Magallana gigas. Lo anterior sugiere que dichas especies son componentes importantes de las comunidades estuarinas y que son susceptibles de ser utilizadas como posibles alternativas para elaborar dietas para la alimentación de bivalvos y crustáceos en cultivo de laboratorio.
De la misma manera que las especies anteriores, Thalassionema nitzschioides var. capitulatum (Fig. 47) fue una de las especies más frecuentes en contenidos intestinales de C. corteziensis y también se ha observado en muestras de arrastres superficiales en los esteros de Teacapán (Núñez-Moreno; 1996), en la columna de agua y en sedimentos de estanques de camarón (Siqueiros-Beltrones & Acevedo-González, 2010). Asimismo, ha sido observada en la columna de agua (Kasim & Mukai, 2006), en sedimentos (Hirose et al., 2004; Ohtsuka, 2005; Kasim & Mukai, 2006; Park et al., 2012) y en contenido intestinal de moluscos bivalvos (Kasim & Mukai, 2006) de ambientes estuarinos en Japón. Además, esta especie forma parte del alimento de copépodos (Schultes et al., 2006), sardinas (Cellamare & Gaspar, 2007) y moluscos filtradores (Muñetón-Gómez et al., 2001; Muñetón-Gómez et al., 2010). Por lo tanto, también podría ser considerada como candidata para explorar sus propiedades nutricionales e incorporarla en la dieta de bivalvos y crustáceos en cultivos in vitro.
Además de los taxones anteriores, resulta interesante el registro de Haslea ostrearia (Gaillon) Simonsen esta diatomea bentónica sintetiza y libera un pigmento verde-azul hidrosoluble (marenina), el cual provoca que las branquias de los ostiones adquieran una coloración verde (Mouget et al., 2005; Pouvreau et al., 2008). Esta característica en los ostiones ha sido aceptada y valorada en la industria gastronómica; además, se ha demostrado que dicho compuesto tiene efectos antioxidantes, antivirales y anticoagulantes. El reverdecimiento causado por H. ostrearia ocurre de manera natural en ambientes similares a los observados en este estudio; es decir, aguas tranquilas y con aportes de agua dulce (Gastineau et al., 2014). De acuerdo con lo anterior, esta diatomea representa un potencial recurso biotecnológico para el cultivo de C. corteziensis que podría redituar beneficios desde el punto de vista alimenticio y comercial.
Los resultados de este estudio mostraron que C. corteziensis se alimentó de un alto número de especies de diatomeas cuyo hábitat es predominantemente bentónico. La composición específica y riqueza de las diatomeas en el contenido intestinal de C. corteziensis es propia de sedimentos de zonas estuarinas y representan una primera descripción de la taxocenosis de diatomeas bentónicas del estero Camichín, Nayarit y de ambientes similares de la región. La frecuencia espacial y temporal de Cyclotella striata, Cymatotheca weissflogii, Neodelphineis silenda, Shionodiscus oestrupii y Thalassionema nitzschioides var. capitulatum en contenidos intestinales, representan alternativas para la dieta de C. corteziensis en cultivos de laboratorio.











 nueva página del texto (beta)
nueva página del texto (beta)



