Introducción
Macrobrachium tenellum (Smith, 1871), conocido como camarón moya, se captura y comercializa en la cuenca baja del río San Pedro Mez quital, México. La especie se distribuye desde Mulegé, Baja California Sur, en la parte media y oriental de la península, hasta su extremo sur y desde Yavaros, Sinaloa, en México, hasta el río Chira, en Perú e isla Galápagos, en Ecuador (Holthuis, 1952b; Boschi, 1974; Guzmán et al., 1981; New, 1988; Ruiz-Santos, 1988). Habita en aguas dulces, salobres y lagunas costeras (Boschi, 1974) y en todo tipo de fondos (Boschi, 1974; Román-Contreras, 1991; Hendrickx, 1995; Signoret-Poillon & Soto, 1997; Arroyo-Rentería & Magaña-Ríos, 2001; Espino-Barr et al., 2006).
El aprovechamiento comercial del camarón moya en el río San Pe dro Mezquital inició en 1995 como una pesquería temporal que cubría la demanda local. Posteriormente, la pesquería se intensificó como una actividad económica alterna con un impacto regional mediante la pro ducción de alimento y la generación de empleos temporales directos e indirectos, principalmente en la temporada de veda de otros recursos pesqueros e incluso durante el periodo de veda de esta especie, del 1 de agosto al 31 de octubre de cada año (Estados Unidos Mexicanos. Secretaría de Pesca, 1994). En Nayarit, el camarón moya se captura principalmente en la temporada de lluvias de junio a octubre, debido a su migración y ciclo de vida, observándose una alta proporción de machos y hembras adultos, en su mayoría hem bras ovígeras, en las capturas (Pérez-Velázquez et al., 2011).
Aunque la fisiología de los crustáceos es muy diferente a la de los peces, su crecimiento, en la mayoría, se adecúa al modelo de crecimiento de von Bertalanffy (Musick & Frazer, 1999). Por ello, las estimaciones de los parámetros de crecimiento y de las tasas de mortalidad y explotación son parte importante del estudio de la biología de los crustáceos de interés comercial, ya que permiten determinar las características biológicas de la especie y el nivel de explotación de la población. A su vez, estos datos proporcionan elementos científicos para la ejecución de políti cas de administración y regulación de los recursos pesqueros que permitan un adecuado aprovechamiento. El objetivo de este trabajo fue determinar la estructura de las longitudes y los parámetros de crecimiento, mortalidad y explotación de la población de M. tenellum en las zonas de captura de Mexcaltitán, San Miguel Aztlán y Boca de Camichín del río San Pedro Mezquital, Nayarit, México.
Materiales y métodos
El río San Pedro Mezquital tiene una longitud de 255 km y drena una región aproximada de 26,480 km2. Hacia el final de su recorrido se bifurca, formando el estero de Las Corrientes, la laguna de Agua Dulce y la laguna de Mexcaltitán, lo que representa una gran extensión de esteros y canales unidos con las aguas del estuario Boca de Camichín en su salida al mar. El área de estudio incluyó tres sitios de captura en el río San Pedro Mezquital: San Miguel Aztlán (21°49’20.55” N, 105°23’40.40” O), isla de Mexcaltitán (21°54’13.24” N, 105°28’35.15” O) y Boca de Camichín (21°44’32.92” N, 105°29’30.30” O) (Figura 1).
En cada sitio se realizaron muestreos mensuales de febrero a octubre de 2010 durante el cuarto creciente o cuarto menguante de la fase lunar, de 23:00 a 04:00 horas del día siguiente en bajamar. El método de pesca utilizado fue la atarraya, con luz de malla de 1.0 y 1.5 pulgadas (2.54 y 3.81 cm, respectivamente). La captura total fue de 1,280 machos y 1,772 hembras de camarón moya, pero se trabajó con una muestra mensual aleatoria de 100 individuos procedentes de los tres sitios de captura, repartidos de manera equitativa, para procesar un total de 900 individuos para el estudio del crecimiento y la mortalidad de M. tenellum. La captura se transportó en bolsas de plástico etiquetadas y con hielo molido para su posterior revisión en el laboratorio húmedo del Centro Regional de Investigación Pesquera Bahía de Banderas, Na yarit. Se registraron las variables de longitud total (LT), tomada desde el extremo apical del rostro hasta la punta del telson con un vernier con precisión de 0.1 mm, y el peso total (PT), tomado con una balanza ana lítica con precisión de 0.1 g (Román-Contreras, 1979). En los estudios de edad y crecimiento de crustáceos se utiliza regularmente el análisis de frecuencia de tallas; en este estudio se utilizó el método de Cassie (1954) para estimar los grupos de edad que integran la población de M. tenellum de los tres sitios de captura. Una vez estimada la longitud total promedio de los grupos de edad que integran la población, se aplicó el método de Walford (1946) para estimar la longitud asintótica teórica (L∞) y la tasa de crecimiento de la población (k). Para obtener to se utilizó la función logarítmica inversa de la ecuación de von Bertalanffy (Sparre & Venema, 1992) y la talla de eclosión de M. tenellum de 1.7 cm (primera zoea), la cual fue estimada por Meruane et al. (2006). Su valor fue incorporado en los cálculos de la ecuación de crecimiento en longitud y peso.
Para comparar el desempeño del crecimiento de M. tenellum, se calculó el índice de crecimiento estándar (phi prima ø’) con las estimaciones previas de la longitud asintótica teórica y la tasa de crecimiento con la siguiente ecuación (Pauly & Munro, 1984):
El peso asintótico se estimó mediante la fórmula citada por Csirke (1980), P∞ = a * (L∞) b , donde P∞ es el peso asintótico y a es el valor de la ordenada al origen de la regresión lineal de la relación longitud-peso. Se establecieron las relaciones longitud-peso de machos, de hembras y de ambos sexos por medio de la ecuación potencial: P = a * (L) b , donde a y b son los parámetros de la ecuación calculada mediante regresión lineal simple, previa transformación logarítmica. Se evaluó estadísticamente el valor del coeficiente de regresión (b) por medio de la prueba t de Student (Zar, 1999), para determinar el tipo de crecimiento de la especie. Si b = 3, el crecimiento se consideró isométrico, y si b ≠ 3 el crecimiento se consideró alométrico (Ricker, 1975).
La mortalidad total anual (Z) se estimó mediante la ecuación propuesta por Beverton y Holt (1957), utilizando la longitud media de la captura (LM), la longitud de explotación (L’) y los parámetros de crecimiento L∞ y k; la ecuación para la mortalidad anual fue Z = k * (L∞ - LM) / LM - L’. La mortalidad natural se determinó por el método de Rikhter y Effanov (1976), el cual se basa en el supuesto de que los peces con una mortalidad natural elevada maduran precozmente y de que existe una relación entre la mortalidad natural (M) y la edad de primera madurez (Epm), usando la ecuación M = 1.521 / (Epm0.720) − 0.155. Para evaluar el estatus de la población, se calculó la tasa de explotación anual (E) con la ecuación E = F / Z * (1 - exp(-Z)); la mortalidad por pesca (F) se obtuvo calculando la diferencia entre la mortalidad total y mortalidad natural, con la fórmula F = Z - M.
Resultados
En los machos, la longitud y el peso promedio presentaron una variabilidad de 7.6-13.6 cm y 3.9-27.3 g, respectivamente, con individuos de menor talla (7.6 cm) y peso (3.9 g) promedio en el mes de febrero y de mayor talla (13.6 cm) y peso (27.3 g) promedio en septiembre. En las hembras, la longitud y el peso promedio fueron 6.8-10.7 cm y 3.2-11.4 g, respectivamente, con una menor talla (6.8 cm) y peso (3.2 g) promedio en el mes de abril y una mayor talla (10.7 cm) y peso (11.4 g) promedio en septiembre. En machos, la mayor captura fue de 14,665 g en el mes de septiembre; para las hembras, de 5,164 g en agosto (Tabla 1). En la Figura 2 se muestra la distribución mensual de la longitud total en machos y hembras. En febrero, la fracción poblacional de machos y hembras presentó una distribución de tipo polimodal inte grada por cohortes de individuos de diferentes tallas, con una longitud y peso totales promedio de 7.6 cm y 3.9 g para machos y 8.0 cm y 4.7 g para hembras. En marzo, la distribución de las tallas fue de tipo poli modal para machos y modal para las hembras. En este mes se inició la diferenciación de tamaños promedio entre los individuos, que fue para machos de 9.4 cm y 7.6 g y para hembras de 7.6 cm y 3.8 g. En abril, la distribución de tallas de la población fue de tipo polimodal, con machos de mayor talla (9.3 cm) y peso (7.9 g) promedio que las hembras (6.8 cm y 3.2 g, respectivamente). En mayo, la distribución fue polimodal en machos y hembras, sobresaliendo la diferenciación de tamaños entre ambos sexos, con machos de talla promedio de 11.2 cm y peso prome dio de 12.6 g y la captura de hembras de menor talla (8.0 cm) y peso (5.1 g) promedio. En junio, ambos sexos presentaron una distribución polimodal de tallas, con machos de mayor talla (10.7 cm) y peso (13.6 g) promedio que las hembras (8.2 cm y 5.8 g, respectivamente). En julio, la distribución de tallas fue de tipo polimodal para los machos y modal para las hembras, con una captura moderada. En agosto, la distribución de tallas fue de tipo modal para los machos y las hembras, con machos de mayor longitud y peso promedio, en comparación con las hembras. En este mes se dio una importante captura (8,622 g) de machos, integrada por individuos con una longitud y un peso promedio de 12.2 cm y 21.6 g, respectivamente. También se capturaron 5,164 g de hembras, con una longitud y un peso promedio de 10.1 cm y 9.6 g, respectivamente. En septiembre, la distribución de tallas fue de tipo modal para ambos sexos; se capturaron machos de talla promedio de 13.6 cm y peso promedio de 27.3 g. Finalmente, en octubre, la distribu ción de tallas fue polimodal para los machos y modal para las hembras y se redujeron las capturas de manera importante con respecto al mes anterior (629 g de machos y 1,836 g de hembras).
Tabla 1 Longitud total promedio, peso total promedio y captura mensual de machos y hembras de Macrobrachium tenellum en el río San Pedro Mezquital, Nayarit.

P= promedio; DE= desviación estándar.

Figuras 2a-i Estructura de tallas por mes del langostino Macrobrachium tenellum. Las mediciones se realizaron durante nueve meses consecutivos en 2010: a) febrero, b) marzo, c) abril, d) mayo, e) junio, f) julio, g) agosto, h) septiembre, i) octubre.
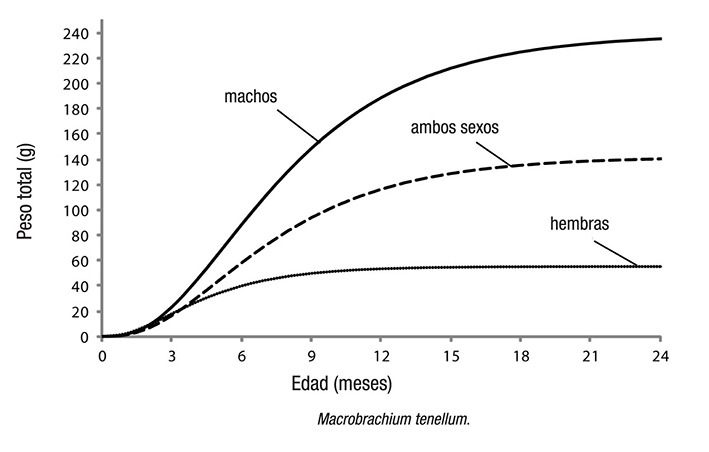
Los parámetros de crecimiento estimados de L∞, k y to para hem bras, machos y la población total de M. tenellum se muestran en la Tabla 2. Éstos se utilizaron para elaborar las curvas de crecimiento en longitud y peso respectivas (Figuras 3 y 4), previa evaluación del valor de la intersección con las ordenadas (a) y de la pendiente de la curva (b) de la regresión lineal en la relación longitud-peso.
Tabla 2 Parámetros de crecimiento en machos, hembras y ambos sexos de Macrobrachium tenellum y valores de la relación longitud-peso en el río San Pedro Mezquital, Nayarit.

L∞ = Longitud infinita; P∞ = peso infinito; k = tasa de crecimiento; to = tiempo de inició del crecimiento; a = intersección ordenada de origen de la relación longitud-peso; b = coeficiente de isometría.
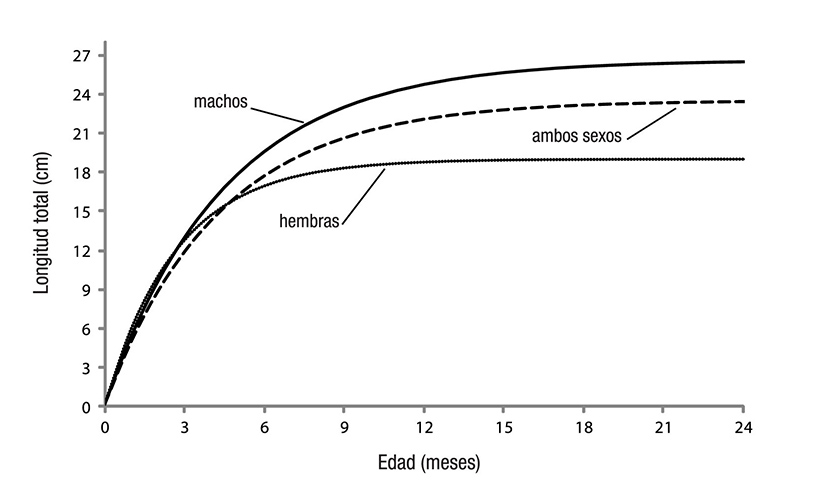
Figura 3 Curvas de crecimiento en longitud de la población y de cada sexo de Macrobrachium tenellum.
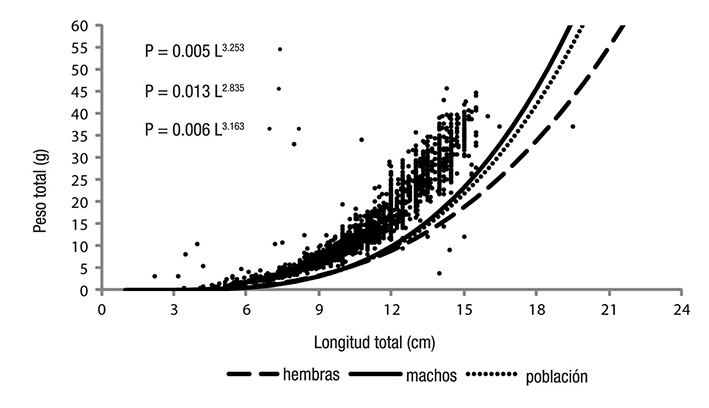
La relación longitud-peso de las hembras, machos y población se presenta en la Figura 5 con valores del exponente de b = 2.8357 (hembras), b = 3.2538 (machos) y b = 3.1635 (población). Estos exponentes indicaron un crecimiento alométrico negativo para las hembras y un crecimiento alométrico positivo para los machos y la población. Estos tipos de crecimiento presentaron diferencias estadísticas significativas, como lo indica la prueba t de Student (p < 0.05): t = 0.0015 (hembras), t = 0.0120 (machos) y t = 0.0066 (población).
En la Tabla 3 se muestra la comparación de los parámetros de crecimiento estimados en este estudio con los de otros autores. Se observaron diferencias importantes, principalmente en el valor del tiempo cero, y de manera secundaria en la longitud asintótica y la tasa de crecimiento. En la Tabla 4 se presentan los valores de las tasas de mortalidad por pesca y de mortalidad total anual, las cuales fueron altas, principalmente para las hembras. La tasa de explotación para los machos fue de 0.70 y para las hembras de 0.79, lo que indica que en los tres sitios de captura la actividad pesquera tiene un impacto importante sobre el recurso.
Tabla 3 Parámetros de crecimiento de Macrobrachium tenellum estimados por diferentes autores.

L∞ = longitud infinita; k = tasa de crecimiento; to = tiempo de inicio del crecimiento; ϕ’ = índice de crecimiento estándar.
Discusión
Uno de los problemas para determinar la edad de los crustáceos es la ausencia de estructuras calcificadas que contengan los anillos de crecimiento, por lo que para este fin existe el análisis de frecuencia de tallas, con adecuaciones a la función de crecimiento de von Bertalanffy. En este trabajo, mediante la integración de la talla de eclosión de M. tenellum en su primera fase larval de zoea, se logró un mejor ajuste de la ecuación de crecimiento en talla y peso, lo que mejora los resultados disponibles para esta especie.
Las mayores capturas de camarón moya ocurrieron en agosto y septiembre; estas capturas estuvieron integradas principalmente por hembras maduras y ovígeras, así como por machos de tallas grandes. En estas capturas se observaron concentraciones de individuos en zo nas cercanas a la desembocadura del río San Pedro Mezquital, que es donde se produce la eclosión de los huevos (Bahamonde & Vila, 1971; Norambuena, 1977). Relacionando el aspecto reproductivo con el pes quero, se observó que la actividad pesquera de este recurso se incre mentó en la época de lluvias (de julio a octubre) (Ruiz-Santos, 1988; Hendrickx, 1995; Arroyo-Rentería & Magaña-Ríos, 2001). La pesca de M. tenellum se realiza en ríos, esteros y cuerpos de agua costeros de manera intensa y es común en muchas comunidades rurales de la cos ta del Pacífico (Hernández-Sandoval, 2008); representa un recurso pes quero importante y altamente explotado por las comunidades locales (Cabrera-Jiménez et al., 1977). En este estudio, los machos de cama rón moya alcanzaron un mayor tamaño que las hembras, posiblemente debido a un menor valor en la tasa de crecimiento, la cual fue indirec tamente proporcional a la longitud asintótica teórica que presentaron.
Esta diferencia en el crecimiento entre sexos fue evidente en el mayor desarrollo de las quelas en los machos, característica descrita para el género Macrobrachium (Holthuis, 1952b; Mossolin & Bueno, 2003; Mariappan & Balasundaram, 2004; Hernández et al., 2007). El mayor desarrollo de la quela en machos adultos es una característica adaptativa desarrollada a nivel interespecífico e intraespecífico para la defensa, el combate, la alimentación y la reproducción, siendo en este último caso importante para la protección de la hembra duran te el apareamiento (Mossolin & Bueno, 2003; Mariappan & Balasun daram, 2004). En las hembras la menor longitud asintótica teórica es congruente con el valor más alto de la tasa de crecimiento y puede explicarse por el mayor gasto energético que las hembras experimen tan durante el proceso reproductivo, limitando su crecimiento (Mossolin & Bueno, 2003; Fransozo et al., 2004). Los parámetros de crecimiento de longitud asintótica y tasa de crecimiento de este trabajo fueron ma yores a los estimados por otros autores en otras localidades pesqueras (Guzmán-Arroyo, 1987; Ruiz-Santos, 1988; Espino-Barr et al., 2006). Esto puede deberse a diferencias en las condiciones ambientales de las localidades de captura, al tamaño de malla usada para la captura, al tamaño de los individuos en los muestreos, al método de evaluación del crecimiento y al nivel de explotación de la población.
En el presente estudio se integró a la ecuación de crecimiento de von Bertalanffy la talla de eclosión de M. tenellum (Lo) de 1.7 mm, lo que permitió obtener un valor más cercano al teórico esperado (cero) tanto en machos como en hembras. Por esta razón los tiempos cero en este trabajo fueron menores a los estimados por otros autores, lo que mejoró el ajuste de las curvas de crecimiento de longitud y peso para la especie. La evaluación del índice de crecimiento estándar presentó valores similares entre la población de M. tenellum de las localidades de Mexcaltitlán, San Miguel Aztlán y Boca de Camichín, Nayarit y las poblaciones de los ríos Armería y Naranjo en Colima (Tabla 3), lo que indica que la especie presenta un similar patrón de crecimiento (Alejo-Plata et al., 2011). Sin embargo, el patrón de crecimiento de camarón moya en los sitios aquí estudiados fue diferente del reportado para lo calidades del estado de Guerrero (Tabla 3), posiblemente debido a la diferencia en los parámetros de crecimiento de longitud asintótica y tasa de crecimiento.
En este trabajo se obtuvieron valores altos de mortalidad total anual, mortalidad por pesca y tasa de explotación para machos y hem bras de camarón moya. Estos altos valores pueden deberse a diversas características biológicas de esta especie, como son su ciclo de vida corto, rápido crecimiento, madurez temprana y alta mortalidad natu ral. Las tasas de mortalidad y explotación fueron congruentes entre los sexos, aunque la mortalidad y explotación fueron más altas en hembras que en machos, ya que las hembras, al tener una menor longitud y peso y una mayor abundancia, son posiblemente más vulnerables al método de pesca utilizado (atarraya), especialmente durante el periodo de reproducción (agosto a octubre), durante el cual se incrementa la actividad pesquera de este recurso. Las tasas de mortalidad natural y por pesca para ambos sexos fueron excesivamente altas; Gracia (1997) puntualiza que no es común obtener estimaciones de mortalidad na tural mayor o igual a 0.40 mensual y que los valores superiores se consideran excesivamente altos. Sin embargo, la probabilidad de que la mortalidad natural presente variaciones es alta, ya que el valor de mortalidad natural no es estable y depende en gran medida de dife rentes variables del ecosistema, como las variaciones estacionales y cíclicas en parámetros ambientales, las fluctuaciones en la abundancia de depredadores y las variaciones poblacionales en los patrones de distribución, agregación y migración, entre otros. La actividad pesque ra se intensifica de manera importante en el periodo de reproducción, cuando se obtienen los mayores volúmenes de captura, lo que se refleja en la alta mortalidad por pesca. Las tasas de mortalidad total anual también resultaron altas, de acuerdo con los criterios de Sparre y Venema (1992), que indican que valores de Z = 0.6 indican una explo tación leve, Z = 0.9 una explotación mediana y Z = 1.2 una explotación intensiva. De acuerdo con este criterio, los resultados estimados en el presente estudio indican que el recurso está siendo explotado en forma intensiva. Las tasas de explotación de machos y hembras (E = 0.70 y E = 0.79, respectivamente) indicaron que las hembras están en un nivel mayor de explotación. Si se siguen los criterios de Gulland (1971) y Pauly (1983), que proponen que el valor de E = 0.5 es un punto de equilibrio y que resultados mayores indican que el recurso está sien do sometido a una alta explotación, se puede decir que M. tenellum es una especie intensamente sobreexplotada en la zona de estudio. Según Pauly (1983), la sobrepesca puede tener lugar en tres formas diferentes: (i) en relación con el crecimiento poblacional, (ii) en relación con el reclutamiento del stock capturable y (iii) como sobrepesca que afecta el ecosistema. Si se siguen estos criterios, se puede sugerir que la población de camarón moya en las localidades de Mexcaltitán, San Miguel Aztlán y Boca de Camichín del río San Pedro Mezquital está sufriendo de la sobrepesca por crecimiento (abundancia). Este tipo de sobrepesca tiene lugar cuando los individuos son capturados antes de que alcancen la talla necesaria para garantizar la renovación biológica de la población. Se concluye, entonces, que el langostino Macrobra chium tenellum presenta un ciclo de vida corto, menor de dos años, una tasa de crecimiento moderada y tasas de mortalidad total y de explotación altas, que ocasionan una sobreexplotación del recurso en el área de estudio. Lo anterior hace necesario que se invierta en esfuerzos para continuar con investigaciones pesqueras que permitan evaluar y diseñar estrategias de manejo para M. tenellum en la pesquería del río San Pedro Mezquital, Nayarit, en una forma que sea consistente con un enfoque precautorio para la pesca responsable de este recurso.











 nueva página del texto (beta)
nueva página del texto (beta)