Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.22 no.1 Ciudad de México ene./abr. 2012
Artículos
Productividad secundaria en los esteros de la barra de arena El Mogote en la Ensenada de La Paz, Baja California Sur, México
Secondary productivity in the estuaries of El Mogote sand bar in Ensenada de La Paz, Baja California Sur, Mexico
Jorge A. López–Rocha,1 Esteban F. Félix–Pico2 y Martín E. Hernández–Rivas2
1 Unidad Multidisciplinaria de Docencia e Investigación, Facultad de Ciencias, Universidad Nacional Autónoma de México, Sisal, Yucatán, 97130, México
2 Centro Interdisciplinario de Ciencias Marinas del IPN. A.P. 592, La Paz, Baja California Sur, 23000, México. E–mail: jorgelopezrocha@ciencias.unam.mx
Recibido: 11 de mayo de 2010.
Aceptado: 2 de diciembre de 2011.
RESUMEN
Los ecosistemas de manglar son un hábitat crítico para numerosas especies y su productividad es importante por su contribución de detritos orgánicos y su producción secundaria. El objetivo del trabajo fue definir indicadores de productividad secundaria para establecer una línea base que permita medir alteraciones en el sistema de manglar por posibles perturbaciones naturales o antropogénicas. Como indicadores se escogieron los moluscos bivalvos pata de mula, Anadara tuberculosa y el ostión de mangle, Crassostrea palmula. Se realizaron muestreos en tres esteros de agosto de 2007 a julio de 2009. Se estimó la abundancia y la producción secundaria con base en el incremento de biomasa. Para la estimación del incremento en peso se usaron las tasas de crecimiento individual obtenidas mediante un análisis de distribuciones de frecuencia de tallas. La abundancia promedio fue de 1.27 y 510 ind · m–2 de la pata de mula y ostión de mangle respectivamente. Se estimó una tasa de crecimiento de 4.91 mm · mes–1 (3.67 g · mes–1) para la pata de mula y de 3.80 mm · mes–1 (0.18 g · mes–1) para el ostión de mangle. La producción secundaria promedio de pata de mula fue de 4.51 g · m–2 · mes–1 y fue mayor durante la primavera, mientras que para el ostión de mangle fue de 97.9 g · m–2 · mes–1, registrándose la máxima producción durante el verano. Los resultados obtenidos demuestran que estos indicadores de calidad del bentos son adecuados para medir alteraciones al sistema de manglar de la Ensenada de La Paz, B. C. S., México.
Palabras clave: Anadara tuberculosa, Crassostrea palmula, manglar, productividad secundaria, esteros El Mogote, México.
ABSTRACT
Mangrove ecosystems are critical habitats for many species, and their productivity is important because of their contribution of organic detritus and secondary production. The objective of this study was to identify suitable indicators of secondary productivity of mangrove systems, in order to establish a baseline for measuring changes in the mangrove system due to natural or anthropogenic potential disturbances. The bivalve mollusks chosen as indicators of secondary productivity were the mangrove cockle Anadara tuberculosa and the mangrove oyster Crassostrea palmula. Samples were collected in three estuaries from August 2007 to July 2009. Abundance and secondary production were estimated from biomass increase, calculated from individual growth rates determined using length frequency distributions analysis. The average abundance was 1.27 and 510 ind · m–2 of mangrove cockle and mangrove oyster respectively. It was estimated a growth rate of 4.91 mm · month–1 (3.67 g · month–1) for mangrove cockle and 3.80 mm · month–1 (0.18 g · month–1) for the mangrove oyster. The mean secondary production of mangrove cockle was 4.51 g · m–2 · month–1 and was higher during spring, while for the mangrove oyster it was 97.9 g · m–2 · month–1, and the maximum production was recorded during summer. The results show that these indicators of benthos quality are suitable for measuring changes of the mangrove system in the Ensenada of La Paz, B. C. S., Mexico.
Key words: Anadara tuberculosa, Crassostrea palmula, mangrove forests, secondary productivity, estuaries El Mogote, Mexico.
INTRODUCCIÓN
Los ecosistemas de manglar son considerados como un hábitat crítico para una gran variedad de moluscos, crustáceos y peces de importancia económica y de interés ecológico. La gran riqueza biológica de los manglares hacen de esta zona uno de los ecosistemas más productivos (Mann, 2000), además, los manglares son importantes porque en ellos encuentran protección y alimento una gran cantidad de organismos juveniles de diversas especies.
La productividad de los manglares es primordial por su contribución en forma de detritos orgánicos y producción secundaria. Los sistemas de manglar son considerados como uno de los ecosistemas más productivos de la Tierra, siendo cuatro veces más productivos que las regiones de plataforma continental y 40 veces más que las regiones oceánicas (Berger et al., 1989).
Los moluscos de los sistemas de manglar son dominados principalmente por gasterópodos y bivalvos, los cuales son comúnmente encontrados adheridos a las raíces de los mangles como los caracoles Littorina ssp., Nerita ssp. y los ostiones Crassostrea corteziensis (Hertlein, 1951) y C. columbiensis (Hanley, 1846). En el sustrato lodoso son comunes los bivalvos Chione spp., Tagelus spp., Anadara spp. y Mytella spp. (Lacerda et al., 2002). En los manglares de la Bahía de La Paz dos de las especies de bivalvos más abundantes son la pata de mula Anadara tuberculosa (Sowerby, 1833) y el ostión de mangle Crassostrea palmula (Carpenter, 1857).
La pata de mula es una especie de gran importancia económica que es explotada a lo largo del litoral del Pacífico (MacKenzie, 2001). La especie está asociada al mangle rojo Rhizophora mangle Linnaeus en la zona intermareal, donde vive enterrada en el fango. Se distribuye en el pacífico oriental desde las costas de Baja California Sur, México hasta Perú (Keen, 1971). La principal área de pesca en México se localiza en Bahía Magdalena, Baja California Sur (Hernández–Valenzuela, 1996; Félix–Pico et al., 2009).
Por su parte, el ostión de mangle se distribuye desde la laguna de San Ignacio, Baja California, México hasta Panamá. Se encuentra también en las Islas Galápagos, Ecuador e Isla del Coco, Costa Rica (Keen, 1971; Cruz & Jiménez, 1994) y, por su pequeño tamaño, tiene escaso valor comercial.
Las áreas de manglar se han visto seriamente reducidas en las últimas décadas por las actividades humanas (Valiela et al., 2001). Ante este escenario resulta importante desarrollar elementos que permitan el correcto manejo de los sistemas de manglar. Por lo anterior, el objetivo del trabajo fue definir indicadores de productividad secundaria de los sistemas de manglar en la Ensenada de La Paz, Baja California Sur, México para establecer una línea base que permita medir alteraciones por posibles perturbaciones naturales o antropogénicas.
MATERIALES Y MÉTODOS
Para la estimación de producción secundaria de los esteros de El Mogote, se seleccionaron las dos especies de bivalvos más abundantes de la zona: la almeja pata de mula, A. tuberculosa y el ostión de mangle, C. palmula. Dentro del área de estudio se eligieron los tres esteros de mayor cobertura y que presentaron las tres especies de mangle (Laguncularia racemosa Gaertner F., Rhizophora mangle Linnaeus y Avicennia germinans (Linnaeus) Stearns). La ubicación de los tres esteros (A, B y C) se muestra en la Figura 1.
En el interior de los tres esteros se realizaron muestreos mensuales de agosto de 2007 a julio 2008 y con frecuencia trimestral entre octubre de 2008 a julio de 2009. Se recolectaron todos los organismos de pata de mula visibles en recorridos entre los mangles de aproximadamente 30 minutos. Se realizó una estimación del área cubierta en metros cuadrados (distancia recorrida por un ancho de búsqueda de 2 m). En el caso del ostión, se observó que en el estero A, había presencia notable de ostión de mangle en la boca del estero, por lo que se decidió realizar el muestreo tanto en la zona interna (A1) como en la boca del estero (A2). En cada uno de los sitios de muestreo se cortaron cuatro raíces de mangle y se contaron todos los organismos presentes. Se realizaron estimaciones de abundancia por metro cuadrado y se tomaron medidas de las conchas (largo, alto y ancho) así como el peso total y sin concha.
La estimación de la producción secundaria de bivalvos del manglar se realizó con base al incremento de biomasa. La producción de tejido vivo de cada especie se estimó como:
P = N · B
Donde P es la producción; N es la densidad en el intervalo de muestreo y B es el incremento del peso promedio en el mismo lapso de tiempo.
La estimación del incremento de peso (B) se realizó mediante la determinación de las tasas de crecimiento individual para cada especie, mediante un análisis de distribuciones de frecuencia de tallas. Las medidas de longitud total de la concha se agruparon en distribuciones de frecuencias de longitud (DFL) mensuales en intervalos de talla de 2 mm. Se aplicó el método de Battacharya (1967) para identificar grupos modales en las DFL, que se asumieron como representantes de cohortes o grupos de edad (Sparre & Venema, 1995). En cada grupo modal identificado, se obtuvo la longitud media y su desviación estándar. Se realizó un seguimiento de los grupos modales a través del tiempo, para medir el incremento en la longitud media debida al crecimiento de los individuos. Los métodos descritos se implementaron utilizando el programa para análisis FISAT II (Gayanilo et al., 2004). Con esta información se calcularon las tasas de crecimiento en mm · mes–1 y, para calcular el crecimiento en peso de los individuos en g · mes–1, se obtuvo la relación peso sin concha (W)–longitud (L) como sigue:
L = a · Wb,
donde a y b son parámetros del modelo.
Adicionalmente, se realizó una estimación de los patrones de reclutamiento de las dos especies por él método descrito por Moreau y Cuende (1991) y Pauly (1983).
Las diferencias de la productividad secundaria entre los esteros fueron probadas por medio de la prueba por rangos de Kruskal–Wallis, debido a que los datos no cumplieron con el supuesto de una distribución normal.
RESULTADOS
Pata de mula. Se recolectaron un total de 2412 individuos con un promedio de 65.0 mm de longitud total y un rango entre 32.8 y 97.5 mm. El peso total presentó un rango de 7.5 a 275.0 g con un promedio de 86.7 g y el peso sin concha varió de 2.1 g a 50.8 g con un promedio de 16.0 g. El peso seco estimado varió de 0.1 a 7.6 g con un promedio de 3.4 g.
La densidad promedio por estero fue de 1.76 (±0.74 d.e.), 1.28 (±0.49 d.e.) y 0.60 (±0.46 d.e.) ind · m–2 para los esteros A, B y C respectivamente, con un promedio general de 1.27 ind · m–2 (±0.75 d.e.) y valores mínimo y máximo de 0.15 ind · m–2 (estero C, octubre 2007 y 3.45 ind · m–2 en el estero A en abril de 2009 (Tabla 1). Entre agosto de 2007 y julio de 2008 se identificaron diversos grupos modales (Fig. 2a–e), y con esta información fue posible calcular el incremento en la longitud media a través del tiempo (Fig. 3) Como resultado se obtuvo una tasa de crecimiento que varió de 3.81 mm · mes–1 a 5.51 mm · mes–1 con un promedio de 4.91 mm · mes–1 (±0.64 d.e.).
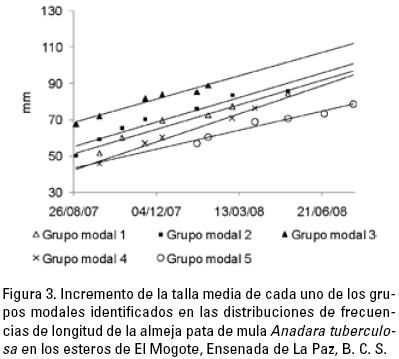
La relación peso sin concha–longitud total fue representada por la ecuación: W = 0.00006 L2.97, con la cual se estimó una tasa de crecimiento en peso que varió de 2.64 g · mes–1 a 5.47 g · mes–1, con un promedio de 3.67 g · mes–1 (±1.06 d.e.).
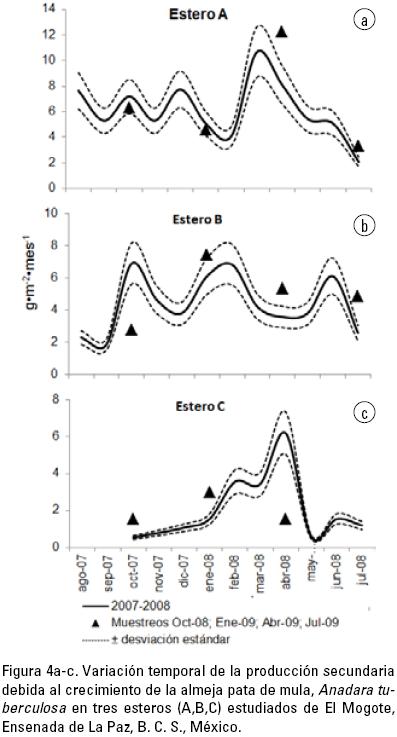
La producción de biomasa, debida al crecimiento, fue en promedio de 4.51 g · m–2 · mes–1, ±2.62 d.e. Ésta fue significativamente diferente en los tres esteros (p < 0.05). La mayor producción se registró en el estero A (6.17 g · m–2 · mes–1, ±2.68 d.e.), seguido del estero B (4.55 g · m–2 · mes–1, ±1.75 d.e.) y por último del estero C (2.14 g · m–2 · mes–1, ±1.64 d.e.) (Tabla 1). La producción máxima fue durante la primavera en los esteros A y C (Fig. 4a,c) mientras que en el estero B, el máximo se registró en el invierno (Fig. 4b). En los periodos 2007–2008 y 2008–2009 se observó un mismo patrón temporal de producción en los esteros A y B, destacando una mayor producción en el periodo 2008–2009. En el estero C, en el periodo 2008–2009, la máxima producción se registró durante el invierno, observándose un cambio con lo ocurrido en el periodo 2007–2008, cuando la producción máxima ocurrió en primavera (Fig. 4b).
Ostión de mangle. Se recolectaron un total de 1068 ostiones, con un promedio de 31.1 mm de longitud total entre 11.0 y 66.2 mm. El peso fresco total presentó un rango de 1.8 a 59.7 g, con un promedio de 13.3 g. El peso sin concha varió de 0.1 g a 7.0 g, con un promedio de 1.3 g y el peso seco estimado varió de 0.09 a 0.85 g con un promedio de 0.37 g.
Se estimó una densidad promedio de 510 ind · m–2 (±333 d.e.), con un mínimo de 80 ind · m–2 estimados en el estero A1 en enero de 2009 y un máximo de 1720 ind · m–2 en el estero A1 en junio de 2007. La densidad promedio por estero fue de 413 (±409 d.e.), 573 (±360 d e.), 395 (±136 d.e.) y 661 (±312 d.e.) ind · m–2 para los esteros A1, A2, B y C respectivamente (Tabla 2).
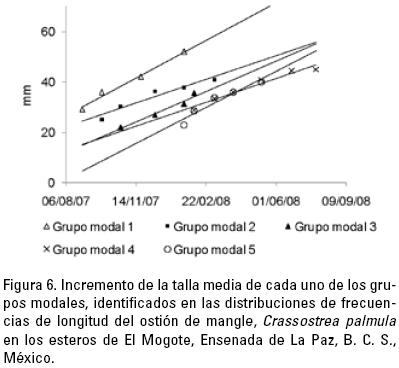
De agosto de 2007 a julio de 2008 se identificaron diversos grupos modales (Fig. 5a–l), con los cuales se calcularon las tasas de crecimiento que variaron de 2.8 a 5.1 mm · mes–1, con un promedio de 3.8 mm · mes–1 (±1.2 d.e.) (Fig. 6).
La relación peso sin concha–longitud total fue representada por: W = 0.012 L1.31, con la cual se calculó una tasa de crecimiento en peso que varió de 0.12 g · mes–1 a 0.25 g · mes–1, con un promedio de 0.18 g · mes–1 (±0.05 d.e.).
El incremento de biomasa, debido al crecimiento, fue en promedio de 97.9 g · m–2 · mes–1, ±63.9 d.e. La mayor producción se registró en el estero C (127.0 g · m–2 · mes–1, ±59.9 d.e.), seguida del estero A2 (110.0 g · m–2 · mes–1, ±69.3 d.e.), del estero A1 (79.4 g · m–2 · mes–1, ±78.5 d.e.) y del estero B (76.0 g · m–2 · mes–1, ±26.3 d.e.) (Tabla 2). La producción del estero C fue significativamente mayor que en los esteros A1 y B (p < 0.05). Se observó un máximo de producción durante el verano (octubre de 2008 a julio de 2009) en los esteros A1, A2 y B (Fig. 7a–c), mientras que en el estero C, el patrón fue constante (Fig. 7d). En cuanto a la variación de la producción de biomasa entre los periodos 20072008 y 2008–2009, se observó en términos generales, un mismo patrón temporal de producción en los diferentes esteros (Fig. 7a–d).
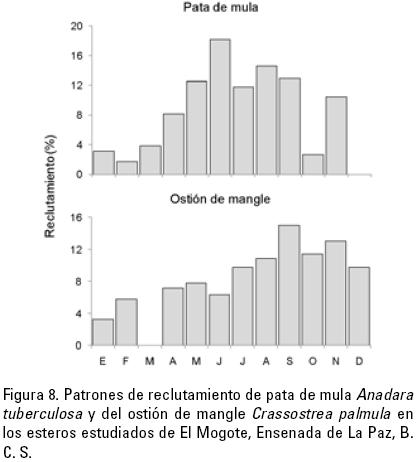
El reclutamiento de las dos especies se llevó a cabo durante todo el año. El periodo principal para la pata de mula ocurrió de junio a septiembre (Fig. 8a), mientras que para el ostión de mangle ocurrió de septiembre a diciembre (Fig. 8b).
DISCUSIÓN
Las densidades estimadas en las dos especies fueron altamente variables, lo que probablemente se relacionó con las condiciones ambientales y tasas locales de supervivencia y reclutamiento: Como respuesta a las condiciones ambientales, estas almejas tienen preferencias y tolerancias a la temperatura, salinidad, López–Rocha J. A. et al. composición del sustrato y nivel de mareas. La gran diferencia en densidades de las dos especies (1.27 ind · m–2 para la pata de mula y 510 ind · m–2 para el ostión de mangle) se debió a que los ostiones se distribuyen ocupando un espacio tridimensional (de uno a un metro y medio) adheridos a lo largo de las raíces de los mangles. Las estimaciones de densidad de pata de mula son bajas si se le compara con las encontradas en Bahía Magdalena, B. C. S., México con un promedio de 12 ind · m–2 (Baqueiro, 1980) y de las de Anadara notabilis (Röding, 1798) de Venezuela con 14 ind · m–2 (Manrique, 1982, en Prieto et al., 1998). Sin embargo, las densidades de la pata de mula encontradas en el Estero El Mogote están dentro del rango de las halladas en Colombia y Costa Rica (de 0.5 a 4.23 ind · m–2) (Squires, 1975; Campos, 1990; Borda & Cruz, 2004). Las altas densidades de la pata de mula documentadas en Bahía Magdalena, B. C. S., hacen de esta región el área de pesca más importante de la almeja pata de mula en México, caso contrario del estero El Mogote, donde no existe una pesquería desarrollada de esta especie.
Las densidades del ostión de mangle, encontradas en este trabajo, fueron superiores a las registradas para otros bivalvos en diversos ambientes y sólo son comparables con las encontradas para C. rhizophorae (Guilding, 1828,1 (818 ind · m–2) (Prieto et al., 2008) y Tivela mactroides (Born, 1778) (485 ind · m–2) (en Venezuela (Tata & Prieto, 1991).
Las distribuciones de frecuencias de longitud de ambas especies fueron multimodales lo que está en concordancia con patrones de reclutamiento y reproducción continuos o prolongados reportados para estas especies (Pérez–Medina, 2005; Romo–Piñera, 2005; Félix–Pico et al., 2007). En cada una de las distribuciones de frecuencias de longitud se identificaron cinco grupos modales, en los que se pudo observar un incremento mensual de la longitud media. Se consideró apropiada la estimación de crecimiento, debido a que el incremento de la longitud media de los diferentes grupos modales fue muy similar lo que indica un patrón consistente de crecimiento.
No fue posible la comparación de la productividad secundaria de estos bivalvos en la misma zona debido a que no hay trabajos previos en esta materia, sin embargo, en lo que se refiere a la pata de mula, la producción secundaria promedio estimada (4.51 g · m–2 · mes–1) estuvo en el rango de lo reportado para otros bivalvos como son: Modiolus squamosus (Beauperthuy, 1967), Tivela mactroides, Chione cancellata (Linnaeus, 1758,, Arca zebra (Swainson, 1833) y Argopecten purpuratus (Lamarck, 1819), con una producción entre 0.8 y 16.3 g · m–2 · mes–1 (Prieto et al., 1985, 1998, 2001; Tata & Prieto, 1991; Tarazona et al., 2007). La producción del ostión de mangle (97.9 g · m–2 · mes–1) está dentro del orden reportado para Crassostrea rhizophorae de 196.3 g · m–2 · mes–1 (Prieto et al., 2008).
La variación de producción secundaria entre esteros está en relación directa con los distintos valores de densidad encontrados. La menor productividad secundaria de la pata de mula, encontrada en los meses de verano (Fig. 4a–c, Tabla 1), está relacionado con su mayor reclutamiento en esos meses (junio a septiembre) (Fig. 8a), durante los cuales existe una mayor proporción de individuos de tallas pequeñas en la población, un patrón similar, pero no tan claro puede observarse en el ostión de mangle (Fig. 8b).
En las Figuras 4a–c y 7a–d, se muestra la comparación de la productividad secundaria estimada mensualmente durante el primer año de estudio (2007–2008) con los muestreos trimestrales del siguiente año (2008–2009), observándose patrones de variación similares, por lo que se sugiere un periodo estable tanto en las condiciones ambientales como por posibles efectos de actividades humanas como contaminación, degradación de hábitat o pesca. Los esteros mantuvieron en condiciones hipersalinas (>36 ups) y cálidas (>21 °C) durante los dos ciclos de muestreo. Además, no se presentaron cambios climáticos significativos durante los periodos de observación.
Dado la importancia del manglar como hábitat crítico de numerosas especies de moluscos, crustáceos, peces, aves y mamíferos (Lara–Domínguez & Yañez–Arancibia, 1999), resulta primordial la conservación y correcto manejo de los ecosistemas de manglar. Los resultados vertidos en este trabajo constituyen parte de los elementos necesarios para establecer una línea base que permita evaluar los efectos de diversas presiones, tanto de origen natural como antropogénico, a que están sujetos los sistemas de manglar en la Ensenada de la Paz, B. C. S., México.
AGRADECIMIENTOS
Este trabajo fue financiado por el programa de Protección y Prevención al Desequilibrio Ecológico y Monitoreo del Desempeño Ambiental de la Ensenada de La Paz, como Proyecto de la empresa Paraíso del Mar en El Mogote, La Paz, Baja California Sur, México, desarrollado por el CICIMAR–IPN. Al Instituto Politécnico Nacional por el apoyo económico que reciben los investigadores del CICIMAR–IPN por medio de las becas al desempeño académico e investigación SIBE (COFAA) y EDI (SEP).
REFERENCIAS
Baqueiro, E. 1980. Population structure of the mangrove cockle Anadara tuberculosa (Sowerby, 1833) from eight mangroves swamps in Magdalena and Almejas Bays, Baja California Sur, México. Proceedings of the National Shellfisheries Association 70: 201–206. [ Links ]
Berger, W. H., V. S. Smetacek & J. S. Gray. 1989. Productivity of the ocean. Present and past. Wiley–Interscience, New York. 470 p. [ Links ]
Bhattacharya, C. G. 1967. A simple method for resolution of a distribution into Gaussian components. Biometrics 23: 115–135. [ Links ]
Borda, C. A. & R. Cruz. 2004. Pesca artesanal de bivalvos (Anadara tuberculosa y A. similis) y su relación con eventos ambientales. Pacífico colombiano. Revista de Investigaciones Marinas 25: 197–208. [ Links ]
Campos, J. A., M. L. Fournier & R. Soto. 1990. Estimación de la población de Anadara tuberculosa (Bivalvia: Arcidae) en Sierpe Térraba, Costa Rica. Revista de Biología Tropical32: 477–480. [ Links ]
Cruz, R. & J. Jiménez. 1994. Moluscos asociados a las áreas de manglar de la Costa Pacífica de América Central. Editorial Fundación UNA. 180 p. [ Links ]
Félix–Pico, E. F., F. A. García–Domínguez, O. E. Holguín–Quiñones & J. A. López–Rocha. 2007. Ciclo reproductivo del ostión de mangle, Crassostrea palmula (Bivalvia: Ostreidae) en el estero El Conchalito, La Paz, B. C. S. In: Ríos–Jara, E., M. C. Esqueda–González & C. M. Galván–Villa (Eds.). Estudios sobre la Malacología y Conquiología en México. Universidad de Guadalajara, México, pp. 255–256. [ Links ]
Félix–Pico, E. F., E. M. Ramírez–Rodríguez & O. E. Holguín–Quiñones. 2009. Growth and fisheries of the black ark Anadara tuberculosa, a bivalve mollusk, in Bahia Magdalena, Baja California Sur, Mexico. North American Journal of Fisheries Management 29: 231–236. [ Links ]
Gayanilo, F. C., P. Sparre & D. Pauly. 2004. The FAO–ICLARM stock assessment tools II Windows Version (FISATII) user's guide (Revision I). FAO Computerized Information Series (Fisheries), No 8. 183 p. [ Links ]
Hernández–Valenzuela, R. 1996. Pesquería de almeja pata de mula. In: Casas–Valdez, M. & G. Ponce–Díaz (Eds.). Estudio del potencial pesquero y acuícola de Baja California Sur, Vol. I. Secretaría Medio Ambiente Recursos Naturales y Pesca México, Centro Interdisciplinario de Ciencias Marinas, Centro de Investigaciones Biológicas del Noroeste, Food and Agriculture Organization of the United Nations, México, pp. 121–126. [ Links ]
Keen, A. M. 1971. Sea shells of tropical West America. Stanford Univ. Press. Stanford. 1064 p. [ Links ]
Lacerda, L. D., J. E. Conde, B. Kjerfve, R. Alvarez–Leon, C. Alarcon & J. Plañía. 2002. American mangroves. In: Lacerda, L.D. (Ed.). Mangrove ecosystems: function and management. Springer, New York, pp. 1–62. [ Links ]
Lara–Domínguez, A. L. & A. Yáñez–Arancibia. 1999. Productividad secundaria, utilización del hábitat y estructura trófica. In: Yáñez–Arancibia, A. & A. L. Lara–Domínguez (Eds.). Ecosistemas de manglar en América tropical. Instituto de Ecología A. C. México, UICN/ORMA, Costa Rica, NOAA/NMFS Silver Spring. pp. 153–166. [ Links ]
Mackenzie, C. L. 2001. The fisheries for mangrove cockles, Anadara spp., from Mexico to Peru, with descriptions of their habitats and biology, the fishermen's lives, and the effects of shrimp farming. Marine Fisheries Review 63: 1–39. [ Links ]
Mann, K. H. 2000. Ecology of coastal waters. With implications for management. Blackwell Science. Oxford. 406 p. [ Links ]
Moreau, J. & F. X. Cuende. 1991. On improving the resolution of the recruitment patterns of fishes. ICLARM Fishbyte 9: 45–46. [ Links ]
Pauly, D. 1983. Some simple methods for the assessment of tropical fish stocks. FAO Fisheries Technical Paper 234: 1–52. [ Links ]
Pérez Medina, D. R. 2005. Biología reproductiva de Anadara tuberculosa (Bivalvia: Arcidae) en el estero Santo Domingo. Tesis de Maestría, Centro Interdisciplinario de Ciencias Marinas, IPN, La Paz, B. C. S., México. 70 p. [ Links ]
Prieto, A., R. Pereira & R. Manrique. 1985. Producción secundaria del mejillón Modiolus squamosus en Tocuchare, Golfo de Cariaco, Venezuela. Acta Científica Venezolana 36: 258–264. [ Links ]
Prieto, A., C. Ramos & D. Arrieche. 1998. Producción secundaria de Chione cancellata (Bivalvia: Veneridae) de la costa sur del Golfo de Cariaco, Venezuela. Revista de Biología Tropical46: 913–919. [ Links ]
Prieto, A., O. Ramos, D. Arrieche, J. Villalba & C. Lodeiros. 2001. Producción secundaria e índice de condición en Arca zebra (Mollusca: Bivalvia) del Golfo de Cariaco, Venezuela. Revista de Biología Tropical 49: 599–608. [ Links ]
Prieto, A., A. Montes & L. J. Ruiz. 2008. Potencial de producción de biomasa en una población natural de la ostra Crassostrea rhizophorae, en la laguna Grande de Obispo, Golfo de Cariaco, Venezuela. Interciencia 33: 747–753. [ Links ]
Romo–Piñera, A. 2005. Ciclo reproductivo del ostión de mangle Saccostrea palmula (Carpenter 1857), en Bahía Magdalena, Baja California Sur. Tesis de Maestría, Centro Interdisciplinario de Ciencias Marinas, IPN, La Paz, B. C. S., México. 74 p. [ Links ]
Sparre, P. & S. C. Venema. 1995. Introducción a la evaluación de recursos pesqueros tropicales. FAO Fisheries Technical Paper 306: 1–96. [ Links ]
Squires, H., M. Estevez, O. Barona & O. Mora. 1975. Mangrove cockles, Anadara spp. of the Pacific Coast of Colombia. The Veliger 18: 57–68. [ Links ]
Tarazona, J., R. Espinoza, M. Solís & W. Arntz. 2007. Crecimiento y producción somática de la concha de abanico (Argopecten purpuratus) en Bahía Independencia, Pisco (Perú) comparados entre eventos El Niño y La Niña. Revista de Biología Marina y Oceanografía 42: 275–285. [ Links ]
Tata, A. & A. Prieto. 1991. Producción secundaria en una población del bivalvo tropical Tivela mactroides (Veneridae) en el Oriente de Venezuela. Caribbean Journal of Science 21: 63–73. [ Links ]
Valiela, I., J. L. Bowen & J. K. York. 2001. Mangrove forests: one of the world's threatened major tropical environments. BioScience 51: 807–815. [ Links ]














