Introducción
Las selvas tropicales son ecosistemas diversos y complejos del planeta tierra. En México, estas se extienden a lo largo de la vertiente del Golfo de México y del Océano Pacífico (Carreón-Santos & Valdez-Hernández, 2014). En el estado de Quintana Roo abarcan alrededor de 1.5 millones de hectáreas con distinta cobertura, estructura y diversidad vegetal (Instituto Nacional de Estadística y Geografía [INEGI], 2017). Predominan la selva mediana, selva baja y vegetación secundaria (INEGI, 2017), con distintos grados de perturbación causados por huracanes, sequías, incendios, actividad agrícola o ganadera, y con periodos de tiempo de recuperación comprendidos de 1 a 20 años (Navarro-Martínez et al., 2012). Estos estadios de recuperación de la vegetación presentan una rica composición florística, que es importante para la alimentación de rumiantes silvestres (Albores-Moreno et al., 2019).
Entre estos rumiantes se encuentra el venado cola blanca (Odocoileus virginianus), que destaca por su habilidad de aprovechar la diversidad y riqueza de recursos vegetales de la selva bajo diferentes condiciones de perturbación (Weber, 2014). Estos animales tienen un área de ramoneo que se ubica en la selva mediana sub-perennifolia, áreas deforestadas y áreas agrícolas (Weber, 2008), por lo que la composición botánica de su dieta puede variar en el número de especies y familias vegetales de acuerdo con el tipo de hábitat que utiliza como área de alimentación (López-Pérez et al., 2012).
Por lo anterior, es importante determinar la composición florística, la diversidad y la riqueza de especies de las selvas para contribuir a conservar el hábitat de este ungulado (García-Flores et al., 2021). Esto es posible si se toma en cuenta el conocimiento local que tienen los agricultores sobre las especies arbóreas y arbustivas que consume el venado cola blanca, y que les sirven como especies indicadoras para su cacería con fines de consumo de subsistencia (Ruiz-Mondragón et al., 2020). Diversos estudios etno-zoológicos indican que los cazadores de subsistencia conocen los hábitos alimenticios del venado cola blanca (García-Flores et al., 2021); por lo cual, el conocimiento que tienen los pobladores con respecto al consumo de especies vegetales presentes en las selvas resulta un recurso útil para el estudio de la alimentación de este cérvido.
En este sentido, se ha señalado que la composición de la dieta de los venados cola blanca es variable, pues depende de los recursos que dispone en un ecosistema específico (Beltrán & Díaz, 2017), del grado de conservación del ecosistema y de la estructura y composición de la vegetación. Con base en lo anterior, conocer la diversidad de las especies de plantas y su nivel de importancia es esencial para la planificación del manejo y preservación de los ecosistemas donde vive el venado cola blanca (Gallina & Mandujano, 2009).
Estudios previos discrepan en la riqueza de especies que conforman la dieta del venado cola blanca (López-Pérez et al., 2012; Lozano et al., 2020; Weber, 2014). Al respecto, un estudio sobre composición botánica en el Sur de México señala que la dieta del venado cola blanca puede constituirse por 83 especies de plantas de 36 familias botánicas, y solo 13 especies pueden llegar a representar más del 50% de la dieta (Vasquez et al., 2016). Otro estudio reporta 82 plantas seleccionadas por el venado cola blanca, de las cuales 12 especies contribuyeron con más del 50% de la dieta anual (Arceo et al., 2005). También existen reportes que señalan una menor cantidad de especies vegetales consumidas por el venado cola blanca. Al respecto, González & Briones-Salas (2012) encontraron que la dieta anual está conformada por 42 especies vegetales de 23 familias botánicas. Por su parte, en la selva baja y bosque tropical de la región de Pitzotlán, Morelos, la dieta del venado cola blanca se conforma por 53 especies y 22 familias botánicas (López-Pérez et al., 2012).
Entre las especies de plantas que Vasquez et al. (2016) identifican como alimento se encuentran Bursera schlechtendalii Engl., Caesalpinia sp., Lysiloma divaricatum (Jacq.) J. F. Macbr., Opuntia lasiacantha Pfeiff., Agave macroacantha Zucc., Ceiba parvifolia Rose, Euphorbia sp., Talinum paniculatum (Jacq.) Gaertn., Bursera fagaroides Ballock, Ziziphus sp., Solanum lanceolatum Cav., Senna wislizeni (Rose) Irwin y Barneby y Karwinskia humboldtiana (Schult.) Zucc., observándose que la mayor frecuencia de consumo se da en las hojas y tallos tiernos de las especies arbóreas y herbáceas.
Adicionalmente, Lozano et al. (2020) señalan que, en matorrales desérticos del estado de Coahuila, la dieta del venado cola blanca se constituye por 39 especies de plantas agrupadas en 18 familias, y las más frecuentes son Poaceae y Fabaceae, mientras que las especies frecuentes en la dieta fueron Prosopis glandulosa, Acacia rigidula, Setaria leucophylla y Leucophyllum frutescens. La dieta del venado en esta región se constituyó por 37.73% arbustivas, 17.21% arbóreas y 3.35% herbáceas.
Por otro lado, es necesario considerar que la dieta del venado es determinada por una variedad de factores (heterogeneidad ambiental, diversidad vegetal, estados sucesionales, fenología y etapa de desarrollo de las especies) que varían a lo largo del año. Así, por ejemplo, las familias Malvaceae, Commelinaceae y Myrtaceae son las de mayor consumo en otoño; las familias Fabaceae, Poaceae, Rubiaceae, Malpighiaceae y Begoniaceae son las de mayor consumo en invierno; y las familias Rubiaceae, Begoniaceae y Anacardiaceae se consumen más en primavera (López-Pérez et al., 2012).
Todos estos estudios evidencian la importancia que adquiere el conocimiento de la composición de las especies en las distintas condiciones ecológicas y en las distintas regiones tropicales; y aún son pocos los estudios realizados sobre la influencia de la composición, diversidad y riqueza de especies de selva mediana subperennifolia, selva baja subcaducifolia, bajos inundables y un complejo patrón de mosaicos de vegetación secundaria (acahuales) de distintas edades sobre el consumo del venado cola blanca (Weber, 2014). También, es escasa la información sobre la relación entre la composición y la diversidad de la vegetación que compone a la selva baja inundable (SBI) y a la selva mediana subperennifolia (SMS) con la composición botánica de la dieta del venado cola blanca.
Por ello, en este estudio el objetivo fue conocer el aporte de la diversidad de los recursos forrajeros de la SBI y la SMS en la composición botánica de la dieta del venado cola blanca (Odocoileus virginianus) en el sur de Quintana Roo, México, así como valorar y corroborar el conocimiento que poseen los pobladores locales (campesinos y cazadores de subsistencia) sobre las plantas consumidas por el venado cola blanca.
Materiales y métodos
Área de estudio
El estudio se realizó en la comunidad de Laguna Om, al noroeste del municipio de Othón P. Blanco, Quintana Roo, México. El sitio se localiza en las coordenadas 18° 41' 49.5"-18° 25' 49.5" N y 88° 29' 22"-88° 36' 44" O. Predomina un clima cálido subhúmedo con lluvias en verano, con una temperatura anual promedio de 26 °C y una precipitación anual de 1250 mm (Comisión Nacional del Agua [Conagua], 2016). La vegetación está compuesta por un mosaico de selva mediana subperennifolia, selva baja subperennifolia y selva baja inundable (Miranda & Hernández, 2014), con asociación de pastizales inducidos para el desarrollo de la actividad ganadera (INEGI, 2013).
Unidad de muestreo
Se tomó en consideración la dominancia de la SMS y la SBI como sitios de muestreo. Este tipo de selvas constituyen el hábitat natural de alimentación y refugio del venado cola blanca. En la SMS se tomaron dos estadios de sucesión, ya que este tipo de vegetación es la que se encuentra sujeta a mayor transformación por acción antropogénica. Se tomaron como unidades de muestreo los estadios sucesionales de SMS de 1 a 10 años (SMSc1-10) y de 11 a 20 años (SMSc11-20), así como la SBI sin alteración antropogénica.
En cada una de las tres condiciones (SBI, SMSc1-10 y SMSc11-20) se establecieron seis sitios de muestreo empleando el mapa de distribución vegetal del ejido Laguna Om (Jean et al., 2019). La definición del sitio de muestreo tomó en consideración la accesibilidad y la limitada presencia humana. Adicionalmente, se tomó en cuenta la opinión y experiencia de los agricultores que practican la cacería de subsistencia, quienes participaron activamente como guías en el campo. Con base en lo anterior, se ubicaron y establecieron seis transectos de 2 km de largo y 4 m de ancho por cada sitio de muestreo, y cada transecto se georreferenció con un geoposicionador satelital (GPS). La información sobre la vegetación se obtuvo durante la época de lluvia (julio-septiembre), siguiendo el protocolo propuesto por Gentry (1982).
Para conocer la composición de la vegetación se realizó un inventario florístico por transecto. De las especies vegetales colectadas, se identificaron aquellas que son consumidas por el venado cola blanca, con base en la experiencia aportada por los agricultores que fungieron como guías en el campo. También, se obtuvo información adicional mediante la aplicación de encuestas que se aplicaron in situ a los agricultores que se dedican a la cacería de subsistencia. Se aplicaron 18 encuestas con el propósito de incorporar el conocimiento campesino sobre la vegetación asociada a los hábitos alimenticios del venado cola blanca, de acuerdo con lo propuesto por García-Flores et al. (2021). De cada planta, se registró el área basal (cm2), diámetro a la altura del pecho (cm) y número de individuos presentes.
También se obtuvieron imágenes fotográficas de las diferentes partes de la planta y se colectó una muestra de sus hojas, tallo, fruto y flores para su identificación taxonómica. Para identificar cada planta se consultó la base de datos del herbario digital del Centro de Investigaciones Científicas de Yucatán (CICY) y las colecciones del herbario de El Colegio de la Frontera Sur (Ecosur). Con base en la información obtenida, se determinó el número de especies, familias y formas de vida.
Identificación micro histológica de las plantas
Para identificar las especies consumidas por el venado cola blanca, fue necesario crear con un catálogo de referencia micro histológico de la epidermis de las plantas reportadas por los cazadores de subsistencia como consumidas, siguiendo la técnica descrita por Spark & Malechek (1968) y modificada por Arellano et al. (2019), y posteriormente fue comparado con los patrones micro histológicos de plantas encontrados en los contenidos ruminales donados por los cazadores.
El catálogo se creó a partir de la colecta de plantas señaladas en las entrevistas a los cazadores. De cada planta señalada como consumida por el venado se tomó una muestra de hoja y tallo tierno, se montó en una prensa y se sometió a secado en estufa a 48 °C por 72 h, de acuerdo con el procedimiento descrito por Amendola (2002) y Whalley & Hardy (2000). Posterior al secado, las hojas fueron sometidas a un proceso de ebullición por 2 h en agua destilada y después por 30 min en hipoclorito de sodio al 32%. Posteriormente, se lavó con agua por 1 min y se obtuvo la epidermis de la hoja mediante el raspado con bisturí y utilizando un estereoscopio marca Leica EZ4. La epidermis de cada planta se montó en portaobjetos y se fijó con cubreobjetos utilizando resina sintética en Xilol al 60% (O’Brien & Mc Cully, 1982). Las laminillas obtenidas se secaron a calor empleando un mechero de alcohol y se elaboró un catálogo fotográfico de referencia con los tejidos epidérmicos de las plantas identificadas como consumidas en los transectos de cada sitio de muestro (SBI, SMSc1-10 y SMSc11-20).
Identificación micro histológica del contenido del rumen
Con la ayuda de cazadores de subsistencia, se recolectaron cinco tractos digestivos de venado cola blanca. La cacería de subsistencia es definida como una forma de extracción de fauna silvestre que realizan las comunidades con fines de autoconsumo y comercio local, donde su venta es proporcional a la satisfacción de las necesidades básicas de los cazadores y de sus dependientes económicos, sin la influencia de un mercado externo que la convierta en una actividad lucrativa (Ley General de Vida Silvestre [LGVS], 2016; Ramírez-Barajas & Calmé, 2015; Ramírez-Barajas & Naranjo-Piñera, 2007).
La cacería de subsistencia que se practica se rige bajo usos y costumbres en áreas de uso común dentro de la comunidad estudiada, como una forma de obtención de proteína de origen animal para la alimentación de las familias. La colecta de los tractos digestivos fue oportunista y solo se usaron cuando el cazador de subsistencia estuvo de acuerdo en donarlos, previa consulta a la comunidad y autoridad ejidal para solicitar autorización, como sugiere Cano et al. (2014). Adicionalmente, se asumió que cada animal tuvo acceso a los sitios de muestreo de la vegetación para alimentarse. Para preservar las condiciones del rumen desde el sitio de cacería hasta el laboratorio, se mantuvo bajo temperatura constante de 39 °C.
En el laboratorio, los contenidos del rumen se filtraron con una criba de 1 mm y se secaron en estufa de aire forzado (marca Binder 9010-0104 modelo FD) a 60 °C hasta alcanzar peso constante. El material seco se trituró con un molino (IKA® MF10 Basic) a tamaño de 1 mm. Posteriormente, se pesaron 20 g de cada muestra y se sometió a ebullición en agua destilada por 2 h, y después por 30 min en hipoclorito de sodio al 32%. Se tomó una gota del material y se montó en un portaobjetos, se fijó con un cubreobjetos previamente marcado con 20 micro parcelas y con la ayuda de resina sintética en Xilol al 60%. Se prepararon cinco laminillas por contenido ruminal. En cada laminilla se observaron los fragmentos de epidermis presente en cada micro campo, utilizando un microscopio de contraste de fase (marca Leica DM500) con un lente de aumento de 10X.
La identificación de las especies se realizó comparando la forma de la epidermis (cuadrada, rectangular, triangular, asimétrica, etc.) y la presencia de estomas, cristales y tricomas con el catálogo fotográfico de referencia de las estructuras celulares de las plantas previamente descrito (López-Pérez et al., 2012; Weber, 2014); además, se registró la presencia de cada planta por campo. Los tricomas presentes que no estaban adheridos a la epidermis no fueron contabilizados. Con el total de laminillas se calculó la frecuencia, frecuencia relativa, densidad y densidad relativa por especie, de acuerdo con Sparks & Malechek (1968): Frecuencia = Número de veces en que aparece una especie / Número de cuadros muestreados; Frecuencia relativa = Valores de frecuencia de una especie x 100 / Valores de frecuencia de todas las especies; Densidad = Log N (1-frecuencia); Densidad relativa = Densidad de una especie x 100 / Densidad de todas las especies. También se calculó el porcentaje que representó cada especie y el aporte de MS por planta en la dieta de los animales, estimado mediante el promedio (± desviación estándar) de peso húmedo (1136.9 ± 41.10 g) y promedio de MS (26.80 ± 8.98%) de los contenidos ruminales filtrados.
Análisis de datos
Con la información del inventario vegetal se calculó la dominancia absoluta, dominancia relativa, densidad absoluta, densidad relativa, frecuencia absoluta y frecuencia relativa de las especies; asimismo, se estimó el índice de valor de importancia (IVI) propuesto por Curtis & McIntosh (1951) y reportado por Corella et al. (2001) y Zarco-Espinosa et al. (2010). El IVI se estimó como la Dominancia relativa + Densidad relativa + Frecuencia relativa, y solo se señalan las especies con un IVI superior a 8, con la finalidad de identificar las más importantes. Posteriormente, se determinó el índice de diversidad de especies mediante el índice de Margalef (Dmg) y el índice de Shannon-Wiener (H´) (Margalef, 1977). El Dmg se calculó como
Para conocer la relación entre los índices de valor de importancia de cada especie de planta encontrada en SBI, SMSc1-10 y SMSc11-20 y el porcentaje de consumo en la dieta, se realizó un árbol de regresión mediante el programa estadístico R (Albores-Moreno et al., 2020), utilizando el paquete gbm versión 1.5-7 (Ridgeway, 2006).
Resultados
Se identificaron 50 especies de plantas presentes en SBI, 62 en SMSc1-10 y 62 en SMSc11-20; y se agruparon en 69 géneros, 40 familias y cuatro formas de vida (Tabla 1). También se encontraron 75 diferentes especies de plantas potencialmente consumibles por el venado cola blanca. El 46.67% de ellas pertenecen a seis familias: Fabaceae (16 especies), Moraceae, Sapotaceae, Rubiaceae, Malvaceae (cuatro especies cada una) y Asteraceae (tres especies), y el 53.33% de las especies restantes se agrupan en 34 familias. Por otra parte, el 50.66% de las especies de plantas identificadas como potencialmente consumibles por el venado se clasifican por su forma de vida en arbórea (17.33%), arbustiva (16.00%), herbácea (23%) y trepadoras (16.01%) (Tabla 1).
Tabla 1 Especies de plantas reportadas como parte de la dieta del venado cola blanca en Quintana Roo, México.
| Nombre científico | Nombre común | Forma de vida | Presencia en vegetación |
| Familia Fabaceae | |||
| Mimosa pudica L. | Dormilona | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Mimosa affinis B. L. Robinson. | Dormilona | Herbácea | SBI, SMSc1-10 |
| Dalbergia glabra (Mill.) Standl. | Muk | Trepadora | SBI, SMSc1-10, SMSc11-20 |
| Machaerium cirrhiferum Pittier | Corcho | Arbustiva | SBI |
| Platymiscium yucatanum Standl. | Granadillo | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Bauhinia divaricata L. | Pata de vaca | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Lonchocarpus guatemalensis Benth | Palo gusano | Árbol | SMSc1-10, SMSc11-20 |
| Lysiloma acapulcense (Kunth) Benth. | Árbol | SMSc11-20 | |
| Vachellia cornigera (L.) Seigler y Ebinger. | Cornezuelo | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Lonchocarpus castilloi Standl. | Arrocillo | Árbol | SBI, SMSc11-20 |
| Lysiloma latisiliquum (L.) Benth. | Tsalam / Arrocillo | Árbol | SBI |
| Gliricidia sepium (Jacq.) Walp. | Cocoite | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Swartzia cubensis (Britton y Wilson) Standl. | Katalox | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Piscidia piscipula (L.) Sarg. | Jabin verde o jaábin | Árbol | SMSc1-10, SMSc11-20 |
| Lonchocarpus rugosus Benth. | Cuerudo u orejudo | Árbol | SMSc11-20 |
| Macroptilium gibbosifolium (Ortega) A. Delgado. | Jicama de monte | Trepadora | SMSc11-20 |
| Familia Moraceae | |||
| Trophis racemosa (L.) Urb. | Ramón colorado | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Brosimum alicastrum Sw. | Ramón | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Ficus lapathifolia (Liebm.) Miq. | Higo | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Pseudolmedia glabrata (Liebm) C. Berg. | Mamba/ Cheryx | Árbol | SMSc11-20 |
| Familia Sapotaceae | |||
| Chrysophyllum mexicanum Brandegee | Caimito morado | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Sideroxylon foetidissimum Jacq. | Caracolillo | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Chrysophyllum cainito L. | Caimito / Caimito Blanco | Árbol | SMSc11-20 |
| Manilkara zapota (L.) P. Royen. | Chicozapote o zapote | Árbol | SBI, SMSc1-10 |
| Familia Rubiaceae | |||
| Margaritopsis microdon (DC.) C.M. Taylor | Lechoso | Arbustiva | SBI, SMSc1-10 |
| Randia aculeata L. | Cariñosa | Arbustiva | SMSc1-10 |
| Hamelia rostrata Bartl. ex DC. | Yaxche | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Hamelia patens Jacq. | Coralillo / Ixcanan | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Familia Asteraceae | |||
| Cyrtocymura scorpioides (Lam.) H. Rob. | Sierrilla | Herbácea | SBI, SMSc1-10 |
| Neurolaena lobata (L.) R.Br. ex Cass. | Mano de lagarto | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Viguiera dentata (Cav.) Spreng. | Tajón o taj | Herbácea | SMSc1-10, SMSc11-20 |
| Familia Malvaceae | |||
| Malvastrum coromandelianum (L.) Garcke | Malva | Herbácea | SBI, SMSc1-10 |
| Hampea trilobata Standl. | Majahua | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Pseudobombax ellipticum (Kunth) Dugand. | Amapola | Árbol | SMSc1-10, SMSc11-20 |
| Malvaviscus arboreus Cav. | Flor de colibrí | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Familia Annonaceae | |||
|
Sapranthus campechianus (Kunth) Standl.
Mosannona depressa (Baill) Chatrou. |
Kanisté
Elemuy |
Árbol
Árbol |
SBI, SMSc1-10,
SMSc11-20 SMSc1-10 |
| Familia Bignoniaceae | |||
|
Stizophyllum riparium (Kunth) Sandwith
Bignonia aequinoctialis L. |
Bejuco Blanco
Peineta |
Trepadora
Trepadora |
SBI, SMSc1-10,
SMSc11-20 SMSc11-20 |
| Familia Convolvulaceae | |||
|
Ipomoea tricolor Cav.
Turbina corymbosa (L.) Raf. |
Camotillo silvestre
Xtabetún |
Trepadora
Trepadora |
SBI, SMSc1-10, SMSc11-20
SBI, SMSc1-10, SMSc11-20 |
| Familia Euphorbiaceae | |||
|
Euphorbia hyssopifolia L.
Manihot esculenta Crantz. |
Corona de cristo
Yuca silvestre |
Trepadora
Arbustiva |
SMSc1-10
SMSc1-10 |
| Familia Myrtaceae | |||
|
Psidium sartorianum (O. Berg) Nied.
Eugenia capuli (Schltdl. y Cham.) Hook. y Arn. |
Guayabillo
Guayabillo rojo |
Árbol
Árbol |
SBI, SMSc1-10, SMSc11-20
SMSc1-10, SMSc11-20 |
| Familia Sapindaceae | |||
|
Serjania goniocarpa Radlk.
Melicoccus oliviformis Kunth |
Cola iguano
Huaya |
Trepadora
Árbol |
SBI, SMSc1-10, SMSc11-20
SMSc1-10, SMSc11-20 |
| Familia Amaranthaceae | |||
| Amaranthus hybridus (L.) | Quelite | Herbácea | SBI, SMSc1-10 |
| Familia Anacardiaceae | |||
| Spondias radlkoferi Donn.Sm. | Jobo o Jobo rojo | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Apocynaceae | |||
| Thevetia ahouai (L.) A.D.C. | Huevo de perro | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Familia Araliaceae | |||
| Dendropanax arboreus (L.) Decne. y Planch | Chakaj blanco | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Boraginaceae | |||
| Ehretia tinifolia L. | Roble | Árbol | SBI, SMSc1-10 |
| Familia Burseraceae | |||
| Bursera simaruba (L.) Sarg. | Chakaj / mulato | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Caricaceae | |||
| Carica papaya L. | Papaya de monte | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Cucurbitaceae | |||
| Cionosicys excisus (Griseb.) C. Jeffrey. | Calabacilla | Trepadora | SBI |
| Familia Cyperaceae | |||
| Cladium mariscus subsp. jamaicense (Crantz) Kük. | Navajuelo o cortadora | Herbácea | SMSc1-10 |
| Familia Dennstaedtiaceae | |||
| Pteridium caudatum (L.) Maxon | Helecho | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Familia Dilleniaceae | |||
| Doliocarpus dentatus (Aubl.) Standl. | Lebisa | Trepadora | SBI, SMSc1-10, SMSc11-20 |
| Familia Ebenaceae | |||
| Diospyros tetrasperma Sw. | Siliil | Árbol | SMSc1-10, SMSc11-20 |
| Familia Erythroxylaceae | |||
| Erythroxylum confusum Britton | Cascarillo 1 | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Lamiaceae | |||
| Vitex gaumeri Greenm | Ya´axnik | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Malpighiaceae | |||
| Byrsonima bucidifolia Standl. | Sak paj | Árbol | SBI, SMSc11-20 |
| Familia Muntingiaceae | |||
| Muntingia calabura L. | Capulín | Árbol | SMSc1-10, SMSc11-20 |
| Familia Nyctaginaceae | |||
| Pisonia aculeata L. | Uña de gato | Trepadora | SMSc11-20 |
| Familia Opiliaceae | |||
| Agonandra macrocarpa L.O. Williams. | Nanchep o x-napche | Árbol | SMSc11-20 |
| Familia Piperaceae | |||
| Piper amalago (L.) | Xolté / Bastón de Viejo | Arbustiva | SBI, SMSc11-20 |
| Familia Polygonaceae | |||
| Coccoloba spicata Ludell. | Cascarillo 2 | Árbol | SMSc1-10, SMSc11-20 |
| Familia Salicaceae | |||
| Casearia commersoniana Cambess. | Volador | Árbol | SMSc1-10, SMSc11-20 |
| Familia Simaroubaceae | |||
| Alvaradoa amorphoides Liebm. | Ruda de monte | Arbustiva | SBI, SMSc1-10, SMSc11-20 |
| Familia Smilacaceae | |||
| Smilax spinosa Mill | Lengua de vaca | Trepadora | SMSc1-10, SMSc11-20 |
| Familia Solanaceae | |||
| Solanum americanum Mill. | Hierba mora | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Familia Ulmaceae | |||
| Trema micrantha (L.) Blume. | Capulín de monte | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Urticaceae | |||
| Cecropia peltata L. | Guarumbo | Árbol | SBI, SMSc1-10, SMSc11-20 |
| Familia Verbenaceae | |||
| Phyla strigulosa (M. Martens y Galeotti) Moldenke | Hierba Buena | Herbácea | SBI, SMSc1-10, SMSc11-20 |
| Familia Vitaceae | |||
| Vitis tiliifolia Humb. y Bonpl. ex Schult. | Uva de monte | Trepadora | SMSc1-10, SMSc11-20 |
Nota. SBI = Selva baja inundable; SMSc1-10 = Selva mediana de 1 a 10 años de sucesión; SMSc11-20 = Selva mediana de 11 a 20 años de sucesión.
Fuente: Elaboración propia.
Respecto al índice de valor de importancia (IVI), se observó que en la SBI 33 especies presentan un IVI > 8, lo que representa el 44% del total de las especies; entre ellas destacan Bursera simaruba, Cecropia peltata, Brosimum alicastrum, Thevetia ahouai, Spondias radlkoferi, Chrysophyllum mexicanum, Bauhinia divaricata y Dalbergia glabra. Por otro lado, en la condición de SMSc1-10 se observaron a 19 (25.33%) especies con un IVI > 8. Destacan Dendropanax arboreus, Sapranthus campechianus y Vitex gaumeri. Conforme aumentó la edad de la SMS (SMSc11-20), se observó un ligero incremento en el porcentaje (30.66%) de especies con un mayor valor de IVI, de las cuales Trophis racemosa y Swartzia cubensis son las dominantes (Tabla 2).
Tabla 2 Valor de importancia relativa de las especies vegetales presentes en distintas condiciones de la vegetación en Quintana Roo, México.
| Especie | Índice de Valor de Importancia (IVI) | ||
| SBI | SMSc1-10 | SMSc11-20 | |
| Bursera simaruba (L.) Sarg. | 13.336 | 9.435 | 9.350 |
| Cecropia peltata L. | 9.562 | 9.435 | 8.017 |
| Brosimum alicastrum Sw. | 9.562 | 9.435 | 8.017 |
| Thevetia ahouai (L.) A. DC. | 10.226 | 7.146 | 8.853 |
| Spondias radlkoferi Donn. Sm. | 9.562 | 9.435 | 6.683 |
| Chrysophyllum mexicanum Brandegee | 9.562 | 9.435 | 5.350 |
| Bauhinia divaricata L. | 8.339 | 7.146 | 7.520 |
| Dendropanax arboreus (L.) Decne. y Planch | 5.789 | 8.136 | 8.017 |
| Sapranthus campechianus (Kunth) Standl. | 5.789 | 9.435 | 6.683 |
| Dalbergia glabra (Mill.) Standl. | 8.339 | 5.847 | 7.520 |
| Trophis racemosa (L.) Urb. | 5.789 | 6.837 | 8.017 |
| Swartzia cubensis (Britton y Wilson) Standl. | 5.789 | 6.837 | 8.017 |
| Vitex gaumeri Greenm. | 5.789 | 8.136 | 6.683 |
| Vachellia cornígera (L.) Seigler y Ebinger. | 6.453 | 5.847 | 7.520 |
| Carica papaya L. | 7.675 | 5.539 | 5.350 |
| Psidium sartorianum (O. Berg) Nied. | 7.675 | 5.539 | 5.350 |
| Trema micrantha (L.) Blume. | 7.675 | 5.539 | 5.350 |
| Platymiscium yucatanum Standl. | 7.675 | 6.837 | 4.017 |
| Hampea trilobata Standl. | 4.566 | 7.146 | 6.187 |
| Gliricidia sepium (Jacq.) Walp. | 9.562 | 4.240 | 4.017 |
| Ficus lapathifolia (Liebm.) Miq. | 5.789 | 4.240 | 6.683 |
| Erythroxylum confusum Britton. | 5.789 | 5.539 | 5.350 |
| Sideroxylon foetidissimum Jacq. | 7.675 | 4.240 | 4.017 |
| Malvastrum coromandelianum (L.) Garcke | 5.796 | 5.278 | 4.080 |
| Neurolaena lobata (L.) R.Br. ex Cass. | 7.683 | 3.979 | 2.746 |
| Alvaradoa amorphoides Liebm. | 4.566 | 3.250 | 6.187 |
| Serjania goniocarpa Radlk. | 5.801 | 2.750 | 5.448 |
| Doliocarpus dentatus (Aubl.) Standl. | 5.801 | 4.049 | 4.115 |
| Hamelia patens Jacq. | 4.566 | 3.250 | 4.853 |
| Pseudobombax ellipticum (Kunth) Dugand. | 6.837 | 5.350 | |
| Eugenia capuli (Schlech y Cham) Hook y Arn. | 6.837 | 5.350 | |
| Phyla strigulosa (M. Martens y Galeotti) Moldenke | 3.909 | 3.979 | 4.080 |
| Lonchocarpus castilloi Standl. | 7.675 | 0.000 | 4.017 |
| Manilkara zapota (L.) P. Royen. | 5.789 | 5.539 | |
| Byrsonima bucidifolia Standl. | 5.789 | 0.000 | 5.350 |
| Lonchocarpus guatemalensis Benth. | 4.240 | 6.683 | |
| Casearia commersoniana Cambess. | 4.240 | 6.683 | |
| Talisia oliviformis (Kunth.) Radlk. | 4.240 | 6.683 | |
| Pteridium caudatum (L.) Maxon. | 3.909 | 3.979 | 2.746 |
| Ehretia tinifolia L. | 5.789 | 4.240 | |
| Lysiloma latisiliquum (L.) Benth | 5.789 | 4.240 | |
| Muntingia calabura L. | 4.240 | 5.350 | |
| Piscidia piscipula (L.) Sarg. | 4.240 | 5.350 | |
| Vitis tiliifolia Humb. y Bonpl. ex Schult. | 6.646 | 2.782 | |
| Solanum americanum Mill. | 3.909 | 1.382 | 4.080 |
| Hamelia rostrata Bartl. ex DC. | 3.909 | 3.979 | 1.413 |
| Malvaviscus arboreus Cav. | 3.909 | 3.979 | 1.413 |
| Margaritopsis microdon (DC.) C.M. Taylor | 4.566 | 4.549 | |
| Turbina corymbosa (L.) Raf. | 5.801 | 1.451 | 1.448 |
| Diospyros tetrasperma Sw. | 4.240 | 4.017 | |
| Coccoloba spicata Lundell. | 4.240 | 4.017 | |
| Mimosa pudica L. | 3.909 | 2.680 | 1.413 |
| Mimosa affinis Robinson | 3.909 | 2.680 | 1.413 |
| Stizophyllum riparium (Kunth) Sandwith | 2.028 | 1.451 | 4.115 |
| Chrysophyllum cainito L. | 0.000 | 6.683 | |
| Cyrtocymura scorpioides (Lam.) H.Rob. | 3.909 | 2.680 | |
| Piper amalago (L.) | 2.679 | 0.000 | 3.520 |
| Viguiera dentata (Cav.) Spreng. | 3.979 | 1.413 | |
| Lonchocarpus rugosus Benth. | 0.000 | 5.350 | |
| Ipomoea tricolor Cav. | 2.028 | 1.451 | 1.448 |
| Machaerium cirrhiferum Pittier | 4.566 | 0.000 | |
| Mosannona depressa (Baill) Chatrou. | 4.240 | ||
| Lysiloma acapulcense (Kunth) Benth | 4.017 | ||
| Pseudolmedia glabrata (Liebm) C. Berg. | 4.017 | ||
| Agonandra macrocarpa L.O. Williams. | 4.017 | ||
| Amaranthus hybridus (L.) | 2.022 | 1.382 | 0.000 |
| Smilax spinosa Mill. | 1.451 | 1.448 | |
| Bignonia aequinoctialis L. | 2.782 | ||
| Pisonia aculeata L. | 2.782 | ||
| Cionosicys excisus (Griseb.) C. Jeffrey. | 2.028 | ||
| Randia aculeata L. | 1.951 | ||
| Manihot esculenta Crantz. | 1.951 | ||
| Euphorbia hyssopifolia L. | 1.451 | ||
| Macroptilium gibbosifolium (Ortega) A. Delgado | 1.448 | ||
| Cladium mariscus subsp. jamaicense (Crantz) Kük. | 1.382 | ||
Nota. SBI = Selva baja inundable; SMSc1-10 = Selva mediana subperennifolia de 1 a 10 años de sucesión; SMSc11-20 = Selva mediana subperennifolia de 11 a 20 años de sucesión.
Fuente: Elaboración propia.
Por otro lado, se observó que los mayores valores de diversidad de especies se encontraron en SMSc11-20 (D mg = 12.17 y H´ = 3.99), seguido de SMSc1-10 (D mg = 12.11 y H´ = 3.96) y SBI (D mg =10.51 y H´=3.80) (Tabla 3). Q0 refleja la riqueza de especies observada, siendo menor en SBI (50) en comparación con SMSc1-10 y SMSc11-20, con 62 especies cada uno. Los valores de Q1 son consistentemente más bajos que Q0, como se esperaba, debido a que Q1 tiene en cuenta la abundancia relativa. En este caso, SMSc11-20 muestra el valor más alto de Q1 (54), lo que sugiere que esta área tiene la mayor equidad en la distribución de la abundancia de especies, seguida por SMSc1-10 (52) y SBI (48).
Tabla 3 Riqueza y diversidad de especies vegetales en condiciones de selva baja inundable y selva mediana subperennifolia en Quintana Roo, México.
| SBI | SMSc1-10 | SMSc11-20 | |
| Número de especies | 50 | 62 | 62 |
| Índice de Margalef (Dmg) | 10.51 | 12.11 | 12.17 |
| Índice de Shannon (H) | 3.80 | 3.96 | 3.99 |
| Q0 | 50 | 62 | 62 |
| Q1 | 48 | 52 | 54 |
Nota. SBI = Selva baja inundable; SMSc1-10 = Selva mediana de 1 a 10 años; SMSc11-20 = Selva mediana de 11 a 20 años.
Fuente: Elaboración propia.
En cuanto a la diversidad de plantas del contenido ruminal, se encontraron 75 especies; no obstante, no fue posible identificar tres de ellas. Del total de la diversidad de plantas, 20 especies son las más importantes en la dieta de los venados debido a que conforman el 61.4% del total de plantas consumidas por los animales (Tabla 4), entre las que sobresalen Cladium mariscus subsp. jamaicense (8.59%), Thevetia ahouai (5.32%), Byrsonima bucidifolia (4.06%) y Machaerium cirrhiferum (4.03%), Dalbergia glabra (Mill.) Standl. (3.97%) y Malvaviscus arboreus Cav. (3.07%). Por otro lado, el 39.6% restante del total de especies consumidas por los venados constituyen del 1.5% a 1.0% de la composición de la dieta total (Tabla 4).
Tabla 4 Composición y aporte de materia seca por especie en la dieta del venado cola blanca en Quintana Roo, México.
| Nombre científico | Composición de
la dieta (%) |
Materia seca en
la dieta (g)* |
| Cladium mariscus subsp. jamaicense (Crantz) Kük. | 8.59 | 26.175 |
| Thevetia ahouai (L.) A. DC. | 5.32 | 16.211 |
| Byrsonima bucidifolia Standl. | 4.06 | 12.371 |
| Machaerium cirrhiferum Pittier | 4.03 | 12.280 |
| Dalbergia glabra (Mill.) Standl. | 3.97 | 12.097 |
| Malvaviscus arboreus Cav. | 3.07 | 9.355 |
| Margaritopsis microdon (DC.) C.M. Taylor | 2.81 | 8.563 |
| Vitis tiliifolia Humb. y Bonpl. ex Schult. | 2.79 | 8.502 |
| Brosimum alicastrum Sw. | 2.79 | 8.502 |
| Cyrtocymura scorpioides (Lam.) H.Rob. | 2.72 | 8.288 |
| Stizophyllum riparium (Kunth) Sandwith | 2.70 | 8.227 |
| Bauhinia divaricata L. | 2.62 | 7.984 |
| Mosannona depressa (Baill) Chatrou. | 2.39 | 7.283 |
| Alvaradoa amorphoides Liebm. | 2.12 | 6.460 |
| Bursera simaruba (L.) Sarg. | 2.08 | 6.338 |
| Serjania goniocarpa Radlk. | 1.65 | 5.028 |
| Bignonia aequinoctialis L. i | 1.59 | 4.845 |
| Manilkara zapota (L.) P. Royen. | 1.58 | 4.815 |
| Spondias radlkoferi Donn. Sm. | 1.56 | 4.754 |
| Euphorbia hyssopifolia L. | 1.51 | 4.601 |
| Dendropanax arboreus (L.) Decne. y Planch | 1.45 | 4.418 |
| Amaranthus hybridus (L.) | 1.40 | 4.266 |
| Hampea trilobata Standl. | 1.39 | 4.236 |
| Solanum americanum Mill. | 1.38 | 4.205 |
| Trema micrantha (L.) Blume. | 1.36 | 4.144 |
| Hamelia patens Jacq. | 1.36 | 4.144 |
| Piper amalago (L.) | 1.34 | 4.083 |
| Ficus lapathifolia (Liebm.) Miq. | 1.27 | 3.870 |
| Randia aculeata L. | 1.17 | 3.565 |
| Vachellia cornigera (L.) Seigler y Ebinger. | 1.15 | 3.504 |
| Carica papaya L. | 1.08 | 3.291 |
| Manihot esculenta Crantz | 1.04 | 3.169 |
| Malvastrum coromandelianum (L.) Garcke | 1.04 | 3.169 |
| Psidium sartorianum (O. Berg) Nied. | 1.03 | 3.139 |
| Pisonia aculeata L. | 0.98 | 2.986 |
| Viguiera dentata (Cav.) Spreng. | 0.96 | 2.925 |
| Platymiscium yucatanum Standl. | 0.93 | 2.834 |
| Muntingia calabura L. | 0.86 | 2.621 |
| Macroptilium gibbosifolium (Ortega) A.Delgado | 0.85 | 2.590 |
| Diospyros tetrasperma Sw. | 0.84 | 2.560 |
| Neurolaena lobata (L.) R.Br. ex Cass. | 0.77 | 2.346 |
| Sapranthus campechianus (Kunth) Standl. | 0.75 | 2.285 |
| Pseudobombax ellipticum (Kunth) Dugand. | 0.74 | 2.255 |
| Hamelia rostrata Bartl. ex DC. | 0.72 | 2.194 |
| Phyla strigulosa (M. Martens y Galeotti) Moldenke | 0.72 | 2.194 |
| Ipomoea tricolor Cav. | 0.69 | 2.103 |
| Mimosa affinis Robinson | 0.69 | 2.103 |
| Lysiloma acapulcense (Kunth) Benth | 0.67 | 2.042 |
| Ehretia tinifolia L. | 0.66 | 2.011 |
| Mimosa pudica L. | 0.66 | 2.011 |
| Cionosicys excisus (Griseb.) C. Jeffrey. | 0.62 | 1.889 |
| Vitex gaumeri Greenm | 0.60 | 1.828 |
| Melicoccus oliviformis Kunth | 0.59 | 1.798 |
| Erythroxylum confusum Britton. | 0.58 | 1.767 |
| Eugenia capuli (Schltdl. y Cham.) Hook. y Arn. | 0.57 | 1.737 |
| Agonandra macrocarpa L.O. Williams. | 0.57 | 1.737 |
| Chrysophyllum mexicanum Brandegee | 0.54 | 1.645 |
| Sideroxylon foetidissimum Jacq. | 0.51 | 1.554 |
| Pseudolmedia glabrata (Liebm.) C. C. Berg | 0.50 | 1.524 |
| Gliricidia sepium (Jacq.) Walp. | 0.47 | 1.432 |
| Cecropia peltata L. | 0.47 | 1.432 |
| Trophis racemosa (L.) Urb. | 0.45 | 1.371 |
| Casearia commersoniana Cambess. | 0.43 | 1.310 |
| Lonchocarpus guatemalensis Benth. | 0.38 | 1.158 |
| Piscidia piscipula (L.) Sarg. | 0.38 | 1.158 |
| Coccoloba spicata Ludell. | 0.31 | 0.945 |
| Turbina corymbosa (L.) Raf. | 0.31 | 0.945 |
| Doliocarpus dentatus (Aubl.) Standl. | 0.29 | 0.884 |
| Smilax spinosa Mill. | 0.29 | 0.884 |
| Swartzia cubensis (Britton y Wilson) Standl. | 0.27 | 0.823 |
| Lysiloma latisiliquum (L.) Benth | 0.25 | 0.762 |
| Lonchocarpus castilloi Standl. | 0.22 | 0.670 |
| Chrysophyllum cainito L. | 0.18 | 0.548 |
| Lonchocarpus rugosus Benth. | 0.17 | 0.518 |
| Pteridium caudatum (L.) Maxon | 0.16 | 0.488 |
*El aporte por planta se estimó con el promedio de peso húmedo y promedio de materia seca de los contenidos ruminales.
Fuente: Elaboración propia.
Las familias que aportaron mayor número de especies fueron: Fabaceae (18.31%) y Cyperaceae (8.59%), seguidas por Rubiaceae (6.74%) y Malvaceae (5.58%) (Tabla 1). Predominó el consumo de especies arbóreas (35.14%), seguidas por especies arbustivas (27.67%) y herbáceas (23.54%). Las especies trepadoras tuvieron menor representación en el consumo (13.66%).
También se observó que la diversidad de especies de plantas que consumen los venados representa el 68%, 82% y 82% de la diversidad de especies presentes en las tres condiciones de vegetación (SBI, SMSc1-10 y SMSc11-20).
Las especies encontradas en SMSc11-20 y SMSc1-10 (Figura 1a) (>0.706 [1.333; n = 75], >=1.416[2.213; n = 13]) se relacionaron con la dieta encontrada en el rumen de los venados, mientras que el IVI de SMSc11-20 tiene la mayor influencia relativa y el mayor valor de importancia en la dieta de los venados cola blanca, seguido por SMSc1-10 y SBI, respectivamente, lo que podría indicar que la población de especies de plantas está centrada en un reducido número de familias botánicas que tienen una mayor cobertura en la vegetación (42%) (Figura 1b).
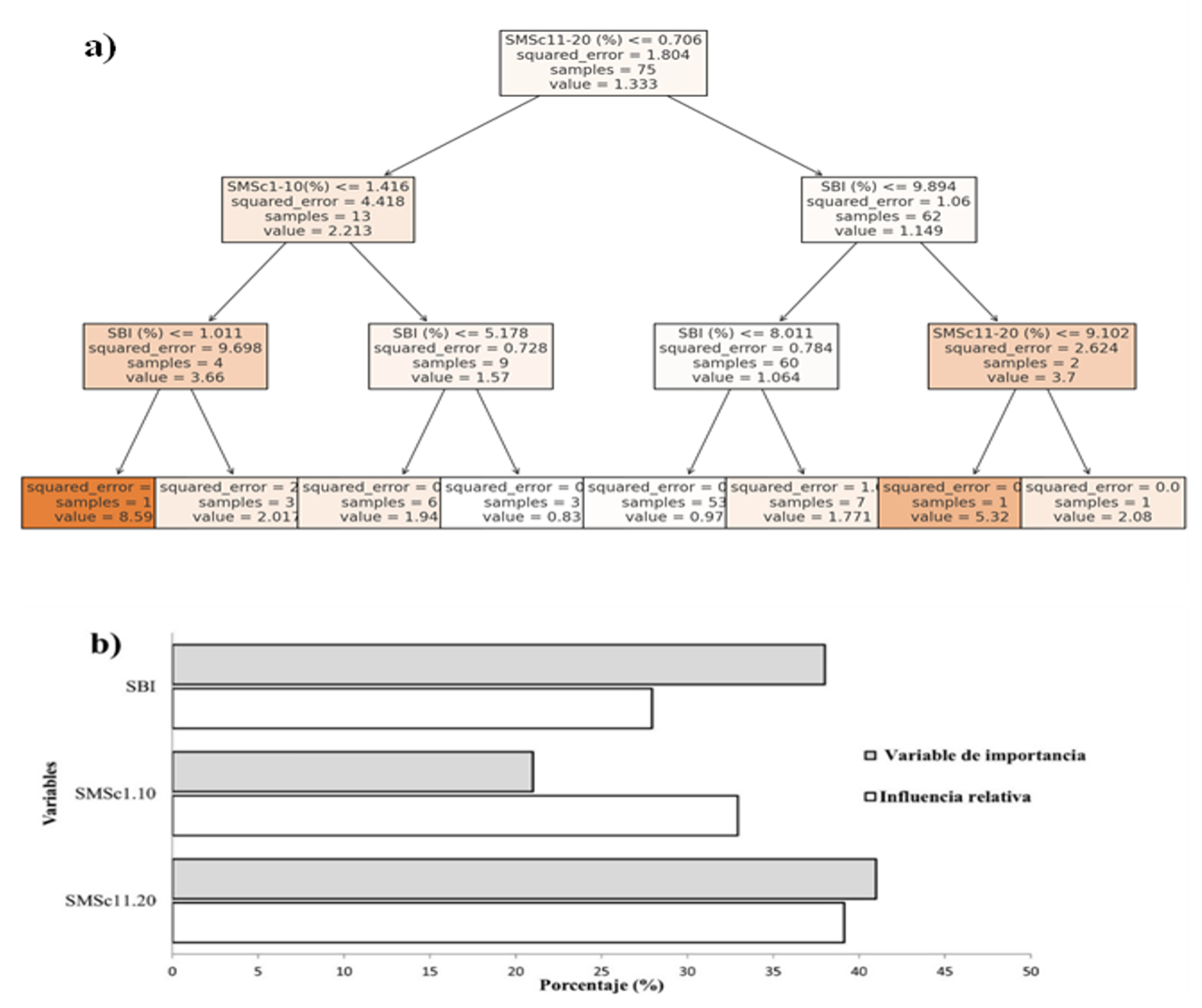
Fuente: Elaboración propia.
Figura 1 Árbol de regresión de los índices de valor de importancia (%) de cada especie de planta encontrada en SBI, SMSc1-10 y SMSc11-20sobre (a) el porcentaje de consumo en la dieta (%) y (b) la influencia del índice de importancia (%) de las especies de plantas en SBI, SMSc1-10 y SMSc11-20 sobre la diversidad de especies consumidas por los venados cola blanca.
Discusión
La información obtenida en los tres estratos de vegetación selvática muestra una correspondencia con la riqueza florística reportada para selvas tropicales, en cuanto a sus caracteres estructurales, que incluyen sus diferentes asociaciones vegetales (Boufennara et al., 2012; Williams et al., 2017). Resultados similares encontraron Navarro-Martínez et al. (2012), quienes señalan un total de 71 especies de plantas en la selva mediana subperenifolia de la Reserva de la Biosfera de Sian Ka´an, mientras que Sosa et al. (2000) registraron 59 especies en la vegetación secundaria de 1 a 5 años en Bacalar, Quintana Roo. Estas aparentes diferencias dentro de la misma región pueden atribuirse a las distintas condiciones de conservación y edad de recuperación de la vegetación estudiada. Por otro lado, nuestros hallazgos son inferiores a los reportados por Tun-Dzul et al. (2008), quienes reportan un total de 105 especies de plantas en bajos inundables, así como a los de Guadarrama et al. (2018), quienes señalan 199 especies en selvas bajas inundables y manglares del estado de Yucatán. Por su parte, Dzib-Castillo et al. (2014) indican un total de 83 especies de plantas en selvas medianas y bajas; igualmente, Chan (2010) reporta hasta 113 especies presentes en la Reserva de la Biosfera de Calakmul, Campeche. También son ligeramente inferiores a los valores reportados para las selvas del Estado de Quintana Roo, donde se reporta un total de 86 hasta 106 especies (Tadeo-Noble et al., 2019).
Del total de especies vegetales se destaca la alta correspondencia del conocimiento local de los agricultores sobre la flora que utilizan los venados para su dieta, ya que el 100% de especies reportadas por los guías de campo como especies que consumen los venados se encontraron presentes en los contenidos del rumen de los animales. El conocimiento que posee la gente local sobre plantas alimenticias para la fauna silvestre es fundamental para estudios sobre dietas y forraje de origen silvestre (Castañeda et al., 2014); sin embargo, existen pocos estudios que abordan el tema. Los cazadores de subsistencia usan el conocimiento de plantas que consume la fauna para rastrear o asechar las presas (Ramírez-Barajas & Naranjo-Piñera (2007). En específico, este amplio conocimiento de la selva y su composición florística lo emplean los agricultores mayas como estrategia de cacería para atraer fauna silvestre a sus cultivos o milpa (Ramírez-Barajas & Calmé, 2015; Santos-Fita et al., 2013) y complementar su dieta a través de la obtención de proteína animal (García-Flores et al., 2021; Santos-Fita et al. 2013).
Asimismo, se ha identificado que alrededor del 65% de los árboles de la selva tiene un uso alimenticio para la fauna, particularmente para herbívoros y omnívoros que dependen de partes de plantas para su alimentación (flores, frutos, semillas, tallos, hojas) (Ramírez-Barajas et al., 2012a, 2012b; Ramírez-Barajas & Calmé, 2015). Este conocimiento sobre la flora también podría jugar un papel importante en las estrategias de manejo del hábitat y para la recuperación y restauración de las selvas tropicales, lo que permite el mantenimiento de servicios ambientales, como la provisión de alimento, la dispersión de semillas, la polinización y el aporte de recursos maderables y medicinales para las familias campesinas (Guadarrama et al., 2018; Ramírez-Barajas et al., 2012b; Sánchez-Sánchez et al., 2015).
Por otro lado, la dominancia de especies de plantas pertenecientes a la familia Fabáceas no es distinta a otros estudios, como el reportado por Tadeo-Noble et al. (2019), quienes señalan el dominio de las familias Fabaceae, Rubiaceae, Malvaceae y Sapotaceae en las selvas de Quintana Roo, México. Estas mismas familias dominan en las selvas de Campeche, México (Dzib-Castillo et al., 2014; Zamora-Crescencio et al., 2017). Esta coincidencia podría obedecer a que la Península de Yucatán está compuesta por un mosaico de comunidades vegetales muy similar (Pérez-Sarabia et al., 2017), y la dominancia de la familia Fabaceae (n = 16) puede atribuirse a la capacidad de regeneración que tienen las especies de esta familia. Esto ocurre a partir de rebrotes desde sus tocones y su capacidad de adaptación, mismas que han evolucionado a lo largo del tiempo, resistiendo a actividades antropogénicas y cambios drásticos en las condiciones medio ambientales, lo que puede justificar el mayor aporte de esta familia (Chan, 2010; Pennington et al., 2009).
La mayor frecuencia de especies de árboles y arbustos que consume el venado cola blanca puede estar relacionado a sus hábitos de forrajeo, tal como reporta Weber (2014), quien indica que el venado cola blanca es un ramoneador nato que prefiere árboles y arbustos, pero además puede llegar a consumir especies vegetales herbáceas y trepadoras, de acuerdo con la disponibilidad de estas a lo largo del año y las condiciones del hábitat presente.
La dominancia y el valor de importancia de las especies presentes en la SBI puede atribuirse a las condiciones particulares presentes en el sitio. Por ejemplo, debido a que el muestreo se realizó en la época de lluvias, la SBI estaba inundada, y en estas condiciones muchas especies de plantas no adaptadas a la anoxia radicular no pueden sobrevivir (Albor et al., 2017; Moreno-Casasola & Infante-Mata, 2009), por lo que dominan las pocas especies que pueden sobrevivir.
Los valores son distintos a los reportados para las SBI en Yucatán, donde Martínez-Gauna (2021) reporta como especies dominantes a Piscidia piscipula, Lysiloma Latisiliquum y Bursera simaruba. En contraste, en el caso de las selvas medianas, como fue el caso de la SMSc1-10, nuestros hallazgos concuerdan con lo reportado por Pat-Aké et al. (2018), quienes indican que las especies con mayor IVI son de Dendropanax arboreus y Vitex gaumeri. De igual manera, nuestros hallazgos en la SMSc11-20 coinciden con lo reportado por Martínez-Gauna (2021), quien indica que en una selva mediana de 10 a 30 años de Yucatán las especies dominantes y de mayor importancia son Pisicidia piscipula y Lonchocarpus guatemalensis. Asimismo, coinciden con los hallazgos de Carreón-Santos & Valdez-Hernández (2014) y Tadeo-Noble et al. (2019), quienes encontraron que B. simaruba es la especie de mayor valor de importancia (IVI:16.6) en la selva mediana en Quintana Roo, México.
Por otro lado, la mayor diversidad observada en la SMSc11-20 podría estar relacionada a un mayor grado de conservación, con respecto a las otras condiciones; esto se respalda con los valores de Q1 en SMSc11-20. En esta vegetación se registró el mayor Q1, lo que sugiere que esta área tiene la mayor equidad en la distribución de la abundancia de especies, dado que a mayor grado de conservación es menor la competencia por nutrientes del suelo entre las especies que conforman un estrato vegetal (Pat-Aké et al., 2018).
El incremento en los valores de la diversidad de especies (Dmg), a medida que aumenta la edad de recuperación del estrato vegetal, coincide con lo encontrado por Puc-Kauil (2014) en dos selvas secundarias (siete y 15 años) del estado de Quintana Roo. El autor reporta valores de Dmg de 2.38 y 3.27, respectivamente, y lo asocia al grado de perturbación por efecto de actividades humanas y medioambientales; ya que estos factores pueden llegar a determinar la composición y estructura de las comunidades vegetales (García-Montiel, 2002).
Por otro lado, nuestros resultados son superiores a los previamente reportados para selvas medianas en Campeche (H´= 2.28) y Quintana Roo (H´= 3.48) (Gutiérrez-Báez et al., 2013; Tadeo-Noble et al., 2019). Con respecto a la SBI, los valores aquí encontrados también son superiores a lo reportado por Tun-Dzul et al. (2008) en bajos inundables de la Península de Yucatán (H´= 3.02) y en selva inundable de Tabasco con un H´ = 2.01 (Maldonado-Sánchez et al., 2016).
La mayor diversidad de especies encontradas en los sitios de estudio pudo contribuir en una mayor oferta para el consumo de los venados cola blanca. Esto se refleja en una mayor cantidad de especies (75 especies, Tabla 4) encontradas en el contenido ruminal, lo cual es superior a lo reportado por otros estudios que analizan los contenidos ruminales del venado cola blanca en condiciones de selva tropical. Al respecto, Weber (2014) encontró solo 26 especies en la dieta de venados cola blanca, mientras que DiMare (1994) reporta consumos de 40 especies.
Adicionalmente, nuestros hallazgos superan la composición de la dieta de venados cola blanca en condiciones de bosque natural o de áreas con matorral y pastizal. En este sentido, Navarro-Cardona (2018) reporta 25 especies en la dieta del venado cola blanca en un bosque con encino y pastizales, y Olguín et al. (2017) reportan 17 especies en condiciones de mezquitales, pastizales y matorral espinoso. Por su parte, Lozano et al. (2020) señalan 39 especies en la dieta de venados cola blanca en Chihuahua, México.
El mayor número de especies potencialmente consumidas por los venados en este estudio (75 especies) pudo estar influenciado por las condiciones del hábitat y por la estacionalidad climática al momento de realizar el estudio, ya que la selección del alimento por los animales puede cambiar debido a estos factores (Ramírez-Lozano, 2004) o por los requerimientos específicos según la condición y necesidades nutricionales del animal (Villarreal-Espino et al., 2011).
Es importante destacar que, de las especies vegetales encontradas con mayor porcentaje (15 especies, Tabla 4), y que conforman el 52% del total de la dieta de los animales, no todas han sido previamente reportadas como especies de plantas predominantes en el consumo del venado cola blanca; por ello, estos hallazgos podrían incentivar estudios ecológicos y biológicos más detallados sobre la alimentación del venado cola blanca, junto con el manejo y la preservación de estas especies de plantas en la selva tropical, con el fin de procurar su conservación.
Es probable que la estacionalidad climática en la región haya ejercido alguna influencia en la composición de la dieta de los animales. Durante la época de lluvia se presenta un mayor número de especies, sobre todo especies estacionales del estrato herbáceo y enredaderas. Así mismo, se generan mayores rebrotes de las especies arbóreas, lo cual pudo mejorar la oferta en cantidad, diversidad y calidad nutricional para los animales (Carreón-Santos & Valdez-Hernández, 2014), ejerciendo una mayor selección en su alimentación y consumiendo plantas con mayor aporte nutricional, abundancia y palatabilidad (Weber, 2014). Esto posiblemente explique por qué los resultados encontrados son diferentes a lo reportado por Weber (2008) en la Reserva de Calakmul, Campeche. Este autor reporta la preferencia del venado cola blanca hacia la especie Eugenia ssp., mientras que Olguín et al. (2017) indican que las especies Leucophyllum frutescens (Berland.), Solanum nigrum y Acacia berlandieri Benth son las de mayor consumo de este ungulado en mezquitales, pastizales y matorral espinoso del estado de Tamaulipas.
La mayor preferencia en el consumo hacia cuatro familias encontradas en este trabajo puede atribuirse al mayor número de especies que las conforman y a la disponibilidad de forraje que estas ofertan (Figura 1a y 1b), ya que el venado cola blanca es un ramoneador que consume gran variedad de recursos vegetales con diferentes formas de vida, tales como árboles, arbustos, herbáceas y trepadoras (Tabla 6) (Aguilera-Reyes et al., 2013). En este sentido, la utilización de los recursos arbóreos y arbustivos está asociado a la época del año, aumentando en verano (Lozano et al., 2020) y disminuyendo en la época de seca el consumo de las herbáceas y trepadoras (Ramírez-Lozano, 2004).
Estos resultados apuntan al importante papel que puede tener el manejo y cuidado de las selvas tropicales para la preservación de la población de venados cola blanca, debido a la gran diversidad de plantas factibles de utilizarse en la alimentación de estos animales, y potencialmente también para otros rumiantes silvestres y domésticos. En este sentido, el estudio con venado cola blanca podría servir como un buen indicador del aporte de la diversidad de especies silvestres, ya que este ungulado consume mayormente árboles y arbustos con una dominancia de las familias Fabaceae, Cyperaceae, Rubiaceae y Malvaceae, entre las cuales existe un mayor consumo de las plantas Cladium mariscus subsp. jamaicense, Thevetia ahouai, Byrsonima bucidifolia y Machaerium cirrhiferum, especies que no han sido reportadas previamente como predominantes en el consumo del cérvido, por lo que estos hallazgos podrían estimular un mayor interés sobre el manejo sustentable y preservación de las especies de plantas en las selvas tropicales.
Conclusiones
La selva mediana subperennifolia y la selva baja inundable aportan una gran diversidad de especies forrajeras para la dieta del venado cola blanca provenientes principalmente de las familias Fabaceae, Cyperacea, Rubiaceae y Malvaceae, entre las que sobresalen las especies Cladium mariscus subsp. jamaicense, Thevetia ahouai, Byrsonima bucidifolia, Machaerium cirrhiferum, Dalbergia glabra, Malvaviscus arboreus, Margaritopsis microdon, Vitis tiliifolia, Brosimum alicastrum, Cyrtocymura scorpioides, Stizophyllum riparium y Bauhinia divaricata. Asimismo, el conocimiento local de plantas alimenticias para el venado cola blanca y la corroboración mediante el análisis histológico en la dieta de este ungulado silvestre permite que potencialmente puedan ser usadas como forraje para la dieta de ungulados domésticos; sin embargo, es necesario realizar más investigación sobre la palatabilidad, la propagación y las propiedades de metabolitos secundarios.
Conflicto de interés
Los autores declaran que no existe conflicto de intereses con respecto a esta publicación.











 nueva página del texto (beta)
nueva página del texto (beta)


