Introducción
El comportamiento fisicoquímico de los suelos salinos y aguas de riego es determinado por los tipos y cantidades de sales presentes en el sistema suelo-agua (Kovda, 1977; Szabolcs, 1994). La concentración salina controla el potencial osmótico (Ψπ) de la solución del suelo y de las aguas de riego (Can-Chulim, Ortega-Escobar, Sánchez-Bernal & Cruz-Crespo, 2014). En este sentido, Strogonov (1964) señala que el Ψπ de la solución del suelo está relacionado con la velocidad de absorción de agua por las plantas. También, se ha comprobado que a concentraciones salinas > 2.56 g L-1 en la solución del suelo, el Ψπ desciende y el crecimiento y desarrollo de las plantas glicófitas disminuye. Ante el estrés osmótico e hídrico salino, algunas especies vegetales cultivadas poco tolerantes a sales padecen sequía fisiológica y reducen su germinación, crecimiento y rendimiento hasta en 50% (Goykovic, Nina & Calle, 2014; Mugdal, Madaan & Mugdal, 2010).
Para estudiar el efecto osmótico producido por las sales se han propuesto varios métodos de evaluación del Ѱπ, en forma alterna al uso de un osmómetro. Estos métodos ayudan en la obtención de resultados válidos para un diagnóstico preciso de los efectos de la salinidad en las fincas agroproductivas.
En el Manual 60 del Laboratorio de Salinidad de los Estados Unidos de América (Richards, 1985) se estiman valores de presión osmótica (π) para diversas soluciones salinas de muchos suelos y aguas con base en valores de conductividad eléctrica (CE). Este parámetro tiene relación con la presión osmótica a través de la igualdad ( (atm) = 0.36 xCE. La relación entre ( y CE ha sido útil en el manejo de suelos agrícolas.
Para el estudio de relaciones hídricas en el sistema suelo-planta se ha considerado
apropiado evaluar el Ѱπ producido por las sales en las soluciones acuosas de los
suelos, aguas y plantas (Maldonado, Pujado &
Squeo, 2002). La expresión matemática de dicho potencial tiene valores
negativos de π y generalmente sus unidades son MPa, por ello la ecuación se escribe
de la siguiente forma: Ѱπ = -0.036 x CE. Diversos investigadores como Ramírez, Ortega, Rodríguez, Ramírez & Rone
(1989) y Sánchez-Bernal &
Ortega-Escobar (2011) consideran que, para realizar estudios del
comportamiento del potencial osmótico en soluciones de suelos y aguas, es
conveniente entender el fenómeno a partir de constantes de proporcionalidad, en los
cuales las relaciones
El objetivo del presente estudio fue determinar los coeficientes osmóticos de quince extractos de suelo y quince muestras de aguas de riego del valle costero de Oaxaca que, multiplicados por los STD de dichas muestras, arrojen los Ѱπ de cada solución, para compararlos con los determinados a partir de la relación Ψπ = -0.036 x CE. Las ecuaciones de regresión lineal y la gráfica correspondiente permitirán simular los valores de potencial osmótico de estas soluciones salinas de acuerdo con su composición química y determinar la intensidad con que la solución del suelo o las aguas de riego generan estrés hídrico en los cultivos o, en su caso, un efecto esencialmente tóxico.
Lo anterior debe comprobar la hipótesis de que la sal, cloruro de sodio (NaCl), principal constituyente de soluciones de suelos y aguas de riego de la planicie costera, disminuye con intensidad el Ѱπ debido a sus propiedades químicas. Con base en los resultados, se proponen medidas para el control de la salinidad en suelos y aguas de la llanura costera de Oaxaca, afectados por este factor abiótico, de común ocurrencia en otras regiones costeras del planeta.
Fundamento teórico
El movimiento de agua del suelo hacia las raíces mediante ósmosis trata de la entrada de agua a las células radicales a través de membranas selectivas (Peña, 2004). La π generada mantiene el equilibrio hídrico en el sistema y es cuantificable mediante modelos termodinámicos (Griffin & Jurinak, 1973; Mujlionov, Averbuj, Furmer & Tumarkina, 1985). El movimiento está influido por gradientes de potencial químico. El agua se mueve de una zona de elevado potencial químico o alta energía libre a otra de bajo potencial químico y se evalúa mediante la ecuación de Gibbs (Cancino, Ulloa & Astudillo, 2009; Del Castillo, 2003):
donde:
μ = |
potencial químico del agua; |
μ* = |
potencial químico del agua pura; |
R = |
constante universal de los gases (0.08206 atm·L∙(mol K)-1; |
T = |
temperatura absoluta de la solución (K); |
C = |
concentración efectiva (substituida por actividad cuando se discuten relaciones hídricas de las plantas); |
P = |
presión sobre el potencial químico (tratándose de presión hidrostática de la célula vegetal, P es la diferencia entre la presión actual y la presión atmosférica); y |
V = |
volumen molar parcial o volumen ocupado por una especie química. |
Existe una relación directa entre el incremento de concentración de solutos en
solución y el aumento de la presión osmótica que, a su vez, es inversamente
proporcional a la actividad química del agua (∆w). Por ello, la adición de
soluto disminuye la ∆w, es decir, disminuye la fracción molar de agua
susceptible de realizar actividad química. La relación entre presión osmótica,
actividad química del agua y fracción molar del agua se expresa en la ecuación
de Van´tHoff (Del Castillo, 2003) como
sigue:
El μw es útil para entender las relaciones hídricas suelo-planta-atmósfera y a nivel celular, pues define la cantidad de trabajo que realiza el agua en un lugar determinado, comparado con el agua pura a presión atmosférica, a la misma temperatura. Este potencial también se expresa como potencial hídrico (Ψ), que resulta de la diferencia entre la presión hidrostática y la presión osmótica (Slatyer & Taylor, 1960). El agua siempre se mueve de una región de alto potencial hídrico a una de bajo potencial hídrico (Aziz & Khan, 2001; Shinozaki & Yamaguchi-Shinozaki, 2007). La ecuación que cuantifica este potencial es la siguiente:
donde:
Ψ = |
potencial hídrico; |
μw = |
potencial químico del agua en solución; y |
μw* = |
potencial químico del agua pura. |
El Ψ del agua pura en Pascales o Joules = 0. En el suelo, sus componentes Ψπ,
potencial matricial (Ψm) y potencial de gravedad (Ψg) adquieren valores
negativos; el osmótico porque disminuye conforme aumenta la concentración de
solutos en la solución del suelo, el matricial debido a la adsorción de
moléculas de agua en las micelas coloidales del suelo, siempre que se trate de
flujos de agua en suelos no saturados (Hillel,
1998), y el de gravedad por la atracción del agua hacia el centro de
la Tierra (considerado solo en estudios de conductividad hidráulica y del nivel
de referencia que se escoja para analizar el sistema suelo-agua). Esta es la
razón por la que el Ѱ = Ѱπ + Ѱm. En lo fundamental, el Ѱπ de soluciones acuosas
indica que el agua se mueve de una región de Ѱπ menos negativo a una de Ѱπ más
negativo, y se calcula mediante el uso de un psicrómetro termopar o un osmómetro
(Cárdenas & Villegas, 2002; Dodd & Donovan, 1999), o mediante la
igualdad propuesta por el Departamento de Agricultura de los Estados Unidos Ѱπ =
-0.36 x CE, cuyo resultado en atmósferas dividido entre 10 arroja valores en MPa
(Richards, 1985). El presente estudio
utilizó un modelo de predicción del potencial osmótico con base en las
relaciones de proporcionalidad:
donde:
K3 = |
Constante de proporcionalidad o Coeficiente osmótico; |
CE = |
conductividad eléctrica (dS m-1); y |
STD = |
sólidos totales disueltos (mg L-1). |
De acuerdo con Ramírez et al. (1989), este método determina con mucha aproximación los valores de Ψπ de extractos de suelos y aguas de riego de diversa composición química. Su nomograma de estado permite identificar el efecto osmótico o tóxico que producen las sales de soluciones acuosas en los suelos y en las plantas.
Materiales y Métodos
Área de estudio
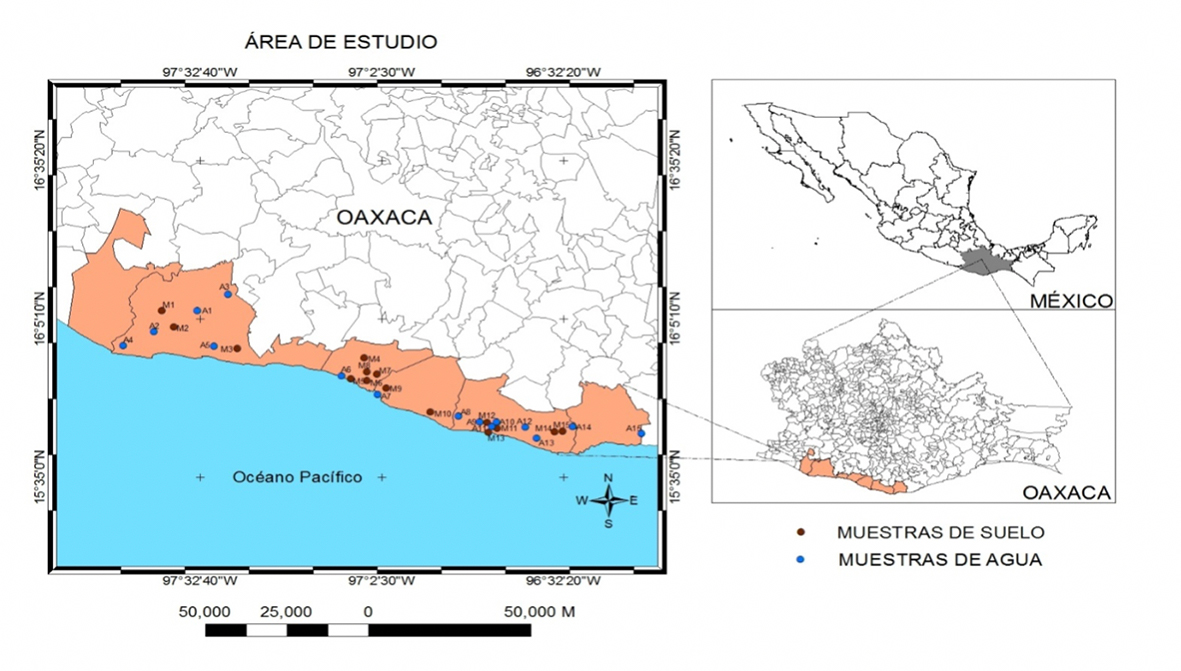
En un transecto longitudinal de 250 km con dirección oeste-este, entre las coordenadas 16° 02’ 6.7” N, 97° 25’ 32.45” O, y 15° 42’15” N, 96° 18’ 04” O, se realizó un muestreo aleatorio de suelos y aguas desde el Distrito de Riego 110 Río Verde, en Tututepec, hasta la zona de cultivos conocida como Bajos de Coyula, Municipio de Santa María Huatulco, en la planicie costera de Oaxaca (Figura 1).
La franja en estudio colinda al norte con las estribaciones de la Sierra Madre del Sur y al sur con el Océano Pacífico. Son terrenos de bajo relieve con altura de 12 m snm a 75 m snm, pendiente de 2% a 5% y hasta de 25% (en lomeríos). Su drenaje es dendrítico con salida al mar. Los suelos de aluvión, formados por acumulaciones sucesivas de depósitos sedimentarios en distintas épocas geológicas, son de tipo litosol en el piedemonte, regosol eutrico y cambisol en la llanura costera y cubren rocas de la formación Xolapa de edad Paleozóica (Tolson, 2005). El clima es cálido subhúmedo con lluvias en verano de menor humedad Aw0 (w). La temperatura media anual es de 27 °C, con una máxima en mayo de 29.4 °C y una mínima en enero de 25.5 °C. La precipitación total anual es de 1057.8 mm, y el periodo de lluvias se distribuye de mayo a noviembre. La vegetación es selva baja caducifolia intensamente perturbada por apertura de tierras a la agricultura y a la ganadería extensiva, para lo cual se usan aguas de los ríos Verde, Colotepec, Cozoaltepec, Tonameca y Copalita, los cuales avenan las cuencas del mismo nombre, así como aguas de pozos noria y profundos.
La zona presenta manchones de pastizales, zonas con vegetación secundaria y áreas de manglar que sufren los embates de la actividad agroproductiva y de asentamientos humanos. La vegetación arbustiva que todavía se observa en la zona consiste de palo mulato (Bursera simaruba), ébano (Lysiloma acapulcense), ceiba (Ceiba pentandra), palo de cucharitas (Trichillia havaniensis), ramón (Brosimum allicastrum), palo armadillo (Aphanante monoica), guanacastle (Enterolobium cyclocarpum), cuajilote (Parmentiera aculeata), cobano (Swietenia humilus), haba de Guatemala (Huria poliandra), palo de rosa (Tabebuia rosea), zapote (Vitex mollis), cuernitos (Acacia cornígera), y árbol de cucharitas (Acacia cochilacanta). Además, se encuentran matorrales arbustivos de cacajo de caballo (Andira inermes), jocote (Spondia ssp.), palo de hormigas (Cordia alliodora) y ficus (Ficus sp.), las cuales tiran sus hojas en época de estiaje. En manchones salinos se observa vegetación halófita como mangle negro (Aviccenia germinans L.), romerito (Suaeda torreyana S.) y ejemplares de nopal (Opuntia sp.). Los cultivos representativos de la zona son maíz (Zea mays L.), sorgo (Sorgum vulgare L.), albahaca (Ocimum bacilicum L.), tomillo (Tymus vulgaris L.), eneldo (Anethum graveolans L.), papaya (Garica papaya L.), cacahuate (Arachys hipogea L.) y jamaica (Hybiscus jamaica L.) (Instituto Nacional de Estadística, Geografía e Informática [INEGI], 2004).
Muestreo y análisis de suelos y aguas
En la primavera de 2013, se establecieron al azar quince monolitos de suelo a lo largo de la planicie costera. Su localización se indica en la Tabla 1. Para determinar la distribución salina en el espesor edáfico, 0 cm-60 cm, se colectaron muestras de suelo en espesores de 20 cm, lo que arrojó tres muestras por monolito y un total de cuarenta y cinco muestras que fueron secadas al aire libre, tamizadas en mallas de 2 mm de diámetro.
Tabla 1 Parámetros fisicoquímicos de extractos de suelos colectados en la planicie costera de Oaxaca.
| No. De Perfil |
Loc. | Alt | Espesor de suelo |
pH | CE (dS m-1) |
Ψπ* (MPa) |
STD | PSI % |
RAS (mmolc L-1) 1/2 |
Textura | Tipo de suelo |
Uso del suelo |
Parámetros estadísticos |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (msnm) | (cm) | (mg L-1) | CE | Ψπ | ||||||||||
| 1.
B1B3 Dto. Riego Río Verde |
16° 06’ 42.45” N/97° 38’ 58.22” O | 22 | 0-20 | 7.5 | 3.74 a/2 | -0.13 a/4 | 2369 | 0.31 | 1.07 | Limo-Arcillosa | Cambisol eutrico | Pastizal Dto. de riego Río Verde | M = 3.21 | M = -0.11 |
| 20-40 | 7.6 | 3.04 a | -0.11 a | 1875 | 0.3 | 1.06 | σ = 0.46 | Σ = 0.01 | ||||||
| 40-60 | 7.5 | 2.85 a | -0.10 a | 1800 | 0.4 | 0.58 | CV = 0.14 | CV = -0.09 | ||||||
| 2.
A1B3 Dto. Riego Río Verde |
16° 03’ 33.9” N/ 97° 36’ 59.57” O | 22 | 0-20 | 7.4 | 6.5 a | -0.23 a | 4148 | 26.91 | 25.82 | Limo-Arcillosa | Cambisol eutrico | Parcela
agrícola Dto. de riego Río Verde |
M = 5.6 | M = -0.2 |
| 20-40 | 7.7 | 6.3 a | -0.23 a | 4084 | 21.49 | 19.42 | σ = 1.38 | σ = 0.05 | ||||||
| 40-60 | 7.8 | 4.0 a | -0.14 a | 2796 | 21.3 | 19.21 | CV = 0.24 | CV = 0.47 | ||||||
| 3.
B1B3 Cultivares Río Grande |
15° 59’ 30” N/97° 26’ 28.49” O | 25 | 0-20 | 6.8 | 0.13 a | 0.00 a | 95 | 4.39 | 3.97 | Franca (Areno-limoso) | Regosol eutrico | Parcela
agrícola Río Grande |
M = 0.22 | M = 0 |
| 20-40 | 6.1 | 0.19 a | 0.00 a | 124 | 2.2 | 2.38 | σ = 0.13 | σ = 0 | ||||||
| 40-60 | 6.3 | 0.13 a | 0.00 a | 86 | 1.57 | 1.64 | CV = 0.61 | CV = 0 | ||||||
| 4.
B1B3 Pastizal San Pedro Mixtepec |
15° 57’ 42” N/97° 05’ 20.1” O | 96 | 0-20 | 6.8 | 0.40a | -0.01ª | 202 | 0.49 | 1.19 | Franco-arenosa | Regosol eutrico | Pastizal
Ranchería EL Guarumbo |
M = 0.22 | M = 0.00 |
| 20-40 | 6.2 | 0.13a | 0.00a | 68 | 0 | 0.26 | σ = 0.15 | σ = 0.00 | ||||||
| 40-60 | 6.5 | 0.13a | 0.00a | 69 | 0 | 0.3 | C V = 0.68 | CV = 0.00 | ||||||
| 5.
B1B3 Parcela Bajos de Chila |
15° 53’ 45.42” N/97° 07’ 36” O | 23 | 0-20 | 7.6 | 0.14a | 0.00a | 89.6 | 0 | 0.44 | Franco-arenosa | Regosol eutrico | Parcela
agrícola Bajos de Chila |
M = 0.11 | M = 0.00 |
| 20-40 | 7 | 0.11a | 0.00a | 70.4 | 0 | 0.26 | σ = 0.03 | σ = 0.00 | ||||||
| 40-60 | 7.2 | 0.08a | 0.00a | 51.2 | 0 | 0.17 | CV = 0.27 | CV = 0.00 | ||||||
| 6.
B1B3 Jardín botánico Puerto Escondido |
15° 54.1’ 41.75” N/97°04’ 29.21” O | 85 | 0-20 | 6.7 | 1.13a | -0.04ª | 512 | 0.21 | 1 | Migajón-arenosa | Litosol | Forestal
Jardín botánico Puerto Escondido |
M = 0.75 | M = -0-02 |
| 20-40 | 7 | 0.77a | -0.02a | 492 | 0 | 0 | σ = 0.41 | σ = -0.01 | ||||||
| 40-60 | 6.6 | 0.45a | -0.01ª | 290 | 0 | 0 | CV = 0.54 | CV = 0.50 | ||||||
| 7.B1B3 Jardín botánico Puerto Escondido |
15° 54’ 54.02” N/97° 04’52.93” W | 80 | 0-20 | 6.8 | 1.15a | -0.04ª | 636 | 0 | 0.17 | Arena-migajonosa | Litosol | Forestal
Jardín Botánico Puerto Escondido |
M = 0.53 | M = -0.02 |
| 20-40 | 7.6 | 0.39a | -0.01a | 249 | 0 | 0.08 | σ = 0.41 | σ = -0.01 | ||||||
| 40-60 | 6.4 | 0.30a | -0.01ª | 192 | 0 | 0.08 | CV = 0.77 | CV = 0.50 | ||||||
| 8.B1B3
Jardín botánico Puerto Escondido |
15° 55’ 1.06” N/97°04’52.93” W | 75 | 0-20 | 7 | 0.60a | -0.02ª | 380 | 0 | 0.18 | Arena-migajonosa | Litosol | Forestal
Jardín Botánico Puerto Escondido |
M = 0.42 | M = -0.01 |
| 20-40 | 6.9 | 0.40a | -0.01a | 256 | 0 | 0.23 | σ = 0.16 | σ = -0.01 | ||||||
| 40-60 | 6.1 | 0.27a | 0.00a | 172 | 0 | 0 | CV = 0.38 | CV = 1.00 | ||||||
| 9.
A1 B3 Barra Colotepec |
15° 51’ 58.47” N/97° 01’ 45.33” O | 20 | 0-20 | 7 | 13.64 a | -0.49 a | 8660 | 46 | 59 | Franco-limosa | Solonchak | Terreno eriazo | M = 8.21 | M = -0.29 |
| 20-40 | 7 | 5.90 b | -0.21 b | 3752 | 36 | 39 | (mancha salina) | σ = 4.71 | σ = 0.17 | |||||
| 40-60 | 7 | 5.11 b | -0.18 b | 3270 | 34 | 36 | CV = 0.57 | CV = 0.58 | ||||||
| 10
B1B3 Cozoaltepec |
15° 49’ 00” N/97° 1’ 44” O | 80 | 0-20 | 6 | 0.40ª | -0.01ª | 202 | 0 | 1 | Areno-limosa | Regosoleutrico | Parcela agrícola | M = 0-22 | M = 0 |
| 20-40 | 6 | 0.13ª | 0.00a | 68 | 0-43 | 1 | σ = 0.15 | σ = 0 | ||||||
| 40-60 | 6 | 0.13a | 0.00a | 69 | 0 | 1 | CV = 0.68 | CV = 0 | ||||||
| 11
A1*A3* Laguna La Salina |
15° 43’ 37.6” N/96° 44’ 25.32” O | 11 | (0-20] | 7 | 88.90 a | -3.24 a | 30056 | 57 | 92 | Migajón-arenoso | Solonchak | Sedimentos lacustres | M = 54.73 | M = -2.11 |
| (20-40] | 7 | 43.20 b | -1.57 b | 22060 | 46 | 58 | σ = 30.10 | σ = 0.97 | ||||||
| (40-60] | 7 | 32.09 b | -1.54 b | 18716 | 50 | 68 | CV = 0.55 | CV = 0.46 | ||||||
| 12
A1A3* Laguna La Salina |
15° 43’ 48.8” N/96° 44’ 46.9” O | 12 | (0-20] | 7 | 30.43 a | -1.10 a | 13492 | 41 | 48 | Arena-Migajón | Solonchak | Sedimentos lacustres | M = 24.41 | M = -0.88 |
| (20-40] | 7 | 22.74 a | -0.83 a | 12456 | 37 | 41 | σ = 5.37 | σ = 0.19 | ||||||
| (40-60] | 8 | 20.08 a | -0.73 a | 10956 | 36 | 39 | CV = 0.22 | CV = 0.21 | ||||||
| 13.
B1B3 Escobilla |
15° 44’ 23”/96° 45’ 40” O | 59 | (0-20] | 6 | 0.38 a | -0.01 a | 243 | 1 | 1 | Franco-arenosa | Regosoleutrico | Parcela agrícola | M = 0.33 | M = -0.01 |
| (20-40] | 7 | 0.30 a | -0.01 a | 190 | 0 | 1 | σ = 0.04 | σ = 0.00 | ||||||
| (40-60] | 7 | 0.32 a | -0.01 a | 230 | 0 | 0 | CV = 0.12 | CV = 0.00 | ||||||
| 14.
B1B3 San Isidro |
15° 43’ 37” N/ 96°33’ 47” O | 25 | (0-20] | 6 | 1.13 a | -0.04 a | 723 | 3 | 3 | Franco-arenosa | Regosoleutrico | Parcela agrícola | M = 0.70 | M = -0.02 |
| (20-40] | 7 | 0.54 a | -0.01 a | 345 | 2 | 2 | σ = 0.36 | σ = 0.01 | ||||||
| (40-60] | 7 | 0.45 a | -0.01 a | 288 | 2 | 2 | CV = 0.52 | CV = 0.86 | ||||||
| 15.B1B3 La Florida |
15° 43’ 45.21” N/96° 32’ 24.63” O | 30 | (0-20] | 8 | 0.15 a | 0.00 a | 96 | 0 | 0 | Franco-arcillo-arenoso | Regosoleutrico | Agroforestal | M = 0.11 | M = 0 |
| (20-40] | 7 | 0.10 a | 0.00 a | 64 | 0 | 0 | σ = 0.02 | σ = 0 | ||||||
| (40-60] | 7 | 0.10 a | 0.00 a | 64 | 0 | 0 | CV= 0.26 | CV = 0 | ||||||
1Prueba de medias entre perfiles de suelo para la variable CE de la solución del suelo. 2Prueba de medias entre espesores de suelo para la variable CE de la solución del suelo. 3Prueba de medias entre perfiles de suelo para la variable potencial osmótico de la solución del suelo. 4Prueba de medias entre espesores de suelo, para la variable potencial osmótico de la solución del suelo. (*) Significancia. (Tukey, 0.05) Nota: Medias con diferente letra en la misma columna son significativamente diferentes. M = media; σ = desviación estándar; CV = Coeficiente de Variación.
Fuente: Elaboración propia.
Enseguida, se empacaron en bolsas de plástico de 4 Kg de capacidad, selladas y etiquetadas. Después, se colectaron quince muestras de agua de los ríos Verde, Colotepec, Cozoaltepec, Tonameca y Copalita, así como de pozos profundos, aprovechadas para riego en parcelas contiguas. Para ello se utilizaron recipientes de polipropileno de 1 L de capacidad, lavados con agua destilada y posteriormente etiquetados.
Las muestras de suelos y aguas fueron trasladadas al Laboratorio de Aguas y Suelos Salinos del Colegio de Postgraduados para su análisis fisicoquímico. A los suelos se les determinó textura por el método del hidrómetro de Bouyoucos (Soil Survey Staff, 2014), color en húmedo y en seco mediante cartas de color Münsell (Münsell, 2000), STD en (mg L-1), con el método de calcinación de extractos acuosos de pastas de saturación en mufla a 600 °C; se determinaron el pH y CE (dS m-1) usando un multiparámetro marca Hanna ® modelo HI98129.
El porcentaje de sodio intercambiable (PSI) se obtuvo por el método de acetato de amonio y, con sus valores, se calculó la relación de adsorción de sodio (RAS) mediante la igualdad propuesta por Richards (1985). Se determinaron cationes Ca2+ Mg2+ y aniones CO3 -2, HCO3 - y Cl- por el método titrimétrico. Se determinaron Na+ y K+ por flamometría (Flamómetro IL-653) y SO4 -2 por espectrofotometría. A las aguas se les practicaron similares determinaciones (Soil Survey Staff, 2014). Los resultados de salinidad de las muestras de suelo y de aguas fueron promediados y se obtuvo su desviación estándar y coeficiente de variación.
Con apoyo en el sistema de Análisis Estadístico SAS (Statistical Analysis System Institute, 2006), se practicó un análisis de varianza con Tukey α = 0.05 para establecer diferencias significativas entre valores de salinidad de muestras de suelo y entre concentraciones salinas de aguas. Para comparar los Ѱπ de extractos acuosos de suelo y aguas de riego, resultado de la aplicación de las ecuaciones del modelo Ψπ = K3 × STD, con los Ψπ obtenidos mediante la relación -0.036 × CE (Richards, 1985), se construyó una gráfica de regresión lineal. Para tal efecto se consideró la concentración salina (STD) como variable independiente (x) y el Ѱπ como variable dependiente (y).
Resultados
Textura
En la Tabla 1 se señalan las características texturales de cada suelo analizado. En una toposecuencia del alto al bajo relieve se observa que los suelos de lomerío del jardín botánico Puerto Escondido de la Universidad del Mar, así como del Huarumbo en San Pedro Mixtepec y de Cozoaltepec, limítrofes con la franja costera (aproximadamente de 85 m snm a 60 m snm), presentan una condición textural que varía de la migajón-arenosa a la arena-migajonosa; son suelos de escaso desarrollo de tipo litosol que sostienen una vegetación de selva baja caducifolia.
Enseguida, en las estribaciones de la Sierra Madre del Sur con la planicie costera (50 m s.n.m. a 20 m s.n.m.) se presenta una transición hacia suelos regosoles eutricos y cambisoles eutricos con más desarrollo de horizontes y más profundidad que los anteriores, cuya textura es modificada por un ligero incremento de limos y arcillas, esto origina una transición de texturas de la franco-arcillosa y franco-limosa para suelos agrícolas y pastizales del Distrito de Riego 110 Rio Verde a texturas franca y franco-arenosa para suelos de Río Grande y Bajos de Chila que forman parte de la sabana costera.
Estos suelos, debido a procesos de depósitos continuos de sedimentos inconsolidados, son más profundos y permiten su incorporación a actividades agrícolas y ganaderas. Más hacia el este en suelos de Barra de Colotepec hasta Barra del Potrero en Cozoaltepec, los suelos tienen una textura franco-limosa a areno-limosa. En algunos casos como en Barra de Colotepec, se presentan suelos salinos del tipo Solonchak que impiden el desarrollo de la agricultura.
Enseguida, los suelos de las inmediaciones de la laguna costera La Salina tienen una textura en transición de migajón-arenosa a la arena-migajón, se caracterizan por su tendencia a acumular sales y sostienen una vegetación de mangle. Por su parte, los suelos de planicie costera de La Florida en San Pedro Pochutla tienen una condición textural franco-arcillo-arenosa; en estos suelos de tipo regosol eutrico se practica la actividad agrícola.
pH, CE, STD y Ѱπ de las soluciones de los suelos
La evaluación de los parámetros fisicoquímicos de extractos de pastas de saturación edáfica se plasma en la Tabla 1. En ella se observa que la reacción del suelo en parcelas agrícolas y pastizales de Bajos de Chila, San Pedro Mixtepec, Barra del Potrero en Cozoaltepec, San Isidro en Tonameca y La Florida en San Pedro Pochutla, Oaxaca, registró niveles ligeramente ácidos (pH ~6 a 6.75). Estos valores transitan hacia niveles ligeramente alcalinos (pH ~7.10 a 7.20) en sedimentos lacustres de Escobilla, Oaxaca. Niveles de pH ~7.5 se detectaron en parcelas agrícolas de Río Verde, Oaxaca.
La CE en el espesor edáfico analizado promedió valores de 3.21 dS m-1 en pastizales del Distrito de riego 110 Río Verde, Oaxaca: 0.14 dS m-1 para zonas de cultivos de Río Grande, 0.11 dS m-1 para Bajos de Chila, 0.22 dS m-1 para pastizales de San Pedro Mixtepec, 0.78, 0.61 y 0.42 dS m-1 para bajo lomeríos del jardín botánico Puerto Escondido. CE de 8.21 dS m-1 se determinaron en los suelos salinos de Colotepec; 0.22 dS m-1 para terrenos de piedemonte de Cozoaltepec y 20.41 dS m-1 y 50.73 v para la zona manglar de las orillas y el centro de la Laguna La Salina, en Cozoaltepec, Oaxaca, respectivamente. Estas últimas CE presentan significancia estadística (p = 0.05). En terrenos agrícolas de San Isidro en Tonameca y La Florida en San Pedro Pochutla, las CE promediaron valores de 0.70 v y 0.11 dS m-1, respectivamente.
En la Tabla 1, se identifica una alta correlación negativa entre los valores de CE y Ψπ de los extractos acuosos de suelos (r = -0.99) y los de STD y Ψπ (r = -0.91); es decir, a mayor CE, o mayor concentración salina, el potencial osmótico disminuye.
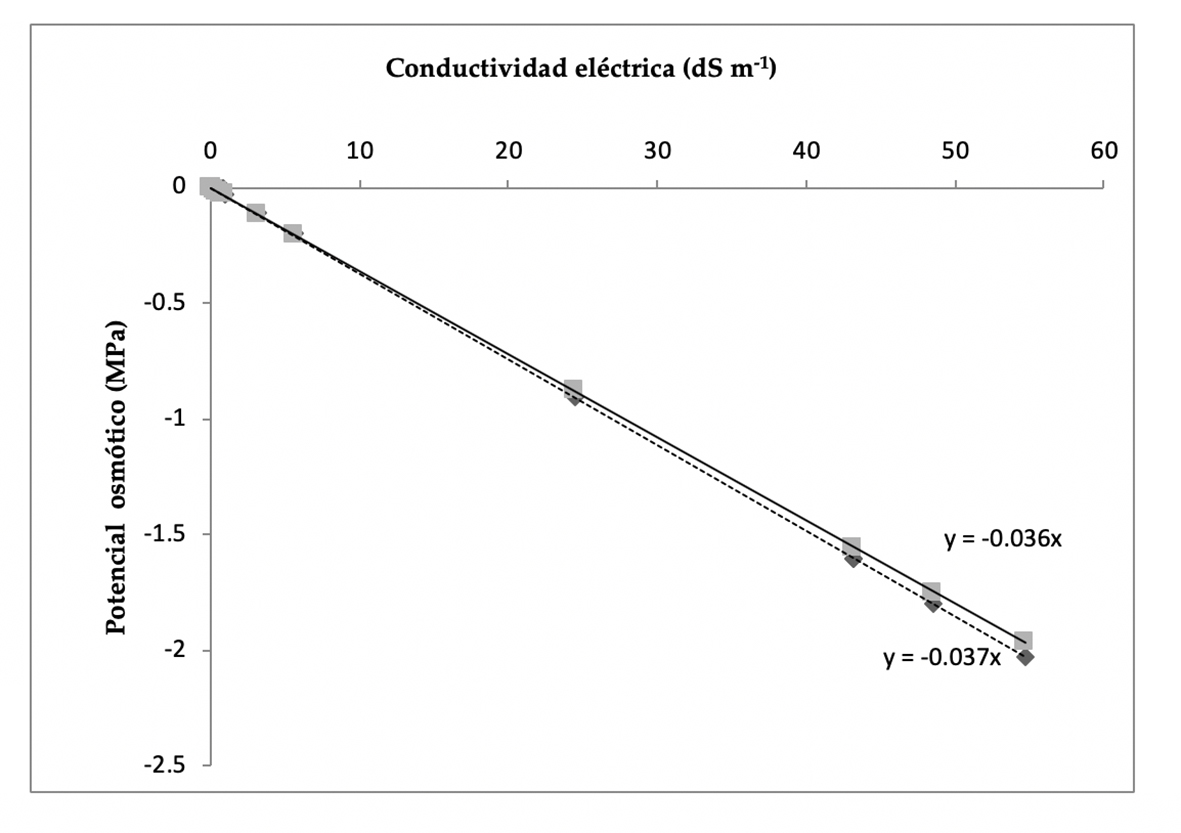
La Figura 2 presenta el grado de asociación entre los parámetros CE y Ψπ experimental, calculado mediante la ecuación Ψπ = K3 × STD, donde K3 debe interpretarse como una constante de proporcionalidad osmótica de las soluciones salinas. Así mismo, se identifican los valores de Ѱπ teórico obtenido por la igualdad K3= -0.036 × CE. Los valores de Ψπ obtenidos a través de la constante de proporcionalidad K3 difieren ligeramente de los obtenidos por la igualdad citada en último término.
Fuente: Elaboración propia.
Figura 2 Regresión lineal entre CE y Ψπ de soluciones acuosas de suelos y aguas de riego, mediante el uso del coeficiente experimental K3 x STD y el coeficiente -0.036 x CE.
El Manual 60 del Laboratorio de Salinidad de Suelos de los Estados Unidos de América (Richards, 1985) señala los valores de π producidos por soluciones de NaCl, CaCl2, MgCl2, MgSO4, Na2SO4 y diversas combinaciones de sales. Si se consideran dichos valores como referencia, entonces el modelo propuesto presenta una tendencia a ajustar más los datos a la línea de Ѱπ teórico. En la Figura 2 se distingue que el coeficiente Ψπ = -0.037(x) de la ecuación de regresión lineal, donde x = CE es próximo al obtenido para diversas soluciones salinas mediante la igualdad Ψπ = -0.036 x CE. Esto indica un error de estimación de 0.01 unidades de desviación estándar. El error típico del coeficiente angular de la recta de regresión (b1) en ambos procedimientos fue < 0.01, por lo que con T α = 0.05 y n-2 grados de libertad (13), se infiere en términos estadísticos que no hay diferencia significativa en los valores de Ѱπ de los extractos de suelo obtenidos a partir de ambos procedimientos.
Composición iónica de pastas de saturación del suelo
En la Tabla 2, se observa la concentración iónica de extractos acuosos de pastas de saturación de suelos analizados. En los suelos del valle, desde el Distrito de riego 110 en San José del Progreso hasta terrenos agrícolas de San Isidro en Tonameca y La Florida en San Pedro Pochutla, es notoria la presencia de cationes Na+ > Ca2+ > Mg2+ > K+ así como de aniones Cl- > HCO3 - > SO4 -2.
Tabla 2 Concentración iónica en extractos de saturación de suelos de los perfiles analizados.
| No. perfil e identificación |
Espesor de suelo (cm) |
Aniones (mmolc 100
g-1 de suelo) |
Cationes (mmolc 100
g-1 de suelo) |
||||||||
| CO3 -2 | HCO3 - | Cl- | SO4 -2 | Total | Ca2+ | Mg2+ | Na+ | K+ | Total | ||
| Pastizales Distrito de riego 110. |
0-20 | 0 | 0.11 | 0.18 | 0.28 | 0.58 | 0.19 | 0.14 | 0.31 | 0.03 | 0.67 |
| 20-40 | 0 | 0.1 | 0.23 | 0.32 | 0.65 | 0.21 | 0.11 | 0.3 | 0.05 | 0.67 | |
| 40-60 | 0 | 0.12 | 0.29 | 0.22 | 0.63 | 0.18 | 0.16 | 0.17 | 0.05 | 0.7 | |
| Limonares Distrito de riego 110. |
0-20 | 0 | 0.25 | 9.48 | 0.82 | 10.55 | 1.47 | 4.24 | 4.63 | 0.71 | 11.05 |
| 20-40 | 0 | 0.24 | 5.68 | 2.87 | 8.79 | 1.27 | 3.96 | 3.42 | 0.34 | 8.99 | |
| 40-60 | 0 | 0.4 | 6.21 | 2.51 | 9.12 | 1.21 | 3.59 | 4.76 | 0.37 | 9.93 | |
| Terrenos de cultivo Río Grande |
0-20 | 0 | 0.25 | 0.36 | 0.41 | 1.02 | 0.17 | 0.16 | 0.55 | 0.06 | 0.94 |
| 20-40 | 0 | 0.24 | 0.5 | 0.36 | 1.1 | 0.2 | 0.17 | 0.35 | 0.08 | 0.8 | |
| 40-60 | 0 | 0.26 | 0.45 | 0.3 | 1.01 | 0.29 | 0.28 | 0.3 | 0.08 | 0.95 | |
| Terrenos de pastizal El Guarumbo San Pedro Mixtepec |
0-20 | 0 | 0.09 | 0.07 | 0.01 | 0.17 | 0.09 | 0.05 | 0.05 | 0.01 | 0.2 |
| 20-40 | 0 | 0.07 | 0.04 | 0.01 | 0.12 | 0.06 | 0.04 | 0.04 | 0.01 | 0.15 | |
| 40-60 | 0 | 0.06 | 0.02 | 0.02 | 0.1 | 0.07 | 0 | 0.04 | 0.01 | 0.12 | |
| Parcela agrícola Bajos de Chila |
0-20 | 0 | 0.05 | 0.04 | 0 | 0.09 | 0.03 | 0.02 | 0.05 | 0 | 0.1 |
| 20-40 | 0 | 0.05 | 0.03 | 0 | 0.08 | 0.03 | 0.02 | 0.03 | 0 | 0.08 | |
| 40-60 | 0 | 0.03 | 0.02 | 0 | 0.05 | 0.02 | 0.03 | 0.02 | 0 | 0.07 | |
| Terrenos
de Lomerío Jardín Botánico Puerto Escondido |
0-20 | 0 | 0.02 | 0.01 | 0 | 0.03 | 0.02 | 0.02 | 0.01 | 0 | 0.05 |
| 20-40 | 0 | 0.02 | 0.01 | 0 | 0.03 | 0.02 | 0.02 | 0 | 0 | 0.04 | |
| 40-60 | 0 | 0.02 | 0.01 | 0 | 0.03 | 0.01 | 0.01 | 0 | 0 | 0.02 | |
| Lomeríos
del Jardín botánico Puerto Escondido |
0-20 | 0 | 0.02 | 0.01 | 0.03 | 0.07 | 0.02 | 0.03 | 0.02 | 0 | 0.07 |
| 20-40 | 0 | 0.02 | 0 | 0.02 | 0.04 | 0.04 | 0.01 | 0.01 | 0 | 0.06 | |
| 40-60 | 0 | 0.02 | 0 | 0.02 | 0.04 | 0.04 | 0.01 | 0.01 | 0 | 0.06 | |
| Terrenos
de piedemonte Jardín botánico Puerto Escondido |
0-20 | 0 | 0.02 | 0.01 | 0 | 0.03 | 0.01 | 0 | 0.03 | 0.01 | 0.05 |
| 20-40 | 0 | 0.02 | 0 | 0 | 0.02 | 0.01 | 0.02 | 0.04 | 0 | 0.07 | |
| 40-60 | 0 | 0.02 | 0 | 0 | 0.02 | 0.01 | 0.01 | 0 | 0 | 0.02 | |
| Terrenos
de cultivo Barra de Colotepec |
0-20 | 0 | 0.06 | 0.04 | 0.13 | 0.23 | 0.09 | 0.05 | 0.07 | 0.02 | 0.23 |
| 20-40 | 0 | 0.05 | 0.04 | 0.1 | 0.19 | 0.06 | 0.04 | 0.09 | 0.01 | 0.2 | |
| 40-60 | 0 | 0.05 | 0.02 | 0.02 | 0.09 | 0.07 | 0 | 0.08 | 0 | 0.15 | |
| Terrenos
de cultivo Cozoaltepec |
0-20 | 0 | 0.03 | 0.05 | 0.13 | 0.21 | 0.02 | 0.03 | 0.08 | 0 | 0.13 |
| 20-40 | 0 | 0.03 | 0.02 | 0.09 | 0.14 | 0.01 | 0.02 | 0.08 | 0 | 0.11 | |
| 40-60 | 0 | 0.01 | 0.02 | 0.01 | 0.04 | 0.01 | 0.02 | 0.06 | 0 | 0.09 | |
| 11.Suelo lacustre laguna La Salina |
(0-20] | 0 | 0 | 0.48 | 0.04 | 0.52 | 0.03 | 0.1 | 0.41 | 0.01 | 0.55 |
| (20-40] | 0 | 0 | 0.15 | 0.01 | 0.16 | 0.01 | 0.03 | 0.14 | 0 | 0.18 | |
| (40-60] | 0 | 0 | 0.2 | 0.01 | 0.21 | 0.01 | 0.04 | 0.17 | 0 | 0.22 | |
| 12.
Suelo aledaño a la laguna La Salina |
(0-20] | 0 | 0.01 | 0.12 | 0.04 | 0.17 | 0.02 | 0.03 | 0.14 | 0 | 0.19 |
| (20-40] | 0 | 0 | 0.06 | 0.01 | 0.07 | 0.01 | 0.01 | 0.05 | 0 | 0.07 | |
| (40-60] | 0 | 0 | 0.06 | 0.01 | 0.07 | 0 | 0.01 | 0.06 | 0 | 0.07 | |
| 13. Zona
de cultivo de cacahuate en Escobilla |
(0-20] | 0 | 0.21 | 0.01 | 0 | 0.22 | 0.01 | 0.04 | 0.17 | 0 | 0.22 |
| (20-40] | 0 | 0.06 | 0.01 | 0 | 0.07 | 0 | 0.01 | 0.05 | 0 | 0.06 | |
| (40-60] | 0 | 0.08 | 0.01 | 0 | 0.09 | 0 | 0.02 | 0.07 | 0 | 0.09 | |
| 14. Zona
de cultivo Río San Isidro |
(0-20] | 0 | 0 | 0.09 | 0 | 0.09 | 0 | 0.02 | 0.07 | 0 | 0.09 |
| (20-40] | 0 | 0 | 0.08 | 0.01 | 0.09 | 0 | 0.02 | 0.06 | 0 | 0.08 | |
| (40-60] | 0 | 0 | 0.07 | 0.01 | 0.08 | 0 | 0.01 | 0.06 | 0 | 0.07 | |
| 15. Terrenos
agroforestales La Florida |
(0-20] | 0 | 0.02 | 0.08 | 0.01 | 0.11 | 0.02 | 0.04 | 0.06 | 0 | 0.12 |
| (20-40] | 0 | 0.02 | 0.07 | 0.01 | 0.09 | 0.02 | 0.03 | 0.05 | 0 | 0.1 | |
| (40-60] | 0 | 0.02 | 0.07 | 0.01 | 0.1 | 0.01 | 0.04 | 0.05 | 0 | 0.1 | |
Fuente: Elaboración propia.
Las muestras de suelo de Escobilla y las estribaciones de la laguna La Salina presentan idéntico patrón iónico. En lo fundamental predominan los iones Na+ y los aniones Cl-. Por su parte, en los suelos de bajo lomeríos que lindan con la franja costera, tales como los pastizales de Río Grande y del Huarumbo, los suelos forestales del jardín botánico Puerto Escondido de la Universidad del Mar, en el Municipio de San Pedro Mixtepec y terrenos agrícolas de Cozoaltepec, presentan concentraciones iónicas en cantidades traza; sin embargo, se distingue el orden Ca2+ > Mg2+ > Na+ > K+; los HCO3 - predominan sobre el resto de los aniones. Por su parte, los suelos salinos de Barra de Colotepec presentan el siguiente orden iónico Na+ > Mg2+ > Ca2+ > K+ y Cl- > SO4 -2 > HCO3 -. En general es notorio que la mayor concentración iónica se presenta en suelos de la planicie aluvial costera, mientras que la menor concentración iónica corresponde a suelos poco profundos de los lomeríos que lindan con el valle costero.
Composición iónica, pH, CE, STD. Ѱπ y RAS de las aguas de riego
La Tabla 3 muestra variación en la composición química de las muestras de agua superficiales y subterráneas utilizadas para riego en la planicie costera de Oaxaca. En las aguas de los ríos Verde, Río Grande, Colotepec, Cozoaltepec, San Isidro y Copalita, próximas a la línea de costa, se determinó una alternancia de cationes básicos Ca2+- Mg2+ y Mg2+- Ca2+, seguida del ion Na+, así como de aniones Cl-, HCO3 - y SO4 -2. El pH promedio fue de 7.78. Los STD variaron de 108 mg L-1 a 363 mg L-1, la CE presentó valores de 0.16 dS m-1 a 0.68 dS m-1 con una media de 0.43 dS m-1 y potenciales osmóticos de 0.00 MPa a -0.03 MPa, con promedio de -0.01 MPa. La RAS promedió 0.52 (mmolc L-1)1/2. Las aguas de canales de riego del Distrito 110 Río Verde, así como del sitio conocido como Paso de la Reyna, registraron un pH de 8.02, la CE fue de 0.44 dS m-1 y el Ѱπ de -0.01 MPa.
Tabla 3 Parámetros fisicoquímicos y concentración iónica de aguas superficiales y subterráneas colectadas en la planicie costera de Oaxaca.
| Muestras
de agua/ Identificación |
pH | CE | Ψπ | STD | RAS (mmolc L-1)1/2 |
Cationes (mmolc L-1) | Aniones (mmolc L-1) | ||||||||
| (dS m-1) | (MPa) | (mg L-1) | Ca2+ | Mg2+ | Na+ | K+ | Total | CO3 -2 | HCO3 - | Cl- | SO4 -2 | Total | |||
| 1. Canal de
Riego Pastoría, Río Verde. B1B2 |
8.03 | 0.44ª | -0.01 | 238 | 0.85 | 0.57 | 1.19 | 1.13 | 0.16 | 3.05 | 0.16 | 1.82 | 0.15 | 0.9 | 3.03 |
| 2. Pozo
Semi-profundo, Distrito de riego 110. B1B2 |
8.52 | 0.81ª | -0.03 | 506 | 2 | 0.4 | 2.23 | 3.12 | 0.18 | 5.75 | 0.18 | 4.34 | 1.84 | 0.62 | 6.98 |
| 3. Paso de la Reyna. B1B2 |
8.2 | 0.38ª | -0.01 | 196 | 0 | 1.16 | 0.43 | 0 | 0.02 | 1.61 | 0 | 1.8 | 0.6 | 0.41 | 2.81 |
| 4. Bocabarra El azufre. B1 B2 |
8.4 | 1.11ab | -0.04 | 584 | 6.25 | 1.27 | 0.76 | 6.3 | 0.14 | 8.47 | 0 | 2.8 | 6 | 0.71 | 9.51 |
| 5. Río
Grande. B1B2 |
7.7 | 0.38ª | -0.01 | 240 | 0 | 0.31 | 0.18 | 0 | 0.02 | 0.51 | 0 | 0.7 | 0.4 | 0.03 | 1.13 |
| 6. Pozo
Semi-profundo Puerto Suelo, Bajos de Chila. B1B2 |
7.32 | 0.45a | -0.01 | 285 | 2.8 | 1.38 | 0.7 | 2.86 | 0 | 4.94 | 0 | 1.2 | 1.52 | 1.14 | 3.86 |
| 7. Pozo
semi-profundo Barra de Colotepec. B1B2 |
7.96 | 0.68ª | -0.02 | 430 | 2 | 1.4 | 0.8 | 2.1 | 0.03 | 4.33 | 0 | 1.84 | 2.3 | 0.56 | 4.7 |
| 8. Río
Cozoaltepec. B1B2 |
7.08 | 0.56ª | -0.02 | 363 | 0.44 | 0.54 | 0.4 | 0.3 | 0.17 | 1.41 | 0 | 1 | 0.37 | 0.06 | 1.43 |
| 9. Laguna La Salina parte media. A1*A2 |
6.1 | 48.60b | -1.77 | 22560 | 66.83 | 6.75 | 38.05 | 313 | 6.6 | 364.4 | 0 | 3.12 | 375 | 16.73 | 394.85 |
| 10. Laguna La Salina, estribaciones. A1*A2* |
6.25 | 43.20b | -1.57 | 22615 | 65.46 | 6.75 | 36.1 | 303 | 6.6 | 352.45 | 0 | 2.91 | 370 | 14.8 | 387.71 |
| 11. Pozo
semi-profundo La Escobilla. B1B2 |
7.72 | 0.90ª | -0.03 | 580 | 2.94 | 1.62 | 1.75 | 2 | 0.48 | 5.85 | 0 | 3.72 | 1.77 | 0.07 | 5.56 |
| 12. Pozo
noria Santo Domingo de Morelos. B1B2 |
6.87 | 1.06ab | -0.03 | 690 | 1.35 | 0.85 | 0.9 | 2.45 | 0.28 | 4.48 | 0 | 3.56 | 1.9 | 0.05 | 5.51 |
| 13. Río San
Isidro. B1B2 |
8.06 | 0.16ª | 0 | 108 | 0.31 | 0.4 | 0.25 | 0.7 | 0.16 | 1.51 | 0 | 0.98 | 0.24 | 0.08 | 1.3 |
| 14. Pozo
Noria La Florida. B1B2 |
6.78 | 0.58ª | -0.02 | 372 | 2.5 | 1.3 | 0.99 | 2.7 | 0.05 | 5.03 | 0 | 4.4 | 0.6 | 0.09 | 5.09 |
| 15. Pozo Noria
Bajos de Coyula. B1 B2 |
8 | 0.68ª | -0.02 | 435 | 2.34 | 1.3 | 2.23 | 3.1 | 0.08 | 6.73 | 0 | 3.34 | 1.8 | 0.08 | 5.22 |
1Prueba de medias entre muestras de agua para la variable CE. 2Prueba de medias entre muestras de agua, para la variable potencial osmótico. (*) Significancia estadística (Tukey, 0.05). Nota: Medias con diferente letra en la misma columna son significativamente diferentes.
Fuente: Elaboración propia.
Por su parte, las aguas de la Bocabarra en el sitio El Azufre, Municipio de San Pedro Tututepec, así como las de pozos semi profundos utilizadas para riego en puntos como el Distrito de Riego 110 Río Verde, Barra de Colotepec, Escobilla, La Florida y Bajos de Coyula, presentaron valores de pH promedio de 7.6, CE de 0.68 dS m-1, STD con media de 485 mg L-1 y Ѱπ promedio de -0.02 MPa. La RAS presentó una media de 2.44 (mmolc L-1)1/2. Solo en aguas de un pozo noria, ubicado en Santo Domingo de Morelos, la CE fue de 1.06 dS m-1 y el potencial osmótico fue de -0.04 MPa. Los parámetros CE y Ѱπ de ambos tipos de agua no son significativamente diferentes (p = 0.05). Por su parte, las aguas de la laguna La Salina en Cozoaltepec presentaron el siguiente orden iónico: Na+ > Mg2+ > Ca2+> K+ y Cl- > HCO3 - > SO4 -2. El pH es ligeramente ácido en la entrada de la Laguna a alcalino en su parte media (6.1 a 7.72), los STD tienen una media de 22 587 mg L-1, la CE promedio es de 45.90 dS m-1 y el potencial osmótico de -1.67 MPa. La RAS promedió (66.14 mmolc L-1)1/2. Sus valores de CE y Ѱπ, en relación con los de las aguas superficiales y subterráneas estudiadas, presentan significancia estadística (p = 0.05).
Ecuaciones de predicción de potenciales osmóticos
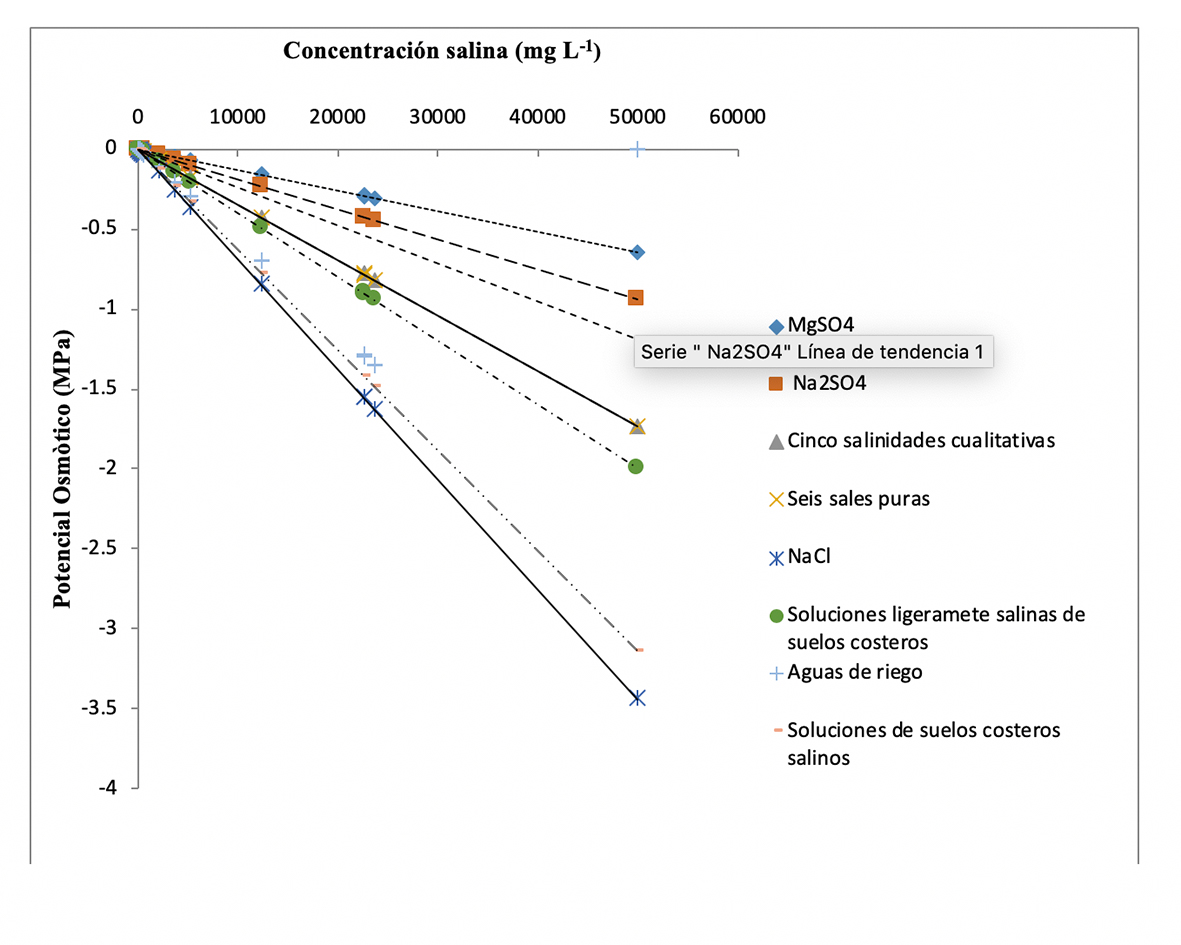
En la Tabla 4 se indican las ecuaciones de regresión lineal, resultado del modelo matemático propuesto, que predicen el Ѱπ de extractos de pastas de saturación de suelos y muestras de agua materia de estudio. Así mismo, a manera de comparación, se presentan los coeficientes osmóticos y las ecuaciones respectivas obtenidos por Ramírez et al. (1989) para diversas soluciones de sales puras y salinidades cualitativas. Los resultados indican que las diversas sales y soluciones salinas tienen su propio espectro de acción osmótica, por ejemplo, la sal MgSO4, cuya ecuación de regresión lineal es Y = 1.632 x 10-7+ (-1.296 x 10-5 ) (x), donde x = STD, simula una línea de tendencia hacia el espectro tóxico, mientras que las soluciones de ligera y moderada salinidad de suelos y aguas de la planicie costera de Oaxaca, con ecuaciones de regresión lineal Y = -2.324 x 10-5 + (-3.992 x10-5 (x), Y = 6.208x10-9 + (-6.282 x 10-5) (x), e Y = -5.151 x 10-5 + (-5.722 x 10-5) (x) , respectivamente, simulan líneas de tendencia hacia el espectro osmótico que es dominado por la sal NaCl con ecuación de regresión lineal Y = -4.911 x 10-4 + (-6.864 x 10 -5) (x). Estas tendencias se observan con notoriedad en la Figura 3.
Tabla 4 Ecuaciones de predicción de potenciales osmóticos de soluciones de suelos y aguas de la planicie costera de Oaxaca, respecto de las obtenidas por Ramírez et al. (1989).
| Identificación | Coeficiente
experimental K3 = K2/K1 |
Coeficiente K’3 = K2/K1 |
Ecuación Y = A + Bx |
R2 |
|---|---|---|---|---|
| Resultado de regresión lineal | ||||
| MgSO4·7H2O | -1.296 x 10-5 | -1.296 x 10-5* | Y = 1.632 x 10-7+ (-1.296 x 10-5) (x) | 1 |
| Na2SO4·10 H2O | -1.889 x 10-5 | -1.888 x 10-5* | Y = -2.555 x 10-4 + (-1.888 x 10-5) (x) | 1 |
| Cinco salinidades cualitativas |
-3.457 x 10-5 | -3.460 x 10-5* | Y = -0.010 + (-3.460 x 10-5) (x) | 0.99 |
| Seis sales puras |
-3.472 x 10-5 | -3.472 x 10-5* | Y = 2.075x10-4 + (-3.472 x 10-5) (x) | 1 |
| Soluciones
salinas del Manual 60 |
-5.625 x 10-5 | -5.625 x 10-5 | Y = 1.330x10-7 + (-5.625 x 10-5) (x) | 1 |
| NaCl | -6.926 x 10-5 | -6.864 x 10-5* | Y = -4.911 x 10-4 + (-6.864 x 10-5) (x) | 0.99 |
| Soluciones
ligeramente salinas de suelos de estribaciones de la planicie costera de Oaxaca. |
- 3.992x 10-5 | -3.992 x 10-5 | Y = -2.324 x 10-5 + (-3.992 x10-5 (x) | 0.99 |
| Soluciones
salinas de algunos suelos costeros de Oaxaca |
-6.281x10-5 | -6.282x10-5 | Y = 6.208x10-9 + (-6.282 x 10-5) (x) | 1 |
| Aguas de riego de la zona costera de Oaxaca. |
-5.720 x 10-5 | -5.722x 10-5 | Y = -5.151 x 10-5 + (-5.722 x 10-5) (x) | 0.99 |
x = STD (mg L-1) *Coeficientes adaptados de Ramírez et al. (1989).
Fuente: Elaboración propia
Discusión
Características edáficas asociadas al potencial osmótico de las soluciones de los suelos
La composición química de los extractos de suelo analizados es propia de suelos formados por meteorización de rocas metamórficas cálcico-magnésicas. Estas conforman la geoquímica del bajo relieve de la Sierra Madre del Sur (Tolson, 2005), donde predominan los cationes Na+ > Ca2+ > Mg2+, así como los aniones Cl-1 > SO4 -2. Su interacción forma las sales hipotéticas NaCl y MgCl2 de alta solubilidad y capacidad de migración en las aguas de escorrentía, lo que está asociado a su coeficiente energético iónico, a la dureza de la red cristalina de los compuestos y a su radio de hidratación (Kovda, 1977; Szabolcs, 1994).
En los suelos juveniles ácidos de lomeríos y estribaciones de la planicie costera, cuya textura var1ía de la areno-migajonosa a la migajón-arenosa, ocurre una lixiviación de estos iones en las aguas de drenaje que los empobrece; se trata de un típico proceso de latosolizaciòn y explica las cantidades traza de iones mayoritarios detectados en los análisis. Por su escaso desarrollo se les identifica como litosoles o suelos ferralíticos de relieve accidentado con pendientes > 25% que, en época de lluvias, favorecen la escorrentía superficial y, con ello, la remoción, depósito y acumulación de iones mayoritarios en los suelos de planicie costera (Palacios & Gama 1994; Sánchez, Ortega, Sandoval, Hernández & Estrada, 2012). Esto también explica los valores de pH ligeramente ácidos y los bajos valores de CE, STD y Ѱπ de la solución iónica de dichos suelos. Los iones que más se desplazan por su capacidad de migración son el Na+, el Mg2+ y el Cl-, identificados como iones de gran efecto osmótico y tóxico para las plantas cultivadas (Szabolcs, 1989).
El continuo depósito y acumulación de sedimentos en los suelos de aluvión del valle costero es el origen de la formación de suelos no consolidados más profundos, que tienen más desarrollados sus horizontes A y B. En las estribaciones del valle costero, el primer horizonte llega a una profundidad de 20 cm aproximadamente, mientras que el B llega a una profundidad de hasta 60 cm para lindar enseguida con material primario meteorizado. Estos son suelos regosoles eutricos cuya textura varía del franco-limoso, a la arena-limosa y franco arcillo-limosa, lo que explica el aumento de la concentración iónica en la solución del suelo (Tabla 1). La ligera salinidad en áreas cultivadas de Río Grande, Bajos de Chila, pastizales y lomeríos de San Pedro Mixtepec, terrenos agrícolas de San Isidro en Tonameca y La Florida en San Pedro Pochutla, está asociada a suelos con buen drenaje natural, una eficiente conductividad hidráulica y una buena calidad de sus aguas de riego, cuyas láminas favorecen la lixiviación de sales. Esta baja salinidad de 0.14 dS m-1 a 0.23 dS m-1 guarda relación con los Ѱπ menos negativos de los extractos del espesor superior de los suelos (-0.00 MPa a -0.08 MPa).
Por su parte, los suelos de planicie costera formados a partir de continuos depósitos aluviales son más profundos y desarrollados; en ellos, la sedimentación influye en el incremento de la concentración iónica. El horizonte A presenta los subhorizontes Oa de materia vegetal fresca y el Oi de transición entre materia mineral y húmica bien definidos en un intervalo (0 cm-20 cm) y un potente horizonte B de hasta 2 m de profundidad. Se trata de suelos cambisoles eutricos de textura franco-arcillo-limosa, cuyo espacio poroso del orden de 45%, reportado por Sánchez et al. (2012), junto con el ineficiente drenaje natural del suelo (por topografía plana), la escasa precipitación pluvial y excesiva evaporación, inciden en el ascenso capilar de las aguas freáticas y acumulación de sales en la superficie, fenómeno de común ocurrencia durante el estiaje (Sánchez, Camacho, Ávila, Can & Ortega, 2014a). Esta salinidad primaria se presenta en terrenos del Distrito de Riego 110 Río Verde, Tututepec, en la llanura oeste y en las proximidades a las Barras de Colotepec y Cozoaltepc. Para estas zonas, los valores de potencial osmótico de la solución del suelo variaron de -0.11 MPa a -0.29 MPa. En estas condiciones, la disminución de la actividad química del agua por el estrés salino produce trastornos fisiológicos en cultivos de limón (Citrus limón), papaya (Garica papaya), maíz y sorgo, que disminuyen sus rendimientos. En contraste, en época de humedad, las sales son desplazadas en forma temporal hacia los horizontes inferiores (Ortega, Sánchez, Bojorges, Ortega & García, 2016; Sánchez et al., 2014b).
Hacia el este, los procesos de sabanización por deforestación de la selva baja subcaducifolia, así como la geoquímica, geomorfología y eco hidrología de la planicie costera, donde la evaporación excede a la precipitación pluvial, y los factores naturales edáficos como la textura franco-limosa, el deficiente drenaje natural, una baja conductividad hidráulica, un manto freático poco profundo, el ascenso capilar de aguas y la acumulación de sales en la superficie, así como las intrusiones de aguas de mar, son factores que incrementan la concentración salina y producen la formación de manchones salinos que impiden el crecimiento de glicòfitas, como sucede en terrenos de Barra de Colotepec (Sánchez et al., 2014a). Lo mismo ocurre en los suelos aledaños a la laguna La Salina, donde la alta concentración de sales > 19.2 g L-1 limita el crecimiento y desarrollo de plantas cultivadas poco tolerantes a sales y explica la presencia en estas áreas de halófitas como el mangle y pastos salinos (Ortega et al., 2016). Los valores promedio de Ѱπ, calculados en los extractos de suelo de estas áreas hipersalinas, arrojaron valores de -0.73 MPa a -1.82 MPa. Esto indica menor actividad química del agua y menor disponibilidad del líquido para las raíces de plantas cultivadas, que tienden a padecer sequía fisiológica (Goykovic et al., 2014; Maldonado et al., 2002). En general, los cultivos de temporal contiguos a estas zonas que resienten el estrés osmótico salino son: maíz, cacahuate (Arachyshipogaea L.), jamaica (Hibiscussabdariffa L.), sandía (Citrulluslanatus L.) y girasol (Helianthus annuus L.), mientras que los cultivos de papaya sufren el estrés abiótico salino en condiciones de riego por goteo.
Influencia de la salinidad en el potencial osmótico de las aguas de riego
Las aguas de los ríos Verde, Río Grande, Cozoaltepec, San Isidro y Copalita, que avenan la planicie costera de Oaxaca, son de tipo bicarbonatada cálcico-magnésica en virtud de las rocas metamórficas por las que atraviesan (Sánchez et al., 2014b). Se trata de aguas con pH ligeramente alcalino a alcalino, CE < 0.5 dS cm-1, STD < 500 mg L-1 y RAS < 1.0. De acuerdo con dichos valores, estos ríos se clasifican como aguas de tipo C1S1, sin problemas de salinidad o sodicidad, y por tanto no presentan riesgo en su uso agrícola (Richards, 1985). La baja concentración electrolítica asociada a Ψπ menos negativos es referente de disponibilidad de agua en el sistema suelo-planta.
En el caso de las aguas de pozos noria analizadas, su composición también es bicarbonatada cálcico magnésica, presentan pH ligeramente alcalino, tienen un intervalo de CE de 0.5 dS m-1 a 0.8 dS m-1 y la RAS es de 2 (mmolc L-1)1/2 a 3 (mmolc L-1)1/2, por lo que generan ligeros problemas de salinidad, pero mayores de impermeabilidad en los suelos (Carrera-Villacrés et al., 2015; Sánchez et al., 2014b). Se trata de aguas C2S1 con restricción para ser usadas en el riego de cultivos, ya que existe riesgo de salinización gradual en los suelos, lo que coincide con lo indicado por Can-Chulim et al. (2014), quien señala que su efecto osmótico y tóxico puede ser dañino para las plantas cultivadas. Las principales sales contenidas en estas aguas y responsables del efecto osmótico-tóxico son NaCl, seguido de MgCl2 y NaHCO3. Las aguas freáticas por naturaleza tienden a mineralizarse y reconcentrarse en sales. El fenómeno tiene más probabilidad de ocurrencia en las aguas subterráneas costeras. Esto se debe a que la extracción hídrica mediante pozos excede las tasas naturales de recarga, lo que a su vez favorece una mayor presión del agua de mar que trasmina los pozos artesianos, cuyas aguas se salinizan paulatinamente (Barlow & Reichard, 2010). El fenómeno descrito causa la salinización de la mayoría de los pozos estudiados en la planicie costera de Oaxaca (Sánchez et al., 2014b). Lo anterior explica los incrementos en valores de CE y la disminución de Ψπ. Como consecuencia, uno de los problemas que afrontan los agricultores de la región es el uso de aguas que provocan estrés salino en cultivos como la papaya, limón y maíz; por tal motivo, es recomendable utilizar mezclas de aguas de menor concentración salina en el riego agrícola (Sánchez et al., 2014a).
Por su parte las aguas de la laguna La Salina, donde crece y se desarrolla el biotopo Mangle, presentan una composición bicarbonatada sódico-magnésica, con pH ligeramente ácido ~ 6.1, CE promedio de 45.90 dS m-1 y RAS de 66.14 (mmolc L-1)1/2. Estos valores indican que se trata de un sistema salino sódico, cuyas aguas de tipo C4S4 (Richards, 1985) favorecen procesos de impermeabilización, anegamiento y acumulación de sales, principalmente de NaCl, propios de una laguna costera. A estas condiciones abióticas se adaptan, en una secuencia zonal hacia el mar, especies halófitas como el mangle negro (Avicceniagerminans), el mangle blanco (Laurunculariaracemosa) y el mangle botoncillo (Conocarpuserectus) (Ortega et al., 2016). El potencial osmótico de estas aguas en promedio es de -1.67 MPa, que está altamente correlacionado con los valores de CE y STD obtenidos. Este valor osmótico explica el comportamiento biosalino de las plantas que crecen en aguas de marismas costeros y que han desarrollado mecanismos fisiológicos que les permiten allegarse agua a pesar de su baja actividad química al interior celular, tales como la producción de osmolitos (Mugdal et al., 2010; Shinozaki & Yamaguchi-Shinozaki, 2007), mecanismo que está asociado a una homeostasis de regulación osmótica negativa (Aziz & Khan, 2001; Gorham, 1996). Igualmente, han desarrollado estructuras anatómicas y mecanismos fisiológicos de adaptación a la salinidad tales como la formación de hojas pequeñas, el cierre estomatal, la presencia de glándulas excretoras y la compartimentación de iones en la vacuola (Flowers & Colmer, 2008). Estos mecanismos les permiten tolerar el desbalance hídrico producido por la salinidad extrema.
Determinación de potenciales osmóticos mediante la constante de proporcionalidad K3
En la Tabla 4 se presentan las constantes de proporcionalidad osmótica K3 de los extractos acuosos de pastas de saturación de los suelos y de las muestras de agua analizadas, su regresión lineal y las ecuaciones de calibración respectivas. Al alimentar estas constantes con los valores de CE, STD y de Ψπ, obtenidos de la expresión Ψπ (MPa) = -0.036 x CE, se observa que incrementos de CE o de STD (mg L-1) producen una disminución del Ψπ. Esto significa que, si el Ψπ de una muestra de solución acuosa con determinada concentración salina se mide en función de otra concentración salina, el nuevo potencial osmótico será Ψπ’ y variará en función de la concentración de solutos y del tipo de salinidad (Tippens, 1981). Por eso, esta proporcionalidad puede establecerse como Ψπ = K3 X STD. Como se trata de una disminución de actividad química del agua por la presencia de solutos, entonces adquiere valores negativos. Esta ley de proporcionalidad osmótica se ha representado gráficamente en la Figura 3 mediante rectas surgidas de ecuaciones de regresión lineal, algunas de las cuales se adaptaron del trabajo de Ramírez et al. (1989).
En la gráfica, la concentración salina se ha colocado como abscisa y el Ψπ como ordenada en sentido negativo. Todas las líneas parten del origen y se observa que cada recta que representa una sal o tipo de salinidad, incluidas las soluciones de suelos y aguas materia de estudio, simulan una tendencia diferencial a disminuir el Ψπ. En lo fundamental, esta disminución de Ѱπ no es la misma para cada sal o salinidad, ya que esto depende del coeficiente energético iónico (KEI), del radio iónico, la valencia y la dureza de la red cristalina, así como del radio de hidratación de cada ion constitutivo de una determinada solución salina (Kovda, 1977). Esto sucede porque a la misma concentración, presión y temperatura, las moléculas de agua son atraídas con más fuerza por los iones que tienen mayor densidad de carga. Por lo general, los iones con mayor poder de hidratación son los de mayor movilidad y, de acuerdo con Keenan, Kleinfelter & Wood (1990), esta secuencia de hidratación presenta el orden liotrófico: Li+ >Na+ > NH4 + > K+ > Rb+ > Cs+ > Mg2+ > Ca2+ > Sr+2> Ba+2. Por ejemplo, el radio iónico del Mg2+ es de 0.65 Å y su número de hidratación es de 18.9 moles de H2O por mol de electrolito, mientras que el Na+ tiene un radio iónico de 0.95 Å y su número de hidratación es de 16.2 moles de H2O por mol de electrolito (Velázquez, Ortega, Martínez, Kohashi & García, 2002). Esto indica que una sal como el MgSO4, al disociarse, cede a la solución iones Mg2+ que con menor capa de hidratación producen un menor efecto osmótico, es decir, una mayor actividad química de las moléculas de agua; en contraste, el ion Na+ de la sal NaCl tiende a hidratarse más, lo que disminuye la actividad química de las moléculas de agua y, por tanto, el potencial osmótico de la solución en que participa. Lo anterior se denota en la posición de las rectas en el nomograma de estado de la Figura 3.
La gráfica de las curvas de proporcionalidad representada por líneas rectas (Figura 3) define con mucha aproximación el espectro de acción de sales y salinidades que producen un efecto puramente osmótico y las distingue de aquellas que tienen un efecto tóxico, lo que coincide con lo reportado por Sánchez-Bernal & Ortega-Escobar (2011). Los coeficientes osmóticos de las soluciones acuosas de suelos y aguas analizadas indican una tendencia a producir un efecto osmótico, lo que está vinculado al tipo de salinidad clorhídrica que prevalece en la planicie costera de Oaxaca (Sánchez et al., 2014b). Su quimismo presenta un predominio de cloruros/sulfatos con un índice > 2.5, que, de acuerdo con la clasificación química de suelos salinos establecida por Arinushkina, citado por Kovda (1977), corresponde a una salinidad clorhídrica. Para Szabolcs (1989), esta salinidad es característica de zonas costeras limítrofes con el mar donde predomina la sal, NaCl. A moderadas concentraciones salinas (2.56 g L-1 a 3.84 g L-1) registradas en suelos y aguas superficiales de uso agrícola, el efecto osmótico se presenta en la solución del suelo con una disminución de la actividad química del agua, cuya indisponibilidad genera estrés hídrico y sequía fisiológica en las plantas cultivadas (Strogonov, 1964). Conforme incrementa la salinidad por riego con aguas de pozo profundo, el estrés osmótico salino induce efectos cáusticos (quema de tejidos y necrosis), que disminuyen el rendimiento biológico y económico de los cultivos agrícolas (Can-Chulim et al., 2017). En la planicie costera de Oaxaca irrigada con aguas de moderada concentración salina, estos efectos son comunes (Sánchez et al., 2012). Los potenciales osmóticos más negativos corresponden a zonas de marismas costeros en los que la salinidad permite el desarrollo de vegetación adaptada a estas condiciones, tal es el caso del biotopo mangle (Ortega et al., 2016). Para atenuar el efecto osmótico salino en los agroecosistemas costeros de Oaxaca, es necesario implementar técnicas de lixiviación de sales, con apoyo en el establecimiento de sistemas de drenaje artificial con salida al mar, pero también en el uso de mezclas de aguas menos salinas para riego, el cultivo de plantas tolerantes a sales y el uso de aguas residuales municipales tratadas en la irrigación como alternativa sustentable para aplicar menores volúmenes de agua de buena calidad en el desplazamiento de sales del suelo (Lavrnić, Zapater-Pereira & Mancini, 2017; Sánchez et al., 2014a).
Conclusiones
Con base en los resultados del presente estudio, y de su discusión y análisis, se llega a las siguientes conclusiones: 1) Los potenciales osmóticos de las soluciones acuosas de suelos y aguas de la zona de estudio, obtenidos mediante los coeficientes osmóticos de la relación K3 x STD, son propios de una salinidad clorhídrica que predomina en la planicie costera de Oaxaca. Esta salinidad produce estrés osmótico en las plantas cultivadas y reduce su crecimiento y rendimiento; 2) La determinación del Ѱπ de soluciones salinas mediante el modelo propuesto y las ecuaciones de predicción respectivas simulan en forma adecuada las tendencias osmóticas o tóxicas de las sales en soluciones de suelos y aguas de riego (las desviaciones estándar respecto del modelo teórico Ѱπ = -0.036 x CE son menores de 1%); y 3) Su determinación es auxiliar en la implementación de mejoras a suelos agrícolas afectados por sales y en la prevención del uso de aguas de riego de determinada concentración salina.











 nueva página del texto (beta)
nueva página del texto (beta)