Introducción
Series liotrópicas en la Enseñanza Química
Los efectos específicos de iones dan lugar a una gran variedad de fenomenologías de gran interés para el ser humano y el entorno (Fernández-d’Arlas, 2016). Sin embargo, a pesar de su importancia, es difícil encontrar reseñas a éstas en los textos de enseñanza química. Únicamente en algunos manuales muy especializados de Biofisicoquímica se realizan vagas reseñas generalistas (Grigera, 2011). Tal vez la tradicional compartimentación de la Química en ‘Inorgánica’ u ‘Orgánica’, pueda relacionarse con esta falta de estudio, cuando la fenomenología se percibe principalmente entre sustancias de ambas áreas, como lo son los iones y las macromoléculas. En este artículo se pretende hacer una breve introducción a la fenomenología y hacer un alegato por su introducción en los textos de Química y Ciencias afines.
Contexto científico y antecedentes históricos
En la bibliografía hispánica los textos legibles más antiguos, relativos al estudio de las aguas y sus propiedades, constan de tan pronto como el Siglo I correspondientes al gaditano Lucio Junio Moderato Columela (Columela, s. 1 d.J.C). En el Siglo XV, en tiempos de la Reina Isabel, se compendiaron y recopilaron las ventajas que ofrecían las distintas aguas en función de su naturaleza química. Por ejemplo, el Dr. Julián Gutiérrez, de Toledo, estudió el impacto de las aguas sulfurosas en los baños, propuso el baño en base a distintos solutos como los de calcinados de cáscaras de huevos, y desarrolló estudios y soluciones para el tratamiento de los cólicos renales (Gutiérrez, 1498). Esta tarea se vio ampliada en tiempos del Felipe II, en cuya época las Ciencias hispánicas tuvieron un gran auge (Martínez-Reguera, 1892). Posteriormente, en la época ilustrada industrialista de Carlos III, también se desarrollaron estudios de calidad de las aguas de balnearios, como el de Fernando Trespalacios, implementando conceptos más actuales, como los desarrollados por químicos como Lavoisier, con el objeto de relacionar la naturaleza química de las aguas con sus efectos sobre la piel y la salud (Trespalacios y Mier, 1799).
El objeto de muchos de los compendios y tareas citadas arriba, en términos actuales, en realidad, trataban de vincular la composición de las aguas con su impacto en la naturaleza orgánica de nuestro cuerpo. La Figura 1 recoge la evolución de la terminología vinculada a algunos conceptos del mundo orgánico y al mundo inorgánico a lo largo de los siglos hasta hoy (Lucrecio-Caro, s. 1 a. J.C; Columela, s. 1 d.J.C; Gutiérrez, 1498; Trespalacios y Mier, 1799; Martínez-Reguera, 1892).
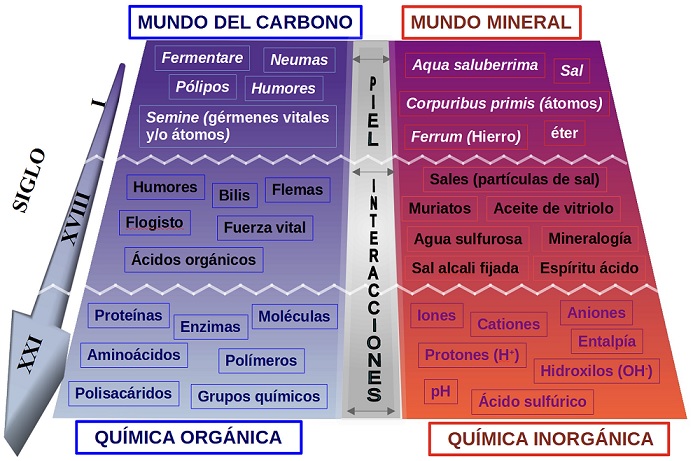
Figura 1 Evolución a lo largo de los siglos de algunos conceptos y vocablos referentes a las áreas del mundo orgánico y a las del mundo inorgánico, referidos al campo de análisis del presente trabajo.
No es sin embargo tras el avance de la Química Inorgánica, y en particular a partir del desarrollo de la electrólisis y el conocimiento de la naturaleza iónica de las sales, y también al desarrollo de la Química Orgánica, cuando se pueden desarrollar hipótesis sobre el origen del comportamiento de las macromoléculas orgánicas en disoluciones salinas. Una de las razones, tal vez, para el retraso de estos estudios puede ser la división histórica de la Química en ‘Orgánica e Inorgánica’ mientras que estos fenómenos liotrópicos (de ordenamiento) se dan justamente ‘en la frontera’ de ambas, donde las sustancias estudiadas genuinamente por la primera, p.ej. las macromoléculas, se encuentran con las segundas, p.ej. las sales.
Macromoléculas e iones en disolución. Fenomenología
Los efectos específicos entre iones y macromoléculas (> 10 KDa), péptidos o tensioactivos, comprenden una gran familia de fenómenos fisicoquímicos que responden a un distinto comportamiento de las macromoléculas en disoluciones de distinta naturaleza salina. Trabajos como los de Manning han tratado de buscar relaciones que cuantifiquen distintas fenomenologías de polielectrolitos en presencia de iones (Manning, 1978). Por otro lado, respecto al origen de la especificidad iónica recientemente, distintas revisiones exhaustivas sobre la fenomenología han sido publicadas por Lo Nostro (2012) y Fernández-d’Arlas (2016). Algunos de estos fenómenos comprenden la solubilidad de las macromoléculas, tamaño micelar, viscosidad, temperatura de nube, actividad enzimática, precipitación selectiva de proteínas, halo-adaptación, intercambio iónico en suelos o crecimiento vegetal, entre otros. La compresión profunda de la naturaleza de las interacciones iónmacromolécula es, por tanto, esencial en un gran número de disciplinas científico-técnicas como por ejemplo Ciencia de Polímeros, Bioquímica, Química Inorgánica, procesado de proteínas, Agronomía o Ciencias de la Alimentación. A pesar de que el común denominador de todas ellas sea la Ciencia Macromolecular, el desarrollo de ésta se limita a 100 años de antigüedad (Salgado-Chavarría, 2021), y no ha sido hasta las dos últimas décadas cuando se ha comenzado a abordar la fenomenología entre iones y macromoléculas.
Series de Hofmeister
Los primeros estudios reportados sobre la acción de distintas sales sobre sustancias ‘albuminosas’ se remontan al entorno de la mitad del siglo XIX (Liebig, 1823; Bernard, 1853; Torres-Muñoz, 1856; Denis, 1858; Bonilla-Mirat, 1881). Ligeramente más tarde, Lewith y Hofmeister realizaron los primeros experimentos sistemáticos sobre la acción de distintas sales en la solubilidad de la ovoalbúmmina (Lewit, 1887; Hofmeister 1887). Así, clasificaron los distintos iones en función de su capacidad para precipitar la ovoalbúmina. Para los aniones (de sales sódicas) dedujeron que SO4 - > NO3 - > F- > Cl- > Br- > I- > SCN-. Para los cationes (de sales clóricas) el poder coagulante era Li+ > Na+ > K+ > NH4 + > Mg2+. Nótese aquí ya, en los iones monoatómicos, una aparente relación entre su poder liotrópico (su grado de inducción al orden) y su posición en el periodo de la Tabla Periódica.
Series inversas
Para varios sistemas, varios autores han observado la misma ordenación iónica que Hofmeister, pero también es cierto que bajo otras condiciones o trabajando con otras macromoléculas otros han observado tendencia opuestas. Un caso paradigmático es el de la lisozima (con punto isoeléctrico pI = 10-11) que a pH < pI, cuando presenta carga neta positiva, el impacto de los aniones en la solubilidad es el opuesto al reportado por Hofmeister con la ovoalbúmina (pI = 4-5) (Zhang, 2009). También la hemoglobina presenta series aniónicas (sales sódicas) y catiónicas (cloruros) inversa cuando el pH ≈ pI (Medda, 2013).
Este aparente vínculo entre el ordenamiento de las series iónicas y la relación entre el pH y el pI de la proteína (o macromolécula) en cuestión, hace pensar que el tipo de carga prevaleciente (p.e., positiva o negativa) es el fenómeno responsable de una u otra tendencia. Sin embargo, siendo esto cierto en parte, la densidad de carga de los grupos cargados parece ser determinante en el ordenamiento, tal y como se expondrá a continuación.
Impacto de los grupos químicos cargados en la macromolécula
El desarrollo de la química orgánica y el conocimiento de la química estructural de las macromoléculas permite estudiar mejor la fenomenología y adscribirla a efectos específicos entre iones y grupos químicos de macromoléculas. En particular, el carácter iónico de ciertos grupos de las macromoléculas, y en especial de las proteínas, permite hipotetizar los comportamientos en función de interacciones iónicas entre iones salinos y grupos de las macromoléculas ionizados (Okur, 2017; Fernández-d’Arlas, 2018).
Así también, algunos policationes sintéticos como ciertos poliuretanos cuaternizados (R3NH+), presentan una serie aniónica inversa cuando el pH < pI, es decir la capacidad precipitante era la inversa a la de Hofmeister, esto es: SCN- > I- > Br- > Cl- > F- (Fernándezd’Arlas, 2017).
Interacción de cationes con funciones carboxilato (-COO-).
Distintos trabajos experimentales y simulaciones, tanto con moléculas modelo como el glutamato como con proteínas naturales, han demostrado que la afinidad de los grupos carboxilatos es mayor hacia los cationes altamente hidratados, es decir se cumple generalmente la serie de Hofmeister según: Li+ > Na+ > K+ > Cs+ (Uejio, 2008; Kherb, 2012; Vlachy, 2009).
Interacción de aniones con funciones grupos amino (R3NH+)
En la naturaleza, las proteínas únicamente presentan un tipo de carga negativa, la derivada de la desprotonación de los ácidos carboxílicos (-COO-). Sin embargo, existen tres tipos de cargas positivas: R-NH3 +, R=NH2 +, R≤NH+, correspondientes a los grupos N-terminales y la lisina (Lis), arginina (Arg) y histidina (His), respectivamente (Figura 2). Esta variedad de cargas positivas hace que la fenomenología de las proteínas sea en general más complicada a pH < pI que a pH > pI, cuando únicamente se dispone de un tipo de carga negativa. En este caso, dependiendo de si el aminoácido es Lis, Arg o His, las cargas positivas varían en cuanto a la densidad de carga o carga efectiva, puesto que esta carga puede encontrarse en distinto grado de deslocalización, en función de la naturaleza de los grupos químicos asociados al nitrógeno amino (Mason, 2010).

Figura 2 Grupos iónicos en proteínas. Grupos con carga positiva ordenados en función de su densidad de carga: a) Histidina, b) Arginina y c) Lisina. d) Interacciones iónicas entre cadenas de proteínas. e) Ácido aspártico, como ejemplo de grupo negativo carboxilato.
Por ello, no todas las proteínas seguirán la misma respuesta fenomenológica en ciertas condiciones salinas o de pH, sino que ésta dependerá de la proporción de unos u otros aminoácidos en su composición. La prevalencia de una interacción iónica tipo macromolécula-macromolécula (Figura 2d) o ión-macromolécula dependerá de la afinidad al agua de los distintos grupos iónicos presentes (Fernández-d’Arlas, 2018).
En la Tabla 1 se recogen los datos de radio iónico cristalino, r c, de densidad de carga Z2/r c, y del coeficiente de viscosidad de la ecuación de Jones-Dole, B, junto con la entalpía, ∆H hidr, y energía libre de Gibbs de hidratación, ∆G hidr, de distintos iones amoniacales junto con las de otros cationes y aniones de relevancia. Puede verse que a medida que el grupo amonio está más sustituido por ramas alquídicas, aumenta el radio iónico (y su densidad de carga) y disminuyen sus entalpías y energías de hidratación.
Tabla 1 Propiedades fisicoquímicas de algunos iones relevantes que cuantifican su tendencia a la hidratación.
| Ion |
(nm) |
*Z2/rc (nm-1) |
†B∫ (dm3/mol) |
∆Hhidr§ (kJ∙mol-1) |
∆Ghidr§ (kJ∙mol-1) |
|
| Cationes | Li+ | 0,078 | 12,3 | 0,150 | -531 | -489 |
| Na+ | 0,11 | 9,3 | 0,085 | -416 | -383 | |
| K+ | 0,13 | 7,0 | -0,007 | -334 | -312 | |
| NH4+ | 0,16 | 6,4 | -0,007 | -329 | -296 | |
| (CH3)4N+ | 0,28 | 3,4 | 0,28 | -218 | -175 | |
| (CH3CH2)4N+ | 0,34 | 2,9 | 0,318 | - | - | |
| Aniones | F- | 0,12 | 8,1 | 0,100 | -510 | -472 |
| Cl- | 0,17 | 5,5 | -0,007 | -367 | -345 | |
| Br- | 0,19 | 5,3 | -0,032 | -336 | -318 | |
| I- | 0,20 | 4,7 | -0,068 | -291 | -280 | |
| HCO3- | - | 3,3 | 0,13 | -384 | -343 | |
| CH3COO- | 0,297 | 3,4 | 0,236 | -425 | -374 | |
| SO4-2 | - | - | - | -1138 | -1064 | |
∫ Datos recogidos en la publicación de B. Fernándezd’Arlas (2018) a partir de los autores citados.
†Coeficiente de la ecuación que relaciona la viscosidad de una disolución, h, con la concentración de un ión, C, según h/h o = 1 + AC 1/2 + BC, e indicativo de las interacciones ión-disolvente. Valores a 25 ºC.
*Parámetro proporcional a la densidad de carga (carga iónica, Z, dividido el radio cristalino, r c).
§Según Marcus (1997), a 25 ºC.
Por analogía, trasladando los valores de los grupos R3NH+ de la Tabla 1, a los aminoácidos Lis, Arg e His, el nitrógeno de la Lis tendría más densidad de carga y estaría más hidratado, y el de la His sería el menos hidratado. Según la fenomenología expuesta arriba y las distintas propiedades de iones es de manifiesto que las interacciones iónicas, han de jugar un papel importante de el comportamiento de las macromoléculas cargadas.
Los iones, no obstante, no solo interactúan con macromoléculas cargadas sino también con el esqueleto de las macromoléculas y grupos sin carga iónica.
Interacciones con el esqueleto de macromoléculas no-cargadas
Trabajos realizados con proteínas (Okur, 2017) u otros polímeros como el copolímero POE-POP-POE (polióxido de etileno-b-polióxido de propileno) (Patel, 2010), la poli(Nisopropilacrilamida) (PNIPAM) (Zhang, 2005), indican que la naturaleza de los iones y su grado de hidratación son determinantes en fenómenos como la coagulación, separación de fases o temperatura de nube. Diferentes estudios con polímeros modelo como péptidos (Pluharova, 2014) o poliuretanos (Fernández-d’Arlas, Huertos, Müller, 2018) indican que la fenomenología se atribuye al distinto grado de interacción de los iones con dipolos químicos como las amida (en proteínas) o uretano (en poliuretanos).
Esta revisión se centra en las interacciones interiónicas que, cualitativamente, son las que predominan. Para una mayor información respecto al impacto de sales sobre disoluciones de macromoléculas sin carga se remite a las referencias citadas arriba en este epígrafe o a la revisión bibliográfica de B. Fernández-d’Arlas (2016).
Iones caótropos e iones cosmótropos
Los iones caótropos, de gran radio iónico, son aquellos que introduces un mayor ‘caos’ estructural en el agua y reducen su viscosidad, tal y como se ve reflejado en sus coeficientes de viscosidad, B (ver Tabla 1). Por lo general, coincide con iones con una baja energía libre de hidratación, es decir que son iones poco hidratados. Al contrario, los cosmótrospos, de bajo radio iónico y alta densidad de carga, están altamente hidratados y introducen un mayor ‘orden’ en el agua, reflejándose en coeficientes de viscosidad positivos.
Algunos autores han tratado de explicar la fenomenología en base a la modificación del orden estructural del agua (Collins, 1997), pero estas premisas no son suficientes para explicar algunas fenomenologías observadas. Para explicar el conjunto de observaciones es necesario también considerar las interacciones directas entre los iones y las macromoléculas, bien con el esqueleto como se ha explicado en el epígrafe anterior, o bien con los grupos cargados de las macromoléculas. Para analizar este último punto cabe introducir el concepto de Afinidades al Agua Equivalente (AAE) propuesto por Morris (1969) en base a observaciones de solubilidad de sales alcalinas por Fajans (1921).
Ley de Afinidades de Fajans y Modelo de Afinidades Equivalentes
Tras observaciones de solubilidad de sales simples halógeno-alcalinas, a partir de Fajans, se estableció una relación entre la solubilidad y el radio iónico y entalpía de disolución de sus iones (Fajans, 1921). Se desarrolló así la Ley de Afinidades de Fajans o modelo de Afinidades al Agua Equivalente, también desarrollada por Morris (Morris, 1969). Este modelo que considera que la solubilidad de dos pares iónicos es menor cuando la diferencia entre energías libres de disolución de sus iones por separado se acerca a cero (Figura 3a).
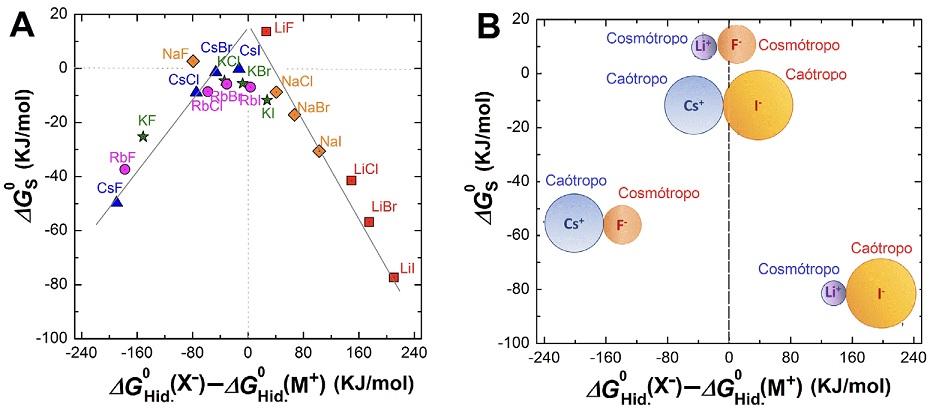
Figura 3 a) Relación de tipo ‘volcán’ de la energía libre de disolución, ∆G0 S, de distintos pares iónicos (sales) en función de la diferencia entre energía libre de hidratación de sus respectivos iones. b) Esquema conceptual en que se relaciona la tendencia a la solubilidad expuesta en (a) con los radios iónicos y su carácter cosmo o caotrópico.
De esta manera, los iones de similar radio iónico, y, por lo tanto, con similar tendencia a la hidratación tenderían a formar pares iónicos menos solubles (Figura 3b).
Aplicación de la Lay de Fajans a las interacciones ión-macromolécula
De igual manera que en el caso de los iones salinos aislados, las macromoléculas cargadas disponen de grupos químicos con una particular carga iónica, caracterizada por una densidad de carga y tendencia a la hidratación. Esta analogía introducida por Collins (1997) para las macromoléculas es capaz de explicar numerosas fenomenologías.
Ya se ha desarrollado en epígrafes anteriores cómo las proteínas poseen grupos químicos con distinta densidad de carga y tendencia a la hidratación. Igualmente, otras macromoléculas naturales y sintéticas también disponen de grupos químicos cargados eléctricamente capaces de interactuar con iones aislados acuosos de diferente manera. El distinto grado de interacción de los distintos pares iónicos, ión-macromolécula, da lugar a distintas fenomenologías vinculadas a su grado de hidratación, solubilidad y conformación. Ejemplos de estas fenomenologías se presentan a continuación para el caso de dos tensioactivos.
Dos ejemplos didácticos con tensioactivos iónicos
Aquí se presenta como ejemplo fenomenológico el comportamiento de dos tensioactivos, uno aniónico y otro catiónico, en presencia de distintas sales. El tensioactivo aniónico, el dodecil sulfato de sodio (DSS o SDS, por sus siglas en inglés) tiene una mayor tendencia a precipitar en presencia del catión K+, caotrópico según el coeficiente B (Figura 4a). También con una alta concentración de Na+. Sin embargo, no precipita en presencia de Li+ ni del NH4 +. Es por esta tendencia que el DDS es denominado también un ‘tensioactivo caótropo’ (Sharker, 2019), por interactuar favorablemente con cationes caótropos. Así, la precipitación del DSS puede vincularse, según la regla de afinidades AAE, con la similitud de la densidad de carga y tendencia a la hidratación de los cationes K+ y Na+ y las de la cabeza aniónica sulfonato R-SO3 -. Así, con estos cationes se formarían pares iónicos que minimizan la hidratación del tensioactivo DSS y haría prevalecer el carácter hidrófobo de la cola metilada, CH3-(CH2)11-, dando lugar a su segregación de la fase acuosa.

Figura 4 a) Esquema del tensioactivo aniónico dodecil sulfato de sodio, DSS o SDS y b) su comportamiento acuoso en presencia de distintas concentraciones (0,03M y 0,3M) de los cloruros indicados. c) Esquema del tensioactivo catiónico poli(cloruro de dialil dimetil amonio), PDDA y d) su comportamiento acuoso en presencia de distintas concentraciones (0,03M y 0,3M) de las sales potásicas indicadas.
Cabe mencionar aquí que, debido a las diferencias entre el anión sulfonato R-SO3 - y las cabezas carboxilato R-COO-, el orden de interacción de los cationes se invierte en este último caso, dando lugar a agregados de mayor tamaño micelar en presencia de sales según: Li+ > Na+ > K+ ≥ Cs+ (Vlachy y col. 2009). Para desarrollar mejor este modelo estaría bien disponer de datos sobre la entalpía, entropía y energía libre de hidratación de alguna sal de sulfónica (R-SO3 -), para comparar los datos con los del anión acetato (Tabla 1). Es muy posible que los valores de ∆G hidr de las sales sulfónicas sean inferiores a sus equivalentes acetato, y que ello venga a justificar esta inversión de la serie liotrópica según el modelo de AAE. De hecho, los trabajos computacionales de Vlachy y col. (2009), apuntan en esta dirección.
De manera similar, estudios con tensioactivos aniónicos han puesto de manifiesto que la naturaleza y concentración del contra-catión tiene un impacto directo sobre la física de las gotas de champú, sus dimensiones y estabilidad (Díaz-Ramírez, 2012).
También se estudia aquí el comportamiento del tensioactivo polimérico catiónico poli(cloruro de dialil dimetil amonio), PDDA, frente a distinto aniones (Figuras 4c,d).). Como puede verse el la Tabla 1, los valores de energía libre de hidratación de los cationes amoniacales (R)4N+, disminuyen según se sustituyen los hidrógenos por grupos alquídicos, atribuible a un aumento del radio iónico y disminución de su densidad de carga. La estabilidad del PDDA en agua es mínima en presencia del anión ioduro, I-, que presenta parámetros de densidad de carga y energía libre de hidratación, ∆G hidr más próximo al del tetrametil amonio, (CH3)4N+.
Conclusiones
El estudio de la estabilidad acuosa de dos tensioactivo iónicos, uno aniónico y otro catiónico, apoya el modelo de Afinidades al Agua Equivalentes de asociación entre pares iónicos. Estos estudios simplificados y demostrativos ponen de relevancia el alto grado de especificidad iónica de ciertos grupos químicos.
Esta afinidad iónica de las macromoléculas cargadas iónicamente hacia los respectivos contraiones es de gran relevancia en cuanto a su comportamiento acuoso. De esta manera la naturaleza y concentración del contraión son factores clave en su devenir en fase acuosa y, por lo tanto, en la función de la macromolécula.
La fenomenología ión-macromolécula tiene, por tanto, gran transcendencia e implicaciones en numerosos campos científicos, ambientales y técnicos.











 nueva página del texto (beta)
nueva página del texto (beta)


