Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.17 no.3 México sep. 2004
Rev Inst Nal Enf Resp Méx 2004; Vol. 17(3):215-231
REVISIÓN
EL MIOFIBROBLASTO, UNA CÉLULA MULTIFUNCIONAL EN LA PATOLOGÍA PULMONAR
CARLOS RAMOS ABRAHAM
Jefe del Departamento de Fibrosis Pulmonar, INER.
CARINA BECERRIL BERROCAL
Investigador en Ciencias Médicas C, Depto. de Fibrosis Pulmonar, Lab. de Biología Celular, INER.
JOSÉ G. CISNEROS LIRA
Investigador en Ciencias Médicas A, Depto. de Fibrosis Pulmonar, Lab. Biología Celular, INER.
MARTHA MONTAÑO RAMÍREZ
Investigador en Ciencias Médicas E, Depto. de Fibrosis Pulmonar, Laboratorio de Biología Celular, INER.
Trabajo recibido: 13-VIII-2004:
Aceptado: 17-IX-2004
Correspondencia
Dr. Carlos Ramos Abraham,
Jefe del Departamento de Fibrosis Pulmonar.
Instituto Nacional de Enfermedades Respiratorias.
Calzada de Tlalpan 4502, colonia Sección XVI.
México, DF., 14080.
Teléfono: 56 66 45 39
E-mail: cramos@iner.gob.mx
cramosa@prodigy.net.mx
RESUMEN
Los miofibroblastos representan una subpoblación de fibroblastos con un fenotipo similar al de las células del músculo liso, debido a que expresan a-actina de músculo liso en su citoesqueleto, aunque también como subpoblación exhiben diferencias fenotípicas entre sí en diferentes órganos, su fisiología es semejante en los diferentes tejidos y órganos en que se encuentren. Con base en su amplio espectro de síntesis y secreción de moléculas, tales como citocinas, interleucinas, quimiocinas, factores del crecimiento, lípidos, diversos mediadores fisiológicos, moléculas de la matriz extracelular, MMPs y TIMPs, desempeñan una participación muy importante durante la embriogénesis, organogénesis, inflamación, reparación y cicatrización, siendo además fundamentales en los diferentes procesos de regeneración y reparación (fibrosis) que ocurren en los distintos órganos. En el caso del sistema respiratorio, los miofibroblastos son importantes, tanto en las vías aéreas como en el pulmón, participando fundamentalmente en los diversos procesos patogénicos, ya sea en enfermedades con un patrón degradativo como el enfisema, o bien, con un patrón reparativo con depósito excesivo de los diversos componentes de la matriz extracelular, tal como ocurre en la fibrosis pulmonar y el asma. Son especialmente importantes en las diferentes formas de fibrosis pulmonar ya sea de causa conocida o idiopática. Esta última, a semejanza del asma, parece restringirse fundamentalmente a zonas del tejido adyacente a epitelios alveolares dañado, donde se da una relación fisiopatogénica neumocito tipo
II-miofibroblasto-fibroblasto. Los miofibroblastos se originan principalmente por transdiferenciación de fibroblastos y principalmente por estimulación del TGF-β1.
PALABRAS CLAVE: Fibroblasto, miofibroblasto, fibrosis pulmonar, matriz extracelular, a-actina de músculo liso.
ABSTRACT
Myofibroblasts are a fibroblast subpopulation with a phenotype similar to smooth muscle cells, since they express the cytoskeletal a-smooth muscle actin (α-SMA); however, in different organs, they show some phenotypical differences. Their physiology is similar in the different tissues and organs. Based on their extensive spectrum of synthesis and secretion of molecules such as cytokines, interleukins, chemokines, growth factors, lipids, diverse physiological mediators, molecules of the extracelullar matrix, MMPs and TIMPs, they play a very important role during embryogenesis, organogenesis, inflammation, repair and wound healing, besides being fundamental in the processes of regeneration and repair (fibrosis) that occur in the different organs. In the case of the respiratory system, the myofibroblasts are as important in the air ways as in the lung, mainly participating in the diverse pathogenic processes; whether in pathologies with a derivative pattern such as emphysema, or in diseases with a fibrogenic pattern with excessive synthesis of the diverse components of the extracellular matrix, as occurs in pulmonary fibrosis and asthma. Myofibroblasts are especially important in the different forms of pulmonary fibrosis whether idiopathic or of known cause. Idiopathic fibrosis, as asthma, seems to be essentially restricted to areas of tissue adjacent to damaged alveolar-epithelial areas, where a physiopathogenic relation of type II neumocyte-myofibroblast-fibroblast exists. On the other hand, myofibroblasts are mostly derived from fibroblast transdifferentiation by TGF-β1 stimulation.
KEY WORDS: Fibroblast, myofibroblast, pulmonary fibrosis, extracellular matrix, a-smooth muscle actin.
INTRODUCCIÓN
Durante los últimos 20 años, en una serie muy amplia de publicaciones ha sido evidenciada la existencia de la heterogeneidad fenotípica en los fibroblastos, de tal modo que existen diferentes subpoblaciones o subtipos de estas células. Algunas de éstas expresan en su citoesqueleto α-actina de músculo liso o α-SMA (del inglés, α- smooth muscle actin ), la cual es una proteína que forma parte del fenotipo de las células del músculo liso, pero no de los fibroblastos 1-4 . Por ello, los fibroblastos expresan, por decirlo de manera sencilla, un fenotipo "promedio" entre los ''fibroblastos clásicos" y las células de músculo liso; este hecho motivó a Gabianni en 1991 a sugerir que estas células se denominasen miofibroblastos 5,6 , partiendo con esto hacia una nueva línea de pensamiento en la biología de los fibroblastos, así como de los mecanismos de recambio metabólico, remodelación-regeneración y reparación de los tejidos conjuntivos en los que estas células participan. Actualmente, sabemos que los miofibroblastos desarrollan funciones muy importante durante el desarrollo ontogénico, crecimiento, diferenciación y mantenimiento del fenotipo de diferentes células y tejidos. Por otra parte, los miofibroblastos muestran un fenotipo similar en los diferentes tejidos en que se ubican, que son por cierto la mayoría; especialmente en su morfología, patrón proteico del citoesqueleto y en su patrón sintético. Sin embargo, en determinadas patologías pueden expresar fenotipos característicos 6
En este trabajo presentamos una revisión comparativa de los miofibroblastos con los "fibroblastos clásicos", en cuanto a aspectos morfológicos, inmunológicos, bioquímicos y fisiológicos; además, indicaremos su participación en algunas patologías pulmonares y describiremos algunos de los mecanismos que participan en su origen, activación y muerte.
EL CONCEPTO TRADICIONAL DE FIBROBLASTO
Los fibroblastos representan el tipo celular más abundante en los tejidos conectivos no cartilaginosos y participan de manera crucial en su fisiopatología. Las características fenotípicas de estas células se muestran en la Tabla I de manera comparativa con las de los miofibroblastos. Algunas de sus características son la forma fusiforme o de huso, la expresión de actinas F, β y γ en su citoesqueleto, un patrón de organelos típico de célula no secretora, la producción y remodelamiento de la matriz extracelular que realizan mediante la producción de diversas enzimas de la familia de las metaloproteinasas (matrix metalloproteinases: MMPs), tales como la colagenasa intersticial (MMP-1), gelatinasa A (MMP-2); proteoglicanasas, glicosaminoglicanasas y los TIMPs (del inglés, tissue inhibitors of metalloproteinase ). Entre las moléculas que sintetizan se encuentran diversos miembros de la familia de las colágenas, principalmente los tipos I y III, fibras elásticas, proteoglicanos, fibronectina y otras glicoproteínas, además de otras proteínas y proteasas, tanto constitutivas como inducibles. Por otra parte, interactúan con las diversas células locales e inflamatorias, a través de diferentes mediadores químicos como las interleucinas, quimiocinas, neuropéptidos y diversos factores de crecimiento 7-9
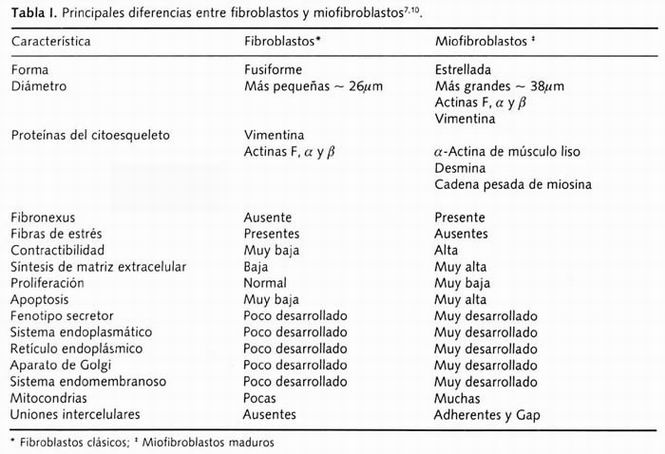
Tabla 1. Principales diferencias entre fibroblastos y miofibroblastos
EL CONCEPTO ACTUAL DE FIBROBLASTO
Es importante destacar que el concepto de fibroblasto, actualmente corresponde al de un grupo heterogéneo de células o subpoblaciones denominadas genéricamente como fibroblastos o células fibroblásticas, las cuales muestran fenotipos característicos en ciertos estadios fisiológicos o fisiopatogénicos 8-10 . Entre estas subpoblaciones se incluyen los "fibroblastos clásicos", los miofibroblastos, los lipofibroblastos, la célula intersticial contráctil (CIC) y los pericitos. Es importante considerar en este aspecto, que la distinción fenotípica entre estas células no está claramente definida, de tal forma que algunos autores aún consideran como miofibroblasto a las células estrelladas y los lipocitos del hígado y riñón 10 ; todas estas células poseen capacidad contráctil en mayor o menor grado, dependiendo fundamentalmente de la composición molecular en su citoesqueleto, por lo que dentro del ámbito del tejido u órgano en que se encuentren participan en las propiedades elásticas en estadios fisiológicos y patológicos 10
DEFINICIÓN DE MIOFIBROBLASTO
Los miofibroblastos se definen mediante criterios morfológicos e inmunológicos, siendo un aspecto fundamental en su fenotipo los tipos de filamentos proteicos contenidas en su citoesqueleto 3,4,10 . La definición más simple de miofibroblasto es que son células semejantes a células del músculo liso, fundamentalmente por expresar α-actina de músculo liso en su citoesqueleto 11-13 . Sin embargo, algunos científicos sugieren que los miofibroblastos representan un estado de diferenciación del fibroblasto mismo 11,14,15
En ambas condiciones, tanto in vitro como en tejidos fijados ( post mortem ), los miofibroblastos se pueden distinguir por diversas características morfológicas (Tabla I); los miofibroblastos demuestran como su principal característica la presencia de prominentes microfilamentos citoplásmicos de α-SMA, los cuales pueden estructurarse como fibras de estrés, que se ubican en diversos planos intracelulares. También los miofibroblastos se interconectan como lo hacen las células epiteliales, a través de uniones intercelulares tipos adherente y Gap 10,16,17 , presentan un fenotipo de célula secretora activa, mostrando por tanto abundante retículo endoplásmico, aparato de Golgi, mitocondrias, vacuolas y ribosomas; además, interactúan con la matriz extracelular a través de contactos membranales focales vía integrinas con la conformación de un complejo de microfilamentos transmembranales conocido como fibronexus, el cual se compone por las fibras de estrés altamente contráctiles en el ámbito intracelular y fibras de fibronectina de la matriz extracelular, los que se observan en los miofibroblastos maduros fundamentalmente 18 ; en la Figura 1 se muestra un esquema de fibroblastos maduros exhibiendo el fibronexus. La formación del fibronexus y su ensamblaje es estimulada y regulada por la vía de señalización del factor Rho, un miembro de la superfamilia de RAS 19 . Adicionalmente, es común observar una lámina basal incompleta alrededor de algunos miofibroblastos maduros. El fibronexus fue descubierto y caracterizado por Eyden y Cantor; su función consiste en interconectar las fibras de estrés constituidas por α-SMA a través de un complejo de integrinas transmembranales con las fibras de fibronectina de la matriz extracelular 18,20,21 , siendo además regulado por Rho-GTPasas, Rac 1-3, Cdc 42, y Rho AH, que responde a PDGF (del inglés, platelet derived growth factor ), TNFα (del inglés, tumoral necrosis factor-α ), bradicinina y lipopolisacáridos 22
La caracterización inmunocitoquímica de los miofibroblastos como en el caso de otras células eucariontes, se basa en el análisis de los tres sistemas de proteínas contenidos en el citoesqueleto 23 , que son: 1) microfilamentos de actinas; 2) filamentos intermedios de vimentina, desmina, laminina, proteína ácida fibrilar glial (GFAP); y 3) las tubulinas α y β de los microtúbulos (las cuales no han sido caracterizados con respecto a los subtipos de tubulinas). Los microfilamentos de actina se expresan en todos los tipos de células, todos los fibroblastos expresan las actinas F, β y γ, pero los miofibroblastos además de estas actinas expresan de manera muy importante la α-SMA 3,4,10 ; por otra parte, aun cuando los miofibroblastos no se han caracterizado por la presencia de las isoformas de miosina, en el caso de algunos cultivos de miofibroblastos pulmonares se ha observado que expresan tres de los ocho isoformas conocidas de miosina sarcomérica (MyHCs), y tres de las cadenas pesadas de miosina (antiguamente denominada tropomiosina), los tipos IIa, IId y embrionaria, todas estas necesarias para su actividad contráctil 24 ; observaciones similares han sido realizadas en miofibroblastos intestinales, células reticulares de los nódulos linfáticos, riñón y bazo 4,25 . Es importante destacar que, además de la importante presencia de la α-SMA que caracteriza a los miofibroblastos, se ha intentado clasificarlos utilizando la presencia de otros dos filamentos intermedios, la vimentina y la desmina 26 , pero al parecer la expresión de estas dos proteínas puede variar de acuerdo con las condiciones fisiopatológicas del tejido estudiado, la especie y otros factores ambientales que participen; por ejemplo, si las células se estudian in situ o in vitro, aun dentro de un mismo tejido, o bien, si las células son activadas por algún mensaje químico o por efecto de algún proceso patogénico 27 . Sin embargo, debido a que se han detectado por tinción inmunocitoquímica estos filamentos en algunos miofibroblastos, se ha propuesto una clasificación que incluye los siguientes subtipos 4 : aquellos que expresan sólo vimentina, denominados miofibroblastos tipo V; los que expresan vimentina y desmina llamados tipo VD; los que expresan vimentina, α-SMA y desmina que se les denomina tipo VAD; los que expresan vimentina y α-SMA que son el tipo VA; y los que expresan vimentina y miosina denotados como tipo VM. (Tabla II).


De manera que como existe cierta controversia en cuanto a la presencia de α-SMA como el criterio principal para definir como miofibroblasto a determinado grupo de fibroblastos, actualmente se acepta como un carácter generalizado, que si la célula es positiva para α-SMA se le puede considerar como miofibroblasto 7,8 . En cultivo, el tratamiento con TGF-β1 generalmente induce la expresión de α-SMA en casi todas las células fibroblásticas, produciéndose prácticamente un clon celular 28 . Por otra parte, la activación del fenotipo de células expresando α-SMA puede requerir además del TGF-β1 la interacción específica célula-matriz y con otros factores de crecimiento y estímulos, dependiendo de que sea necesario mantener el fenotipo de fibroblasto, o bien, que fuera necesaria la transdiferenciación hacia miofibroblasto 29-31
FUNCIONES DE LOS MIOFIBROBLASTOS
Se ha evidenciado la participación de los miofibroblastos en muchísimos procesos fisiológicos y patológicos; a continuación se citan algunos de ellos:
- Cicatrización, como un proceso de regeneración dentro de los mecanismos fisiológicos de crecimiento y diferenciación 2,32 , la que se desarrolla debido a que los miofibroblastos poseen alta capacidad contráctil, contribuyendo a la reducción del área de tejido en remodelación 33,34
- Síntesis, remodelación y reparación de la matriz extracelular en tejidos no cicatriciales, produciendo diversas moléculas de la matriz extracelular, tales como colágenas, fibras elásticas, glicosaminoglicanos, tenascina y fibronectina, entre otras, tanto a nivel intersticial como en las membranas basales epiteliales y endoteliales (Tabla III y referencias 34-37 ).

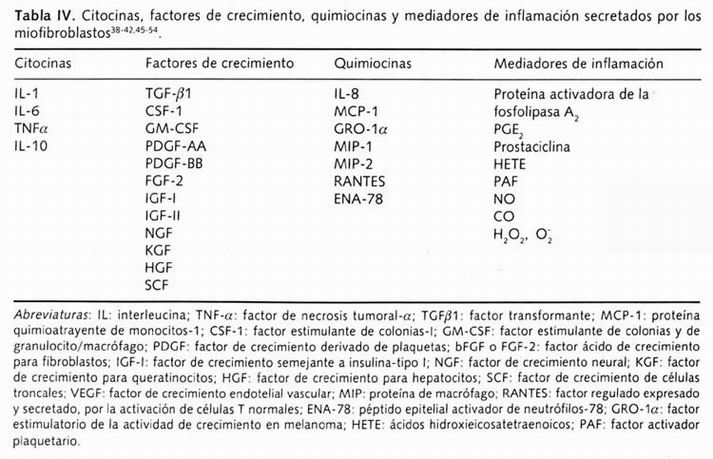
- Participan en la respuesta inmune como productores importantes, tanto de quimiocinas como de citocinas y otros mensajes químicos, ya sea estimulando o suprimiendo la respuesta inmune debido a la secreción de los diversos mediadores solubles que producen durante la inflamación tisular (Tabla IV y referencias 35,38-54); de manera que estimulan a los linfocitos, células troncales, neutrófilos para que participen en reacciones inmunológicas e inflamatorias 31
- Sintetizan diferentes prostaglandinas 50
- Expresan diversos receptores membranales (Tabla V y referencias 37,39,41,45,54-70 ).
- Participan en la remodelación activa de la matriz extracelular en tejidos en proceso fibrogénico o reparativo, produciendo los diversos componentes de la matriz extracelular, principalmente las colágenas tipos I y III 6,7,10
- Proliferación y diferenciación epitelial, parenquimatosa, vascular y neurogénica 70
- Participan de manera muy importante en el proceso de septación de los tabiques alveolares durante el desarrollo ontogenético del pulmón 7,10
- Expresan integrinas que forman parte del mecanismo de la adhesión de miofibroblastos a las proteínas de la matriz extracelular, misma que moldean en los diversos tejidos 71,72
- Participan en la formación de granulomas durante la cicatrización y otros procesos patogénicos 73
- Participan en la expulsión de la secreción gástrica debido a su capacidad contrácil 40
- Participan la movilidad de las vellosidades intestinales en el peristaltismo con su capacidad contráctil 74
- Regulan localmente del flujo de sangre en los órganos en proceso de cicatrización y con procesos infecciosos en el riñón 30
- Almacenan calcio en caveolas asociadas a su membrana plasmática, por lo que participan como "marcapasos" en el movimiento peristáltico intestinal 75 ; también debido a que los miofibroblastos se interconectan por uniones adherentes 75 por las que envían señales eléctricas generadas mediante flujos cíclicos del calcio que se transmiten a través de los sincicios y consecuentemente a todo lo largo del intestino.
- Sintetizan y secretan diversas citocinas, factores de crecimiento, quimiocinas y mediadores de inflamación (Tabla IV y referencias 35,38-54,57 ).
- En algunos tejidos producen óxido nítrico, actuando como reguladores importantes de la inflamación 76
- Expresan moléculas de adhesión intracelular, tales como la molécula de adhesión-1, molécula de adhesión vascular celular y la molécula de adhesión a células neurales 56
- Son responsables de la reacción desmoplástica observada en muchos tipos de neoplasias, es decir, la proliferación del tejido fibrogénico dentro de o adyacente al tumor mismo, lo que ha sido observado en carcinomas de glándula mamaria, tumores tipo carcinoide, en la enfermedad de Hodgkin y en melanomas malignos, entre otros 77
- Participan de manera muy importante en los procesos de restitución y reparación tisular 78

Tabla V. Familias de receptores expresados por los miofibroblastos
ORIGEN, ACTIVACIÓN, PROLIFERACIÓN Y MIGRACIÓN DE LOS MIOFIBROBLASTOS
En la Figura 1 se propone el posible mecanismo para el origen, activación y transdiferenciación de fibroblastos en miofibroblastos.
Existen diversas hipótesis acerca del origen de los miofibroblastos, algunas de éstas sugieren que se originan de las células troncales de la médula ósea, o de las células troncales residentes en los tejidos (cuyo origen a su vez resulta incierto) 78 , o que se transdiferencian de los fibroblastos locales 79 , o bien, que se derivan de células específicas en los diferentes tejidos, o que se derivan del músculo liso mismo 7,10,12 , o aún más, que se originan por la transdiferenciación de los fibrocitos sanguíneos 80 . Estas variadas posibilidades se encuentran en estudio actualmente, ya que aunque existen evidencias experimentales que apoyan algunas de estas hipótesis, faltan bastantes investigaciones para definir cuál o cuáles de estas hipótesis son correctas; en tal caso, éste es un problema central dentro del ámbito de la biología de los fibroblastos.
El mecanismo mejor estudiado acerca del origen de los miofibroblastos es el de la transdiferenciación de fibroblastos (Figura 1) 79 ; además, recientemente se sugirió que las células del túbulo renal (que son células endodérmicas) posiblemente se transdiferencien en miofibroblastos. En cuanto a los estímulos que dan origen a los fibroblastos, es importante considerar que existen evidencias de que los miembros del PDGF inducen la diferenciación de células troncales en fibroblastos, principalmente las isoformas PDGF-AA y PDGF-BB 52 . Se ha observado en ratones transgénicos tipo knockout para el gene de PDGF-AA, los cuales presentan 50% de mortalidad comparado con el tipo silvestre, siendo que los animales sobrevivientes carecen casi completamente de miofibroblastos alveolares; además, y muy importante, desarrollan enfisema pulmonar debido a una falla en el proceso de la septación alveolar 61 ; en contraste, los animales nacidos con interrupción del gene de PDGF-BB tienen una ausencia virtual de células renales mesangliales y defecto en la formación de la compleja estructura de los glomérulos 80 . Por otra parte, en animales transgénicos del tipo knockout para el gene PDGF-BB se ha observado la carencia de pericitos, el desarrollo de microaneurismas, cataratas en la retina, mala coagulación y heridas hemorrágicas con muy mala y deficiente cicatrización 41
Se han identificado diferentes factores de crecimiento, estímulos y moléculas que inducen la transdiferenciación de fibroblastos en miofibroblastos; entre éstos se encuentran el PDGF, TGF-β1 (del inglés, transforming growth factor-1β); la IL-1β (del inglés, interleukin -1β), el EGF (del inglés, epidermal growth factor), el TNFα ( tumoral necrosis factor-α ), el FGF-2 o bFGF ( basic fibroblasts growth factor), el IGF-I ( insulin-like growth factor-I) y el CTGF ( connective tissue growth factor ). Por otra parte, las isoformas del PDGF, además, de inducir la transdiferenciación de fibroblastos en miofibroblastos, son potentes mitogénicos para fibroblastos 7,10 . El SCGF ( stem cell growth factor) es otro probable estimulante en la diferenciación de las células troncales en fibroblastos 81 . Es importante destacar que el más potente factor que estimula la transdiferenciación de fibroblastos en miofibroblastos tanto in vivo como in vitro es el TGF-β1 82 . Además, en el hígado el TGF-β1 estimula no solamente la transdiferenciación de fibroblastos en miofibroblastos sino también la de miofibroblasto activados en miofibroblastos estrellados 83 . Esta transdiferenciación por supuesto induce toda una serie de cambios en la expresión génica, y por consiguiente en el fenotipo de síntesis y secreción de matriz extracelular; esta serie de cambios se indica de manera comparativa con los fibroblastos en la Tabla I.
Un aspecto importante recientemente publicado, es que el TGF-β1 desarrolla sus efectos estimuladores mediante la inducción de la síntesis y secreción de otros factores en decrecimiento con los que actúa sinérgicamente; tal es el caso del CTGF, el cual actúa en presencia de IGF-1 y TGF-β1 para estimular la transdiferenciación del fibroblasto en miofibroblasto; o bien, el CTGF que junto con EGF y TGF-β1 mantienen el fenotipo de fibroblasto, sin que éste se transdiferencie en miofibroblastos 84
En relación con aquellos factores y moléculas que actúan antagónicamente con el TGF-β1 y otros factores, reduciendo el porcentaje de miofibroblastos, se conoce el IFNγ (interferón gamma) 85 , el FGF-1 86 y el neuropéptido sustancia P 87 . Los mecanismos moleculares y las vías de señalización que participan en este mecanismo no han sido aclarados y se encuentran en proceso en diversas investigaciones. Los fibroblastos se transdiferencian en miofibroblastos estrellados, se activan y proliferan en medios de cultivo libres de suero o cuando son sembrados en baja densidad 88
El TGF-β1 parece ser, por tanto, hasta ahora, la citocina más importante en la inducción de la expresión de α-SMA y con esto el fenotipo de miofibroblasto 39 , así como de todas las diferencias que se indican en la Tabla I en relación con los fibroblastos 39 . La fuente de TGF- β1 en el tejido dañado puede ser de leucocitos polimorfonucleares, células parenquimatosas, células epiteliales y los mismos miofibroblastos de manera autocrina; en el caso del pulmón una fuente importante de esta citocina, al menos en el asma, son los eosinófilos 89 . Recientemente, se ha determinado que la activación del miofibroblastos requiere la presencia de moléculas de la matriz extracelular, y específicamente del dominio de ED-UN (EIIIA) de fibronectina 29 . Durante la cicatrización se sintetiza este dominio, el cual es un sitio obligatorio para la unión a membranas celulares, así como para otras moléculas de la matriz extracelular. Se ha mostrado en tejido de la granulación de piel en etapa de granulación 90 y modelos hepáticos 29 que este dominio es necesario para que TGF- β1 induzca la expresión de a-SMA y la secreción de colágena por los miofibroblastos, además de que es un inductor de apoptosis 39 . Por otra parte, el PDGF parece ser el factor principal factor inductor de la proliferación en fibroblastos y miofibroblastos 91
El TGF-β1 pertenece a una superfamilia de factores de crecimiento generalmente soluble, muy importantes en procesos como la ontogenia, desarrollo, crecimiento, cicatrización y fibrogénesis 7,10 . TGFβ-1, TGFβ-2, y TGFβ-3 son codificados por tres genes separados, el TGFβ-1 que es la isoforma más abundante en la cicatrización es secretado en una forma latente y almacenada en la plasmática y matriz de extracelular para posteriormente ser activado.
El EGF 37 , GM-CSF 39 , y FGF-1 y FGF-2 (αFGF y βFGF, respectivamente) 1,2,39 , el IGF-I, IGF-II son los factores que se cree promueven la proliferación de miofibroblastos 92 . Algunas citocinas proinflamatorias como TNFα, IL-1β, IL-6, y IL-8 son capaces de inducir la activación y proliferación de estas células. Por su parte, la IL-4 que es antiinflamatoria parece ser antagónica con estas últimas citocinas 93
La angiotensina II, aldosterona, trombina y endotelina-1 son los factores solubles también importantes en la promoción de la activación de miofibroblastos 64 . La endotelina-1, por ejemplo, es capaz de inducir, tanto en el intestino como in vitro y en tan sólo 30min, la transdiferenciación de fibroblastos en miofibroblastos estrellados activados 66 , además de inhibir su proliferación e incrementar la apoptosis 81
En cocultivos de fibroblastos y miofibroblastos con células de cáncer y otros tipos celulares, se induce la transdiferenciación de fibroblastos en miofibroblastos, así como su activación 50 . Esta propiedad de las células neoplásicas, quizá vía secreción de hormonas de crecimiento, tales como TGF-β1, puede ser responsable de la reacción desmoplástica tisular que incluye un proceso de fibrosis observado en diversos tipos de cáncer.
PARTICIPACIÓN DE LOS MIOFIBROBLASTOS EN LA CICATRIZACIÓN
El proceso de cicatrización se encuentra sumamente orquestado en la formación del tejido de granulación, el cual trae consigo la liberación de citocinas proinflamatorias, eicosanoides de las vías de la ciclooxigenasa y lipooxigenasa, citocromo P-450, óxido nítrico y diversos factores de crecimiento; además de la secreción de colágena y otras proteínas de la matriz extracelular, la elaboración de factores angiogénicos, angiostáticos y factores de crecimiento; finalmente, si la herida es profunda o abierta ocurre un proceso de reparación con fibrosis localizada 94 . En este contexto, los miofibroblastos parecen ser las células clave en estos acontecimientos, se activan y proliferan en las etapas tempranas de la herida contrayéndola; más adelante, mediante la estimulación por diversas citocinas proinflamatorias, sintetizan proteínas de la matriz extracelular, con las que se regenera el tejido; finalmente estos miofibroblastos, cuando ya se ha resuelto la herida, son inducidos a morir por apoptosis 16
EL PAPEL DE LOS MIOFIBROBLASTOS EN EL PROCESO DE REPARACIÓN
Los tejidos epiteliales tales como el intestino y el estómago, en contraste con los órganos parenquimatosos como el hígado, el riñón y el pulmón, no desarrollan comúnmente una fibrosis uniforme. Sin embargo, los tejidos epiteliales gastrointestinales como se hieren a menudo en su superficie, generalmente por exfoliación epitelial, producen una respuesta en defensa a ciertos agentes nocivos tales como las toxinas, invasión microbiológica o reacciones anafilácticas 7,10 . En el primero, si la membrana basal es desnudada de las células epiteliales, las células residuales que permanecen intactas ya no se duplican y no se reepiteliza el epitelio; entonces los miofibroblastos atraviesan la membrana basal mediante remodelación y se extienden, además de interconectarse por sus uniones adherentes y sintetizar el fibronexus por regulación del factor Rho y su vía de señalización, lo cual se coordina con la expresión de integrinas, permitiendo la fijación de los miofibroblastos a la matriz extracelular 72 . Este proceso se conoce como restitución. Las prostaglandinas COX-1 o COX-2 son los factores clave que promueven este proceso de restitución 81 . Otros factores que estimulan a los miofibroblastos para desarrollar este proceso son, TGF-β1, EGF, FGF-1, y FGF-2 y citocinas como IL-1 e IFNγ promueven también la restitución 78 . Opuestamente, en el segundo mecanismo, sí la herida es más profunda, los tejidos subepiteliales que contienen la matriz extracelular intersticial, los vasos sanguíneos, los nervios y fibroblastos deben ser entonces reconstruidos. En este caso, sí la membrana basal ha sido destruida por el estímulo nocivo, las células epiteliales y mesenquimatosas forman una nueva membrana basal y las células troncales experimentan mitosis, proliferan y emigran por la membrana basal nuevamente formada, y se originan miofibroblastos a partir de fibroblastos. Este último proceso es un acontecimiento coordinado que implica secreción de proteínas de matriz extracelular y factores de crecimiento, así como la participación de los miofibroblastos. Ergo, los miofibroblastos son cruciales en los procesos de restitución y reparación 78
SÍNTESIS Y DEGRADACIÓN DE MATRIZ EXTRACELULAR POR LOS MIOFIBROBLASTOS
Dado que la matriz extracelular se constituye por una mezcla compleja de colágenas, fibras elásticas, proteoglicanos y diversas glicoproteínas, con un arreglo específico en cada tejido u órgano 95,96 , y con una relación fisiopatológica específica, es importante analizar el patrón sintético y degradativo de los miofibroblastos. En la Tabla IV se citan las moléculas del metabolismo de la matriz extracelular que sintetizan y degradan los miofibroblastos. Éstos sintetizan y degradan varios de los 19 tipos de colágena, secretan las colágenas I, III, IV, y VIII 97 , proteoglicanos, tenascina, laminina, perlecano 35 . Secretan MMPs 1-3, degradan MMP-1, MMP-2, colágenas I, II, III; colágena nativa IV, MMP-3 (estromelisina), degradan laminina, fibronectina, proteoglicanos, colágena de tipo IV y caseína 97 . Además, secretan los diferentes TIMPs 97 . Los factores del crecimiento pueden unir proteoglicanos de heparán sulfato con colágena, controlando así la disponibilidad temporal de ambos y especialmente, para modificar su actividad biológica 36
LOS FACTORES DEL CRECIMIENTO SECRETADOS POR LOS MIOFIBROBLASTOS
En la Tabla III se muestra cuáles son los principales citocinas, factores de crecimiento, quimiocinas y mediadores inflamatorios que secretan los miofibroblastos.
Los factores del crecimiento secretadas por miofibroblastos tienen tres funciones generales de la siguiente manera: 1) iniciar o aumentar la movilidad de la célula,
2) inducir proliferación, es decir, ellos son mitógenos de manera paracrina para células epiteliales y parenquimatosas, y posiblemente como mitógenos de autocrinos, 3) inducen la diferenciación terminal de estas células, o bien, pueden inducir apoptosis de manera paracrina y/o autocrina; algunos factores del crecimiento parecen tener los tres efectos 10, 92
Entre los factores de crecimiento producidos por los miofibroblastos y que se enlistan en la Tabla III, se encuentra el TGF-β1, el cual induce la expresión de receptores de PDGF y la secreción de CTGF, causando la proliferación y diferenciación al aparecer como una respuesta autocrina al TGF- β1 10
En la reparación de los tejidos se ha observado la secreción de IL-1β 60 , IL-6, IL-15 7,10 , y TNFα que son mitógenos para varias líneas de células epiteliales y mesenquimatosas; además, ciertas combinaciones de factores de crecimiento y citocinas y pueden tener otros efectos estimulatorios que modifiquen la proliferación y otros factores, lo que complica su participación 10, 51
Los miofibroblastos secretan EGF y TGFβ1, el IGF-I e IGF-II 7,10 , HGF 28,84 , y miembros de la familia de FGF, tales como FGF-1 y FGF-2 y FGF-7 (también conocido como KGF (del inglés, Keratonocite Growth Factor). Este último ha demostrado ser uno de los principales mitógenos para diversas células epiteliales y parenquimatosas 10, 71,98
FGF-1 y FGF-2 son importantes mitógenos para los miofibroblastos y tienen un poderoso efecto neurotrófico y angiogénico durante la cicatrización 68 . Otros factores angiogénicos secretados por miofibroblastos incluyen la familia de CXC de citocinas como IL-8 y el péptido activado por neutrófilos (ENA-78). El contacto célula a célula, tal como ocurre en la cicatrización, posee una acción antiapoptótica vía N-caderinas, la cual actúa activando el receptor de FGF y estimulando con esto un efecto de antiapoptótico, al menos para FGF-2 10,71,91
IGF-I e IGF-II son dos factores que no se ha definido bien si inducen metabolismo proliferativo de fibroblastos, o más bien, si son parte del mecanismo para transdiferenciar y mantener el fenotipo de miofibroblasto, ya que son factores que se incrementan en las diferentes formas de fibrosis 45
PARTICIPACIÓN DE MIOFIBROBLASTOS EN PROCESOS FIBROSANTES
Por razones poco claras hay una alteración en la regulación de las señales que inducen el proceso de regeneración, llevando a la reparación o fibrosis, la que se considera como un proceso patogénico 7,10 . Actualmente, los miofibroblastos son el denominador celular común a todas las formas de fibrosis analizadas. Todas éstas muestran un patrón muy similar, siendo la célula determinante del desarrollo de la fibrosis activa e irreversible el miofibroblasto; esto involucra, además, factores de crecimiento comunes, tales como PDGF, TGF-β1, CTGF y IGF-I, entre otros 3,71 . El TGF-β1 está también presente como inductor profibrosante en modelos animales transgénicos de fibrosis, o por su misma sobreexpresión en ratones 83-85
LOS MIOFIBROBLASTOS EN EL ASMA, LA EPOC Y EL CÁNCER
Así como se ha observado en otros órganos, en el pulmón se desarrollan diferentes procesos de fibrosis, tanto al nivel de las vías aéreas como al nivel del parénquima pulmonar. En el caso de las vías aéreas, el proceso fibrogénico que se desarrolla y que implica la presencia importante de los miofibroblastos es el asma, mientras que en parénquima pulmonar se desarrollan procesos, tanto de etiología conocida como desconocida o idiopática 99-102
Entre los acontecimientos fisiopatogénicos que ocurren en la inflamación y remodelación de las vías aéreas en el asma se encuentran los siguientes eventos: 1) infiltración por macrófagos y linfocitos; 2) proliferación de fibroblastos que pueden transdiferenciarse en miofibroblastos; 3) angiogénesis; 4) incremento de tejido conectivo (fibrosis), y 5) la destrucción del tejido. Estos eventos alteran el músculo liso, las glándulas mucosas y tienen la capacidad de modificar la función de la vía aérea, causando la hiperreactividad en los pacientes con asma. Sin embargo, no se conoce cómo es que los cambios estructurales que ocurren en la pared de la vía aérea contribuyen a la alteración funcional de la vía aérea en el asma. Se sabe por estudios en biopsias que la colágena se deposita de manera excesiva en la membrana basal, aunque no se demuestre clínicamente de manera clara. En cuanto a la cascada de eventos que ocurren en el epitelio bronquial y su impacto potencial en la remodelación se encuentran: 1) la pérdida de la integridad de epitelio, debida por lo menos en parte a la apoptosis, ya que la mayoría de las células epiteliales, bronquiales y ciliadas experimentan descamación: 2) por otro lado, las células epiteliales elementales que permanecen conectadas a la membrana basal expresan altos niveles de Bcl-2, una molécula de antiapoptótica, como parte de un intento de reparación, 3) este proceso, sin embargo, no se puede alcanzar debido a una habilidad reducida de las células epiteliales para experimentar proliferación, 4) además, las células epiteliales parecen estar activadas por la expresión aumentada del factor nuclear kb, con el cual se liberan varios mediadores implicados en la inflamación y la reparación, inclusive TGF-β1. Como resultado de este círculo vicioso, el epitelio llega a ser una fuente de mediadores como los factores de crecimiento y citocinas, que perpetúan el daño al epitelio y promueven la deposición exagerada de proteínas de matriz al desarrollarse la remodelación de la vía aérea. Este fenómeno implica una interacción epitelio-mesénquima tal como ocurre con otras formas de fibrosis. Nuevamente el TGF-β1 parece ser el principal factor que induce la transdiferenciación de los fibroblastos en miofibroblastos, y que se considera como el principal agente profibrogénico en las vías aéreas 103
Entonces, tanto los fibroblastos como los miofibroblastos contribuyen a la remodelación del tejido en la vía aérea, sintetizando y secretando colágenas y otros componentes 0de la matriz extracelular, tales como elastina, fibronectina y laminina. Sin embargo, se ha visto que se incrementa el porcentaje de miofibroblastos en las vías aéreas de pacientes asmáticos, y su número parece tener correlación con el espesor de la membrana basal 104 . Por otra parte, el porcentaje de miofibroblastos se incrementa como resultado del reto alergénico 105 . Los miofibroblastos son regulados por los linfocitos T y al parecer el o los principales factores quimioatrayentes para miofibroblastos son producidos por los eosinófilos; además, se considera a los eosinófilos como la principal fuente de TGF-β1 106
Es importante destacar que existen varias características fisiopatogénicas entre la fibrosis del asma y las otras formas de fibrosis que ocurren en los diferentes órganos; la fibrosis en el asma se produce en la membrana basal de la vía aérea, como el resultado de un desequilibrio entre los niveles de MMPs y sus inhibidores específicos que son los TIMPs.
Una de las MMPs que desempeña una participación crucial en el asma y cuyos niveles se incrementan es la MMP-9 (gelatinasa B), algunos de cuyos sustratos son la colágena tipo IV nativa, colágena tipo V, gelatina, entactina, proteoglicanos y elastina. Por otra parte, un exceso de TIMP-1 en relación a MMP-9 ha sido observado en pacientes con asma, lo que parece contribuir junto con la presencia de los miofibroblastos y fibroblastos a la fibrosis de la vía aérea 107,108 . También como en otras fibrosis se encuentran incrementados prácticamente las mismas moléculas y factores de crecimiento, tal es el caso del TGF-β1, IGF-1 y EGF, entre otros 109 . En la enfermedad pulmonar obstructiva crónica operan mecanismos semejantes a los descritos en el asma, siendo los miofibroblastos y el TGF-β1 centrales 109, 111,112
LA FIBROSIS PULMONAR Y EL MIOFIBROBLASTO
La presencia de miofibroblastos en pacientes con fibrosis pulmonar se ha documentado, tanto en tejidos pulmonares de pacientes con fibrosis pulmonar como en los de modelos animales con esta enfermedad 106-108,113 . Estudios diversos de corte bioquímico y genético han mostrado que los focos de fibroblastos y miofibroblastos adyacentes a las lesiones en el epitelio pulmonar dañado son los responsables del depósito anormal e incrementado de matriz extracelular, principalmente las colágenas I y III 109,113 , lo cual se determinó además como los sitios con deposición activa de matriz extracelular, encontrándose que los miofibroblastos son los principales responsables de la síntesis activa de matriz extracelular, de manera semejante a los procesos normales del tejido de granulación de las heridas 106-108 . De modo que los miofibroblastos son las fuentes de expresión y síntesis de matriz extracelular alveolar e intraalveolar, tal como ocurre en la vía aérea en el asma y en otros procesos fibrosantes.
Se ha demostrado que ciertos factores de crecimiento y citocinas se presentan en concentraciones elevadas en estas lesiones prefibróticas con focos de fibroblastos/miofibroblastos. Tal es el caso del TGF-β1 que es considerado el principal agente profibrogénico 101,112 . Como en otros órganos, el TGF-β1 induce la transdiferenciación de fibroblastos en miofibroblastos, pero además proporciona otro efecto muy importante para la perpetuación del proceso fibrogénico, el cual es proporcionar cierta protección contra la muerte celular por apoptosis 109,113 ; de manera que los miofibroblastos pulmonares no se comportan en este sentido como los de la cicatrización, los cuales son eliminados por apoptosis y desaparecen una vez resuelta la cicatrización de la herida 8,113 . Este fenómeno parece relacionarse con la presencia de una elevada proporción de miofibroblastos que poseen el fenotipo ya citado previamente, pero además, con una elevada actividad de las telomerasas, lo que trae como consecuencia el mantenimiento de una población de miofibroblastos activados en duplicación celular, síntesis de matriz extracelular y sobrevivencia, la cual parece estar presente en las diferentes etapas del proceso fibrogénico pulmonar y hasta su consumación 102
CONCLUSIONES Y PERSPECTIVAS
Los miofibroblastos son células presentes en prácticamente todos los tejidos, mostrando un fenotipo muy semejante en todos ellos. Participan en todos los procesos morfogenéticos, fisiológicos y fisiopatogénicos en los que ha sido analizada de manera dirigida su participación.
En el caso específico de los diferentes procesos fibrogénicos que se desarrollan en los diferentes tejidos, presentan una participación crucial y exhiben un fenotipo también similar. De tal manera, que los miofibroblastos pueden ser considerados como el común denominador de todos los procesos fibrogénicos. En el caso del aparato respiratorio, son fundamentales cuando menos, en los estadios fisiopatogénicos de la fibrosis pulmonar, asma, enfermedad pulmonar obstructiva crónica y cáncer. A pesar de esto, se necesitan más estudios para utilizar el mismo potencial que los miofibroblastos muestran en la patología pulmonar, pero con el objetivo de explorar nuevas medidas terapéuticas que revierten esos mismos procesos. Por ejemplo, a través de su manipulación genética, para así con los mismos miofibroblastos modificados revertir los procesos fibrogénicos en los cuales participan.
REFERENCIAS
1. Fries KM, Blieden T, Looney RJ, Sempowski GD, Silvera MR, Willis RA, et al. Evidence of fibroblast heterogeneity and the role of fibroblast subpopulations in fibrosis. Clin Immunol Immunopathol 1994;72:283-292. [ Links ]
2. Komuro T. Re-evaluation of fibroblasts fibroblast-like cells. Anat Embryol 1990;182:103-112. [ Links ]
3. Sappino AP, Schurch W, Gabbiani G. Differentiation repertoire of fibroblastic cells: Expression of cytoskeletal proteins as marker of phenotypic modulations. Lab Invest 1990;63:144-161. [ Links ]
4. Schmitt-Graff A, Desmouliere A, Gabbiani G. Heterogeneity of myofibroblast phenotypic features: an example of fibroblastic cell plasticity. Virchows Arch 1994;425:3-24. [ Links ]
5. Gabbiani G, Rungger-Brandle E. The fibroblast. In: Glynn LE, editor. Handbook of inflammation. Tissue repair and regeneration. Amsterdam:Elsevier/North-Holland Biomedical; 1981.p.1-50. [ Links ]
6. Gabbiani G, Ryan GB, Majne G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia 1971;27:549-550. [ Links ]
7. Powell DW, Mifflin RC, Valentich JD, Crowe SE, Saada JI, West AB. Myofibroblast I. Paracrine cell important in health and disease. Am J Physiol 1999;277 (1 Pt 1):C1-9. [ Links ]
8. Phan SH. Fibroblast phenotypes in pulmonary fibrosis. Am J Respir Cell Mol Biol 2003;29 (3 Suppl):87-92. [ Links ]
9. Fries KM, Blieden T, Looney RJ, Sempowski GD, Silvera MR, Willis RA, et al. Evidence of fibroblast heterogeneity and role of subpopulations in fibrosis. Clinical Immunol Immunopathol 1994;72:283-292. [ Links ]
10. Thomasek JJ, Gabbiani G, Linz B, Chaponnier C, Brown R. Myofibroblast and mechano-regulation of connective tissue remodelling. Nature Rev 2002;3:349-363. [ Links ]
11. Kohnen G, Kertschanska S, Demir R, Kaufmann P. Placental villous stroma as a model system for myofibroblast differentiation. Histochem Cell Biol 1996; 105:415-429. [ Links ]
12. Ronnov-Jessen L, Petersen OW, Koteliansky VE, Bissell MJ. The origin of the myofibroblasts in breast cancer: recapitulation of tumor environment in culture unravels diversity and implicates converted fibroblasts and recruited smooth muscle cells. J Clin Invest 1995;95:859-873. [ Links ]
13. McCaffrey TA, Du B, Consigli S, Szabo P, Bray PJ, Hartner L, et al. Genomic instability in the type II TGF-beta1 receptor gene in atherosclerotic and restenotic vascular cells. J Clin Invest 1997;100:2182-2188. [ Links ]
14. Hayward SW, Rosen MA, Cunha GR. Stromal-epithelial interactions in the normal and neoplastic prostate. Br J Urol 1997;79 (Suppl 2):18-26. [ Links ]
15. Kassen A, Sutkowski DM, Ahn H, Sensibar JA, Kozlowski JM, Lee C. Stromal cells of the human prostate: Initial isolation and characterization. Prostate 1996;28:89-97. [ Links ]
16. Darby I, Skalli O, Gabbiani G. Alpha-smooth muscle actin is transiently expressed by myofibroblasts during experimental wound healing. Lab Invest 1990;63:21-29. [ Links ]
17. Tang WW, Ulich TR, Lacey DL, Hill DC, Qi M, Kaufman SA, et al. Platelet-derived growth factor-BB induces renal tubulointerstitial myofibroblast formation and tubulointerstitial fibrosis. Am J Pathol 1996;148:1169-1180. [ Links ]
18. Eyden BP. Brief review of the fibronexus and its significance for myofibroblastic differentiation and tumor diagnosis. Ultrastruct Pathol 1993;17:611-622. [ Links ]
19. Hall A. Rho GTPases and the actin cytoskeleton. Science 1998;279:509-514. [ Links ]
20. Singer II. The fibronexus: a transmembrane association of fibronectin-containing fibers and bundles of 5 nm microfilaments in hamster and human fibroblasts. Cell 1979;16:675-685. [ Links ]
21. Singer II, Paradiso PR. A transmembrane relationship between fibronectin and vinculin ( 130 kDa protein ): Serum modulation in normal and transformed hamster fibroblasts. Cell 1981;24:481-492. [ Links ]
22. Adler KB, Low RB, Leslie KO, Mitchell J, Evans JN. Contractile cells in normal and fibrotic lung. Lab Invest 1989;60:473-485. [ Links ]
23. Fuchs E, Cleveland DW. A structural scaffolding of intermediate filaments in health and disease. Science 1998;279:514-519. [ Links ]
24. Rice NA, Leinwand AL. Skeletal myosin heavy chain function in cultured lung myofibroblasts. J Cell Biol 2003;163:119-129. [ Links ]
25. Torihashi S, Gerthoffer WT, Kobayashi S, Sanders KM. Identification and classification of interstitial cells in the canine proximal colon by ultrastructure and immunocytochemistry. Histochemistry 1994;101:169-183. [ Links ]
26. Mermall V, Post PL, Mooseker MS. Unconventional myosins in cell movement, membrane traffic, and signal transduction. Science 1998;279:527-533. [ Links ]
27. Powell DW, Mifflin RC, Valentich JD, Crowe SE, Saada JI, West AB. Myofibroblasts II. Intestinal subepithelial myofibroblasts. Am J Physiol 1999;277 (Cell Physiol 46):C183-C201. [ Links ]
28. Simmons JG, Pucilowska JB, Lund PK. Autocrine and paracrine actions of intestinal fibroblast-derived insulin-like growth factors. Am J Physiol 1999;276 (Gastrointest Liver Physiol 39):G817-G827. [ Links ]
29. Jarnagin WR, Rockey DC, Koteliansky VE, Wang SS, Bissell DM. Expression of variant fibronectins in wound healing: cellular source and biological activity of the EIIIA segment in rat hepatic fibrogenesis. J Cell Biol 1994;127:2037-2048. [ Links ]
30. Kaneda K, Ekataksin W, Sogawa M, Matsumura A, Cho A, Kawada N. Endothelin-1-induced vasoconstriction causes a significant increase in portal pressure of rat liver: Localized constrictive effect on the distal segment of preterminal portal venules as revealed by light and electron microscopy and serial reconstruction. Hepatology 1998;27:735-747. [ Links ]
31. Gabbiani G. The cellular derivation and the life span of the myofibroblast. Pathol Res Pract 1996;192:708-711. [ Links ]
32. Hebda PA, Collins MA, Tharp MD. Mast cell and myofibroblast in wound healing. Dermatol Clin 1993;11:685-696. [ Links ]
33. Guido M, Rugge M, Chemello L, Leandro G, Fattovich G, Giustina G, et al. Liver stellate cells in chronic viral hepatitis: the effect of interferon therapy. J Hepatol 1996;24:301-307. [ Links ]
34. Tomasek JJ, Haaksma CJ, Eddy RJ, Vaughan MB. Fibroblast contraction occurs on release of tension in attached collagen lattices: dependency on an organized actin cytoskeleton and serum. Anat Rec 1992;232:359-368. [ Links ]
35. Simon-Assmann P, Kedinger M, de Arcangelis A, Rousseau V, Simo P. Extracellular matrix components in intestinal development. Experientia 1995;51:883-900. [ Links ]
36. Birchmeier C, Birchmeier W. Molecular aspects of mesenchymal-epithelial interactions. Annu Rev Cell Biol 1993;9:511-540. [ Links ]
37. Kovacs EJ, DiPietro LA. Fibrogenic cytokines and connective tissue production. FASEB J 1994;8:854-861. [ Links ]
38. Pache JC, Christakos PG, Gannon DE, Mitchell JJ, Low RB, Leslie KO. Myofibroblasts in diffuse alveolar damage of the lung. Mod Pathol 1998;11:1064-1070. [ Links ]
39. Border WA, Noble NA. Transforming growth factor in tissue fibrosis. N Engl J Med 1994;331:1286-1292. [ Links ]
40. Pfeilschifter J. Mesangial cells orchestrate inflammation in the renal glomerulus. News Physiol Sci 1994;9:271-276. [ Links ]
41. Lindahl P, Johansson BR, Leveen P, Betsholtz C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science 1997;277:242-245. [ Links ]
42. Berndt A, Kosmehl H, Mandel U, Gabler U, Luo X, Celeda D, et al. TGF-beta and bFGF synthesis and localization in Dupuytren's disease (nodular palmar fibromatosis) relative to cellular activity, myofibroblast phenotype and oncofetal variants of fibronectin. Histochem J 1995;27:1014-1020. [ Links ]
43. Campbell SE, Katwa LC. Angiotensin II stimulated expression of transforming growth factor-1 in cardiac fibroblasts and myofibroblasts. J Mol Cell Cardiol 1997;N29:1947-1958. [ Links ]
44. Flaumenhaft R, Abe M, Mignatti P, Rifkin DB. Basic fibroblast growth factor-induced activation of latent transforming growth factor in endothelial cells: regulation of plasminogen activator activity. J Cell Biol 1992;118:901-909. [ Links ]
45. Lund PK. Insulin-like growth factors. In: Dockray G, Walsh JH, editors. Gut peptides: Biochemistry and physiology. New York: Raven; 1994.p. 587-613. [ Links ]
46. Rubin JS, Bottaro DP, Chedid M, Miki T, Ron D, Cheon G, et al. Keratinocyte growth factor. Cell Biol Int 1995;19:399-411. [ Links ]
47. Goke M, Kanai M, Podolsky DK. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. Am J Physiol 1998;274 (Gastrointest Liver Physiol 37):G809-G818. [ Links ]
48. Klimpel GR, Langley KE, Wypych J, Abrams JS, Chopra AK, Niesel DW. A role for stem cell factor (SCF): c-kit interaction(s) in the intestinal tract response to Salmonella typhimurium infection. J Exp Med 1996;184:271-276. [ Links ]
49. Casola A, Kapoor A, Saada JI, Mifflin R, Powell DW, Crowe SE. Chemokine expression by intestinal myofibroblasts (Abstract). Gastroenterology 1997;112:A944. [ Links ]
50. Berschneider HM, Powell DW. Fibroblasts modulate intestinal secretory responses to inflammatory mediators . J Clin Invest 1992;89:484-489. [ Links ]
51. Xing Z, Gauldie J, Cox G, Baumann H, Jordana M, Lei XF, et al. IL-6 is an antiinflammatory cytokine required for controlling local or systemic acute inflammatory responses. J Clin Invest 1998;101:311-320. [ Links ]
52. Valentich JD, Powell DW. Intestinal subepithelial myofibroblasts and mucosal immunophysiology. Curr Opin Gastroenterol 1994;10:645-651. [ Links ]
53. Forstermann U, Boissel JP, Kleinert H. Expressional control of the "constitutive" isoforms of nitric oxide synthase (NOS I and NOS III). FASEB J 1998;12:773-790. [ Links ]
54. Pang G, Couch L, Batey R, Clancy R, Cripps A. GM-CSF, IL-alpha, IL-beta, IL-6, IL-8, IL-10, ICAM-1 and VCAM-1 gene expression and cytokine production in human duodenal fibroblasts stimulated with lipopolysaccharide, IL-1 and TNF. Clin Exp Immunol 1994;96:437-443. [ Links ]
55. Hinterleitner TA, Saada JI, Berschneider HM, Powell DW, Valentich JD. IL-1 stimulates intestinal myofibroblast COX gene expression and augments activation of Cl secretion in T84 cells. Am J Physiol 1996;271 (Cell Physiol 40):C1262-C1268. [ Links ]
56. Hellerbrand S, Wang C, Tsukamoto H, Brenner DA, Rippe RA. Expression of intracellular adhesion molecule 1 by activated hepatic stellate cells. Hepatology 1996;24:670-676. [ Links ]
57. Papanicolaou DA, Wilder RL, Manolagas SC, Chrousos GP. The pathophysiologic roles of interleukin-6 in human disease. Ann Intern Med 1998;128:127-137. [ Links ]
58. Burns AR, Simon SI, Kukielka GL, Rowen JL, Lu H, Mendoza LH, et al. Chemotactic factors stimulate CD18-dependent canine neutrophil adherence and motility on lung fibroblasts. J Immunol 1996;156:3389-3401. [ Links ]
59. Keegan AD, Ryan JJ, Paul WE. IL-4 regulates growth and differentiation by distinct mechanisms. Immunologist 1996;4:194-198. [ Links ]
60. Liu Q, Du XX, Schindel DT, Yang ZX, Rescorla FJ, Williams DA, et al. Trophic effects of interleukin-11 in rats with experimental short bowel syndrome. J Pediatr Surg 1996;31:1047-1050. [ Links ]
61. Bostrom H, Willetts K, Pekny M, Leveen P, Lindahl P, Hedstrand H, et al. PDGF-A signaling is a critical event in lung alveolar myofibroblast development and alveogenesis. Cell 1996;85:863-873. [ Links ]
62. Ichiki Y, Smith E, LeRoy EC, Trojanowska M. Different effects of basic fibroblast growth factor and transforming growth factor- on the two platelet-derived growth factor receptors' expression in scleroderma and healthy human dermal fibroblasts. J Invest Dermatol 1995;104:124-127. [ Links ]
63. Bernex F, de Sepulveda P, Kress C, Elbaz C, Delouis C, Panthier JJ. Spatial and temporal patterns of c-kit-expressing cells in WlacZ/+ and WlacZ/WlacZ mouse embryos. Development 1996;122:3023-3033. [ Links ]
64. Beecher KL, Andersen TT, Fenton JW, Festoff BW. Thrombin receptor peptides induce shape change in neonatal murine astrocytes in culture. J Neurosci Res 1994;37:108-115. [ Links ]
65. Saada JI, Mifflin R, Powell DW. Nonsteroidal anti-inflammatory drugs (NSAIDs) induce cyclooxygenase-2 (COX-2) expression via delayed activation of ERK and P38 MAPK pathways in human intestinal subepithelial myofibroblasts synergistic interaction with interleukin-1 induced signaling (Abstract). Gastroenterology 1999;116:A297. [ Links ]
66. Valentich JD, Popov V, Saada JI, Powell DW. Phenotypic characterization of an intestinal subepithelial myofibroblast cell line. Am J Physiol 1997;272 (Cell Physiol 41):C1513-C1524. [ Links ]
67. Campbell SE, Janicki JS, Weber KT. Temporal differences in fibroblast proliferation and phenotype expression in response to chronic administration of angiotensin II or aldosterone. J Mol Cell Cardiol 1995;27:1545-1560. [ Links ]
68. Knittel T, Aurisch S, Neubauer K, Eichhorst S, Ramadori G. Cell-type-specific expression of neural cell adhesion molecule (N-CAM) in Ito cells of rat liver. Up-regulation during in vitro activation and in hepatic tissue repair. Am J Pathol 1996;149:449-462. [ Links ]
69. Sprenger H, Kaufmann A, Garn H, Lahme B, Gemsa D, Gressner AM. Induction of neutrophil-attracting chemokines in transforming rat hepatic stellate cells. Gastroenterology 1997;113:277-285. [ Links ]
70. D'Amore PA. Capillary growth: a two-cell system. Semin Cancer Biol 1992;3:49-56. [ Links ]
71. Demayo F, Minoo P, Plopper CG, Schuger L, Shannon J, Torday JS. Mesenchymal-epithelial interactions in lung development and repair: are modeling and remodeling the same process? Am J Physiol Lung Cell Mol Physiol 2002;283:L510-L517. [ Links ]
72. Racine-Samson L, Rockey DC, Bissell DM. The role of alpha1 beta1 integrin in wound contraction. A quantitative analysis of liver myofibroblasts in vivo and in primary culture. J Biol Chem 1997;272:30911-30917. [ Links ]
73. Rungger-Brandle E, Gabbiani G. The role of cytoskeletal and cytocontractile elements in pathologic processes. Top Clin Nurs 1986;8:361-392. [ Links ]
74. Synnerstad I, Ekblad E, Sundler F, Holm L. Gastric mucosal smooth muscles may explain oscillations in glandular pressure: role of vasoactive intestinal peptide. Gastroenterology 1998;114:284-294. [ Links ]
75. Hogaboam CM, Smith RE, Kunkel SL. Dynamic interactions between lung fibroblasts and leukocytes: implications for fibrotic lung disease. Proc Assoc Am Physicians 1998;110:313-320. [ Links ]
76. Christopherson KS, Bredt DS. Nitric oxide in excitable tissues: physiological roles and disease. J Clin Invest 1997;100:2424-2429. [ Links ]
77. Frazier KS, Grotendorst GR. Expression of connective tissue growth factor mRNA in the fibrous stroma of mammary tumors. Int J Biochem Cell Biol 1997;29: 153-161. [ Links ]
78. Dignass AU, Podolsky DK. Cytokine modulation of intestinal epithelial cell restitution: central role of transforming growth factor. Gastroenterology 1993;105:1323-1332. [ Links ]
78. Jain MK, Layne MD, Watanabe M, Chin MT, Feinberg MW, Sibinga NE, et al. In vitro system for differentiating pluripotent neural crest cells into smooth muscle cells. J Biol Chem 1998;273:5993-5996. [ Links ]
79. Eickelberg O. Endless healing: TGF-β1, SMADs, and fibrosis. FEBS 2001;506:11-14. [ Links ]
80. Abe R, Donnelly SC, Peng T, Bucal R, Metz CN. Peripheral blood fibrocytes: Differentiation pathway and migration to wound sites. J Immunol 2001;166:7556-7562. [ Links ]
81. Mallat A, Gallois C, Tao J, Habib A, Maclouf J, Mavier P, et al. Platelet-derived growth factor-BB and thrombin generate positive and negative signals for human hepatic stellate cell proliferation. Role of a prostaglandin/cyclic AMP pathway and cross-talk with endothelin receptors. J Biol Chem 1998;273:27300-27305. [ Links ]
82. Fritsch C, Simon-Assmann P, Kedinger M, Evans GS. Cytokines modulate fibroblast phenotype and epithelial-stroma interactions in rat intestine. Gastroenterology 1997;112:826-838. [ Links ]
83. Clouthier DE, Comerford SA, Hammer RE. Hepatic fibrosis, glomerulosclerosis, and a lipodystrophy-like syndrome in PEPCK-TGF-1 transgenic mice. J Clin Invest 1997;100:2697-2713. [ Links ]
84. Grotendorst GR, Rahmanie H, Duncan MR. Combinatorial signaling pathways determine fibroblast proliferation and myofibroblast differentiation. FASEB J 2004;18:469-479. [ Links ]
85. Desmouliere A, Rubbia-Brandt L, Abdiu A, Walz T, Macieira-Coelho A, Gabbiani G. Alpha-smooth muscle actin is expressed in a subpopulation of cultured and cloned fibroblasts and is modulated by gamma-interferon. Exp Cell Res 1992;201:64-73. [ Links ]
86. Becerril C, Pardo A, Montaño M, Ramos C, Ramírez R, Selman M. Acidic fibroblast growth factor induces an antifibrogenic phenotype in human lung fibroblasts. Am J Respir Cell Mol Biol 1999;20:1020-1027. [ Links ]
87. Ramos C, Delgado-Tello J, Selman M, Pardo A, Montaño M. Effect of sustance P on interstitial collagenase, tussue inhibitor of metalloproteinases (TIMP-1) and type y collagen in human normal lung fibroblasts. Am Rev Respir Dis 1997;155:A654. [ Links ]
88. Masur SK, Dewal HS, Dinh TT, Erenburg I, Petridou S. Myofibroblasts differentiate from fibroblasts when plated at low density. Proc Natl Acad Sci USA 1996;93:4219-4223. [ Links ]
89. Bissell DM, Wang SS, Jarnagin WR, Roll FJ. Cell-specific expression of transforming growth factor- in rat liver. Evidence for autocrine regulation of hepatocyte proliferation. J Clin Invest 1995;96:447-455. [ Links ]
90. Serini G, Bochaton-Piallat ML, Ropraz P, Geinoz A, Borsi L, Zardi L, et al. The fibronectin domain ED-A is crucial for myofibroblastic phenotype induction by transforming growth factor-1. J Cell Biol 1998;142:873-881. [ Links ]
91. Friedman SL. The cellular basis of hepatic fibrosis. N Engl J Med 1993;328:1828-1835. [ Links ]
92. Winkler MK, Fowlkes LJ. Metalloproteinase and growth factor interactions: do they play a role in pulmonary fibrosis? Am J Physiol Lung Cell Mol Physiol 2002;283:L1-L11. [ Links ]
93. Doucet C, Brouty-Boye D, Pottin-Clemenceau C, Canonica GW, Jasmin C, Azzarone B. Interleukin (IL) 4 and IL-13 act on human lung fibroblasts. Implication in asthma. J Clin Invest 1998;101:2129-2139. [ Links ]
94. Inkinen K, Wolf H, Lindroos P, Ahonen J. Connective tissue growth factor and its correlation to other growth factors in experimental granulation tissue. Connective Tissue Research 2003;44:19-29. [ Links ]
95. Scott-Burden T. Extracellular matrix: the cellular environment. News Physiol Sci 1994;9:110-115. [ Links ]
96. Martinez-Hernandez A, Amenta PS. The extracellular matrix in hepatic regeneration. FASEB J 1995;9:1401-1410. [ Links ]
97. Benyon RC, Iredale JP, Goddard S, Winwood PJ, Arthur MJ. Expression of tissue inhibitor of metalloproteinases 1 and 2 is increased in fibrotic human liver. Gastroenterology 1996;110:821-831. [ Links ]
98. Chedid M, Rubin JS, Csaky KG, Aaronson SA. Regulation of keratinocyte growth factor gene expression by interleukin-1. J Biol Chem 1994;269:10753-10757. [ Links ]
99. Selman M, Pardo A. Pathogenic mechanism in the development of diffuse pulmonary fibrosis. Braz J Med Biol Res 1996;29:1117-1126. [ Links ]
100. Lasky JA, Brody AR. Interstitial fibrosis and growth factor. Environ Health Perspect 2000;108:751-762. [ Links ]
101. Selman M, Pardo A. Pathogenic mechanism in the development of diffuse pulmonary fibrosis. Braz J Med Biol Res 1996;29:1117-1126. [ Links ]
102. King T, Pardo A. Idiopathic pulmonary fibrosis: Progress in understanding its pathogenesis and implications for therapy. Ann Inter Med 2001;134:136-151. [ Links ]
103. Vignola AM, Mirabella F, Costanzo G, Di Giorgi R, Gjomarkaj M, Bellia V, et al. Airway remodeling in asthma. Chest 2003;123:417S-422S. [ Links ]
104. Holgate ST, Davies DE, Puddicombe S, Richter A, Lackie P, Lordan J, et al. Epithelial-mesenchymal interactions in the pathogenesis of asthma. J Allergy Clin Immunol 2000;105:193-204. [ Links ]
105. Gizycki MJ, Adelroth E, Rogers AV, O'Byrne PM, Jeffery PK. Myofibroblast involvement in the allergen-induced late response in mild atopic asthma. Am J Respir Cell Mol Biol 1997;16:664-673. [ Links ]
106. Teran LM, Mochizuki M, Bartels J, Valencia EL, Nakajima T, Hirai K, et al. Th1- and Th2-type cytokines regulate the expression and production of eotaxin and RANTES by human lung fibroblasts. Am J Respir Cell Mol Biol 1999;20:777-786. [ Links ]
107. Tanaka H, Miyazaki N, Oashi K, Tanaka S, Ohmichi M, Abe S. Sputum matrix metalloproteinase-9: tissue inhibitor of metalloproteinase-1 ratio in acute asthma. J Allergy Clin Immunol 2000;105:900-905. [ Links ]
108. Kelly EA, Busse WW, Jarjour NN. Increased matrix metalloproteinase-9 in the airway after allergen challenge. Am J Respir Crit Care Med 2000;162: 1157-1161. [ Links ]
109. Pache JC, Christakos PG, Gannon DE, Mitchell JJ, Low RB, Leslie KO. Myofibroblasts in diffuse alveolar damage of the lung. Mol Pathol 1998;11:1064-1070. [ Links ]
110. Holgate ST, Davies DE, Puddicombe S, Richter A, Lackie P, Lordan J, et al. Mechanisms of airway epithelial damage: epithelial-mesenchymal interactions in the pathogenesis of asthma. Eur Respir J Suppl 2003; 44:24S-29S. [ Links ]
111. Vignola AM, Chanez P, Chiappara G, Merendino A, Pace E, Rizzo A, et al. Transforming growth factor-ß expression in mucosal biopsies in asthma and chronic bronchitis. Am J Respir Crit Care Med 1997;156:591-599. [ Links ]
112. Puddicombe SM, Polosa R, Richter A, Krishna MT, Howarth PH, Holgate ST, et al. Involvement of the epidermal growth factor receptor in epithelial repair in asthma. FASEB J 2000;14:1362-1374. [ Links ]
113. Zhang H, Phan SH. Inhibition of myofibroblast apoptosis by transforming growth factor ß1. Am J Respir Cell Mol Biol 1999;21:658-665. [ Links ]














