Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Universidad y ciencia
versión impresa ISSN 0186-2979
Universidad y ciencia vol.25 no.3 Villahermosa dic. 2009
Artículos
Detección de bacterias benéficas en suelo con banano (Musa AAA Simmonds) cultivar 'Gran enano' y su potencial para integrar un biofertilizante
Detection of beneficial bacteria in soils with banana (Musa AAA Simmonds) cultivar 'Gran enano' and its potential to prepare a biofertilizer
Y Córdova–Bautista1, MC Rivera–Cruz * 1, R Ferrera–Cerrato2, JJ Obrador–Olán1, V Córdova–Ávalos1
1 Campus Tabasco, Colegio de Postgraduados. (YCB)(MCRC)(JJOO)(VCA) * Correo electrónico: mariari@colpos.mx
2 Campus Montecillo, Colegio de Postgraduados. (RFC)
Artículo recibido: 11 de enero de 2007,
Aceptado: 25 de noviembre de 2009
RESUMEN
Se determinaron las densidades de bacterias totales fijadoras de N de vida libre en suelo hasta 110 cm de profundidad y en suelo rizosférico de la planta de banano establecido en un Fluvisol éutrico. Se colectaron muestras de suelo en los seis horizontes del perfil y en 30 puntos de muestreo rizosférico (0–10 cm de profundidad) distribuidos en forma aleatoria en 10 000 m2. Las poblaciones de Azospirillum y Azotobacter se aislaron hasta profundidades de 59 y 110 cm, respectivamente. Los gremios aislados más grandes fueron 42x104 y 11x105 UFC g–1 de suelo seco para Azospirillum y Azotobacter, respectivamente. Tres aislados de Azospirillum y tres de Azotobacter se utilizaron en la formulación de inoculantes microbianos sostenidos en soportes orgánicos (pollinaza, pollinaza + suelo, pinzote, pinzote + suelo) y en suelo testigo. Se establecieron dos bioensayos integrados con 10 tratamientos cada uno durante 60 días de incubación. Las densidades se contaron los días 1, 30 y 60, y el nitrógeno total se cuantificó el día 60. Azospirillum creció mejor en pinzote + inóculo con 15x105 UFC por cada gramo de biofertilizante mientras que para Azotobacter fue 63x104 UFC en pinzote + suelo + inóculo. El mayor contenido de nitrógeno total fue 5.25%, fue liberado en el suelo con pollinaza y bioaumentado con el consorcio Azospirillum + Azotobacter; no obstante, las poblaciones de Azospirillum y Azotobacter disminuyeron a 68x104 y 20x104 UFC g–1 de biofertilizante, respectivamente.
Palabras clave: Azospirillum, Azotobacter, biofertilizante, nitrógeno total.
ABSTRACT
The densities of free living total N–fixing bacteria in soil down to a depth of 110 cm and in rhizospheric soils of banana plants established in a eutric Fluvisol, were evaluated. Soil samples were collected from the six horizons of the profile and from 30 rhizospheric sampling points (0–10 cm depth) randomly distributed throughout 10 000 m 2. Populations of Azospirillum and Azotobacter were isolated at depths of 59 and 110 cm, respectively. The largest isolates were 42x104 and 11x105 CFU g–1 of dry soil for Azotobacter and Azospirillum, respectively. Three isolates of Azospirillum and Azotobacter each were used in the formulation of sustained microbial inoculants in organic media (chicken manure, chicken manure + soil, rachis of banana raceme, rachis of banana raceme + soil) and in control soil. Two integrated bioassays with 10 treatments each were established for 60 days of incubation. Densities were counted on days 1, 30 and 60, and total nitrogen was quantified on day 60. Azospirillum grew best on rachis of banana raceme + consortium with 15x105 CFU per gram of biofertilizer, whereas Azotobacter grew best on 63x104 CFU per gram of the biofertilizer formulated with rachis of banana raceme + soil + consortium. The greatest total nitrogen content was 5.25% released into the soil with chicken manure and bioaugmented with the Azospirillum + Azotobacter consortium. However, the Azospirillum and Azotobacter populations decreased to 68x104 and 20x104 CFU g–1 of biofertilizer, respectively.
Key words: Azospirillum, Azotobacter, biofertilizer, total nitrogen.
INTRODUCCIÓN
El banano Musa AAA Simmonds es un cultivo de regiones tropicales y subtropicales del planeta. En México existe una superficie sembrada de 72 000 ha, distribuida en los estados de Tabasco, Veracruz, Colima, Michoacán y Chiapas, ocupando el séptimo lugar a nivel mundial con 2 361 144 ton que constituye el 4% de la producción mundial (SAGARPA 2005). La productividad de las plantaciones de banano es regulada por la disponibilidad de nutrimentos, lo que ha inducido a la aplicación de fertilizantes inorgánicos en cantidades de 200 kg de nitrógeno (N) ha–1 año–1 y 400 kg de potasio (K) ha–1 año–1 (Colque et al. 2005). Sin embargo, la aplicación excesiva de estos fertilizantes no es sustentable debido a que son económicamente no viables y poco amigables con el ambiente (Rajendran & Devaraj 2004), inducen la disminución de la población de bacterias benéficas para la planta (Deb & Bora 1996) y de bacterias fijadoras de N de vida libre que viven en asociación con la raíz de muchas plantas cultivadas (Ögüt et al. 2005). La asociación planta–bacterias fijadoras de nitrógeno ha sido estudiada en plantas anuales y perennes debido a que contribuyen en el efecto directo del crecimiento de la planta, por la producción de fitohormonas, en la disponibilidad de nutrimentos y en la reducción de las poblaciones de patógenos de la raíz (Rao & Krishna 2006). Azospirillum y Azotobacter son fijadoras de N de vida libre, llamadas también diazotróficas debido a que dos moles de amonio producen un mol de nitrógeno gaseoso (Philippot & Germon 2005). La densidad de población de Azospirillum en rizósfera y en suelo ha sido determinada en plantas de banano (Abdul et al. 2005), garbanzo, haba (Hamaoui et al. 2001), lechuga, pasto (Díaz–Vargas et al. 2001) y arroz (Velazco & Castro 1999); mientras que la de Azotobacter en plantas de algodón, avena, cebada, maíz, papa, remolacha azucarera, tomate, trigo y zanahoria (Alexander 1994). La utilización de bacterias fijadoras de N de vida libre como Azotobacter y Azospirillum en sustratos es una práctica en la agricultura sustentable (Tripathy & Ayyappan 2005).
El potencial natural de Azotobacter y de Azospirillum en la nutrición de la planta y en la fertilidad del suelo es recomendable utilizarla en la agricultura (Mrkovacki & Milic 2001). Las bacterias reguladoras del crecimiento, sostenidas en sustratos orgánicos nativos de regiones tropicales húmedas, tienen grandes posibilidades para el desarrollo de biofertilizantes para la producción de banano. Los biofertilizantes son sustancias que contienen microorganismos vivos que, cuando son aplicados a la semilla, a superficies de la planta o al suelo, colonizan la rizósfera o el interior de la planta y promueven el crecimiento aumentando el suministro o disponibilidad de nutrimentos primarios de la planta (Vessey 2003). En el presente estudio las bacterias fueron evaluadas en suelo y en rizósfera de banano, aisladas e inoculadas en acarreadores como suelo, pollinaza (estiércol de pollo) y pinzote (raquis central del racimo del banano). Se determinó la densidad de bacterias de los géneros Azotobacter y Azospirillum a través del tiempo así como los contenidos de nitrógeno en los sustratos inoculados, con el fin de proponerlo como biofertilizante formulado.
MATERIALES Y MÉTODOS
Rizósfera, suelo y perfil agrológico
Se seleccionó un sitio cultivado con plantación de banano (Musa AAA Simmonds) cv. 'Gran enano' con una edad de 15 años, propiedad de AGRISNA S. P. R. de R. L. El sitio se localiza en el km 6.5 de la carretera federal 180, tramo Cárdenas–Villahermosa, en el estado de Tabasco, México. Se delimitó en el interior de la plantación bananera una superficie de una hectárea, se realizó el conteo del total de plantas, la población fue 1 466 plantas. Se seleccionaron completamente al azar 30 plantas, como referencia de los puntos de muestreo de suelos rizosférico y no rizosférico. Se realizaron barrenaciones agrológicas para identificar el sitio con la morfología del perfil representativo del suelo. El perfil agrológico se excavó en el sitio ubicado en las coordenadas geográficas 17° 59' 03" latitud norte y 93° 18' 48.35" longitud oeste. Se colectaron cinco sub–muestras de cada horizonte, se mezclaron homogéneamente y se formaron muestras compuestas de cada horizonte. Las muestras compuestas para los análisis de las propiedades físicas y químicas se introdujeron en bolsas de plástico. Las muestras de suelo para determinar las poblaciones de bacterias de horizontes, suelo rizosférico y de suelo no rizosférico, se metieron en frascos esterilizados de vidrio ámbar, se taparon con papel aluminio y se cerraron con la tapa con rosca, se preservaron en campo en hielera con hielo y después se almacenaron durante una semana en refrigeración a 4 °C en el laboratorio. La caracterización morfológica de los perfiles agrológicos se realizó de acuerdo con Cuanalo (1981), la nomenclatura del suelo se basó en el sistema de clasificación de ISSS–ISRIC–FAO (2002).
Análisis de las propiedades físicas y químicas del suelo
Las muestras para la medición de las propiedades físicas y químicas del suelo se secaron a temperatura ambiente a la sombra y se molieron con mazo de madera; las muestras orgánicas se fragmentaron con rodillos de madera y se tamizaron en malla 10 (2 mm). Las rutinas analíticas para medir N total (%), P aprovechable y K intercambiable (Cmol+k–1), capacidad de intercambio catiónico (CIC) (Cmol+k–1), materia orgánica (MO) (%), pHH20 1:2,5, conductividad eléctrica (CEH20 1:2,5) (dSm–1), textura (%) y contenido de humedad son las indicadas en la NOM–021–RECNAT–2000 (DOF 2002).
Análisis microbiológico
La evaluación de la densidad de poblaciones de bacterias de los géneros Azotobacter y Azospirillum en suelos rizosférico, no rizosférico y en el suelo de horizontes del perfil se realizó con el método de conteo viable de células vivas por siembra en superficie (Madigan et al. 2004). Se utilizaron diluciones seriadas con base en 10, se diluyeron 10 g de suelo en 90 ml de agua estéril, hasta 1/108. Se tomó 0.1 ml de cada dilución y se colocó en el centro de la caja Petri con medios de cultivos sólidos específicos, distribuyéndose con espátula trigalsqui. El procedimiento se realizó por triplicado. El conteo de células viables se efectuó contando las unidades formadoras de colonias (UFC) que crecieron en la superficie del medio de cultivo de la caja Petri, luego se transformó a UFC g–1 de suelo seco. El conteo se efectuó con contador de colonias Darkfield Quebec (Cia American Optical). Los medios de cultivos utilizados fueron: carbón combinado para bacterias totales fijadoras de N (BFNT), solución A (0.9 g K2HPO4, 0.2 g KH2PO4, 0.1 g KCl, 0.025 Na2MoO4.2H2O, 4.9 g Na2FeEDTA, 15 g agar y 1.0 ml agua destilada), y solución B (0.2 g MgSO4.7H2O, 0.06 g CaCl2.H2O, 100 ml agua destilada) (Rennie 1981). El medio de cultivo para bacterias del género Azospirillum fue rojo congo D–Döbereiner (D) (5 g ácido málico, 0.5 g K2HPO, 0.2 g MgSO4.7H2O, 0.1 g NaCl, 0.5 g extracto de levadura, 0.015 g FeCl3.6H2O, 4.8 g KOH, 15 ml de rojo congo, 15 g de agar y 1.0 ml agua destilada, pH 7.0) (Holguín et al. 1996). Azotobacter se estableció en medio de cultivo Ashby (5 g manitol, 5 g K2HPO4, 0.2 g MgSO47H2O, 0.5 g NaCl, 0.1 g K2SO4, 5 g CaCO3, 15 g de agar y 1.0 L de agua destilada, pH 7.0) (Rao 1999).
Aislados de bacterias
Las colonias fueron purificadas, aislando cada una de ellas a través de la técnica de estría en cuadrante sobre medio de cultivo sólido. Estas colonias se caracterizaron por su morfología externa e interna. La primera se evaluó con los parámetros diámetro, color, consistencia, forma, elevación y borde. La segunda se caracterizó por microscopía, para esto a cada aislado se le realizó la tinción de Gram (Ramírez–Gama et al. 1998).
Preparación de sustratos e inóculo bacteriano Los sustratos secos (pollinaza, pinzote, pollinaza + suelo, pinzote + suelo y suelo) fueron molidos y tamizados en una malla de 2 mm de abertura, se pesaron 500 g para cada unidad experimental, después se colocaron en bolsas de papel, las cuales se cubrieron con papel aluminio y se esterilizaron en autoclave a 180 °C y 1.3 kg cm–1 durante 30 min (Ingraham & Ingraham 1998). Se realizaron las determinaciones de contenido de humedad, pH, nitrógeno total, fósforo aprovechable y potasio intercambiable (Tabla 1). Según los parámetros de fertilidad químicos de referencia establecidos en la NOM–021–RECNAT–2000 (DOF 2002), el pH para la pollinaza y pollinaza + suelo es neutro, el pinzote y pinzote + suelo es fuertemente alcalino y el suelo es ligeramente alcalino. El contenido de materia orgánica en todos los sustratos agrícolas es mayor que 6%, clasificado como valor muy alto (DOF 2002) excepto para el suelo que varía de 1.6 a 3.5 %, clasificado en la clase media. El nitrógeno total tiene contenidos bajos (10 a 20 mg kg–1) en los cinco sustratos. El fósforo aprovechable es alto (mayor de 30 mg kg–1 ) en sustratos neutros y ácidos y también alto (mayor de 11 mg kg–1 ) en sustratos alcalinos. El contenido de potasio intercambiable es alto (mayor de 0.6 Cmol (+) kg–1) en los sustratos y en el suelo (DOF 2002).
El inóculo de bacterias se preparó de manera individual con cada una de las seis cepas aisladas, en la Tabla 2 se reportan la nomenclatura y características macroscópicas y microscópicas de cada cepa. Se utilizaron los medios de cultivo líquidos específicos para Azospirillum y Azotobacter, indicados en el apartado de análisis microbiano. Cada aislado bacteriano se hizo crecer durante 72 h en medio de cultivo sólido específico, después se resuspendió la colonia en medio de cultivo líquido y se incubó a 28 °C y agitación a 180 rpm durante seis días. En este tiempo se evaluó a través del método de cuenta viable por dilución seriada, el tamaño de la población de cada una de las bacterias contenidas en los inóculos. Los resultados mostraron una población de 106 UFC ml –1 tanto de Azotobacter como de Azospirillum.
Establecimiento de experimento para biofertilizante
Para probar el potencial de los sustratos como soporte de los consorcios de Azospirillum y de Azotobacter, que permita seleccionar la mejor combinación sustrato + consorcio e integrar el bio–fertilizante, se estableció un experimento con 15 tratamientos y tres repeticiones por tratamiento. Se utilizaron dos factores, tipo de sustrato [suelo, pollinaza, pinzote, pollinaza + suelo, pinzote + suelo)] y tipo de consorcio de bacteria [sin consorcio (S/C)], con Azospirillum (C/Azop), con Azospirillum+Azotobacter (C/Azosp+Azot) y con Azotobacter (C/Azot)]. En total se establecieron 45 unidades experimentales, cada una fue una bolsa negra de polietileno de 27x28 cm con 500 g de sustrato agrícola e inoculado y no inoculado según tratamiento, manteniendo 32 % de humedad. Las características físicas y químicas de los sustratos y del suelo se reportan en la Tabla 1. Los consorcios estuvieron integrados por tres aislados de Azospirillum (FBAzop1, FBAzop2, FBA–zop3) y tres de Azotobacter (FBAzot1, FBAzot2, FBAzot3), procedentes del suelo y rizósfera de plantas de banano de la plantación seleccionada. Los tratamientos fueron: suelo + C/Azopirillum (Bio–1), pollinaza + C/Azopirillum (Bio–2), pollinaza + suelo + C/Azopirillum (Bio–3), pinzote + C/Azopirillum (Bio–4), pinzote + suelo + C/Azopirillum (Bio–5), suelo + C/Azospirillum + C/Azotobacter (Bio–6), pollinaza + C/Azospirillum + C/Azotobacter (Bio–7), pollinaza + suelo + C/ Azospirillum + C/Azotobacter (Bio–8), pinzote+ C/Azospirillum + C/Azotobacter (Bio–9), pinzote + suelo + Azopirillum + C/Azotobacter (Bio–10), suelo + C/Azotobacter (Bio–11), pollinaza + C/Azotobacter (Bio–12), pollinaza + suelo + C/Azotobacter (Bio–13), pinzote + C/Azotobacter (Bio–14) y pinzote + suelo + C/Azotobacter (Bio–15).
Análisis microbiológico del biofertilizante
A los días 1, 30 y 60 después de establecido el experimento, se tomaron muestras de 20 g de cada unidad experimental con el fin de evaluar la densidad poblacional de bacterias inoculadas y el contenido de humedad. Para ello se utilizó el método de cuenta viable por dilución seriada en placa de agar sólido en medio de cultivos específicos para bacterias Azotobacter y Azospirillum.
Nitrógeno total en biofertilizante
Muestras de cada uno de los 15 biofertilizantes fueron colectados el día 60 después de establecido el experimento y se analizaron mediante micro–Kjeldhal para determinar el contenido de nitrógeno total (Keeny & Nelson 1982).
Clasificación del suelo
La clasificación del suelo se realizó con la nomenclatura de la ISSS–ISRIC–FAO (2002).
Análisis de la información
Se realizó el análisis de varianza y la prueba de medias Tukey (p < 0.05) a las variables densidad de población de bacterias fijadoras de nitrógeno de vida libre, Azotobacter y Azospirillum evaluadas en horizontes del perfil agrológico, suelo y suelo rizosférico de banano y en las unidades experimentales que integran el bioensayo del biofertilizante, así como nitrógeno total y fósforo disponible en biofertilizante. Se utilizó el procedimiento ANOVA del programa Statistical Analysis System (SAS 1999).
RESULTADOS
Propiedades físicas y químicas del perfil y clasificación del suelo
La presencia de un epipedón úmbrico, las propiedades de diagnóstico éutricas, el porcentaje de saturación de bases del 50 % hasta 100 cm de profundidad, además la disminución del contenido del carbono orgánico al aumentar la profundidad del perfil, indican que el suelo estudiado es un Fluvisol éutrico (ISSS–ISRIC–FAO 2002). Los resultados de los análisis químicos evidenciaron que es un suelo que favorece el crecimiento de colonias de bacterias, ya que nutrimentalmente posee los elementos químicos necesarios para el crecimiento bacteriano (Tabla 2). El pH en los primeros tres horizontes superficiales fluctúa de medianamente alcalino (7.4 a 8.5) a moderadamente ácido (5.1 a 6.5), pero a partir del cuarto horizonte la alcalinidad del suelo aumenta con el incremento de la profundidad. Se determinaron contenidos altos de carbono orgánico de 7.42 y 2.20% en los dos primeros horizontes (A1p y A2p), el cual disminuye conforme aumenta la profundidad en el suelo, observándose la misma tendencia en los contenidos de nitrógeno total y el potasio intercambiable. No obstante lo anterior, el fósforo disponible en el primer y segundo horizontes tienen contenidos muy altos, 144 y 21.7 mg kg–1, respectivamente, que disminuye en los horizontes subyacentes (Tabla 2). La capacidad de intercambio catiónico, según la clasificación de Cottenie (1980), corresponde a la clase alta en los horizontes A1p y A2p, y a la clase media en los horizontes A3s, C1sq, C2s y C3s (Tabla 2). El porcentaje de saturación de bases en los cuatro horizontes intermedios es de 50 %, en el primer horizonte y en el sexto es menor a 50 %. El contenido de carbonato de calcio es mayor al aumentar la profundidad del suelo, es 1.88% en el horizonte superficial A1p (0–2 cm) y 4.9 % en el horizonte subyacente C2s (59–70 cm). Las propiedades físicas en los primeros cuatro horizontes son apropiadas para la multiplicación de las bacterias, destacando contenidos de humedad normales en todo el perfil, lo cual favorece los contenidos de oxígeno en el espacio poroso.
Densidad de bacterias en suelo cultivad o con banano
La comparación de las medias de la densidad de bacterias fijadoras de N de vida libre muestran diferencias significativas (p < 0.05) (Tabla 2). La población más grande (33.4x103 UFC g–1 suelo seco) correspondió a las BFN del horizonte superficial A1p (0–2 cm), fue 55 veces mayor que la población del horizonte C1sq (39–59 cm) más profundo en donde se localizó la población de BFN (Figura 1). En los horizontes más profundos (> 59 cm de profundidad) no se localizaron colonias de bacterias, posiblemente por las condiciones anaeróbicas. Azospirillum se encontró en los primeros cuatro horizontes. La mayor población (4.3x103 UFC g–1 suelo seco) se localizó en el horizonte superf¡cial A1p (0–2 cm), a partir de I horizonte A2p (2 –15 /19) hasta C 1s q (39–59 cm) las medias de la densidad de bacterias no mostraron diferencias significativas (Figura 1). La mayor densidad poblacional de Azotobacter (18.93 x103 UFC g–1 suelo seco) se localizó en el horizonte A2p (215/19 cm) y fue 17 veces mayor que la población encontrada en muestras del horizonte mas profundo C3s (70–110 cm), con una población de 11x102 UFC g_1 suelo seco y correspondió a un sólo tipo de aislado (Figura 1). La mayor (cuatro) diversidad de aislados de Azospirillum y Azotobacter se localizaron en los dos primeros horizontes superficiales.
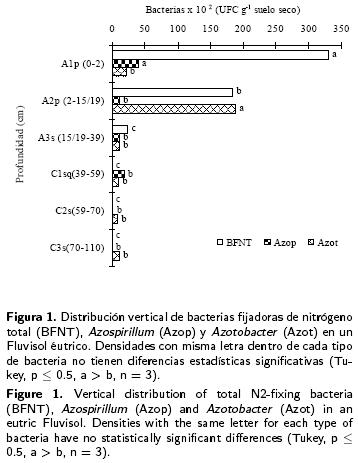
Azospirillum y Azotobacter se localizaron en los 30 puntos del muestreo, tanto en suelo como en rizósfera de banano (Tabla 3). Se observan diferencias significativas entre las medias del tamaño de población de ambos tipos de bacterias en los puntos de evaluación (suelo rizosférico y suelo seco), distribuidos en los 10 000 m2 evaluados. La más alta población de Azospirillum (94x104 UFC g– suelo seco) se encontró en el suelo rizosférico de la planta 175 y de Azotobacter con 110x105 UFC g–1 suelo seco en la planta 634. Las menores poblaciones de Azospirillum (9x102 UFC g–1 suelo seco) y de Azotobacter (16x102 UFC g–1 suelo seco) se contaron en muestras de suelo a distancia de las plantas 360 y 1151, respectivamente. En los 30 puntos se observa efecto rizósfera, este presenta valores desiguales entre los puntos evaluados desde 1.7 a 270 en la población de Azospirillum y de 13.9 a 192.5 con Azotobacter (Tabla 3).
Aislados de bacterias
En base a los resultados previamente citados se aislaron seis cepas de bacterias, tres son FBazp1, FBazp2 y FBazp3 que corresponden al género Azospirillum y tres de Azotobacter, identificadas como FBazt1, FBazt2 y FBazt3, las características macroscópicas y microscópicas se observan en la Tabla 4. Los aislados de Azospirillum se caracterizaron por su forma de bacilos cortos y Gram negativos, mientras que los tres aislados de Azotobacter presentaron forma de coco y Gram negativos.
Azospirillum en biofertilizante
En los tres tiempos (días 1, 30 y 60) después de la inoculación de Azospirillum se observaron diferencias significativas entre medias de los tratamientos (p < 0.05) (Tabla 5), por efecto del sustrato y consorcio de bacterias utilizados en la formulación del biofertilizante. Los resultados indican que en los días 1 y 60 la formulación integrada por el Bio–4 (pinzote + C/ Azospirillum) promueve el aumento de la población de Azospirillum ya que se alcanzaron tamaños máximos, con 55x102 UFC g–1 suelo seco el día 1 y 150x104 UFC g–1 suelo seco el día 60 (Tabla 5).
Azotobacter en biofertilizante
Al evaluar el tamaño de población del consorcio Azotobacter los días 1, 30 y 60 después de la inoculación, se observan diferencias significativas entre medias de tratamientos (Tukey, p< 0.05) por efecto del sustrato y consorcio integrante del biofertilizante (Tabla 6). El día uno la mayor población (90x102 UFC g–1 suelo seco) se observó en Bio–15 integrado con pinzote + suelo + C/Azotobacter, pero el día 30 la mayor población (90x104 UFC g–1 suelo seco) se encontró en Bio–7 (pollinaza + C/Azospirillum + C/Azotobacter). El día 60 la población de Azotobacter está presente en los 10 tratamientos inoculados, pero la mayor población (63x104 UFC g–1 suelo seco) se observa en el tratamiento Bio–10 (pinzote + suelo + C/Azospirillum + C/Azotobacter) y la menor (84x102 UFC g–1 suelo seco) en el Bio–6, integrado con suelo + C/Azospirillum + C/Azotobacter.
Nitrógeno total y su relación con Azospirillum y Azotobacter en biofertilizante
Al cuantificar los contenidos de nitrógeno total el día 60 después de la inoculación de los biofertilizantes con los consorcios de bacterias, se encontraron diferencias significativas entre las medias de los tratamientos (Tukey, p < 0.05). El mayor contenido de N (5.25%) se localizó en el Bio–7 (pollinaza + C/Azospirillum y Azotobacter) con una densidad de Azospirillum de 68x104 UFC g–1 suelo seco (Tabla 5) y Azotobacter de 20x104 UFC g–1 suelo seco (Tabla 6). Los menores contenidos de N total (0.39%), de Azospirillum (22x102 UFC g–1 suelo seco) y Azotobacter 17x104 UFC g–1 suelo seco se muestran en el Bio–6 (suelo + C/ Azospirillum y Azotobacter) (Tabla 5).
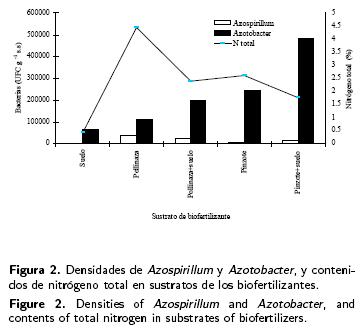
En la Figura 2 se observa que las densidades de Azospirillum y de Azotobacter y los contenidos de N total en los sustratos son superiores respecto a los localizados en suelo. El sustrato de pollinaza presentó la mayor población (37x103 UFC g–1 suelo seco) y los altos contenidos de N total (4.45 %), presentando una correlación positiva (0.723) entre las dos variables. Sin embargo, la mayor densidad de Azotobacter (11x104 UFC g–1 suelo seco) se localiza en el sustrato pinzote + suelo (Bio–15) mostrando bajos contenidos de N total (1.76%). El coeficiente de correlación indica que no existe relación (–0.132) entre las dos variables.
DISCUSIÓN
Las características físico–químicas y propiedades de diagnóstico indican que el cultivo de banano presente en la finca se localiza en vega de río, en un Fluvisol éutrico, condiciones que acorde con Anónimo (2001) menciona que estos suelos sustentan cultivos de frutales como plátano y han sido formados a partir de aluviones recientes, que en la región han sido depositados por el río Samaria. No obstante lo anterior, es importante indicar que bajo condiciones de un sustrato Calcisol vértico, existen plantaciones de banano en otras regiones de México (Orozco–Romero & Pérez–Zamora 2006), igualmente en otras regiones como en la provincia de Sullana en Perú, donde existen plantaciones bananeras en Fluvisoles (Soldevilla 2005).
Asimismo se identificó que en los diferentes horizontes del Fluvisol cultivado con banano, se identificó que las poblaciones de bacterias disminuyen al aumentar la profundidad, principalmente aquellas que son fijadoras de N de vida libre como son Azotobacter y Azospirillum. Al respecto, Rivera–Cruz et al. (2002) encontraron en Gleysol histi–orthiéutrico similares resultados en bacterias fijadoras de N de vida libre, las cuales fueron localizadas hasta una profundidad de 70 cm, por su parte Coyne (2000) encontró bacterias aeróbicas hasta una profundidad de 145 cm. En el presente estudio se localizaron bacterias fijadoras de N y Azospirillum hasta 59 cm de profundidad, pero Azotobacter fue localizado hasta los 110 cm. La densidad de estas bacterias a través de la profundidad fueron del orden de 101 a 103 UFC g–1 de suelo seco (Figura 1), lo que indica poblaciones aceptables al compararlas con lo que menciona Alexander (1994) respecto a Azotobacter que no es común encontrar cifras mayores de 103 UFC g–1 suelo seco en regiones tropicales, pero se pueden hallar poblaciones que excedan 104 por gramo de suelo seco en regiones templadas. Esta densidad de bacterias posiblemente se debe a las condiciones químicas que son favorables para el crecimiento de las bacterias ya que el suelo es rico en nutrimentos (Tabla 2). Los contenidos de materia orgánica, nitrógeno, fósforo y potasio son abundantes en los dos primeros horizontes y disminuyen en los más profundos. El pH y los contenidos de carbonatos aumentaron en el cuarto, quinto y sexto horizontes. Las condiciones físicas son propicias para las bacterias en la mayoría de los horizontes, destacando las condiciones de humedad favorables (20 a 39 %), lo que permite un mejor desplazamiento de oxígeno en el espacio poroso.
Azospirillum y Azotobacter se localizaron tanto en rizósfera de la planta de banano como en suelo alejado de la ésta, pero las mayores densidades de ambas bacterias se localizaron en la rizósfera (Tabla 3). Esta respuesta se ha reportado en varios trabajos y lo atribuyen a que la rizósfera es el espacio raíz–suelo en donde las poblaciones microbianas son mayores porque existen mejores condiciones nutritivas. Las condiciones son mejores porque se incrementa la acumulación de carbono y energía por el continuo flujo de substratos orgánicos solubles en agua (azúcares, aminoácidos, ácidos orgánicos, hormonas y vitaminas), e insolubles en agua como la pared celular, material descompuesto y otros residuos de raíces y mucílagos (Brimecombe et al. 2001; Manoharachary & Mukerji 2006).
Se localizó en la rizósfera de banano la mayor densidad de Azospirillum con 94x104 UFC g–1 r.s (planta 175) (Tabla 5), en tomate se reportan densidades de 104 UFC g–1 raíz seca (Meunchang et al. 2006), así mismo la presencia de Azospirillum se ha localizado en rizósferas de plantas de arroz, maíz y sorgo (Dos Santos et al. 2005). Azotobacter ha sido reportada en pastos (Döbereiner et al. 1972), en trigo con 11x104 UFC g–1 de suelo rizosférico (Kumar et al. 2001) y en tomate con 103 UFC g–1 r.s (Meunchang et al. 2006). En el presente estudio la mayor densidad (11x105 UFC g–1 r.s) se localizo en la rizósfera de la planta 634 de banano (Tabla 3). El efecto rizósfera tomando como indicador a la densidad de Azospirillum y Azotobacter en rizósfera y en suelo, se observó en esta investigación debido a la naturaleza física y química que existe en la raíz.
De los sustratos utilizados como acarreadores de Azospirillum para la formulación de bio–fertilizantes, pinzote únicamente con consorcio de Azospirillum (Bio–4) favoreció la densidad de Azospirillum el día 60 después de la inoculación (Tabla 5), pero al relacionar tipo de sustrato con densidad de Azospirillum se localizó que pollinaza favorece la densidad (Figura 2). Respecto al consorcio de Azotobacter, el mejor acarreador que favoreció su mayor densidad fue pinzote + suelo (Bio–10) (Tabla 6, Figura 2). Se ha reportado el uso de sustratos orgánicos y minerales como acarreadores de Azospirillum y Azotobacter. Okon & Labandera–González (1994) encontraron que el carbón de leña, arcilla, vemiculita y alginatos tienen el potencial de sostener una alta densidad de Azospirillum, con la ventaja de sobrevivencia después de la inoculación en semillas.
El uso de pollinaza y pinzote como acarreadores de bacterias reguladoras del crecimiento de plantas, presenta la ventaja de contener reserva de carbón orgánico y contenidos de nitrógeno, fósforo y potasio en el biofertilizante, lo que le da un valor agregado al producto. Al respecto, en esta investigación se encontraron contenidos de N total en los 15 tratamientos, pero fueron mayores cuando se utilizó sustrato orgánico (Tablas 5 y 6), aunque pollinaza con 5.25% fue 10.5 y 2.03 veces mayor que el localizado en suelo y en pinzote, respectivamente.
En conclusión, los resultados de esta investigación sugieren que el uso de pollinaza como sustrato de Azospirillum es favorable porque mantuvo una población de 104 UFC g–1 suelo seco, con contenido de N total de 4.18%. Sin embargo, para Azotobacter el mejor sustrato es pinzote con 50 % de suelo debido al incremento de su densidad (63x104 g–1 suelo seco), aunque se localizaron 3.38 veces menores contenidos de N total respecto al determinado en el sustrato de pollinaza. La formulación integrada por pollinaza + consorcio Azospirillum + Azotobacter se sugiere como biofertilizante por los contenidos altos (5.25 %) de N total y por la capacidad de sostener densidades de 15x104 y 20x104 UFC g–1 suelo seco de Azospirillum y Azotobacter, respectivamente. Los futuros trabajos en esta línea de investigación deben conducirse evaluando mayor cantidad de parámetros químicos que permitan fortalecer los contenidos químicos de reserva de los biofertilizantes.
AGRADECIMIENTOS
Se agradece las facilidades proporcionadas por el propietario y personal técnico de la empresa bananera 'El Castaño' AGRISNA S. P. R. de R. L., localizada en el municipio de Cárdenas, Tabasco, para realizar el estudio del suelo y de la microbiología del suelo dentro de la plantación de 40 hectáreas. El primer autor agradece al Consejo Nacional de Ciencia y Tecnología por la beca otorgada para realizar estudios de Maestría en Ciencias en el Colegio de Postgraduados Campus Tabasco.
LITERATURA CITADA
Abdul BM, Zulkifli HS, Zakaria W, Mahmood M (2005) High–yielding and quality banana production through plant growth–promoting rhizobacterial inoculation. Fruits 60: 179–185. [ Links ]
Alexander M (1994) Introducción a la microbiología del suelo. Peña CJJ (trad). 2a. reimp. AGT editor, S.A. México, DF 491 p. [ Links ]
Anónimo (2001) Síntesis de Información Geográfica del Estado de Tabasco. INEGI. Aguascalientes, México. 89 p. [ Links ]
Brimecombe JM, de Leij FA, Lynch J (2001) The effect of Root Exudates on Rhizosphere Microbial Populations. En: Pinton R, Varanini Z, Nannipieri P(eds.) The Rhizosphere Biochemistry and Organic Substances at the Soil–Plant Interface. Marcel Dekker. New York. pp. 95–140. [ Links ]
Colque O, Iquize E, Ferrufino A (2005) Efecto de la fertilización nitrogenada y potásica en la producción del banano Musa AAA en fincas comerciales de tres localidades del Trópico de Cochabamba. La Jota, Chimoré, Bolivia. Informaciones Agronómicas 26: 1–7. [ Links ]
Cottenie A (1980) Los análisis de suelos y plantas como base para formular recomendaciones sobre fertilizantes. Boletín de suelos de la FAO. Roma, Italia 70 p. [ Links ]
Coyne M (2000) Microbiología del suelo: un enfoque exploratorio. Editorial Paraninfo. Madrid, Esp. 416 p. [ Links ]
Cuanalo de la CH (1981) Manual para la descripción de perfiles de suelo en el campo. 2a. ed. Colegio de Postgraduados. Chapingo, Méx. 40 p. [ Links ]
Deb B, Bora N (1996) Effect of chemical fertilizer on the rhizosphere mycoflora and nodulation of pea plant. Environment and Ecology 14: 747–751. [ Links ]
Díaz–Vargas P, Ferrera–Cerrato R, Almaráz–Suárez JJ, Alcántar–González G (2001) Inoculación de bacterias promotoras de crecimiento en lechuga. Terra 19: 327–335. [ Links ]
Döbereiner J, Day JM, Dart PJ (1972) Nitro–genase activity and oxigen sensitivity of the Paspalum notatum–Azotobacter paspali association. Journal of General Microbiology 17: 103–116. [ Links ]
DOF (2002) Diario Oficial de la Federación. Norma Oficial Mexicana NOM–021–RECNAT–2000. Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. México DF. 74 pp. [ Links ]
Dos Santos AM, Dos Santos TRK, Kirchoff G, Hartmann A, Ivo BJ (2005) Influence of soil and host plant crop on the genetic diversity of Azospirillum amazonense isolates. Pedobiologia 49: 565–576. [ Links ]
Hamaoui B, Abbadi JM, Burdman S, Rashid A, Varig S, Okon Y (2001) Effects of inoculation with Azospirillum brasiliense on chickpeas (Cicer arietinum) and faba beans (Vicia faba) under different growth conditions. Agronomie 21: 553–560. [ Links ]
Holguín G, Bashan Y, Ferrera–Cerrato R (1996) Interacciones entre plantas y microorganismos benéficos. III. Procedimientos para el aislamiento y caracterización de hongos micorrízicos y rizobacterias promotoras del crecimiento de plantas. Terra 14: 211–224. [ Links ]
Ingraham LJ, Ingraham AC (1998) Introducción a la microbiología. Vol. I. Nieto JJ, Quesada E, Ventosa A (trads.), Reverté. Barcelona Esp. 328 pp. [ Links ]
ISSS–ISRIC–FAO (2002) World Reference Base For Soil Resources. World Soil Resources Reports 84. International Society of Soil Science. International Soil Reference and Information Centre. Food and Agriculture Organization of the United Nations. Rome Italia. 91 p. [ Links ]
Keeny DR, Nelson DW (1982) Nitrogen–Inorganic Forms. En: Page AL (ed) Methods of Soil Analysis. part 2. Agronomy 9. American Society of Agronomy, Madison. Wisconsin, USA. 643–693 pp. [ Links ]
Kumar V, Behl RK, Narula N (2001) Establishment of phosphate–solubilizing strains of Azotobacter chroococcum in the rhizosphere and their effect on wheat cultivars under green house conditions. Microbiological Research 156: 87–93. [ Links ]
Madigan MT, Martinko JM, Parker J (2004) Brock. Biología de los microorganismos. 10a. ed. rev. Pearson Educación, S. A. Madrid, Esp. 1096 p. [ Links ]
Manoharachary C, Mukerji GK (2006) Rhizosphere biology–an overview En: Mukerji KG, Manoharachary C, Singh J (eds) Microbial Activity in the Rhizosphere. Springer–Verlag Berlin Heidelberg. 1–38 pp. [ Links ]
Meunchang S, Panichsakpatana S, Weaver RW (2006) Tomato growth in soil amended with sugar mill by–products compost. Plant and Soil 280: 171–176. [ Links ]
Mrkovacki N, Milic V (2001) Use of Azotobacter chroococcum as potentially useful in agricultural application. Annals of Microbiology 51: 145–158. [ Links ]
Ögüt M, Akdag C, Düzdemir O, Sakin MA (2005) Single and double inoculation with Azospirillum/Trichoderma: the effects on dry bean and wheat. Biology and Fertility of Soils 41: 262–272. [ Links ]
Okon Y, Labandera–González CA (1994) Agronomic applications of Azospirillum: an evaluation of 20 years worldwide field inoculation Soil Biology and Biochemistry 26: 1591–1601. [ Links ]
Orozco–Romero J, Pérez–Zamora O (2006) Tensión de humedad del suelo y fertilización nitrogenada en plátano (Musa AAA Simmonds) cv. Gran Enano. Agrociencia 40: 149–162. [ Links ]
Philippot L, Germon JC (2005) Contribution of bacteria to initial input and cycling of nitrogen in soil. En: Buscot F, Varma A (eds.) Microorganisms in soils Roles in Genesis and Functions. Springer–Verlag Berlin Heidelberg. Germany 159–176 pp. [ Links ]
Rajendran K, Devaraj P (2004) Biomass and nutrient distribution and their return of Casuarina equisetifolia inoculated with biofertilizers in farm land. Biomass and Bioenergy 26: 235–249. [ Links ]
Ramírez–Gama RM, Luna MB, Mejía CA, Velázquez MO, Tsuzuki RG, Vierna GL, Hernández GL, Muggenburg I (1998) Manual de Prácticas de Microbiología General. Facultad de Química, UNAM. México, DF. 300 pp. [ Links ]
Rao NS (1999) Soil microorganisms and plant growth. Oxford and IBH Publ. New Delhi, India. 407 p. [ Links ]
Rao PA, Krishna KG (2006) Plant growth–promoting rhizobacteria. En: Gnanamanickam SS (ed) Plant–Associated Bacteria. Springer The Netherlands. 195–230 pp. [ Links ]
Rennie RJ (1981) A single medium for the isolation of acetylene–reducing (Dinitrogen–fixing) bacteria from soils. Canadian Journal Microbiology 27: 8–14. [ Links ]
Rivera–Cruz MC, Ferrera–Cerrato R, Volke–Haller V, Fernández–Linares L, Rodríguez–Vázquez R (2002) Poblaciones microbianas en perfiles de suelos afectados por hidrocarburos del petróleo en el estado de Tabasco, México. Agrociencia 36: 149–160. [ Links ]
SAS Institute INC. 1999. SAS Users Guide Statistical Analysis Institute. Cary, NC. [ Links ]
SAGARPA. 2005. Sistema de Información Agropecuaria de Consulta, 1980–2004 (SIACON). México DF. http://www.sagarpa.mx [ Links ]
Soldevilla CS (2005) Impacto económico, social y ambiental de la producción de banano orgánico en el Valle del Chira Perú. Tesis Doctor en Ciencias. Colegio de Postgraduados. Montecillo, Texcoco, edo de México. 114 pp. [ Links ]
Tripathy PP, Ayyappan S (2005) Evaluation of Azotobacter and Azospirillum as biofertilizers in aquaculture. World Journal of Microbiology & Biotechnology 21: 1339–1343. [ Links ]
Velazco AN, Castro SG (1999) Estudio de la inoculación de Azospirillum brasiliense en el cultivo de arroz (variedad A'82) en condiciones de macetas. Cultivos Tropicales 20: 27–41. [ Links ]
Vessey JK (2003) Plant growth promoting rhizobacteria whit biofertilizers. Plant and Soil 255: 571–586. [ Links ]














