Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.32 no.2 México mar./abr. 2009
Actualización por temas
Electroencefalograma y potenciales relacionados con eventos en el trastorno obsesivo compulsivo
Electroencephalogram and event related potentials in obsessive compulsive disorder
Josefina Ricardo Garcell,1,2* Walfred Rueda Medina2
1 Instituto de Neurobiología, Universidad Nacional Autónoma de México, Campus Juriquilla.
2 Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
*Correspondencia:
Dra. Josefina Ricardo Garcell.
Instituto de Neurobiología,
Universidad Nacional Autónoma de México, Campus Juriquilla.
Boulevard Juriquilla 3001,
76230 Juriquilla, Querétaro, México.
E.mail. oojrg@yahoo.com y walf_med@yahoo.com.mx
Recibido: 18 de abril de 2008
Aceptado: 20 de noviembre de 2008
Abstract
The obsessive compulsive disorder (OCD) is a diverse and multidimensional psychiatric syndrome, characterized by obsessions and compulsions, where anxiety is considered to be a key clinical component. Imaging studies have shown brain abnormalities in patients with OCD involving mainly the frontotemporal circuits, the orbitofrontal and the anterior cingulate cortex. These techniques have a high spatial resolution to identify brain alterations in this disorder but have less time resolution and are more expensive than electrophysiological studies. The electroencephalogram (EEG) and event–related potentials (ERPs) are the most common electrophysiological techniques used in the research of OCD. The EEG represents the electrical activity of the brain as recorded by electrodes placed on the scalp. The ERPs are voltage fluctuations that are temporarily linked to the presence of a physical or mental event. The best–known type of EEG is the <<traditional EEG>> (analyzed by visual inspection), which is characterized by the presence and topographic distribution of four frequency bands: delta (δ),theta (θ), alfa (α), and beta (β). The δ and θ bands are identified as slow activities while the α and β bands are known as fast activities. The slow activity has been referred to as the most common abnormality in OCD, specially in the θ band. Moreover, the Broad Band Spectral Parameters (BBSPs) have contributed, for more than two decades, to the study of psychiatric patients and their values can be presented in a compact form as a topographic map on the scalp (Brain Mapping in the frequency domain).
The Absolute Power (AP) and the Relative Power (RP) are the most common BBSPs used. Is difficult to determine if AP is abnormal at certain age due to the fact that AP values vary with age. To solve it, it is suggested to transform AP's values, in every band, into Z values which indicate how close is the subject to the average values of normal individuals of the same age. Since abnormal increases and decreases have been described in the anterior brain regions by the slow bands (δ and θ) and the fast bands (α and β), some authors have considered inconsistent the alterations that have been observed with the BBSPs.
Nevertheless, in accordance with traditional EEG studies, other authors have confirmed the excess of theta activity in patients with OCD. Of special interest for the clinical practice is that some authors have demonstrated, using the BBSPs, the existence of two OCD patients subgroups, which were homogeneous from the clinical point of view: one group with an excess of θ in the RP values, specially in the frontal and fronto–temporal regions, and a significative increase of α RP values for the other group. Eighty per cent of the patients of the first subgroup did not improved with selective serotonine reuptake inhibitors treatment, whereas 82.4 % of the patients of the second group improved. These results were confirmed ten years later and the α RP excess, present in those patients who improved, decreased after three months of treatment. However, it must be reminded that the generator of abnormal brain electrical activity, could be originate in a distant place to the location shown by the scalp electrodes.
LORETA and VARETA are two methods used to calculate the origin of the generators above mentioned. The first investigation using LORETA was published in 2005, and it was observed that compared to controls, the OCD group showed an excess of β activity in the cingulate gyrus (mainly in the middle cingulate gyrus), as well as in the adjacent frontal, parietal and occipital regions. Two years later, in another EEG sources study, but using VARETA, has been found an excess of α activity with abnormal EEG sources located in the striatum and in the orbito–frontal and temporo–frontal regions, which decreased after successful treatment with paroxetine.
Therefore, it is also heartening to confirm, through the study of generators of the EEG, a result of great clinical value previously proved with BBSPs.
The ERPs are divided into two types: exogenous and endogenous. In this paper we shall refer to the endogenous or cognitive type which depends on the nature of the interaction between the subject and the stimulus, so it will vary with attention, relevance of the task and the processing required. The ERPs are small voltage fluctuations that are identified by their latency (time of appearance in milliseconds), its amplitude (voltage in microvolts) and its polarity (positive or negative voltage).
Among the most characteristic ERPs components are the N200 and the P300. In most cases these components are elicited through a classical <<oddball>> paradigm, in which an infrequent stimulus (<<target>>) is randomly interspersed within an ongoing train of a different repeating stimulus (<<standard>>). There are at least two subcomponents of the P300: a frontal/central maximum amplitude component, the P3a that appears after the occurrence of unexpected distracters, regardless of its relevance for the task and represents an orienting response. The other one is the P3b, which has been more studied, it has a central/parietal distribution and evaluates attention and working memory.
The N200 component has been linked to the automatic and voluntary process of identification and categorization of the stimuli. In patients with OCD there have been described shorter latencies and larger amplitudes for the P3b and N200 components, suggesting hyperarousal of the cortex and overfocused attention. However, there have also been described shorter amplitudes and larger latencies for the P300 component in the frontal regions, which have been related to an impairment of working memory or attention. Some authors have observed an inverse correlation between the N200 amplitude and the severity of the symptoms as well as a positive correlation between this variable and the response to treatment with selective serotonine reuptake inhibitors, but others have pointed out that patients that respond to treatment have a lower N200 amplitude, a larger P300 amplitude and a N200 and P300 shorter latencies.
As for the possible association between the ERPs and the disease's evolution time, there has been a positive correlation between the N200 amplitude and the chronicity of the disorder. It has also been found that the amplitude of the P300 component is positively associated with the severity of symptoms assessed by the Yale–Brown obsessive compulsive scale.
Finally, it can be considered that, from a clinical point of view, patients with OCD have the feeling that <<something is not right>> or <<of having committed an omission>> when it has not been committed, and <<get caught>> on excessive verification responses when an error mistake has happened. That phenomenological consideration has been associated to an alteration of the action monitoring process, which represents one of the executive functions mediated by the frontal regions, particularly the anterior cingulate cortex, which may be <<hyperactive>> in OCD patients when they have the feeling of having made a mistake. The action monitoring process has been evaluated in patients with OCD through an ERP component called <<Error–related Negativity>> (ERN). The ERN is a negative wave around the 50–150 ms, which appears after the subject committed an error or thinks it has been done. In an ERN study it was found greater ERN amplitudes in the frontal regions in subjects with high obsessivity rates compared to subjects with low obsessivity ones, which is consistent with the hyperactivity hypothesis of the fronto–temporal system proposed for this disorder and is according to the theory that patients with OCD show an increase of the monitoring function when a mistake has been done.
However, there are authors who have not found differences in the NRE between healthy subjects and patients with OCD under pharmacological treatment, but they have observed a significant negative association between the ERN amplitude and the severity of the disorder. Hajcak et al. 2008, noticed an amplitude ERN increase in a group of subjects with pediatric OCD compared with the control group, which is consistent with ERN adult studies. In addition, since the ERN was not associated with the symptom severity or the response to treatment with cognitive behavioral therapy, that is why this alteration of the ERN could be a trait–like marker. Based on the foregoing, these researchers suggested that the increase in the amplitude of the NRE could be considered as an endophenotype.
The EEG and ERPs can do an important contribution, in conjunction with clinical and imaging studies, to the identification of the structures and circuits involved in the pathophysiology of OCD. In addition, there are several evidences to support the utility of these electrophysiological techniques as complementary studies in the clinical evaluation and treatment of patients with OCD.
Key words: Obsessive–compulsive disorder, electroencephalogram, event–related potentials, P300, frequency analysis.
Resumen
El Trastorno Obsesivo Compulsivo (TOC) es un trastorno psiquiátrico crónico, clínicamente heterogéneo, multidimensional, caracterizado por la presencia de obsesiones y compulsiones, en el cual la ansiedad es un componente fundamental del cuadro clínico. Los estudios de imágenes tienen una gran resolución espacial que permite la identificación de las alteraciones presentes en esta entidad pero tienen menor resolución temporal y son de mayor costo que los estudios electrofisiológicos. Entre las técnicas electrofisiológicas más utilizadas para investigar el TOC se encuentran el electroencefalograma (EEG) y los potenciales relacionados con eventos (PREs). El EEG es el registro de la actividad eléctrica cerebral, es decir, de las diferencias de voltaje entre dos electrodos situados sobre el cuero cabelludo, en función del tiempo. Los PREs son las fluctuaciones de voltaje que están asociadas temporalmente a la presencia de un evento físico o mental.
El tipo de EEG más conocido es aquél que se analiza por inspección visual (EEG tradicional: EEG–T) y que se describe mediante la presencia y distribución topográfica de cuatro tipos de actividades electroencefalográficas: delta (δ), theta (θ), alfa (α) y beta (β). Las bandas δ y θ se identifican como actividades lentas mientras que las bandas α y β se conocen como actividades rápidas. En el TOC se ha referido la actividad lenta como la anormalidad más común en el EEG–T, especialmente la actividad de tipo θ, aunque también se han descrito EEGs normales. Por otra parte, las medidas espectrales de banda ancha (MEBAs) han comprobado este exceso de actividad lenta además de anormalidades en las bandas rápidas, particularmente en la α.
Entre las MEBAs más utilizadas se encuentran la potencia absoluta y la potencia relativa. Se ha demostrado, tanto con las MEBAs como con el análisis de generadores del EEG, que aquellos pacientes que tienen un exceso de a en regiones anteriores y medias responden mejor a los inhibidores de la recaptura de serotonina, lo cual es de gran utilidad clínica.
Los PREs se dividen en dos tipos: exógenos y endógenos. En este trabajo se hará referencia a los endógenos o cognitivos. Entre los componentes de los PREs cognitivos más característicos están el N200 y el P300. En los pacientes con TOC se han descrito amplitudes mayores y latencias más cortas en los componentes P3b y N200, lo cual se ha atribuido a hiperalertamiento cortical y sobrefocalización de la atención. También se han observado correlaciones positivas entre la amplitud del componente N200 y la cronicidad del trastorno y entre la amplitud del componente P300 y la severidad de la sintomatología del TOC. Los pacientes con este trastorno tienen la sensación de que <<algo no está bien>> y se <<enganchan>> en respuestas de verificación excesiva. Esto se ha asociado con una alteración en el proceso de monitorización de la acción, que representa una de las funciones ejecutivas a cargo de las regiones frontales, particularmente del cíngulo anterior, el cual posiblemente se <<hiperactive>> en los pacientes con TOC cuando tienen la sensación de haber cometido un error. La <<negatividad relacionada al error>> (NRE) es una onda negativa, alrededor de los 50–150 ms, posterior a que el sujeto cometió un error o cuando está seguro de haberlo cometido.
Se ha encontrado que los pacientes con TOC (niños y adultos) muestran un incremento de la negatividad de este componente en comparación a sujetos controles y se ha propuesto que pudiera considerarse como un marcador biológico del TOC.
El EEG y los PREs pueden contribuir de manera importante, junto con los estudios clínicos e imagenológicos, a la identificación de las estructuras y circuitos involucrados en la fisiopatología del TOC. Además, hay evidencias que apoyan la utilidad de estas técnicas electrofisiológicas como estudios complementarios en la evaluación clínica y terapéutica de los pacientes con TOC.
Palabras clave: Trastorno obsesivo compulsivo, electroencefalograma, potenciales relacionados con eventos, P300, análisis de frecuencia.
INTRODUCCIÓN
El Trastorno Obsesivo Compulsivo (TOC) es un trastorno psiquiátrico crónico, clínicamente heterogéneo, multidimensional, caracterizado por la presencia de obsesiones y compulsiones, en el cual la ansiedad es un componente fundamental del cuadro clínico. Las obsesiones son ideas, imágenes o impulsos, de carácter intrusivo, repetitivo, absurdo y angustiante mientras que las compulsiones son conductas repetitivas, ritualísticas, absurdas y que se desarrollan con el fin de disminuir la angustia provocada por las obsesiones.1
Los estudios de imágenes estructurales y funcionales han mostrado la presencia de alteraciones cerebrales en los pacientes con TOC que involucran, sobre todo, a los circuitos fronto–estriados y a las cortezas órbito–frontal y del cíngulo anterior; sin embargo, se han señalado otras regiones (témporo–límbica, corteza parietal, tálamo), que sugieren una disfunción cerebral amplia y compleja.2–4
Aunque es obvia la importancia de este tipo de investigaciones para lograr un mayor conocimiento de las bases neurobiológicas del TOC, es importante señalar que, al mismo tiempo que ofrecen una gran resolución espacial para la identificación de las alteraciones presentes en esta entidad, muestran las desventajas de tener una menor resolución temporal y ser de mayor costo que los estudios electrofisiológicos.
Entre las técnicas electrofisiológicas más utilizadas para investigar el TOC se encuentran el electroencefalograma (EEG) y los potenciales relacionados con eventos (PREs). La primera se refiere al registro de la actividad eléctrica cerebral, es decir, de las diferencias de voltaje entre dos electrodos situados sobre el cuero cabelludo, en función del tiempo. La segunda comprende a las fluctuaciones de voltaje que están asociadas temporalmente a la presencia de un evento físico o mental.5 Los primero trabajos con EEG y PREs datan desde hace casi 40 años pero la búsqueda de nuevos métodos de análisis de la actividad eléctrica cerebral y de paradigmas experimentales que permitan caracterizar mejor a los pacientes con TOC, tiene gran vigencia en la actualidad.
ELECTROENCEFALOGRAMA
El tipo de EEG más conocido es aquél que se analiza por inspección visual (EEG tradicional: EEG–T) y que se describe mediante la presencia y distribución topográfica de cuatro tipos de actividades electroencefalográficas: delta (δ), theta (θ), alfa (α) y beta (β). La actividad δ tiene una frecuencia de 1–3 Hertzios (Hz.) o ciclos por segundo, la θ de 4–7 Hz., la α de 8–13 Hz. y la β de 14–30 Hz.). Las bandas delta y theta se identifican como actividades lentas mientras que las bandas alfa y beta se conocen como actividades rápidas.
Por otra parte, en las últimas décadas, el análisis cuantitativo del EEG (Quantitative EEG: Q–EEG, por sus siglas en inglés) ha realizado contribuciones importantes a la investigación en psiquiatría. En particular, las medidas derivadas del análisis de frecuencias del EEG, han puesto de manifiesto la presencia de subgrupos electroencefalográficos en pacientes que pertenecen a un mismo diagnóstico clínico.6,7 Los valores de dichas medidas pueden tener una presentación compacta en forma de un mapa topográfico sobre el cuero cabelludo (mapeo cerebral en dominio de las frecuencias).
EEG tradicional y TOC
La primera referencia que hemos encontrado sobre EEG–T y TOC data de 19448 y, tanto en ésta como en otras investigaciones, se ha referido la presencia de actividad lenta como la anormalidad más común, especialmente la actividad de tipo theta.9–11
Jenike y Brotman10 también observaron que la tercera parte de los 12 pacientes portadores de TOC grave que ellos estudiaron tenía anormalidades en los lóbulos temporales y que, cuando recibieron tratamiento con anticonvulsivantes, sólo se notó mejoría en uno de ellos.
Por su parte, Perros et al.12 evaluaron a 13 pacientes que sufrían de TOC intenso por lo menos desde un año antes de su estudio de EEG y no respondían ni a la psicoterapia ni al tratamiento farmacológico. Once de estos pacientes tenían actividad theta en el EEG, de diferente intensidad y localización, y en dos de ellos estuvo presente la actividad delta. Sin embargo, el EEG fue normal en dos pacientes.
EEG durante sueño espontáneo: Los registros de sueño de toda la noche en los pacientes con TOC han mostrado un acortamiento de la latencia del sueño MOR, menor proporción del sueño de ondas lentas y una disminución del tiempo total de sueño, con relación a controles normales.13
EEG cuantitativo y TOC
En la década de 1960, el grupo de Livanov que trabajaba en la antigua Unión Soviética, llevó a cabo una serie de investigaciones en las que evaluaba, mediante el coeficiente de correlación, la sincronización de la actividad electroencefalográfica entre un gran número de áreas corticales. Livanov14 observó que los sujetos normales, en reposo, tenían una baja sincronización, existiendo pocas áreas que tuvieran una relación entre sí.
Sin embargo, al presentarles un problema complejo que debían solucionar, aparecía un aumento considerable en el número de áreas en la corteza cerebral que trabajaban sincrónicamente (valores altos del coeficiente de correlación), con una gran activación de los lóbulos frontales. Una vez resuelto el problema, los sujetos presentaban de nuevo el patrón de reposo.
Siguiendo el mismo procedimiento, Aslanov15 estudió seis casos con neurosis obsesiva y encontró que estos pacientes mostraban una elevada sincronización de su actividad eléctrica cerebral, en las regiones anteriores y medias, durante la fase de agudización de la enfermedad (patrón semejante al de los sujetos normales que tratan de solucionar un problema complejo), mientras que en los periodos de mejoría clínica la sincronización era menor, acercándose al patrón de los sujetos normales en reposo.
Hasta donde sabemos, este trabajo no ha sido reproducido y son las medidas derivadas del análisis de frecuencias del EEG las que han prevalecido en las investigaciones con pacientes psiquiátricos. En la figura 1 se sintetizan los pasos para obtener el espectro de potencia que es de donde se obtienen dichas medidas.16,17

El EEG en cada derivación (figura 1A) representa una mezcla de frecuencias las cuales pueden ser separadas mediante el procedimiento matemático conocido como Análisis de Fourier. Por medio del mismo, el EEG en cada derivación se transforma del dominio del tiempo al dominio de la frecuencia y, en lugar de tener oscilaciones de voltaje en función del tiempo, se tendrán valores de potencia en función de la frecuencia (figura 1B), los cuales surgen de elevar al cuadrado los valores de amplitud de cada una de las ondas en que se ha descompuesto la actividad correspondiente a cada derivación. A partir de ellos se calcula el espectro de potencia que es una gráfica de la potencia en función de la frecuencia y de donde se derivan las diferentes medidas espectrales (figuras 1C y 1D).
En la figura 1C se ejemplifica el espectro de potencia de <<banda estrecha>> correspondiente a una derivación hipotética. Este tipo de espectro se obtiene cuando se utilizan las potencias correspondientes a cada una de las frecuencias en que se ha descompuesto la actividad de la derivación. Sin embargo, en la práctica, la tendencia ha sido agrupar las potencias de la banda estrecha en los rangos de las bandas clásicas de la electroencefalografía (<<análisis de banda ancha>>): δ, θ, α, β (figura 1D).16,17
Entre las medidas espectrales de banda ancha (MEBAs) más utilizadas en las investigaciones clínicas se encuentran: la potencia absoluta (PA) y la potencia relativa (PR). La PA es el área representada bajo la curva del espectro mientras que la PR representa el por ciento de actividad en una banda y se calcula como el valor de la PA en esa banda entre la suma de los valores de PA de todas las bandas (figura 1D). Debido a que la PA varía con la edad18–20 es difícil decidir cuándo la PA es anormal para la edad del sujeto en estudio. Para solucionarlo se sugiere transformar los valores de PA, en cada banda, en valores Z los cuales nos indican qué tanto el sujeto se desvía o se encuentra próximo a la media de los sujetos normales de su edad. El valor Z se calcula así: Z PA δ= (PA δ del sujeto –PA δ del promedio) /desviación estándar (DE) de la PA δ. En este caso, el promedio y la DE se refieren al grupo de individuos de la misma edad que el sujeto. Un valor Z mayor o menor que 2.0 significa que el sujeto se encuentra 2 DE por arriba o por debajo de la norma, respectivamente, lo cual puede considerarse como anormal con una p=0.05.16,17,21 En la figura 2 se ejemplifica, por medio de un Mapa–Z que pudiera corresponder a la PA o a la PR, la presencia de un exceso significativo de actividad en las regiones anteriores y medias el cual podría ser de tipo delta, theta, alfa o beta.
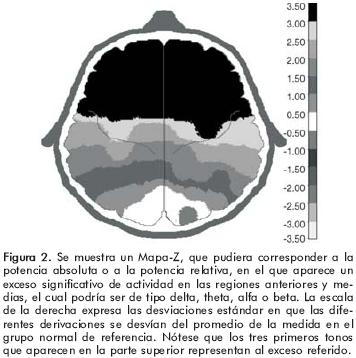
En la sección anterior pudo notarse que en los estudios de EEG tradicional en los pacientes con TOC predominaron las alteraciones en la banda theta pero no quedaron excluidas las anormalidades en la banda delta ni la presencia de un EEG normal. Con respecto al análisis de frecuencias, según Bucci et al.22 las alteraciones referidas han sido inconsistentes ya que se han descrito aumentos y disminuciones en las regiones cerebrales anteriores tanto para las bandas lentas (δ y θ) como para las rápidas (α y β) .6,23,24
No obstante, en concordancia con los estudios de EEG tradicional, algunos autores6,12,25 han confirmado el exceso de actividad theta en los pacientes con TOC. Perros et al.12 encontraron un exceso significativo de la PR theta (entre 6.0 y 7.5 Hz.) en los pacientes con TOC, respecto a controles sanos, en las regiones central y temporal anterior izquierdas. De forma análoga, Karadag et al.25 refirieron un aumento de la PA theta en las regiones frontotemporales pero con una disminución de la PA beta. Los pacientes con TOC grave tenían disminuida, significativamente, la actividad alfa e incrementada la lenta (menos de 5 Hz.) en las regiones anteriores y medias.
Pogarell et al.26 evaluaron a 18 pacientes no medicados e igual número de controles sanos. Encontraron que la frecuencia media de la actividad de base fue significativamente más baja en los pacientes (p≤0.01), predominantemente en las regiones frontales. La PA reveló un incremento en la banda delta y una disminución en el cociente PA alfa/PA beta en los pacientes (p<0.05).
También se observaron correlaciones significativas (p≤0.05) positivas entre estas medidas espectrales y los puntajes de <<obsesiones>> de la escala de severidad de Yale–Brown para Trastorno Obsesivo Compulsivo (Yale–Brown Obsessive Compulsive Scale: Y–BOCS, por sus siglas en inglés) y negativas con los puntajes de las <<compulsiones>> de la misma escala.
Bucci et al.22 estudiaron a 32 pacientes con TOC no medicados y 32 controles sanos emparejados en edad, sexo y dominancia con los pacientes. Encontraron diferentes tipos de anormalidades en los valores de la PA y la PR de los pacientes cuando los compararon con los sujetos sanos pero el hallazgo más consistente fue una disminución de los valores de estas medidas en la banda alfa baja (7.7–9.5 Hz.), de manera difusa pero con predominio en las regiones anteriores (el análisis no incluyó a los pacientes con puntajes ≥ 16 en la escala de Hamilton). También observaron una asociación negativa y significativa entre los valores de la banda alfa baja y el tiempo requerido para completar una prueba neuropsicológica que exploraba funciones ejecutivas: mientras más bajos eran los valores de la PA y de la PR en esta banda, más lenta era la ejecución de la prueba.
Simpson et al.27 llevaron a cabo una investigación, en seis pacientes con TOC, para explorar los cambios regionales de la actividad eléctrica cerebral durante la exposición imaginaria y real a estímulos que provocaban temor de contaminación. Ellos observaron un cambio significativo en la distribución antero–posterior de los valores de la PA alfa durante la exposición real: disminución en las regiones frontales e incremento en las posteriores. Sus resultados preliminares les permitieron sugerir: 1. que la exposición real es más efectiva que la imaginaria para provocar cambios en medidas conductuales y electrofisiológicas y 2. que la disminución anterior de la PA alfa podría reflejar una mayor activación cerebral en esa región lo cual sería consistente con el aumento en la activación frontal descrito en estudios de imágenes cerebrales, en pacientes con TOC, en los que se han utilizado paradigmas de provocación de síntomas.
De especial interés para la práctica clínica han sido los trabajos realizados por Prichep et al.6 y Hansen et al.28 Prichep et al.6 demostraron la existencia de dos subgrupos electroencefalográficos en un grupo de pacientes con TOC, que eran homogéneos desde el punto de vista clínico: uno se caracterizaba por un exceso de potencia relativa theta, especialmente en las regiones frontales y frontotemporales, y el otro por un incremento en la potencia relativa alfa.
El 80% de los pacientes del primer subgrupo no respondió al tratamiento con inhibidores de la recaptura de serotonina mientras que el 82.4% del segundo sí lo hizo. Diez años después, Hansen et al.28 confirmaron estos resultados en un grupo de pacientes con TOC sin depresión y observaron que el exceso de actividad alfa, presente en los respondedores, disminuyó al cabo de los tres meses de tratamiento.
Los resultados precedentes son sugestivos de que, a pesar de las inconsistencias señaladas por Bucci et al.,22 predominan las alteraciones en las regiones frontales y que las medidas espectrales pueden ser utilizadas con fines clínicos. Sin embargo, no se puede obviar el hecho de que, debido a la complejidad anatómica del cerebro, la fuente de corriente o generador de actividad eléctrica cerebral anormal, puede originarse en un lugar distante a la localización que muestran los electrodos colocados sobre el cuero cabelludo.29 Existen diversos métodos matemáticos para calcular el origen de una fuente de corriente a partir de los valores de voltaje registrados en los diferentes electrodos de superficie, entre ellos se encuentran: la Tomografía Electromagnética Cerebral de Baja Resolución (Low Resolution Electromagnetic Tomography: LORETA, por sus siglas en inglés)30,31 y la Tomografía Eléctrica Cerebral de Resolución Variable (Variable Resolution Electromagnetic Tomography: VARETA, por sus siglas en inglés).32–34
Sherlin y Congedo35 publicaron en el 2005 el primer trabajo de fuentes anormales del EEG en TOC. Ellos encontraron, mediante la técnica LORETA, que los pacientes con TOC presentaban, como hallazgo principal, un exceso de actividad beta, comparado con los controles, en la circunvolución del cíngulo (sobre todo en su parte media) así como en las regiones adyacentes frontales, parietales y occipitales. La actividad beta de menor frecuencia predominó hacia las zonas anteriores del cíngulo y la de mayor frecuencia hacia las posteriores.
No hay dudas de que el estudio de Sherlin y Congedo35 representa un paso importante en la investigación del TOC mediante análisis cuantitativo del EEG; sin embargo, a juicio de los autores, sus resultados necesitaban ser validados en una muestra donde se especificaran mejor los aspectos clínicos de los pacientes.
Dos años después, Bolwig et al.36 publicaron otro estudio de generadores del EEG en un grupo de pacientes con TOC, libres de tratamiento farmacológico, pero utilizando el método VARETA. Estos autores encontraron un exceso de actividad en el rango alfa, con fuentes anormales ubicadas en el cuerpo estriado y en las regiones órbito–frontal y témporo–frontal. De forma análoga a como ocurrió en las investigaciones de Prichep et al.6 y Hansen et al.,28 usando las MEBAs, las fuentes anormales observadas por Bolwig et al.36 disminuyeron después de un tratamiento exitoso con paroxetina.
El mapeo cerebral en el dominio de la frecuencia ha demostrado, desde hace más de dos décadas, su aporte al estudio del paciente psiquiátrico37,38 y resulta alentador confirmar, por medio del estudio de generadores del EEG, que las medidas espectrales del EEG pueden ser de utilidad para evaluar la respuesta al tratamiento con inhibidores de la recaptura de serotonina.
POTENCIALES RELACIONADOS CON EVENTOS
Los PREs se dividen en dos tipos: exógenos y endógenos. En los exógenos, las características de sus componentes dependen de las propiedades físicas del estímulo sensorial y no son afectados por la manipulación cognitiva; mientras que los endógenos o cognitivos dependen de la naturaleza de la interacción del sujeto con el estímulo y varían según la atención, relevancia de la tarea que los genera y la naturaleza del procesamiento requerido.39
Para la obtención de los PREs se expone al sujeto a una serie de estímulos físicos (visuales, auditivos, somestésicos o motores) o cognitivos, mientras se registra la actividad eléctrica cerebral asociada a los mismos. Una vez obtenido el registro, se promedia la actividad eléctrica dentro de una ventana de tiempo que incluye la duración del estímulo y un tiempo adicional que depende de los componentes a evaluar. Mediante este promedio se refuerza la actividad relacionada con el estímulo y se elimina la actividad electroencefalográfica que tiene un comportamiento aleatorio.40
En el PRE promedio aparece una serie de ondas que se identifican por su tiempo de aparición (latencia, en milisegundos), su voltaje (amplitud, en microvoltios) y su polaridad (voltaje positivo o negativo). De esta forma, una onda positiva que aparece alrededor de los 300 milisegundos (ms) se conoce como el componente P300.
Entre los componentes de los PREs cognitivos más característicos están el N200 y el P300 (figura 3). En la mayoría de los casos éstos se obtienen mediante un paradigma denominado <<oddball>> (clásico), que consiste en la presentación de un estímulo de aparición frecuente y otro de presentación infrecuente y aleatoria. Existen por lo menos dos subcomponentes del P300: el P3a que ocurre después de la aparición de un evento inesperado, independientemente de la relevancia del estímulo para la tarea, cuya distribución es típicamente frontal y que se asocia a una respuesta automática de la atención. Y el subcomponente P3b, el cual ha sido más estudiado, tiene una distribución centro–parietal y evalúa atención y memoria de trabajo.41 El componente N200 se ha relacionado con el proceso tanto automático como voluntario de identificación y categorización del estímulo.42,43

PREs en el TOC
Cielsielski et al.44 realizaron el primer acercamiento para dilucidar posibles anormalidades en los PREs endógenos en sujetos con síntomas obsesivos. Estos autores propusieron que en los pacientes con TOC ciertas conductas se aprenden y se fijan de manera anormal debido a que presentan niveles altos de activación cerebral y bajos de inhibición. Estas alteraciones en el sistema de regulación de activación cerebral producirían amplitudes mayores y latencias más cortas en los componentes de los PREs. Para probar su hipótesis evaluaron, mediante PREs visuales con distintos grados de complejidad, a un grupo de sujetos con diagnóstico de neurosis obsesiva y a un grupo control sano.
Los autores del estudio observaron un aumento de la amplitud del N200 y acortamiento de las latencias de este componente y del P300 en los pacientes respecto a los controles, al aumentar la dificultad de la prueba; sin embargo, de manera contraria a lo esperado, no hubo un incremento de la amplitud en el componente P300.
Los hallazgos anteriores fueron reproducidos por Towey et al.,45 quienes compararon un grupo de pacientes con TOC (según criterios del DSM–III–R) y un grupo control sano mediante dos tareas <<oddball>> (modalidad auditiva) de distinta complejidad (simple y difícil). De forma similar, se encontró que al aumentar la dificultad de la prueba las latencias de los componentes N200 y P300 en los pacientes con TOC fueron menores que la de los controles y que en los pacientes fue mayor la amplitud del componente N200. Con base en sus resultados, estos autores propusieron que los pacientes con TOC presentaron un incremento en la velocidad de procesamiento de información respecto a los controles debido a hiperalertamiento cortical y sobrefocalización de la atención.
En un estudio más reciente, Papageorgiou et al.46 encontraron, mediante un paradigma de <<oddball>> auditivo, que un grupo de pacientes con TOC tuvo amplitudes menores y latencias mayores del componente P300, en las regiones frontales, que los controles. Estos resultados fueron atribuidos a una alteración en la memoria de trabajo o en la atención a cargo de las regiones frontales cerebrales.
Di Russo et al.47 emplearon una prueba <<go–no go>> modificada, la cual evalúa la función del lóbulo frontal. Esta prueba consiste en dos fases, en la primera se presentan dos estímulos a uno de los cuales el sujeto debe atender y, en la segunda fase, el estímulo que previamente era importante ahora no genera ninguna respuesta. Estos autores evaluaron a ocho pacientes con TOC, según criterios del DSM–IV, los compararon con 12 controles sanos y observaron, en los pacientes, una mayor amplitud del componente P300 en las derivaciones centrales en lugar de las frontales como ocurrió en el grupo control. Estos resultados avalan la utilidad de la prueba <<go–no go>> modificada para evaluar la activación de las estructuras frontales.
Otra prueba de inhibición cognitiva que ha sido utilizada para la evaluación de pacientes con TOC es la prueba de Stroop, la cual se basa en la habilidad para leer de manera más eficiente y automática las palabras que los colores y el mecanismo implicado es la inhibición de una respuesta automática. Johannes et al.48 compararon, mediante PREs con la prueba de Stroop modificada, a tres grupos de sujetos: pacientes con TOC, con síndrome de Gilles de la Tourette y controles sanos. El grupo de pacientes con TOC presentó mayor amplitud tanto para el componente N200 como para el P3b.
Por otra parte, para comprender el significado clínico de las alteraciones en los componentes N200 y P300, Towey et al.49 examinaron la relación entre estos dos componentes (modalidad auditiva) y la severidad de los síntomas, la respuesta al tratamiento y la presencia de signos neurológicos blandos. En los resultados se encontró una correlación inversa entre la amplitud del N200 y la intensidad de los síntomas, así como la presencia de signos neurológicos blandos; mientras que se observó una correlación positiva entre esta variable y la respuesta al tratamiento con inhibidores de la recaptura de serotonina. Sin embargo, este hallazgo no es consistente, ya que Morault et al.50,51 encontraron que los pacientes respondedores a dicho tratamiento presentaron una menor amplitud del N200, mayor amplitud del P300 y menor latencia de ambos componentes.
Cabe mencionar que solamente se ha publicado un estudio52 en el que se haya evaluado la asociación entre los componentes de los PREs auditivos y el tiempo de evolución del padecimiento. De Groot et al.52 observaron una correlación positiva entre la amplitud del componente N200 y la cronicidad del trastorno y que la amplitud del componente P300 se asoció positivamente con la intensidad de la sintomatología evaluada mediante la escala Y–BOCS.
Finalmente, vale la pena considerar que, desde el punto de vista clínico, los pacientes con TOC tienen la sensación de que <<algo no está bien>>, <<de haber cometido una omisión>> o de <<haber cometido un error>> cuando éste no ha sido cometido y se <<enganchan>> en respuestas de verificación excesiva al cometer un error. Esta apreciación fenomenológica ha sido asociada con una alteración en el proceso de monitorización de la acción, que representa una de las funciones ejecutivas a cargo de las regiones frontales, particularmente del cíngulo anterior, el cual posiblemente se <<hiperactive>> en los pacientes con TOC cuando tienen la sensación de haber cometido un error.
El proceso de monitorización de la acción ha sido evaluado en pacientes con TOC mediante el componente de los PRES denominado <<negatividad relacionada al error>> (NRE). La NRE es una onda negativa, alrededor de los 50–150 ms, posterior a que el sujeto cometió un error o cuando está seguro de haberlo cometido53 (figura 4). En una investigación con 35 estudiantes universitarios con índices de obsesividad altos y bajos, Hajcak y Simons53 observaron que el grupo con índices elevados de obsesividad presentó una mayor NRE en las regiones frontales en comparación a los sujetos con obsesividad baja, lo cual consideraron congruente con la hipótesis de hiperactividad del sistema fronto–estriado en estos sujetos.

Por su parte, Ruchsow et al.54 midieron este componente por medio de una prueba <<go–no go>> en un grupo de 11 pacientes con TOC y 11 sujetos controles y encontraron que los pacientes tuvieron mayor amplitud en la NRE. Esto concuerda con la teoría de que los pacientes con TOC muestran un incremento en la función de monitorización al cometer un error. No obstante, Nieuwenhuis et al.55 no encontraron diferencias en la NRE entre sujetos sanos y pacientes con TOC bajo tratamiento farmacológico, pero sí observaron una asociación negativa significativa entre la amplitud de la NRE y la intensidad del trastorno.
Hajcak et al.56 evaluaron la NRE en un grupo de sujetos con TOC infantil y observaron un incremento en la negatividad de este componente en el grupo de pacientes con TOC en comparación al grupo control, lo cual concuerda con lo observado en estudios de NRE en adultos con este trastorno.
Además, la NRE no se relacionó con la gravedad de la sintomatología ni con la respuesta al tratamiento con terapia cognitivo–conductual, por lo que esta alteración de la NRE en el TOC pudiera ser un indicador de rasgo más que de estado. Con base en lo anterior, este grupo de investigadores propusieron que el incremento en la amplitud de la NRE pudiera ser considerado como un marcador biológico del TOC.
CONCLUSIONES
Existen evidencias de que el TOC es una entidad clínica heterogénea, con alteraciones que sugieren una disfunción cerebral amplia y compleja, lo cual apoya la necesidad de un enfoque multidisciplinario para su evaluación. En este contexto, los aportes del EEG y los PREs pueden contribuir de manera importante, conjuntamente con los estudios clínicos e imagenológicos, a la identificación de las estructuras y circuitos involucrados en su fisiopatología. Además, hay evidencias que apoyan la utilidad de estas técnicas electrofisiológicas como estudios complementarios en la evaluación clínica y terapéutica de los pacientes con TOC. En la medida en que se logren avances en este sentido, cada vez será más probable la caracterización adecuada de los distintos subgrupos de pacientes con TOC así como el desarrollo de medidas terapéuticas, e incluso preventivas, que mejoren la calidad de vida de estos pacientes.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento a Carlos A. Peña y a Héctor Belmont por su apoyo en las figuras de la sección de EEG.
REFERENCIAS
1. Attiullah N, Eisen JL, Rasmussen SA. Clinical features of obsessive–compulsive disorder. Psychiatr Clin North Am 2000;23(3) :469–91. [ Links ]
2. Anderson KE, Savage SR. Cognitive and neurobiological findings in obsessive–compulsive disorder. Psychiatr Clin North Am 2004;27(1):37–47. [ Links ]
3. Szeszko PR, Ardekani BA, Ashtari M, Malhotra AK, Robinson DG et al. White matter abnormalities in obsessive–compulsive disorder: a diffusion tensor imaging study. Arch Gen Psychiatry 2005;62(7) :782–790. [ Links ]
4. Valente AAJR, Miguel EC, Castro CC, Amaro EJR, Duran FL et al. Regional gray matter abnormalities in obsessive–compulsive disorder: a voxel–based morphometry study. Biol Psychiatry 2005;58(6) :479–487. [ Links ]
5. Picton TW, Bentin S, Berg P, Donchin E, Hillyard SA et al. Guidelines for using human event–related potentials to study cognition: recording standards and publication criteria. Psychophysiology 2000; 37(2): 127–152. [ Links ]
6. Prichep LS, Mas F, Hollander E, Liebowitz M, John ER et al. Quantitative electroencephalographic subtyping of obsessive–compulsive disorder. Psychiatry Res 1993;50(1):25–32. [ Links ]
7. Ricardo–Garcell J. Clinical homogeneity vs EEG heterogeneity in psychiatric illness. Attention Deficit Hyperactivity Disorder a good example. Guadalajara, Mexico: International Meeting of Mind & Electrophysiology; 2005; p 265–266. [ Links ]
8. Pacella BL, Polatin P, Nagler SH. Clinical and EEG studies in obsessive–compulsive states. Am J Psychiatry 1949;100:830–838. [ Links ]
9. Insel TR, Donnelly EF, Lalakea ML, Alterman IS, Murphy DL. Neurological and neuropsychological studies of patients with obsessive– compulsive disorder. Biol Psichiatry 1983;18:741–751. [ Links ]
10. Jenike MA, Brotman AW. The EEG in obsessive–compulsive disorder. J Clin Psychiatry 1984;45(3): 122–124. [ Links ]
11. Rockwell FV, Simons DJ. The electroencephalogram and personality organization in the obsessive–compulsive reactions. Arch Neurol Psychiatry 1947; 57:71–80. [ Links ]
12. Perros P, Young ES, Ritson JJ, Price GW, Mann P. Power spectral EEG analysis and EEG variability in obsessive–compulsive disorder. Brain Topography 1992;4(3): 187–192. [ Links ]
13. Marsch GR, McCall VW. Sleep disturbances in psychiatric disease. En: Ebersole JS (ed.). Ambulatory EEG monitoring. New York: Raven Press; 1989. [ Links ]
14. Livanov MN. Information processing in the nervous system. Trabajo presentado en el XXII Congreso Internacional de Ciencias Fisiológicas, Leiden. Amsterdam: Excerpta Medica Foundation; 1962; p. 899. [ Links ]
15. Aslanov AS. On various features of the spatial distribution of biopotentials in the cerebral cortex of patients with an obsessive neurosis. Zh Nevropatol Psikhiatr Im S S Korsakova 1968;68(7):1019–1026. [ Links ]
16. Ricardo–Garcell J. Aportes del electroencefalograma convencional y el análisis de frecuencias para el estudio del Trastorno por Déficit de Atención. Primera parte. Salud Mental 2004;27(1):22–27. [ Links ]
17. Ricardo–Garcell J, Galindo y Villa G. El Trastorno por Déficit de Atención: un enfoque multidisciplinario. Revista Latina de Pensamiento y Lenguaje, número monográfico (<<Electrofisiología y Cognición>>) 2004;6(2B):247–270. [ Links ]
18. Matousek M, Petersen I. Frequency analysis of the EEG in normal children and adolescents. En: Kellaway P, Petersen I (eds.). Automatic assessment of the EEG. New York: Raven Press; 1973. [ Links ]
19. John ER, Ahn H, Prichep L, Trepetin M, Brown D et al. Developmental equations for the EEG. Science 1980;210:1255–1258. [ Links ]
20. Harmony T, Marosi E, Díaz De León AE, Becker J, Fernández T. Effect of sex, psychosocial disadvantages and biological risk factors on EEG maturation. Electroenceph Clin Neurophysiol 1990;75:482–491. [ Links ]
21. Harmony T, Fernández–Bouzas A. Mapeo del EEG en el estudio de los pacientes con lesiones expansivas intracraneales. Archivos Clínica Neurológica Querétaro 1995;4:20–24. [ Links ]
22. Bucci P, Mucci A, Volpe U, Merlotti E, Galderisi S et al. Executive hypercontrol in obsessive–compulsive disorder: electrophysiological and neuropsychological indices. Clin Neurophysiol 2004;115(6): 1340–1348. [ Links ]
23. Khanna S. Obsessive–Compulsive disorder: is there a frontal lobe dysfunction? Biol Psychiatry 1988;24:602–613. [ Links ]
24. Molina V, Montz R, Pérez–Castejon MJ, Martin–Loeches M, Carreras JL et al. Cerebral perfusion, electrical activity, and effects of serotoninergic treatment in obsessive–compulsive disorder. Neuropsychobiology 1995;32:139–148. [ Links ]
25. Karadag F, Oguzhanoglu NK, Kurt T, Oguzhanoglu A, Atesci F et al. Quantitative EEG analysis in obsessive compulsive disorder. Int J Neurosci 2003;113(6):833–847. [ Links ]
26. Pogarell O, Juckel G, Mavrogiorgou P, Mulert C, Folkerts M et al. Symptom–specific EEG power correlations in patients with obsessive–compulsive disorder. Int J Psychophysiol 2006;62(1):87–92. [ Links ]
27. Simpson HB, Tenke CE, Towey JB, Liebowitz MR, Bruder GE. Symptom provocation alters behavioral ratings and brain electrical activity in obsessive–compulsive disorder: a preliminary study. Psychiatry Res 2000;95(2):149–155. [ Links ]
28. Hansen ES, Prichep LS, Bolwing TG, John ER. Quantitative electroencephalography in OCD patients treated with paroxetine. Clin Electroencephalogr 2003;34(2):70–74. [ Links ]
29. Fernández–Bouzas A, Harmony T, Fernández T, Aubert E, Ricardo–Garcell J et al. Sources of abnormal EEG activity in spontaneous intracerebral hemorrhage. Clin Electroencephalogr 2002;33(2):70–76. [ Links ]
30. Pascual–Marqui RD. LORETA in 3d solution space. Newsletter 1995;6:22–24. [ Links ]
31. Pascual–Marqui RD, Michel CM, Lehman D: Low resolution electromagnetic tomography: a new method for localizing electrical activity in the brain. Int J Psychophysiol 1994;18:49–65. [ Links ]
32. Bosch–Bayard J, Valdés–Sosa P, Virués–Alba T, Aubert–Vázquez E, John ER et al. 3D statistical parametric mapping of EEG source spectra by means of variable resolution electromagnetic tomography (VARETA). Clin Electroencephalogr 2001 ;32(2):47–61. [ Links ]
33. Fernández–Bouzas A. El mapeo del electroencefalograma cuantificado en el estudio de diversas entidades patológicas intracraneales. Su relación con la tomografía computada. Tesis doctoral en Neurobiología, Universidad Nacional Autónoma de México, Campus Juriquilla, Querétaro; 1999. [ Links ]
34. Valdés–Sosa P, García F, Casanova R. Variable resolution electromagnetic tomography. En: Wood C (ed.). Proceedings of the 10th International Conference on Biomagnetism. Santa Fe, New Mexico: BIOMAG; 1996. [ Links ]
35. Sherlin L, Congedo M. Obsessive–compulsive dimension localized using low–resolution brain electromagnetic tomography (LORETA). Neurosci Lett 2005;387(2):72–74. [ Links ]
36. Bolwig TG, Hansen ES, Hansen A, Merkin H, Prichep LS. Toward a better understanding of the pathophysiology of OCD SSRI responders: QEEG source localization. Acta Psychiatr Scand 2007;115(3):237–42. [ Links ]
37. Hughes JR, John ER. Conventional and quantitative electroencephalography in psychiatry. J Neuropsychiatry Clin Neurosci 1999;11 (2) :190–208. [ Links ]
38. John ER, Prichep LS, Fridman J, Easton P. Neurometrics: computer–assisted differential diagnosis of brain dysfunctions. Science 1988;239(4836):162–169. [ Links ]
39. Rugg MD, Coles MGH (eds.). Electrophysiology of mind: Event–related brain potentials and cognition. USA: Oxford University Press; 1996. [ Links ]
40. Lopes da Silva F. Event–related potentials: methodology and quantification. En: Niedermeyer E, Lopes da Silva F (eds.). Electroencephalography, basic principles, clinical applications, and related fields. Philadelphia: Williams & Wilkins; 2005. [ Links ]
41. Polich J, Criado JR. Neuropsychology and neuropharmacology of P3a and P3b. Int J Psychophysiol 2006;60(2) :172–185. [ Links ]
42. Daffner KR, Mesulam MM, Scinto LF, Calvo V, Faust R et al. An electrophysiological index of stimulus unfamiliarity. Psychophysiology 2000;37(6):737–747. [ Links ]
43. Patel SH, Azzam PN. Characterization of N200 and P300: selected studies of the event–related potential. International J Medical Science 2005;2(4):147–154. [ Links ]
44. Ciesielski KT, Beech HR, Gordon PK. Some electrophysiological observations in obsessional states. Br J Psychiatry 1981;138:479–484. [ Links ]
45. Towey JP, Bruder GEM, Hollander E, Friedman D, Erhan H et al. Endogenous event–related potentials in obsessive–compulsive disorder. Biol Psychiatry 1990;28:92–98. [ Links ]
46. Papageorgiou C, Rabavilas A, Liaappas I. Do obsessive–compulsive patients and abstinent heroin addicts share a common psychophysiological mechanism? Neuropsychobiology 2003;47:1–11. [ Links ]
47. Di Russo F, Zaccara G, Ragazzoni A, Pallanti S. Abnormal visual event–related potentials in obsessive–compulsive disorder without panic disorder or depression comorbidity. J Psychiatr Res 2000;34:73–82. [ Links ]
48. Johannes S, Wieringa BM, Nager W, Rada D, Müller–Vahl K et al. Tourett syndrome and obsessive–compulsive disorder: event–related brain potentials show similar mechanisms of frontal inhibition but dissimilar target evaluation processes. Behav Neurol 2003;14:9–17. [ Links ]
49. Towey JP, Bruder GE, Tenke CE, Leite P, Decaria C et al. Event–related potential and clinical correlates of neurodysfunction in obsessive–compulsive disorder. Psychiatry Res 1993;49:167–181. [ Links ]
50. Morault P, Guillem F, Bourgeois M, Laville J, Bensch C et al. Psychophysiological and clinical value of event–related potentials in obsessive–compulsive disorder. Biol Psychiatry 1997;42:46–56. [ Links ]
51. Morault P, Guillem F, Bourgeois M, Paty J. Improvement predictors in obsessive–compulsive disorder. An event–related potential study. Psychiatry Res 1998;81:87–96. [ Links ]
52. De Groot CM, Torello MW, Boutros NN, Allen R. Auditory event–related potentials and statistical probability mapping in obsessive–compulsive disorder. Clin Electroencephalogr 1997;28(3):148–154. [ Links ]
53. Hajcak G, Simons RF. Error–related brain activity in obsessive–compulsive disorder undergraduates. Psychiatry Res 2002;110:63–72. [ Links ]
54. Ruchsow M, Grön G, Reuter K, Spitzer M, Hermle L et al. Error–related brain activity in patients with obsessive–compulsive disorder and healthy controls. J Psychophysiology 2005;19(4):298–304. [ Links ]
55. Nieuwenhuis S, Nielen MM, Mol N, Hajcak G, Veltman DJ. Performance monitoring in obsessive–compulsive disorder. Psychiatry Res 2005;134:11–122. [ Links ]
56. Hajcak G, Franklin ME, Foa EB, Simons RF. Increased error–related brain activity in pediatric obsessive–compulsive disorder before and after treatment. Am J Psychiatry 2008;165(1): 116–23. [ Links ]














