Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.31 no.4 México jul./ago. 2008
Actualización por temas
Los antidepresivos inhibidores selectivos de recaptura de serotonina (ISRS, ISR–5HT)
Selective serotonin reuptake inhibitors antidepressants (SSRIs)
Enrique Chávez– León1 *, Martha Patricia Ontiveros Uribe2, Carlos Serrano Gómez3
1 Secretario de actividades académicas de la Asociación Psiquiátrica Mexicana. Coordinador de Psicología Clínica de la Universidad Anáhuac México Norte. Profesor del Departamento de Psiquiatría y Salud Mental de la Universidad Nacional Autónoma de México (UNAM).
2 Presidenta de la Asociación Psiquiátrica Mexicana. Miembro Director del Consejo Mexicano de Psiquiatría. Subdirectora del Servicio de Hospitalización y Urgencias del Instituto Nacional de Psiquiatría Ramón de la Fuente. Profesora del Departamento de Psiquiatría y Salud Mental de la UNAM.
3 Miembro Director del Consejo Mexicano de Psiquiatría. Jefe del Servicio de Psiquiatría del Hospital Español, México D.F. Profesor del Departamento de Psiquiatría y Salud Mental de la UNAM.
*Correspondencia:
Dr. Enrique Chavez–León.
Coordinador de Psicología Clínica,
Universidad Anáhuac México Norte.
Av. Lomas Anáhuac s/n.
Lomas Anáhuac, Huixquilucan,
52786 Estado de México.
E.mail: ecleon@yohoo.com
Recibido: 28 de marzo de 2008.
Aceptado: 15 de abril de 2008.
Abstract
Depression is a frequent mental disorder in the general population. Approximately 3.7% of the population will suffer a major depressive episode throughout life. Pharmacological treatment with selective serotonin receptor inhibitors (SSRIs) is useful to treat this condition and other mental disorders. Citalopram, escitalopram, fluoxetine, fluvoxamine, paroxetine and sertraline, which constitute this group, are characterized by having an easy way of administration and a very extensive security profile.
Objectives
The objectives in this revision were: 1. To establish current indications of selective serotonin receptor inhibitors, using as basis those authorized by the Food and Drug Administration (FDA) of the United States of America. 2. To describe the mechanisms that explain antidepressant action. Initially, the SSRIs inhibit the reuptake of serotonin at the synaptic cleft; later there is a downregulation of the 5HT1A receptors; and finally antidepressants raise the levels of brain derived neurotrophic factor (BDNF). 3. To present its way of administration and dosage. 4. To describe frequent collateral effects and those specifically associated to this group of antidepressants and the recommended treatment.
Results
SSRIs antidepressants are the first choice treatment in depression, in the anxiety disorder, the obsessive–compulsive disorder, the post–traumatic stress disorder, bulimia nervosa and the premenstrual dysphoric disorder. At present, SSRIs displace benzodiacepines in the treatment of generalized anxiety disorder, just as they displaced tricyclic antidepressants in the past. Depressed patients show less activity than normal of the serotonin neurotransmitter (serotonergic hypothesis of depression) and the reuptake blockade at the site of the serotonergic presinaptic receptors 5HT1A, 5HT2C and 5HT3C increases neurotransmission in this system. Desensitization of autoreceptors 5HT1A and the downregulation of the 5HT2 receptors coupled to the G protein, a late effect of the SSRIs, result in the improvement of the depressive symptoms. The mechanism that explains the relatively late antidepressant effect seems to be different to the acute and fast serotonergic effect responsible of improvement in the premenstrual dysphoric disorder. Moreover, these antidepressants, in the same way than mood stabilizers and electroconvulsive therapy, increase serum levels of the brain–derived neuronal growth factor, as well as other neurotrophic factors. Although the SSRIs dosages are variable, it is possible to start antidepressant treatment with therapeutic doses in the majority of cases; at the same time, if necessary, it is possible to augment them gradually up to the largest dose, with a wide security margin. Their most frequent collateral effects occur in the gastrointestinal system, in the sexual response and on bone density. Nevertheless, there are collateral effects specifically related to the use of these antidepressant medications: 1. The serotonergic syndrome, characterized by changes in the mental status, autonomic hyperactivity and neuromuscular anomalies. 2. The syndrome of inappropriate secretion of antidiuretic hormone, which occurs in 25% of the elder depressed patients treated, and which is characterized by a high serum osmolarity, low urinary osmolarity and hyponatremia. Its manifestations are malaise, myalgias, drowsiness and headache, but it may produce also confusion, convulsions and coma. 3. Gastrointestinal bleeding mainly and cutaneous bleeding: Use of SSRIs raises 2 to 4 times the risk of bleeding. When the patient takes aspirin it is raised up to 7 times, and with the concomitant use of anti–inflammatory drugs, by nearly 16 times. Other risk factors are age, the antecedent of bleeding and the potency of SSRIs to inhibit the serotonin reuptake. 4. The discontinuation syndrome, lesser with fluoxetine, and greater with paroxetine and sertraline. It appears by the second day and it lasts two weeks. Its manifestations are nausea, headache, paresthesias, nasal congestion and general malaise. They are due to the decrease in serotonin levels at the synaptic cleft. 6. Effects on the newborn when the SSRIs are used during pregnancy consist in specific congenital malformations. Sertraline has been associated to omphalocele, ventricular septum heart defects and anencephaly. Fluoxetine is associated to craniosynostosis and paroxetine to heart defects, gastroschisis, neural tube defects, omphalocele and anencephaly also. Its use also increases the range of spontaneous abortions up to 1.45 times, premature delivery and low birth weight, problems in the early newborn period (respiratory problems and hypotony), hypoglycemia, cyanosis, restlessness, convulsions and low Apgar. Its use during the third trimester can cause persistent lung hypertension. Although it is a rare condition, it is associated to a mortality range of 10% to 20%. 8) Little is known about the effects caused by the use of SSRIs during breastfeeding. In the case of sertraline and paroxetine, these antidepressant drugs are not detected in the child's serum; on the other hand, serum levels of citalopram were 1.9 nmol/L, fluoxetine 47 nmol/L, and venlafaxine 91 nmol/L. In the available studies, neither behavioral effects nor effects in the development of the newborn were observed. 9) Suicide risk or suicidality. Although the antidepressant treatment lowers both, ideation and the frequency of suicides in the patients treated, the FDA has established a series of general recommendations for the management of patients who start the treatment with antidepressants. To start with the lowest dose, to make an appointment weekly during six consecutive weeks, to recommend and facilitate contact via telephone, to prohibit the use of alcohol and drugs, to ask on each date about suicidal thoughts or behaviors or about self–mutilation, to document the information in the file and to use supportive psychotherapy or cognitive, behavioral or interpersonal therapies.
Key words: Antidepressants, bleeding, breastfeeding, major depression, selective serotonin reuptake inhibitors, serotonergic syndrome, syndrome of inappropriate secretion of antidiuretic hormone, pregnancy, suicide.
Resumen
La depresión es un trastorno mental que afecta a 3.7 % de la población. Los antidepresivos inhibidores selectivos de la recaptura de serotonina (ISRS) resultan útiles en el tratamiento de éste y otros trastornos mentales. El citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina y sertralina constituyen este grupo de fácil administración y con un amplio perfil de seguridad.
Objetivos
1) Establecer las indicaciones actuales de los antidepresivos ISRS. 2) Describir los mecanismos que explican su acción antidepresiva. 3) Describir los efectos secundarios frecuentes y aquéllos específicamente relacionados con este grupo antidepresivo.
Resultados
Los antidepresivos ISRS son el tratamiento de elección para la depresión, los trastornos de angustia, de ansiedad generalizada, obsesivo–compulsivo, de estrés postraumático, disfórico premenstrual y la bulimia nervosa. Los pacientes deprimidos muestran una actividad menor a la normal del neurotransmisor serotonina. La inhibición de la recaptura de la serotonina sobre los receptores serotoninérgicos presinápticos 5HT1A, 5HT2C y 5HT3C aumenta la neurotransmisión en este sistema. La desensibilización de los autorreceptores 5HT1A y la regulación hacia abajo (downregulation) de los receptores 5HT2 acoplados a la proteína G, efecto tardío de los ISRS, dan por resultado la mejoría de los síntomas depresivos. El mecanismo que explica el efecto antidepresivo relativamente tardío parece ser distinto al efecto serotoninérgico agudo y rápido responsable de la mejoría en el caso del trastorno disfórico premenstrual. Estos antidepresivos, como los estabilizadores del ánimo y la terapia electroconvulsiva, incrementan los niveles séricos del factor de crecimiento neuronal cerebral, así como de otros factores neurotróficos. Aunque las dosis de los ISRS son variables, en la mayoría de los casos es posible iniciar el tratamiento antidepresivo con dosis terapéuticas e incrementarlas paulatinamente hasta las dosis máximas con seguridad. Sus efectos secundarios más frecuentes son gastrointestinales, en la respuesta sexual y sobre la densidad ósea. Los efectos secundarios específicamente relacionados con el uso de estos antidepresivos son: 1. El síndrome serotoninérgico, caracterizado por cambios en el estado mental, hiperactividad autonómica y anomalías neuromusculares. 2. El síndrome de secreción inapropiada de hormona antidiurética, que se caracteriza por osmolaridad sérica alta, urinaria baja e hiponatremia, así como por mialgias, letargo, cefalea e incluso confusión, convulsiones y coma. 3. El sangrado, principalmente de tubo digestivo y cutáneo. El uso de los ISRS aumenta el riesgo de sangrar entre dos y cuatro veces. Cuando el paciente usa aspirina, el riesgo aumenta hasta siete veces y con el uso concomitante de antiinflamatorios, cerca de 16 veces. La edad, el antecedente de sangrado y la capacidad de inhibir la recaptura constituyen también factores de riesgo. 4. El síndrome de descontinuación, menor con la fluoxetina, mayor con la paroxetina y sertralina, aparece a partir del segundo día y su duración es de dos semanas. Manifestaciones como náusea, cefalea, parestesias, congestión nasal y malestar general se deben a la disminución de los niveles de serotonina en la sinapsis. 5. Los efectos sobre el producto cuando los ISRS se utilizan durante la gestación consisten en malformaciones congénitas específicas. La sertralina se ha asociado a onfalocele, defectos del septum cardíaco y anencefalia. A su vez, la fluoxetina se ha asociado a craneosinostosis y defectos cardíacos. Y la paroxetina a defectos cardíacos, gastrosquisis, defectos del tubo neural y también a onfalocele y anencefalia. Su uso también aumenta la tasa de abortos espontáneos hasta 1.45 veces, parto prematuro y bajo peso al nacer, problemas en el neonato inmediato (problemas respiratorios e hipotonía), hipoglucemia, cianosis, inquietud, convulsiones y Apgar bajo. Su uso durante el tercer trimestre puede ocasionar hipertensión pulmonar persistente que, aunque es rara, se asocia a una mortalidad de 10– 20 %. 6) De los efectos por el uso de ISRS durante la lactancia se conoce poco. En el caso de la sertralina y la paroxetina no se detectan estos antidepresivos en el suero del niño; en cambio, los niveles séricos de citalopram fueron de 1.9 nmol/L, de fluoxetina 47 nmol/L y de venlafaxina de 91 nmol/ L. En los estudios disponibles no se observaron efectos conductuales o en el desarrollo del recién nacido. 7) Suicidalidad o riego suicida. Aunque el tratamiento antidepresivo disminuye tanto la ideación y la frecuencia de suicidios en los pacientes tratados, la FDA ha establecido una serie de recomendaciones para el manejo de pacientes que inician el tratamiento con antidepresivos ISRS: Iniciar con la dosis más baja, citar semanalmente a los pacientes durante 6 semanas consecutivas, recomendar y facilitar el contacto telefónico, prohibir el uso de alcohol y drogas, interrogar en cada ocasión sobre pensamientos y comportamientos suicidas o autolesivos, documentar en el expediente la información y usar psicoterapia de apoyo, cognitivo–conductual o interpersonal en el tratamiento.
Palabras clave: Depresión, antidepresivos, embarazo, lactancia, inhibidores selectivos de recaptura de serotonina, sangrado, síndrome serotoninérgico, secreción inadecuada de hormona antidiurética, suicidio.
INTRODUCCIÓN
El trastorno depresivo mayor se observa en 3.7% de la población general.1 Los antidepresivos, psicofármacos esenciales para el tratamiento de este padecimiento, también son útiles para el manejo del trastorno distímico y el trastorno bipolar, sobre todo el tipo II. Se han utilizado exitosamente en los trastornos orgánicos del estado de ánimo (trastorno depresivo secundario a enfermedad médica general y el inducido por sustancias), los trastornos de ansiedad (trastorno obsesivo–compulsivo, de angustia, de estrés postraumático, de ansiedad generalizada), la tensión premenstrual, las manifestaciones vasomotoras de la menopausia e incluso en el manejo del trastorno límite de personalidad.2,3
Los antidepresivos se agrupan tomando en consideración sus características químicas y en función de su efecto sobre los sistemas neurotransmisores.4 Por ejemplo, los antidepresivos tricíclicos (amitriptilina, imipramina, nortriptilina y desipramina) y tetracíclicos (maprotilina) son antidepresivos inhibidores «no selectivos» de la recaptura de noradrenalina y serotonina, pues muestran además efectos antagonistas sobre sistemas neurotransmisores como el colinérgico, el histamínico y el adrenérgico.5 Citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina y sertralina constituyen el grupo antidepresivo de los inhibidores selectivos de la recaptura de serotonina (ISRS o ISR–5HT). La duloxetina y la venlafaxina, como los tricíclicos, inhiben también la recaptura de serotonina y norepinefrina, pero sin antagonizar en forma importante otros sistemas neurotransmisores. De ahí su denominación de antidepresivos inhibidores selectivos de recaptura de serotonina y norepinefrina (antidepresivos duales o SNRI). Los antidepresivos antagonistas de los receptores serotoninérgicos tipo 2 o 5–HT2 (SARI) son la trazodona y la nefazodona. Los antidepresivos antagonistas de los receptores 5HT2 y alfa 2 adrenérgicos presinápticos (NaSSA) son la mirtazapina y la mianserina, este último considerado por su estructura como tetracíclico. La anfebutamona (bupropión de acción prolongada) es el único antidepresivo perteneciente al grupo de los inhibidores de la recaptura de la norepinefrina y la dopamina. Los antidepresivos inhibidores de la recaptura de norepinefrina (NaRI) se utilizan poco, pues la reboxetina no está disponible y la atomoxetina, de estructura química similar a la fluoxetina, se utiliza como tratamiento del trastorno por déficit de atención e hiperactividad (TDA–H). Los antidepresivos inhibidores de la monoamino oxidasa (IMAOs) son: moclobemide, selegilina, fenelzina y tranilcipromina.6
No todos los antidepresivos anotados se encuentran disponibles. La reboxetina, nefazodona, fenelzina y tranilcipromina no están disponibles en México; la selegilina está disponible en forma oral para el tratamiento de la enfermedad de Parkinson y no existe aún la presentación para uso transdérmico. La nortriptilina sólo se encuentra comercialmente combinada con un antipsicótico, la fluofenazina.
En el tratamiento de la depresión, los antidepresivos producen efectos terapéuticos similares pero difieren en sus efectos secundarios,7 lo que influye en la adherencia al tratamiento por parte del paciente, que finalmente se traduce en su efectividad clínica.8,9
Aunque los antidepresivos ISRS son más costosos que los tricíclicos, son los más utilizados en la actualidad por su perfil de seguridad, incluso en poblaciones con padecimientos médicos graves.10
Antidepresivos inhibidores selectivos de recaptura de serotonina
Los antidepresivos ISRS han desplazado a los antidepresivos tricíclicos como tratamiento del trastorno depresivo mayor 11 y del trastorno de angustia.12 Constituyen el tratamiento farmacológico de primera elección tanto del trastorno obsesivo–compulsivo13 como del trastorno por estrés postraumático.14 Aunque se siguen utilizando las benzodiacepinas como tratamiento del trastorno de ansiedad generalizada, los ISRS también han resultado útiles al igual que la venlafaxina.12 El tratamiento tradicional de la fobia social con beta bloqueadores, IMAOs y clonazepam ha sido reemplazado por los antidepresivos ISRS.12 Los trastornos de la alimentación también se benefician; en la bulimia, por ejemplo, disminuyen la frecuencia de comilonas.15 También se han utilizado exitosamente como tratamiento continuo o intermitente de la tensión premenstrual 16 y como coadyuvante del tratamiento psicoterapéutico del trastorno límite de personalidad.17
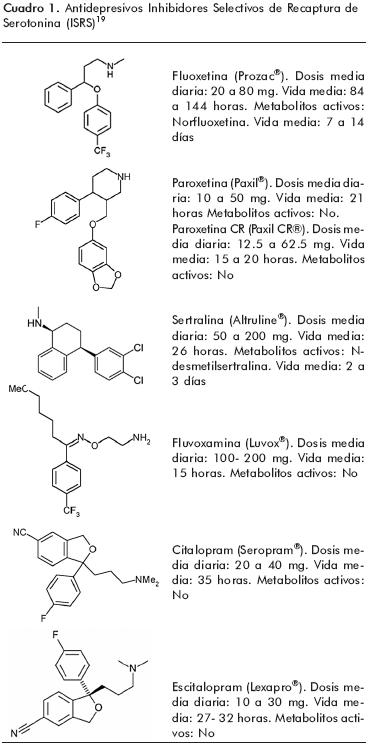
En la actualidad se encuentran disponibles en México seis antidepresivos ISRS: fluoxetina, paroxetina, sertralina, fluvoxamina, citalopram y escitalopram (cuadro 1). Aunque su mecanismo de acción esencial es la inhibición de la recaptura de serotonina, cada uno de los antidepresivos pertenecientes a este grupo tiene un perfil ligeramente diferente con actividad clínica y efectos secundarios distintos e interacciones farmacológicas particulares.7 Este grupo antidepresivo tiene en común su seguridad, incluso en sobredosis, y que puedan administrarse desde el principio a dosis terapéuticas. Sus indicaciones son diversas 18 y la FDA de los Estados Unidos ha aprobado el uso de los ISRS para tratar de los siguientes trastornos:
• Depresión mayor y distimia: Todos los antidepresivos ISRS, excepto la fluvoxamina.
• Trastorno de angustia: Fluoxetina, paroxetina y sertralina.
• Trastorno de ansiedad generalizada: Escitalopram y paroxetina.
• Trastorno obsesivo–compulsivo: Todos los ISRS, excepto el citalopram y el escitalopram.
• Fobia social: Paroxetina y sertralina.
• Trastorno por estrés postraumático: Paroxetina y sertralina.
• Bulimia: fluoxetina.
• Trastorno disfórico premenstrual: Fluoxetina, paroxetina y sertralina.
Mecanismo de acción de los antidepresivos ISRS
Para explicar el mecanismo de acción de los ISRS, se han considerado tres sistemas: el sistema serotoninérgico, las hormonas sexuales y también al factor de crecimiento neuronal derivado del cerebro (brain derived neurotrophic factor, BDNF).
La serotonina es una monoamina neurotransmisora sintetizada por las neuronas serotoninérgicas del Sistema Nervioso Central y las células enterocromafines del sistema digestivo. Se sintetiza a partir de la descarboxilación e hidroxilación del L– triptofano. Su concentración depende de la interacción entre su síntesis, el mecanismo de recaptura y la actividad de la MAO tipo A, enzima que la destruye. Son siete las familias de los receptores serotoninérgicos en el Sistema Nervioso Central (5–HT1 a 5– HT7) y algunas de ellas tienen varios subtipos (5–HT1A a 5–HT1F). Los receptores varían de un individuo a otro debido al polimorfismo alélico, receptores isomórficos y receptores heterodímeros.19 Las neuronas serotoninérgicas se encuentran principalmente en los núcleos del rafé medio en el tallo cerebral, desde el bulbo hasta el mesencéfalo. Sus funciones incluyen regular la vigilia, las conductas emocional y sexual, la ingesta y el vómito; también participa en la percepción del dolor y el tono muscular.20
La hipótesis serotoninérgica de la depresión propone que en este padecimiento la actividad de la serotonina es menor a la normal debido a causas genéticas.21,22 La inhibición de la recaptura del neurotransmisor serotonina (5–HT o hidroxitriptamina) en el nivel de los receptores serotoninérgicos presinápticos 1A, 2C y 3C (5HT1A, 5HT2C y 5HT3C) aumenta la neurotransmisión de este sistema, lo que da por resultado el efecto antidepresivo. El periodo de tiempo que transcurre entre la administración de los antidepresivos y la mejoría clínica, de alrededor de 2 a 3 semanas, se debe al parecer a que la activación inicial de los autorreceptores 5–HT1A de las neuronas serotoninérgicas presinápticas, cuya función es inhibitoria, atenúa la liberación de serotonina por las neuronas. Deben transcurrir varias semanas para que estos autorreceptores se desensibilicen, y permitan entonces el incremento en la neurotransmisión responsable de la mejoría clínica.23 Los receptores 5–HT2 acoplados a la proteína G inducen una cascada de efectos bioquímicos que producen efectos celulares diversos. Estos receptores aumentan su sensibilidad (upregulation) cuando se exponen a antagonistas serotoninérgicos y disminuyen su sensibilidad (downregulation) con la exposición a los agonistas. El tratamiento crónico con algunos antidepresivos ISRS ocasiona su regulación hacia abajo, lo que coincide con la aparición de la respuesta antidepresiva.
Las observaciones realizadas en la depresión atípica han permitido proponer la influencia de las hormonas sexuales en las manifestaciones de la depresión y en la actividad de los receptores serotoninérgicos. Por ejemplo, las características atípicas de los cuadros depresivos desaparecen con la menopausia, lo que sugiere que las hormonas sexuales influyen en los síntomas depresivos. Por otro lado, la hiperfagia y la hipersomnia son reguladas por el receptor 5–HT2C. Esta relación también está presente en la fisiopatología de la tensión premenestrual. Por ejemplo, la irritabilidad, el ánimo deprimido, el aumento del apetito y el aumento de peso, las alteraciones de sueño y la labilidad emocional), ocurren en la fase lútea del ciclo menstrual cuando la progesterona y los estrógenos alcanzan sus niveles séricos más altos. El efecto serotoninérgico agudo de los antidepresivos ISRS controla inmediatamente los síntomas de la tensión premenstrual y no requiere un periodo de latencia como ocurre en el tratamiento de la depresión.23
El BDNF es un péptido neurotrófico crítico para la supervivencia neuronal, el crecimiento axonal y la plasticidad cerebral. Sus niveles se modifican en función del estrés y, por lo mismo, de los niveles de cortisol.24 Se ha confirmado que, aun durante la eutimia, los pacientes deprimidos tienen niveles bajos de este neuropéptido, al igual que los pacientes con trastorno bipolar I y II.25,26 El tratamiento con antidepresivos y con terapia electroconvulsiva aumenta el nivel de el BDNF y de otros factores neurotróficos.27
Dosis de los antidepresivos ISRS
Los antidepresivos ISRS pueden administrarse desde el principio a dosis terapéuticas; sin embargo, es recomendable iniciar con dosis bajas. Por ejemplo, el citalopram, la fluoxetina y la paroxetina se pueden iniciar con dosis de 10 o 20 mg diarios. En caso de que se necesite aumentar la dosis, el citalopram se puede incrementar paulatinamente hasta 40 mg, la fluoxetina, hasta 80 mg y la paroxetina, hasta 50 mg diarios. La paroxetina de liberación controlada puede iniciarse con 12.5 mg e incrementarse hasta 50 mg diarios. El tratamiento con escitalopram puede iniciarse con dosis de 5 a 10 mg diarios e incrementarse semanalmente en forma paulatina hasta 20 mg. La administración de sertralina es necesariamente gradual, comenzando con 25 o 50 mg, hasta llegar a una dosis máxima de 200 mg diarios.
Efectos secundarios
Los efectos secundarios más frecuentes de los antidepresivos ISRS son: náusea, diarrea, insomnio, somnolencia, mareo e inquietud. Estos efectos pueden ser transitorios y variar de acuerdo con el antidepresivo.2
Las disfunciones sexuales también son frecuentes. Los ISRS pueden influir negativamente en cualquiera de las fases de la respuesta sexual: disminuye el deseo, interfiere con la excitación, impide o retarda el orgasmo (anorgasmia).22,29 Para tratarlas puede prescribirse un inhibidor de PDE–5 (sildenafilo, taladafilo), en el caso de disfunción eréctil, o bupropión, en los casos de pérdida de la libido, o bien, disminuir la dosis o sustituir por un antidepresivo no ISRS.30
Estos antidepresivos se asocian también a osteoporosis y a mayor frecuencia de caídas y fracturas 31,32 y ocasionan síntomas secundarios específicos 33 que se describen a continuación.
Síndrome serotoninérgico
El síndrome serotoninérgico es una reacción potencialmente mortal asociada al uso de distintos medicamentos que aumentan la disponibilidad de la serotonina, entre los que se encuentran los antidepresivos ISRS. Su sintomatología se engloba en la siguiente tríada: 1. cambios en el estado mental (nerviosismo, confusión, agitación, estupor o coma), 2. hiperactividad autonómica (diarrea, escalofríos, fiebre, sudoración, taquicardia, taquipnea, alteraciones en la presión arterial, hipertensión en casos moderados e hipotensión en los graves, dilatación pupilar, náusea y vómito) y 3. anomalías neuromusculares (acatisia, ataxia, rigidez, mioclonias, hiperreflexia, temblor e incoordinación motora y convulsiones). El síndrome serotoninérgico puede variar desde temblor y diarrea en casos leves hasta confusión mental, rigidez muscular e hipertermia en los más graves.20 La leucocitosis, la elevación de la creatininfosfoquinasa y de las transaminasas, así como la acidosis metabólica también pueden observarse, aunque no frecuentemente.
Son diversos los mecanismos y sustancias relacionados con el síndrome serotoninérgico:
a) Aumento en la producción de serotonina por mayor disponibilidad del precursor L– triptofano.
b) Reducción en el catabolismo de la serotonina: Antidepresivos inhibidores de la monoamino–oxidasa (IMAOs) reversibles y selectivos como la moclobemida y la selegilina y los IMAOs no selectivos como la fenelzina, tranilcipromina e isocarboxazida.
c) Aumento en la liberación de serotonina: 3,4–metilendioximetanfetamina (MDMA)/ éxtasis, anfetaminas, cocaína, ácido lisérgico (LSD), meperidina, mirtazapina, reserpina y cuando hubo fenfluramina disponible.
d) Bloqueo de la recaptura de serotonina: MDMA, los antidepresivos ISRS (citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina y sertralina),los antidepresivos heterocíclicos (amitriptilina, imipramina, nortriptilina y principalmente la clomipramina), los antidepresivos inhibidores selectivos de recaptura de serotonina y norepinefrina (venlafaxina, duloxetina), otros antidepresivos como la trazodona y la mirtazapina, así como otras sustancias que también inhiben la recaptura de serotonina como las anfetaminas, cocaína, dextrometorfán, analgésicos (meperidina, pentazocina y tramadol), la MDMA y la sibutramina.
e) Estimulación directa de los receptores serotoninérgicos: el LSD, buspirona, meta–anfetaminas, triptanos (almotriptan, naratriptan, sumatriptan y zolmitriptan), ginseng e hipericum perforatum (flor de San Juan).
Otros fármacos asociados potencialmente al síndrome serotoninérgico son el ácido valproico, metoclopramida, ondansetron y el carbonato de litio.34 Recientemente se reportó que el azul de metileno indujo este síndrome en el postoperatorio de un paciente tratado con antidepresivos ISRS por trastorno obsesivo–compulsivo.35
Este síndrome ocurre aproximadamente en 15% de los pacientes que ingieren sobredosis de antidepresivos ISRS;36 en 2002 ocasionó 93 muertes.37 Se ha reportado en niños38 e incluso en recién nacidos cuyas madres utilizaron este tipo de psicofármacos.39,40 El uso de otras sustancias serotoninérgicas concomitantemente al tratamiento con ISRS puede, como es el caso de los triptanos para el tratamiento de la migraña 41 y de los antidepresivos inhibidores de la monoamino– oxidasa (IMAOs), inducir este síndrome. Los triptanos son agonistas selectivos de los receptores 5–HT1B y 5–HT1D que producen vasoconstricción en el nivel craneal. Los IMAOs pueden producirlo aun varias semanas después de haber suspendido los antidepresivos ISRS. Debido a su metabolito norfluoxetina, la fluoxetina debe suspenderse al menos cinco semanas antes de iniciar el tratamiento con antidepresivos inhibidores de la MAO. Se ha reportado que la clomipramina, antidepresivo tricíclico inhibidor de la recaptura de serotonina con un metabolito (desmetilclomipramina) que inhibe la recaptura de norepinefrina, puede producir por sí misma el síndrome serotoninérgico42 y también cuando se ha combinado con un antipsicótico atípico, la olanzapina.43
Puede aparecer cuando se administra algún medicamento que inhiba las isoenzimas CYP2D6 y CYP3A4, y disminuya el metabolismo del antidepresivo ISRS; por ejemplo, la eritromicina.44
El tratamiento es de sostén e incluye hidratación, sedación, control de la fiebre y apoyo ventilatorio. La ciproheptadina es el medicamento antiserotoninérgico de elección y el más efectivo. Sin embargo, lo más importante es prevenir la presentación del síndrome serotoninérgico teniendo presentes los medicamentos serotoninérgicos que utiliza el paciente, así como aquellos que inhiben su metabolismo.
Síndrome de secreción inapropiada de hormona antidiurética (SIADH)
El síndrome de secreción inapropiada de hormona antidiurética (SIADH) se debe a una liberación excesiva de esta hormona por el hipotálamo posterior. Su acción ocurre en los receptores a vasopresina de los túbulos colectores de los riñones al retener agua y disminuir así los niveles de sodio. Para establecer su diagnóstico deben coincidir la osmolaridad sérica por arriba de 100 mOsm/kg, la urinaria por debajo de 280 mOsm/kg y el nivel de sodio plasmático menor a 135 mOsm/kg. Los síntomas se hacen aparentes cuando el sodio se encuentra por debajo de 130 mOsm/kg.45 Muchos medicamentos se han asociado a este síndrome: antidepresivos, antipsicóticos, estabilizadores del ánimo y anticonvulsivantes, desinflamatorios no esteroideos, diuréticos, antineoplásicos, hipoglucemiantes, vasopresina y oxitocina. Pueden producirlo también el vómito, la diarrea y el ejercicio prolongado, así como tumores de pulmón, pleura, páncreas y próstata, secretores de hormona antidurética, infecciones como neumonía, tuberculosis, encefalitis y meningitis, problemas endocrinos (hipotiroidismo e insuficiencia suprarrenal), la insuficiencia cardiaca, renal o hepática, el asma, embarazo, hidrocefalia y el hematoma epi y subdural. Los antidepresivos ISRS se asocian frecuentemente a este síndrome: en ancianos ocurre hasta en 25%.46,47 Los factores de riesgo para desarrollar SIADH son: sexo femenino, edad avanzada, padecer alguna de las enfermedades mencionadas o utilizar algunos de los fármacos relacionados.48 En el caso de los ISRS, el SIADH ocurre en la primera semana de tratamiento antidepresivo y los síntomas consisten inicialmente en malestar, mialgias, letargo y dolor de cabeza. Si el cuadro avanza, aparecen confusión, convulsiones y coma; los niveles de sodio menores a 115 mOsm/kg condicionan el edema cerebral. Para tratar la hiponatremia, debe suspenderse el tratamiento antidepresivo, restringir el agua y reemplazar el sodio. Debe determinarse el sodio antes de iniciar el uso de antidepresivos ISRS, en caso de que el paciente presente alguno de los factores de riesgo anotados o si experimenta malestar durante los primeros días o semanas de tratamiento.
Hemorragias y sangrado
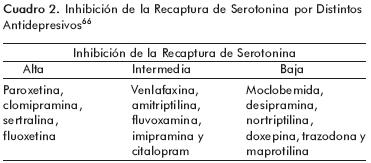
La serotonina liberada por las plaquetas facilita la agregación plaquetaria. Los antidepresivos ISRS disminuyen los niveles de serotonina en las plaquetas pues inhiben la recaptura de serotonina por el transportador localizado en su membrana. Por ello pueden ocasionar hemorragias en la piel (equímosis),49 aunque las más frecuentemente reportadas son las del tubo digestivo.50–55 Con los ISRS, el riesgo de sangrar aumenta entre 1.71 y 3.6 veces; el uso concomitante de aspirina lo aumenta hasta 7.2 veces y el de antiinflamatorios no esteroideos (AINES), hasta 15.6 veces.56 También se ha reportado sangrado uterino pero no del Sistema Nervioso Central.57 La edad y el antecedente de sangrados constituyen factores de riesgo y, al parecer, también la potencia de los antidepresivos para inhibir la recaptura de serotonina. Los antidepresivos con mayor efecto inhibidor de recaptura de serotonina son la paroxetina, clomipramina, sertralina y fluoxetina, seguidos por la fluovoxamina y el citalopram, que producen una inhibición intermedia (cuadro 2). Un estudio reciente no encontró relación entre las variantes genéticas del transportador de serotonina, el uso de ISRS y la aparición del sangrado.58 Aunque el riesgo de sangrado desaparece al suspender el tratamiento con ISRS, debe comentarse acerca de ello y recomendar al paciente que evite el uso de otros medicamentos que puedan contribuir.
Síndrome de descontinuación
El síndrome de descontinuación ocurre en pacientes que suspenden bruscamente el tratamiento con antidepresivos que han tomado durante cuando menos 6 semanas. Cuando se suspende la fluoxetina, se observa entre 9 y 14%; tras la suspensión de paroxetina, se presenta entre 50 y 66% y con sertralina se da una frecuencia similar (60%).59,60 En general, aparece al segundo día y su duración es de una a dos semanas aproximadamente. Si se reinstala el antidepresivo, los síntomas desaparecen con rapidez. Aunque también se ha recomendado cambiar a fluoxetina, su suspensión no está exenta de generar el síndrome de descontinuación a corto plazo, o bien semanas después, debido a la farmacocinética de su metabolito.
El síndrome de descontinuación caracterizado por náusea, dolor de cabeza, parestesias, congestión nasal y malestar general aparece entre el primero y séptimo días después de haber suspendido el tratamiento antidepresivo. Al parecer, la inhibición de la recaptura de la serotonina y el aumento del nivel del neurotransmisor en la sinapsis disminuye la sensibilidad de los receptores postsinápticos (down– regulation). La ausencia brusca de la inhibición de la recaptura por los antidepresivos y la disminución de los niveles de serotonina en la sinapsis lleva a una falla en la estimulación de los receptores postsinápticos que se encuentran «hiposensibles». Las manifestaciones se deben directamente a la falla del sistema serotoninérgico o bien por el efecto que produce a nivel de noradrenalina, dopamina o GABA.61 Uno de los factores involucrados en la aparición de este síndrome es el perfil farma–cocinético del antidepresivo. En el caso de la paroxetina, cuya vida media es más corta, el síndrome de descontinuación es más frecuente que en el caso de la fluoxetina, cuya vida media más larga y además tiene metabolitos activos.62
Uso de los antidepresivos ISRS durante el embarazo
Contrariamente a lo que se pensaba, el embarazo no protege a la mujer de los trastornos del estado de ánimo ni de los de ansiedad. Aproximadamente 10 % de ellas cursa con depresión durante el embarazo o en el primer año después del parto63. Las mujeres presentan depresión antes de embarazarse en 8.7 %, durante el embarazo en 6.9 % y después del parto en 10.4 %. Los trastornos de ansiedad también están presentes durante el embarazo, mas no se conoce su prevalencia.
La depresión no tratada impide que la mujer realice sus actividades cotidianas, establezca un lazo afectivo con su bebé y mantenga una relación apropiada con su pareja. El embarazo en las mujeres con depresión preexistente conlleva interrumpir la continuidad del tratamiento antidepresivo. Para algunas mujeres, el parto y el periodo posterior representan una circunstancia estresante que puede precipitar un primer episodio depresivo.64 El 56.4 % de las mujeres que han tenido depresión meses antes continuaron sintomáticas durante el embarazo. En el posparto, 54.2% había cursado con depresión previa o durante el embarazo. Durante el embarazo se les trató menos con fármacos (67.2 %) que antes de embarazarse (77.4 %) o en el periodo posparto (81.5 %).
Tratar los trastornos del estado de ánimo durante el embarazo constituye un reto en que debe buscarse un equilibrio entre las consecuencias de la depresión en la mujer embarazada y los riesgos que conlleva la exposición del producto al tratamiento con psicofármacos.
Los antidepresivos prescritos más comúnmente en la actualidad son los antidepresivos ISRS. En un estudio realizado de 1999 a 2003 con más de 100 mil mujeres se observó que 8.7% había tomado antidepresivos y 6.2%, antidepresivos ISRS. Las mujeres caucásicas mayores de 25 años y de nivel educativo alto fueron las que más los utilizaron. En 1999, 5.7% de las mujeres que dieron a luz había recibido antidepresivos y en 2003 la frecuencia había subido a 13.4 %, principalmente antidepresivos ISRS. Los antidepresivos más utilizados son la sertralina y la fluoxetina, seguidas de la paroxetina y el citalopram.65
Los antidepresivos ISRS atraviesan la barrera placentaria y entran en la circulación del feto.66 Hasta hace poco se les consideraba seguros para ser usados durante el embarazo. Sin embargo, se reportaron neonatos de mujeres tratadas con paroxetina, con malformaciones 1.5–2 veces más frecuentes que las tratadas con otros antidepresivos, sobre todo cardiovasculares.
Las anormalidades congénitas «menores» ocurren en 4% de los hijos de madres sin tratamiento farmacológico alguno. Se han realizado varios estudios metaanalíticos de estudios prospectivos de mujeres embarazadas en tratamiento con ISRS. Sólo en uno de ellos se observó que el uso de ISRS aumentaba el riesgo de malformaciones congénitas. Sin embargo, aunque al parecer no aumentan la frecuencia de malformaciones, los ISRS se han asociado a malformaciones específicas: la sertralina se asocia más riesgo de onfalocele, defectos del septum cardíaco y anencefalia; la fluoxetina, con craneosinostosis y defectos cardíacos; y la paroxetina, con defectos cardiacos, gastrosquisis, defectos del tubo neural y también con onfalocele y anencefalia. Al parecer influye la dosis del medicamento, pues los hijos de las mujeres tratadas con paroxetina a dosis altas mostraron mayor frecuencia de malformaciones congénitas graves principalmente cardíacas.67,68
En un estudio metaanalítico de seis estudios de cohorte, la tasa habitual de abortos espontáneos fue de 8.7%. Pero si la mujer había sido tratada con antidepresivos ISRS, la tasa aumentaba a 12.4 % y el riesgo de tener un aborto espontáneo era 1.45 veces mayor, al margen del ISRS usado.69
El uso de este tipo de antidepresivos durante el embarazo también se ha asociado a complicaciones neonatales como parto prematuro y bajo peso al nacer,70,71 problemas neonatales (respiratorios e hipotonía)72 hipoglucemia, cianosis, inquietud, convulsiones, Apgar bajo y necesidad de cuidados especiales.73 Estos síntomas pueden asociarse a un efecto directo de estos medicamentos sobre el producto74 o corresponder a manifestaciones del síndrome de descontinuación.75,76
Tradicionalmente, se ha considerado que el tiempo de mayor riesgo para el uso de medicamentos durante el embarazo correspondía al primer trimestre de gestación. Sin embargo, el uso de los ISRS durante el último trimestre del embarazo puede ocasionar al recién nacido hipertensión pulmonar persistente.77 La hipertensión pulmonar persistente es rara pero en 10 a 20% de los casos puede resultar fatal y se caracteriza por afectar a recién nacidos a término o casi a término (> 34 semanas de gestación), sin otras anomalías congénitas. Debido a que existe una elevación persistente de la resistencia vascular pulmonar, se va a presentar una comunicación de la circulación pulmonar a la general a través del conducto arterioso persistente o el foramen oval, hipoxemia grave que requiere ayuda ventilatoria. Los factores asociados a la hipertensión pulmonar persistente en el recién nacido son: factores relacionados con el neonato (masculino, presencia de meconio en el líquido amniótico, sepsis neonatal, presentación no cefálica al momento del parto y neumonía) y factores relacionados con la madre (uso de antiinflamatorios no esteroideos, raza negra o asiática, cesárea, diabetes, fiebre, obesidad previa al embarazo, nivel educativo bajo, uso de tabaco e infecciones urinarias).
El uso de los antidepresivos ISRS (citalopram, fluoxetina, paroxetina y sertralina) después de las 20 semanas de gestación aumentó 6.1 veces el riesgo de que el recién nacido cursara con esta patología (IC 95 % 2.2– 16.8). Esto representa un aumento en el riesgo de sólo 0.5%, esto es, existe 99.5% de probabilidades de que el niño NO sea afectado. Sin embargo, el número necesario para que el niño resulte dañado es sólo de 200. El uso de otros antidepresivos distintos conlleva también riesgo, aunque más bajo (OR de 3.2, IC 95% de 1.3 a 7.4).77
El mecanismo potencial para este efecto adverso no se conoce con certeza, pero parece estar relacionado con la inhibición de la síntesis de óxido nítrico, con el efecto vasoconstrictor de la serotonina sobre los vasos pulmonares o con la proliferación de la musculatura lisa con el consiguiente aumento de la resistencia pulmonar.
El efecto del uso de este grupo de antidepresivos por la madre durante el embarazo en el desarrollo del niño no se había detectado previamente. Hay tres estudios de niños expuestos a antidepresivos durante su gestación, seguidos por un espacio hasta de siete años sin que se observaran alteraciones en su coeficiente intelectual, lenguaje o comportamiento.78,79,80 Sólo uno señala que pudieran condicionar alteraciones sutiles en el desarrollo motor.81
Una vez detectada la presencia de un trastorno mental (depresión o ansiedad) que requiera tratamiento antidepresivo en la mujer embarazada, se debe realizar una evaluación del riesgo–beneficio. Es muy importante considerar los efectos de no dar tratamiento o de suspenderlo, en caso de que la mujer estuviera en tratamiento antes de embarazarse; el riesgo de tener un nuevo episodio depresivo durante el embarazo es cinco veces mayor si se suspende el tratamiento que si se continúa.82 Hay que determinar cuál es la medicación más apropiada, considerando las manifestaciones clínicas y antecedentes de la paciente, así como los datos disponibles del uso de los antidepresivos durante el embarazo (cuadro 3). Se tiene mayor experiencia con el uso de fluoxetina la cual se asocia menos al síndrome de descontinuación por su vida media.

Los elementos esenciales que deben conocer la paciente embarazada y su pareja para decidir aceptar o no el tratamiento antidepresivo son:
El riesgo, prevalencia y relación específicos del uso de antidepresivos ISRS con malformaciones congénitas e hipertensión pulmonar persistente; el riesgo de recaer si descontinúa el tratamiento antidepresivo; las limitaciones y necesidades mayores de tratamiento e intervención de las pacientes con trastornos depresivos o de ansiedad no tratados;83 la asociación de la depresión al maternaje inadecuado, apego inseguro y a trastornos internalizados en el niño; 78,84,85 el daño que puede ocurrir tanto en la paciente como en el bebé si no se tratan los trastornos depresivos o de ansiedad.
Debe mencionarse que el tratamiento antidepresivo puede no remediar por completo los síntomas depresivos: más de 70 % de mujeres tratadas con fluoxetina, paroxetina o sertralina tuvo una calificación mayor de siete en la Escala de Hamilton de Depresión. En este mismo estudio se observó una correlación significativa entre los trastornos internalizados y el grado de depresión y ansiedad materno, tanto en pacientes tratadas como en las no tratadas.78 Esta observación señala la necesidad de implementar tratamientos psicosociales simultáneos al tratamiento farmacológico para un mejor control de la depresión y para disminuir el efecto sobre la descendencia.86
Uso de los antidepresivos ISRS durante la lactancia
La lactancia facilita el apego materno–infantil,87 y la leche materna protege al niño de infecciones y de reacciones alérgicas.88 Los antidepresivos entran en la leche materna por difusión pasiva. Su concentración varía de acuerdo con la concentración plasmática. Se recomienda que la lactancia se realice antes de tomar el antidepresivo cuando se supone que su concentración es menor. Desafortunadamente, no es posible predecirlo ya que varía de acuerdo con el tipo de ISRS, su peso molecular, grado de ionización, unión a proteínas, liposolubilidad, frecuencia de administración y la diferencia de pH entre el suero y la leche materna.
El método más confiable para determinar la exposición del bebé es medir en su plasma la concentración del ISRS; también se utilizan el radio de concentración leche/ plasma del fármaco y la llamada dosis relativa que corresponde al porcentaje de la concentración de la madre correspondiente al niño en función de su peso (dosis del niño en mg/kg dividida entre la dosis materna en mg/kg).87 Debe tenerse en mente que un niño de menos de dos años tiene un metabolismo mucho menor debido a que el funcionamiento tanto hepático como renal es inmaduro, lo mismo que la barrera hematoencefálica.89 Los niños particularmente vulnerables son los prematuros y los que tengan algún problema metabólico heredado.
Aunque existe poca información acerca del uso de los antidepresivos ISRS durante la lactancia, se sabe que se excretan en la leche materna.90,91 En lactantes entre 2 y 42 semanas, la relación de las concentraciones de la leche maternal con la de los niveles séricos (radio de concentraciones leche/suero materno) oscila entre 0.3 y 2.4 de acuerdo con el tipo de antidepresivo ISRS. El radio promedio del citalopram es de 2.1, el de la sertralina, de 1.8, el de la paroxetina, de 0.7, y el de la fluoxetina, de 0.3. La venlafaxina, un antidepresivo inhibidor selectivo de la recaptura de serotonina y norepinefrina, tiene el radio mayor (2.4). Los niños mostraron variación en los niveles séricos de acuerdo con el tipo de antidepresivo utilizado por la madre. En el caso de la sertralina y la paroxetina, no existieron niveles séricos detectables. Para el citalopram, los niveles séricos en los niños fueron de 1.9 nmol/l, para la fluoxetina, de 47 nmol/l y para la venlafaxina, de 91 nmol/l. Estos niveles séricos correspondieron, en proporción a la concentración materna a 0.9, 6.4 y 10.2%, respectivamente. Es curioso que, aunque existieron casos tanto de madres como de niños con un metabolismo lento de paroxetina (isoenzima CYP2D6) y de citalopram (CYP2C19), los niveles séricos fueron indetectables en el caso de la paroxetina y bajos en el del citalopram.92 En los pocos estudios disponibles no se observaron efectos conductuales o en el desarrollo del recién nacido.73,93
Riesgo suicida («suicidalidad»)
De 1985 a 1999, la prescripción anual de antidepresivos se había cuadruplicado; el índice de suicidios se había reducido 22.5 % en las mujeres y 12.8 % en los hombres, y la tasa de prescripción de antidepresivos mostraba una asociación inversa con la tasa nacional de suicidios en Estados Unidos.94 Pero ya en 1990 habían surgido informes de casos de que los antidepresivos ISRS podían inducir pensamientos o comportamientos suicidas.95 Aunque un metaanálisis de 17 ensayos clínicos no encontró relación entre el uso de la fluoxetina y la «suicidalidad»,96 en 2003, el British Comittee on Safety of Medicines alertó contra el uso de dos antidepresivos en niños: la venlafaxina y la paroxetina. Poco después, en 2004, la FDA señaló que los pacientes en ensayos clínicos que recibían tratamiento antidepresivo tenían ideación suicida (suicidalidad) en 4%, en comparación con sólo 2% de los que recibían placebo. Aunque estas observaciones se basaron en estudios en que se utilizaron cinco antidepresivos ISRS (citalopram, fluoxetina, fluvoxamina, paroxetina y sertralina) y otros cuatro antidepresivos (bupropión, mirtazapina, nefazodona y venlafaxina), se decidió que todos los antidepresivos tuvieran un aviso impreso en la caja (black box) en que se describiera que el uso en niños aumentaba el riesgo suicida. Esta medida hizo que disminuyera la tasa de diagnóstico de depresión en niños en 32%97 y también la prescripción de antidepresivos en niños y adolescentes.98 Sin embargo, el índice de suicidios entre los jóvenes aumentó de 1.26 por 100 mil a 1.4 por 100 mil, poco más de 11%, después de que durante tres años consecutivos había mostrado un descenso.99 En diciembre de 2006, cuando la FDA revisó la relación del uso de antidepresivos con la «suicidalidad» en adultos, encontró que la «suicidalidad» de los pacientes entre 18 y 24 años era mayor en comparación con el placebo.100 La evidencia se hizo patente después de haber analizado a 77380 pacientes de 295 ensayos clínicos controlados. Al principio, dos grupos independientes con dos metodologías distintas observaron que la tasa de «suicidalidad» era similar entre pacientes tratados con antidepresivos (62%) y los tratados con placebo (72%). Al dividir a los pacientes por edades, encontraron que, en los ancianos (65 años o más), los antidepresivos tenían un efecto protector; en cambio, en los adultos más jóvenes (18 a 24 años), el riesgo de «suicidalidad» se duplicaba. A partir de estos hallazgos, la black box incluyó también a los adultos jóvenes. Al anticipar el efecto negativo de esta nueva medida101, la FDA añadió una descripción de las consecuencias dañinas de no tratar la depresión, con la finalidad de promover el uso cuidadoso y monitorizado de los antidepresivos, en especial durante los primeros uno o dos meses de tratamiento en que ocurre con más frecuencia la ideación suicida.102
Al revisar con detalle las razones de momios (odds ratios), únicamente en los estudios donde los pacientes tuvieron diagnóstico psiquiátrico y fueron tratados con antidepresivos, sí se nota que en los menores de 17 años aumenta 2.2 veces la ideación y el comportamiento suicidas con un intervalo de confianza de 1.40 a 3.60, esto es, aumenta cuando menos 1.4 veces la «suicidalidad» y este incremento puede llegar a ser de hasta 3.6 veces más que con placebo. En cambio, en el grupo de adultos más jóvenes (18 a 24 años), aunque la razón de momios es de 1.55, esto es, aumenta la «suicidalidad» ese número de veces, el intervalo de confianza va de 0.91 a 2.70. Aunque el número mayor hace referencia a que el tratamiento antidepresivo aumenta la «suicidalidad» 2.7 veces en comparación con el placebo, el número inferior (0.91) debe interpretarse en el sentido opuesto: que la disminuye. Fuera de estos grupos de edad desaparece el fenómeno: los adultos entre 25 y 30 años tienen una razón de momios de 1.00 (IC95% de 0.60 a 1.69), los de 31 a 64 años, de 0.77 (IC95% de 0.60 a 1.00) y los mayores a estas edades, de 0.39 (IC95% de 0.69 a 1.02).
El riesgo de suicidio asociado al uso de ISRS en ancianos fue estudiado en Ontario, Canadá. Los autores identificaron los casos de suicidio ocurridos en un periodo de 9 años (1992 a 2000) en ancianos mayores de 65 años. En él se observó que el riesgo de suicidio durante el primer mes de tratamiento con ISRS aumentaba hasta cinco veces, en comparación con otros antidepresivos; del segundo mes de tratamiento en adelante desaparecía este fenómeno. También durante el primer mes, los ISRS se asociaron, respecto de otros tratamientos antidepresivos, con suicidios «violentos» (ahorcamiento, arma de fuego, saltar al vacío, arma blanca, choques, explosión, electrocución y autoinmolación).103
Aunque no se conoce el mecanismo por el que el tratamiento con antidepresivos ISRS condiciona ocasionalmente la «suicidalidad» durante las primeras semanas de tratamiento, se ha propuesto que la mejoría de algunos síntomas depresivos, como el impulso y el retardo psicomotor, podría tener alguna relación.104 La aparición de síntomas de inquietud, agitación (jitterness)105,106,107 o disforia pueden provocar ideación suicida.108
Las diferencias genéticas en el metabolismo de estos antidepresivos, o bien, el polimorfismo de los receptores de serotonina, participan también en su seguridad y tolerabilidad.109,110,111
Dada la contraindicación de los antidepresivos ISRS en el tratamiento de niños y adolescentes, se realizó un metaanálisis de 27 ensayos clínicos controlados de población específicamente pediátrica, donde se incluyeron los estudios usados en el metaanálisis de la FDA, además de siete estudios adicionales de pacientes con depresión, trastorno obsesivo–compulsivo y otros trastornos de ansiedad, que encontró resultados distintos. Los hallazgos fueron alentadores, ya que además de comprobar que los antidepresivos eran eficaces en el tratamiento de los trastornos mencionados, la frecuencia de «suicidalidad» asociada al uso de estos psicofármacos fue de 3%, un índice 25% más bajo que el calculado por la FDA y 2% con placebo, similar al de la FDA.
Para determinar si el beneficio del tratamiento antidepresivo era superior al riesgo de «suicidalidad», los autores calcularon primero el número necesario a tratar (NNT), esto es, el número de pacientes que deben ser tratados para obtener una respuesta terapéutica que no habría ocurrido con placebo; resultó de 3 a 10. Posteriormente, hicieron el cálculo del número necesario para dañar (NNH), esto es, el número de pacientes que deben ser tratados para que ocurra un caso de ideación suicida/intento no mortal de suicidio que no habría ocurrido con placebo; éste se encontró en el rango de 112 a 200. La interpretación para los autores fue que la diferencia entre estos dos índices era «indicativo de un perfil riesgo–beneficio total favorable para los antidepresivos en el tratamiento del trastorno depresivo mayor, obsesivo–compulsivo y de ansiedad en pediatría».112
También en el análisis de los datos de más de 200 mil sujetos de la Administración de Salud de Veteranos (Veterans Health Administration Data Set) se observaron menos intentos suicidas en aquellos veteranos deprimidos tratados con antidepresivos ISRS y tricíclicos en comparación con los que no se trataron. El número de intentos suicidas también disminuyó con el tratamiento con antidepresivos como bupropión, mirtazapina, nefazodona y venlafaxina.113 El estudio de la «suicidalidad» con un tipo específico de antidepresivo ISRS sólo se ha realizado en el caso de la fluoxetina. En él se analizan 18 ensayos clínicos de 2200 pacientes tratados con fluoxetina y se demostró que el tratamiento antidepresivo disminuye y resuelve rápidamente la ideación suicida.114 Cuando se han comparado los antidepresivos ISRS (fluoxetina y citalopram) con un antidepresivo inhibidor selectivo de la recaptura de serotonina y norepinefrina (venlafaxina), se ha observado que la ideación suicida es menor con los antidepresivos ISRS, aunque no hay diferencia en el suicidio consumado.115
A partir de estas observaciones se hacen las siguientes recomendaciones al iniciar tratamiento antidepresivo en general y en adultos jóvenes en particular: Iniciar el tratamiento con la mitad de la dosis habitual de los antidepresivos ISRS (citalopram 10 mg, escitalopram 5 mg, fluoxetina 10 mg, fluvoxamina 25 mg, paroxetina 10 mg, sertralina 12.5 mg); programar citas subsecuentes semanales por lo menos durante seis semanas consecutivas; recomendar y facilitar el contacto telefónico por parte del paciente y sus familiares; no prescribir otros medicamentos en cantidades grandes (por ejemplo, si se prescribe alguna benzodiacepina, la receta debe hacerse por la menor cantidad posible); prohibir el uso de alcohol y sustancias que pudieran empeorar la depresión o inducir ansiedad o impulsividad; evaluar en cada ocasión los pensamientos y comportamientos suicidas o automutilatorios; documentar en el expediente la información proporcionada y el plan de tratamiento, y considerar la psicoterapia de apoyo, cognitivo–conductual o interpersonal dentro del esquema de tratamiento. En caso de que exista ideación/comportamiento suicidas antes de iniciar el tratamiento o si aparecen con el tratamiento, debe recomendarse la hospitalización.
Por último, cada vez es más frecuente que los pacientes o sus familiares busquen información por Internet, donde existe difusión del fenómeno de la «suicidalidad». Es conveniente por parte del especialista aclarar sus dudas, hacer las recomendaciones apropiadas, establecer el plan de tratamiento, así como la solución de las posibles contingencias. Debe quedar en la mente de los pacientes y familiares que el problema real es dejar la depresión sin tratamiento. Es necesario que el médico a cargo del paciente le hable del riesgo de que en algunos casos pueden presentarse ideas suicidas, sobre todo al principio del tratamiento.116
REFERENCIAS
1. Medina–Mora ME, Borges G, Lara C, Benjet C, Blanco J. Prevalence, service use, and demographic correlates of 12–month DSM– IV psychiatric disorders in Mexico: results from the Mexican National Comorbidity Survey. Psychol Med 2005;35:1773–1783. [ Links ]
2. Chavez–León E. Fármacos antidepresivos. En: Chávez–León E, Del Bosque–Garza J, Ontiveros–Uribe MP (eds). Manual de psicofarmacología. Capítulo 1. México: Asociación Psiquiátrica Mexicana; 2007; 5–9. [ Links ]
3. Soares CN, Joffe H, Viguera AC et al. Paroxetine versus placebo for women in midlife after hormone therapy discontinuation. Am J Med 2008;121(2):159–162. [ Links ]
4. Schatzberg AF, Cole JO, Debattista C. Manual of clinical psychopharmacology. Washington: American Psychiatric Publishing, Inc.; 2007; p. 35–38. [ Links ]
5. Gillman PK. Tricyclic antidepressant pharmacology and therapeutic drug interaction updated. Br J Pharmacol 2007;151:737–748. [ Links ]
6. Krishnan KR. Revisiting monoamine oxidase inhibitors. J Clin Psychiatry 2007;68(supl 8):35–41. [ Links ]
7. Stahl SM. Not so selective serotonin reuptake inhibitors. J Clin Psychiatry 1998;59:343–344. [ Links ]
8. Hansen RA, Gartlehener G, Lohr KN, Gaynes BN, Carey T. Treatment of major depressive disorder. Ann Intern Med 2005;143:415–426. [ Links ]
9. Machado M, Iskedjian M, Ruiz I, Einarson TR. Remission, dropouts, and adverse drug reaction rates in major depressive disorder: A meta– analysis of head–to–head trials. Curr Med Res Opin 2006;22(9):1825–1837. [ Links ]
10. Swenson JR, Doucette S, Fergusson D. Adverse cardiovascular events in antidepressants trials involving high risk patients: A systematic review of randomized trials. Can J Psychiatry 2006;51:923–929. [ Links ]
11. Nemeroff CB, Schatzberg AF. Pharmacological treatments for unipolar depression. En: Nathan PE, Gorman JM (eds). Treatments that work. New York: Oxford University Press; 2007; p. 271–288. [ Links ]
12. Rubino A, Roskell N, Tennis P et al. Risk of suicide during treatment with venlafaxine, citalopram, fluoxetine, and dothiepin: Retrospective cohort study. Br Med J 2007;334(7587):242–247. [ Links ]
13. Fougherty DD, Rauch SL, Jenike MA. Pharmacological treatments for obsessive–compulsive disorder. En: Nathan PE, Gorman JM (eds). Treatments that work. New York: Oxford University Press; 2007; p. 447–474. [ Links ]
14. Golier JA, Legge JA, Yehuda R. Pharmacological treatment of posttraumatic stress disorder. En: Nathan PE, Gorman JM (eds). Treatments that work. New York: Oxford University Press; 2007; p. 475–512. [ Links ]
15. Wilson GT, Fairburn CG. Treatments for eating disorders. En: Nathan PE, Gorman JM (eds). Treatments that work. New York: Oxford University Press; 2007; p. 579–610. [ Links ]
16. Landén M, Nissbrandt H, Allgulander C, Sörvik K, Ysander C et al. Placebo–controlled trial comparing intermittent and continuous paroxetine in premenstrual dysphoric disorder. Neuropsychopharmacol 2007;32:153–161. [ Links ]
17. Chavez–León E, Ng B, Ontiveros–Uribe MP. Tratamiento farmacológico del trastorno límite de personalidad. Salud Mental 2006;29(5):16–24. [ Links ]
18. Davidson JRT: Pharmacotherapy of social anxiety disorder: What does the evidence tell us? J Clin Psychiatry (supl) 2006;67 12:20–26. [ Links ]
19. Hoyer D, Clarke DE, Fozard JR et al. International Union of Pharmacology classification of receptors for 5–hydroxytryptamine (serotonin). Pharmacol Rev 1994;46:157–203. [ Links ]
20. Boyer EW, Shannon M. The serotonin syndrome. N Engl J Med 2005;352:1112–1120. [ Links ]
21. Holmans P, Weissman MM, Zubenko GS et al. Genetics of early–onset major depression (GenRED): final genome scan report. Am J Psychiatry 2007;64:248–258. [ Links ]
22. Kendler KS, Gats M, Gardner CO, Pedersen NL. A Swedish national twin study of lifetime major depression. Am J Psychiatry 2006;163:109–114. [ Links ]
23. Landén M, Thase ME. A model to explain the therapeutic effects of serotonin reuptake inhibitors: the role of 5–HT2 receptors. Psychopharmacol Bull 2006;39(1):147–166. [ Links ]
24. Belmaker RH, Agam G. Mechanisms of disease. Major depressive disorder. N Engl J Med 2008;358(1):55–68. [ Links ]
25. Kerege F, Vaudan G, Schwald M et al. Neurotrophin levels in postmortem brains of suicide victims and the effects of antemortem diagnosis and psychotropic drugs. Brain Res Mol 2005;136:29–37. [ Links ]
26. Monteleone P, Serritella C, Martiadis V, Maj M. Decreased levels of serum brain–derived neurotrophic factor in both depressed and euthymic patients with unipolar depression and in euthymic depressed and euthymic patients with bipolar I and II disorders. Bipolar Disord 2008;10:95–100. [ Links ]
27. Chen B, Dowlatshahi D, Macqueen GM et al. Increased hippocampal BDNF immunoreactivity in subjects treated with antidepressant medication. Biol Psychiatry 2001;50:260–265. [ Links ]
28. Clayton AH, Pradko JF, Croft HA et al. Prevalence of sexual dysfunction among newer antidepressants. J Clin Psychiatry 2002;63:357–366. [ Links ]
29. Williams VSL, Baldwin DS, Hogue SL et al. Estimating the prevalence and impact of antidepressant– induced sexual dysfunction in 2 European countries: a cross sectional patient survey. J Clin Psychiatry 2006;67:204–210. [ Links ]
30. Balon R. Disfunción sexual asociada a los ISRS. Am J Psychiatry (Ed Esp) 2006;9(10):39–64. [ Links ]
31. Diem SJ, Blackwell TL, Stone KL, Yaffe K, Haney EM et al. Use of antidepressants and rates of hip bone loss in older women. Arch Intern Med 2007;167:1240–1245. [ Links ]
32. Richards JB, Papaioannou A, Adachi JD, Joseph L, Whitson HE. For the Canadian Multicenter Osteoporosis Study (CAMOS) Research Group: Effect of selective serotonin reuptake inhibitors on the risk of fracture. Arch Intern Med 2007;167:188–194. [ Links ]
33. Looper KL. Potential medical and surgical complications of serotonergic antidepressant medications. Psychosom 2007;48(1):1–9. [ Links ]
34. Birmes P, Coppin D, Schmitt I et al. Serotonin syndrome: a brief review. Can Med Assoc J 2003;168(11):1439–1442. [ Links ]
35. Ng BKW, Cameron AJD, Liang R, Rahman H Serotonin syndrome following methylene blue infusion during parathyroidectomy: a case report and literature review. Can J Anesthesiol 2008;55:36–41. [ Links ]
36. Isbister GK, Bowe SJ, Dawson A, Whyte IM. Relative toxicity of selective serotonin reuptake inhibitors (SSRIs) in overdose. J Toxicol Clin Toxicol 2004;42:277–285. [ Links ]
37. Watson WA, Litovitz TL, Rodgers GC Jr. 2002 annual report of the American Association of Poison Control Centers Toxic Exposure Surveillance System. Am J Emerg Med 2003;21:353–421. [ Links ]
38. Gill M, Lovecchio F, Selden B. Serotonin syndrome in a child after a single dose of fluvoxamina. Ann Emerg Med 1999;33:457–459. [ Links ]
39. Isbister GK, Dawson A, Whyte IM et al. Neonatal paroxetine withdrawal syndrome or actually serotonin syndrome? Arch Dis Child Fetal Neonatal Ed 2001;F147–F148. [ Links ]
40. Laine K, Heikkinen T, Ekblad U, Kero P. Effects of exposure to selective reuptake serotonin inhibitors during pregnancy on serotoninérgico symptoms in newborns and cord blood monoamine and prolactin concentrations. Arch Gen Psychiatry 2003;60:720–726. [ Links ]
41. U.S. Food and Drug Administration. Selective serotonin reuptake inhibitors (SSRIs), selective serotonin– norepinephrin reuptake inhibitors (SNRIs), 5–hydroxytryptamine receptor agonists (triptans). http://www.fda.gov/CDER/DRUG/InfoSheets/HCP/triptansHCP.htm Accesada en enero de 2008. [ Links ]
42. Rosenbaum JF, Fava M, Hoog SL, Ascroft RC, Krebs WB. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998;44:77–87. [ Links ]
43. Verre M, Bossio A, Mammone M et al. Serotonin syndrome caused by olanzapine and clomipramine. Minerva Anestesiol 2007;73:1–5. [ Links ]
44. Lee A, Woo J, Ito S. Frequency of infant adverse events that are associated with citalopram use during breast– feeding. Am J Obstet Gynecol 2004;190:218–221. [ Links ]
45. Palmer BF, Gates JR, Lader M. Causes and management of hiponatremia. Ann Pharmacother 2003; 37:1694–1702. [ Links ]
46. Bouman WP, Pinner G, Johnson H. Incidence of selective serotonin–reuptake inhibitor (SSRI)– induced hyponatraemia due to the syndrome of inappropriate antidiuretic hormone (SIADH) secretion in the elderly. Int J Geriatr Psychiatry 1998;13:12–15. [ Links ]
47. Fabian TJ, Amico JA, Kroboth PD et al. Paroxetine–induced hyponatremia in older adults: a 12– week prospective study. Arch Intern Med 2004;164:327–332. [ Links ]
48. Kirby D, Ames D. Hyponatraemia and selective serotonin–reuptake inhibitors in elderly patients. Int J Geriatr Psychiatry 2001;16:484–493. [ Links ]
49. Meijer WE, Heerdink ER, Nolen WA et al. Association of risk of abnormal bleeding with degree of serotonin–reuptake inhibition by antidepressants. Arch Intern Med 2004;164:2367–2370. [ Links ]
50. Dalton SO, Johansen C, Mellemkjaer L et al. Use of selective serotonin reuptake– inhibitors and risk of upper gastrointestinal tract bleeding: a population–based cohort study. Arch Intern Med 2003;163:59–64. [ Links ]
51. De Abajo FJ, Rodriguez LA, Montero D. Association between selective serotonin reuptake– inhibitors and upper gastrointestinal bleeding: population–based, case–control study. Br Med J 1999;319(7217):1106–1109. [ Links ]
52. Kurdiak PA, Juurlink DN, Kopp A et al. Antidepressants, warfarin, and the risk of hemorrhage. J Clin Psychopharmacol 2005;25:561–564. [ Links ]
53. Tata LJ, West J, Smith C et al. General population based–study of the impact of tricyclic and selective serotonin reuptake–inhibitor antidepressants on the risk of acute myocardial infarction. Heart 2005;91:465–471. [ Links ]
54. Van Walraven C, Mamdani MM, Wells PS et al. Inhibition of serotonin reuptake by antidepressants and upper gastrointestinal bleeding in elderly patients: retrospective cohort study. Br Med J 2001;323(7314):655–658. [ Links ]
55. Wessinger S, Kaplan M, Choi L et al. Increased use of selective–serotonin reuptake inhibitors in patients admitted with gastrointestinal haemorrhage: a multicentre retrospective analysis. Aliment Pharmacol Ther 2006;23:937–944. [ Links ]
56. Loke YK, Trivedi AN, Singh S. Meta–analysis: gastrointestinal bleeding due to interaction between selective serotonin uptake inhibitors and non–steroidal antiinflammatory drugs. Aliment Pharmacol Ther 2008;27:31–40. [ Links ]
57. De Abajo FJ, Jick H, Derby L et al. Intracraneal haemorrhage and use of selective serotonin reuptake inhibitors. Br J Clin Pharmacol 2003;50:43–47. [ Links ]
58. Hougardy DM, Egberts TC, Van Der Graaf F et al. Serotonin transporter polymorphism and bleeding time during SSRI therapy. Br J Clin Pharmacol (en prensa) 2008. [ Links ]
59. Bogetto F, Bellino S, Revello RB, Patria L. Discontinuation syndrome in dysthymic patients treated with selective serotonin reuptake inhibitor: a clinical investigation. CNS Drugs 2002;16:273–283. [ Links ]
60. Rothschild AJ, Locke CA. Reexposure to fluoxetine alter serious suicide attempts by three patients: the role of acatisia. J Clin Psychiatry 1991;52:491–493. [ Links ]
61. Lane RM. Withdrawal symptoms after discontinuation of selective serotonin reuptake inhibitors (SSRIs). J Serotonin Res 1996;3(2):75–83. [ Links ]
62. Judge R, Parry MG, Quail D, Jacobson JG. Discontinuation symptoms: comparison of brief interruption in fluoxetine and paroxetine treatment. Int Clin Psychopharmacol 2002;17:217–225. [ Links ]
63. Gavin NI, Gaynes BN, Lohr KN et al. Perinatal depression. Obstet Gynecol 2005;106:1071–1083. [ Links ]
64. Dietz PM, Williams SB, Callaghan WM rt al. Clinically identified maternal depression before, during, and alter pregnancies ending in live births. Am J Psychiatry 2007;164:1515–1520. [ Links ]
65. Cooper WO, Willy ME, Pont SJ et al. Increasing use of antidepressants in pregnancy. Am J Obstet Gynecol 2007;196:544.e1–544.e5. [ Links ]
66. Hendrick V, Stowe ZN, Altshuler LL et al. Placental passage of antidepressant medications. Am J Psychiatry 2003;160:993–996. [ Links ]
67. Alwan S, Reefhuis J, Rasmussen S. Use of selective serotonin–reuptake inhibitors in pregnancy and the risk of birth defects. N Engl J Med 2007;356(26):2684–2692. [ Links ]
68. Louik C, Lin AE, Werler MM et al. First–trimester use of selective serotonin–reuptake inhibitors and the risk of birth defects. N Engl J Med 2007;356(26):2675–2683. [ Links ]
69. Rahimi R, Shekoufen N, Abdollahi M et al. Pregnancy outcomes following exposure to serotonin reuptake inhibitors: a meta–analysis of clinical trials. Reprod Toxicol 2005;22(4):571–575. [ Links ]
70. Kallen B. Neonate characteristics alter maternal use of antidepressants in late pregnancy. Arch Pediatr Adolesc Med 2004;158:312–316. [ Links ]
71. Simon GE, Cunningham ML, Davis RL. Outcomes of prenatal antidepressant exposure. Am J Psychiatry 2002;159:2055–2061. [ Links ]
72. Oberlander TF, Misri S, Fitzgerald CE et al. Pharmacologic factors associated with transient neonatal symptoms following prenatal psychotropic medication exposure. J Clin Psychiatry 2004;65:230–237. [ Links ]
73. Sivojelezova A, Shuhaiber S, Sarkissian L et al. Citalopram use in pregnancy: prospective comparative evaluation of pregnancy and fetal outcome. Am J Obstet Gynecol 2005;193:2004–2009. [ Links ]
74. Bairy KL, Madhyastha S, Ashok KP et al. Developmental and behavioral consequences of prenatal fluoxetine. Pharmacol 2007;79:1–11. [ Links ]
75. Levinson–Castiel R, Merlob P, Linder N et al. Neonatal abstinence syndrome after in– utero exposure to selective serotonin– reuptake inhibitors in term infants. Arch Pediatr Adolesc Med 2006;160:173–176. [ Links ]
76. Sanz EJ, De las Cuevas C, Kiuru A et al. Selective serotonin–reuptake inhibitors in pregnant women and neonatal withdrawal syndrome: a database analysis. Lancet 2005;365(9458):482–487. [ Links ]
77. Chambers CD, Hernandez Diaz S, Van Marter LJ, Werler MM. Selective serotonin–reuptake inhibitors and risk of persistent pulmonary hypertension of the newborn. N Engl J Med 2006;354(6):579–587. [ Links ]
78. Misri S, Reebye P, Kendrick K et al. Internalizing behaviors in 4–year–old children exposed in–utero to psychotropic medications. Am J Psychiatry 2006;163:1026–1032. [ Links ]
79. Nulman I, Rovet J, Stewart DE et al. Neurodevelopment of children exposed in utero to antidepressant drugs. N Engl J Med 1997;336:258–262. [ Links ]
80. Nulman I, Rovet J, Stewart DE et al. Child development following exposure to tricyclic antidepressants or fluoxetine throughout fetal life: a prospective, controlled study. Am J Psychiatry 2002;159:1889–1895. [ Links ]
81. Casper RC, Fleisher BE, Lee–Ancajas JC et al. Follow–up of children of depressed mothers exposed or not exposed to antidepressant drugs during pregnancy. J Pediatr 2003;142:402–408. [ Links ]
82. Cohen LS, Altshuler LL, Harlow Bl et al. Relapse of major depression during pregnancy in women who maintain or discontinue antidepressant treatment. J Am Med Assoc 2006;295:499–507. [ Links ]
83. Andersson L, Sundstrom–Poromaa I, Wulff M et al. Implications of antenatal depression and anxiety for obstetric outcome. Obstet Gynecol 2004;104:467–476. [ Links ]
84. Misri S, Oberlander TF, Fairbrother N et al. Relation between prenatal maternal mood and anxiety and neonatal health. Can J Psychiatry 2004;49:684–689. [ Links ]
85. Murray L. The impact of posnatal depression on infant development. J Child Psicol Psychiatry 1992;33:543–561. [ Links ]
86. Spinelli MG, Endicott J. Controlled clinical trial of interpersonal psychotherapy versus parenting education program for depressed pregnant women. Am J Psychiatry 2003;160:555–562. [ Links ]
87. Eberhard–Gran M, Eskild A, Opjordsmoen S. Use of psychotropic medications in treating mood disorders during lactation. CNS Drugs 2006;20(3):187–198. [ Links ]
88. Van Odijk J, Kull I, Borres M et al. Breast feeding and allergic disease: a multidisciplinary review of the literature (1996– 2001) on the mode of early feeding in infancy and its impact on later atopic manifestations. Allergy 2003;58:833–843. [ Links ]
89. Anderson PO, Pochop SL, Manoguerra AS. Adverse drug reactions in breastfed infants: less than imagined. Clin Pediatr 2003;42:325–340. [ Links ]
90. Rampono J, Proud S, Hackett LP et al. A pilot study of newer antidepressant concentrations in cord and maternal serum and possible effects in the neonate. Int J Neuropsychopharmacol 2004;7:329–334. [ Links ]
91. Weissman AM, Levy BT, Hartz AJ et al. Pooled analysis of antidepressant levels in lactating mothers, breast milk, and nursing infants. Am J Psychiatry 2004;161:1066–1078. [ Links ]
92. Berle JO, Steen VD, Aamo TO et al. Breastfeeding during maternal antidepressant treatment with serotonin reuptake inhibitors: infant exposure, clinical symptoms, and cytochrome P450 genotypes. J Clin Psychiatry 2004;65:1228–1234. [ Links ]
93. Merlob P, Stahl B, Sulkes J. Paroxetine during breast– feeding: infant weight gain and maternal adherence to counsel. Eur J Pediatr 2004;163:135–139. [ Links ]
94. Grunebaum MF, Ellis SP, Shuhua L, Oquendo MA, Mann J. Antidepressants and suicide risk in the United States, 1985–1999. J Clin Psychiatry 2004;65(11):1456–1462. [ Links ]
95. Teicher MH, Glod C, Cole JO. Emergence of intense suicidal preoccupation during fluoxetine treatment. Am J Psychiatry 1990;147:207–210. [ Links ]
96. Beasley CM, Dornseif BE, Bosomworth JC et al. Fluoxetine and suicide: A meta–analysis of controlled trials of treatment for depression. Br Med J 1991;303:685–692. [ Links ]
97. Libby AM, Brent DA, Morrato EH et al. Decline in treatment of pediatric depression after FDA advisory on risk of suicidality with SSRIs. Am J Psychiatry 2007;164:884–891. [ Links ]
98. Gibbons RD, Hendricks Brown C, Hur K et al. Early evidence on the effects of regulators' suicidality warnings on SSRI prescriptions and suicide in children and adolescents. Am J Psychiatry 2007;164:1356–1363. [ Links ]
99. US Department of Health and Human Services. Centers for Disease Control and Prevention. Fatal Injury Report: Web based injury statistics query and reporting system, www.cdc.gov/NCIPC/wisqars. Accesada en enero de 2008. [ Links ]
100. US Food and Drug Administration: Briefing Document for Psychopharmacologic Drugs Advisory Committee, December 13, 2006, http://www.fda.gov/ohrms/dockets/ac/06/briefing/2006–4272b1–01–FDA.pdf. Accesada en enero de 2008. [ Links ]
101. Nemeroff CB, Kalali A, Keller MB et al. Impact of publicity concerning pediatric suicidality data on physician practice patterns in the United States. Arch Gen Psychiatry 2007;64:466–472. [ Links ]
102. The Tads Team: The Treatment for Adolescents with Depression Study (TADS): Long–term effectiveness and safety outcomes. Arch Gen Psychiatry 64(10):1132–1143. [ Links ]
103. Juurlink DN, Mamdani MM, Koop A, Redelmeier DA. The risk of suicide with selective serotonin reuptake inhibitors in the elderly. Am J Psychiatry 2006;163:813–821. [ Links ]
104. Nutt DJ. Death and dependence: current controversies over the selective serotonin reuptake inhibitors. J Psychopharmacol 2003;17:355–364. [ Links ]
105. Baldassano CF, Trumen CJ, Nierenberg A et al. Akathisia: a review and case report following paroxetine treatment. Compr Psychiatry 1996;37:122–124. [ Links ]
106. Lipinski JF Jr, Mallya G, Zimmerman P, Pope HG Jr. Fluoxetine–induced akathisia: clinical and theoretical implications. J Clin Psychiatry 1989;50:339–342. [ Links ]
107. Roy–Byrne P, Cowley DS. Pharmacological treatments for panic disorder, generalized anxiety disorder, specific phobia, and social anxiety. En: Nathan PE, Gorman JM (eds). Treatments that work. New York: Oxford University Press; 2007; p.395–430. [ Links ]
108. Mann JJ, Kapur S. The emergence of suicidal ideation and behavior during antidepressant pharmacotherapy. Arch Gen Psychiatry 1991;48:1027–1033. [ Links ]
109. Charlier C, Broly F, Lhermitte M et al. Polymorphisms in the CYP 2D6 gene: association with plasma concentrations of fluoxetine and paroxetine. Ther Drug Monit 2003;25:738–742. [ Links ]
110. Murphy GM Jr, Kremer C, Rodrigues HE, Schatzberg AF. Pharmacogenetics of antidepressant medication intolerance. Am J Psychiatry 2003;160:1830–1835. [ Links ]
111. Perlis RH, Purcell S, Fava M et al. Association between treatment–emergent suicidal ideation with citalopram and polymorphisms near cyclic adenosine monophosphate response element binding protein in the STAR*D study. Arch Gen Psychiatry 2007;64:689–697. [ Links ]
112. Bridge JA, Iyengar S. Salary CB et al. Clinical response and risk for reported suicidal ideation and suicide attempts in pediatric antidepressant treatment. JAMA 2007;297(15):1683–1696. [ Links ]
113. Gibbons RD, Brown CH, Hur K et al. Relationship between antidepressants and suicide attempts: An analysis of the Veterans Health Administration Data Set. Am J Psychiatry 2007;164:1044–1049. [ Links ]
114. Beasley CM Jr, Ball SG, Nilsson ME et al. Fluoxetine and adult suicidality revisited: An updated meta–analysis using expanded data sources from placebo–controlled trials. J Clin Psychopharmacol 2007;27 (6):682–686. [ Links ]
115. Rosebush PI, Margetts P. Serotonin syndrome as a result of clomipramine monotherapy. J Clin Psychopharmacol 1999;19:285–287. [ Links ]
116. Friedman RA, Leon AC. Expanding the Black Box–Depression, antidepressants, and the risk of suicide. N Engl J Med 2007;356(23):2345–2346. [ Links ]