Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud mental
versión impresa ISSN 0185-3325
Salud Ment vol.31 no.3 México may./jun. 2008
Artículo original
Potenciales relacionados con eventos y comorbilidad en un grupo de adolescentes con trastorno por déficit de atención con hiperactividad
Event–related potentials and commorbidity in a group of teenagers with Attention Deficit Hiperactivity Disorder
Ernesto Reyes Zamorano,1* Josefina Ricardo Garcell,1 Lino Palacios Cruz,1 Elvia Serra Toca,1 Gabriela Galindo y Villa Molina,2 Francisco de la Peña Olvera1
1 Instituto Nacional de Psiquiatría Ramón de la Fuente.
2 Centro de Neurorehabilitación Ángeles.
*Correspondencia:
Dr. Ernesto Reyes Zamorano.
Instituto Nacional de Psiquiatría Ramón de la Fuente.
Calz. México–Xochimilco 101,
col. San Lorenzo Huipulco,
deleg. Tlalpan, 14370
México, D F.
Fax: 5655–8570,
E–mail: errezam@imp.edu.mx
Recibido: 11 de enero de 2008.
Aceptado:10 de marzo de 2008.
Abstract
Attention deficit hyperactivity disorder (ADHD) is a neuro–developmental disorder clinically characterized by three core symptoms: deficits in attentional processes, failure in inhibitory control —usually expressed through behavioral and cognitive impulsiveness—, and motor and verbal restlessness.
Deficit in attentional resources is the main alteration in patients with this disorder. Attention can be considered as a neurocognitive state of neural preparation that precedes both perception and action. Attention focalizes consciousness in order to filter the constant flux of sensorial information, solve competence between stimuli for parallel processing and recruit and activate cerebral regions necessary to accomplish appropriate responses.
Event–related potentials (ERPs) are a technique that has proven useful in the gathering of valuable information in the study of ADHD. One of the most studied ERPs is the P300 component. The most robust finding in the P300 research in ADHD is a decrease in the amplitude of the component in patients when compared to normal controls. This finding is usually interpreted as an evidence for a deficit in attention.
ADHD usually presents commorbidity with several disorders; research shows that up to 87% of the children with ADHD present commorbidity with another disorder, up to 60% has either a behavioral or affective disorder commorbid with ADHD. Due to the wide range of disorders that are usually associated with this entity, it is useful in the research of commorbidity to use dimensional diagnostics, that is, a patient with ADHD may have commorbidity with an externalized disorder (EXT) (i.e. oppositionist defiant disorder); an internalized (INT) disorder (i.e. anxiety or affective disorder); or both an externalized and an internalized disorder (MIX). Commorbidity may have important implications in the electrophysiology of ADHD since no homogeneous results have been evident in the scarce research on the subject.
Taking into account these considerations, the following experiment was designed in order to answer the question: Patients with the same main diagnostic, ADHD, but different commorbidities (INT and MIX) show different psychophysiological patterns of activation, as measured by ERPs to a continuous performance task?
Sixteen patients diagnosed with ADHD by a specialist were recruited. Diagnosis was corroborated by a semi–structured interview, K–SADS–PL–MX, eight of them with an externalized comorbid (EXT) disorder, and eight of them with at least two comorbid disorders, one externalized an one internalized (MIX). A control group (CON) of eight normal subjects with no psychiatric diagnostic and matched by sex was also recruited. All subjects were between 13–16 years old with no history of Central Nervous System damage and normal IQ in the Weschler Intelligence Scale for Children. Brain electrical activity was recorded in the 19 derivations of the 10–20 international system while subjects executed a continuous performance task (CPT).
Comparisons of behavioral data between groups showed some significant differences. A one–way ANOVA found differences between groups in the mean reaction time to the first part of the CPT and in the number of false positives in the second part.
Electrophysiological data was analyzed with a non–parametrical multivariate test of permutations. When comparing responses to the frequent stimulus with responses to the infrequent, statistically significant differences were found in every subject; such differences share the topography and latency characteristics of the P3b component. When comparing the amplitude of this component between the groups, only two statistically significant differences were found.
First, the EXT group presented a greater amplitude of the component elicited by the first part of the task in a latency of 425 to 445 msec in the parietal region of the medial line than the CON group. Second, also in response to the first part of the task, the amplitude of the CON group was bigger than that of the MIX group in a latency between 355 and 420 msec in the left temporal anterior region. No other comparison yielded significant results.
When comparing between groups, mean reaction time to the first part of the task was the only behavioral variable that adequately distinguished control and patients. Even though controls executed significantly faster, they maintained the same efficacy as no differences were found in the number of errors or correct responses. This result is not surprising due to the fact that long reaction times usually denote inattention and so the fact that both groups of patients execute slower than the controls may be interpreted as a sign that, in spite of having different commorbidities, inattention is still a common problem in every patient of the sample.
On the second part of the task, only the number of false positives showed statistically significant differences. However, in a posterior analysis of the data, it was evident that such differences were only between the EXT and the CON groups, with the EXT group presenting significantly more errors. False positives, especially on the second part of the task, are a measure of behavioral inhibition. Failure in inhibitory control is one of the three main symptoms of ADHD. However, some have proposed it as the main characteristic of the disorder.
Analysis of the electrophysiological response to the first part of the task showed characteristic profiles of execution for each group. First, the P300 component was smaller in amplitude in the MIX group than in the control group and, even though differences were significant only in one derivation (T3), several other electrode sites more typically associated with the P300 component (C3, C4, P3, P4 and Pz) showed similar tendencies that did not reach statistical significance.
Second, EXT patients had greater amplitude of the same P300 component in Pz than CON subjects. This result may seem to contradict most of the research on ADHD and P300. Nevertheless, considering the behavioral data, specially that no differences in correct responses were found between patients an controls, it is posible to assert that the greater amplitude of the component represents an overactive compensation in attentional circuits, necessary in the EXT group in order to execute at the same level of non–ADHD subjects.
The results of this study present with information on a poorly reasearched subject: comorbidity and electrophysiology on ADHD.
Key words: Event–related potentials, attention deficit hyperactivity disorder, externalized commorbidity and P300.
Resumen
La principal función afectada en el trastorno por déficit de atención con hiperactividad (TDAH) es la atención, la cual puede considerarse como un estado neurocognoscitivo cerebral de preparación que precede tanto a la percepción como a la acción. Los potenciales relacionados con eventos (PREs), una técnica útil en el estudio de la atención en esta entidad, pueden definirse como los cambios en la actividad eléctrica cerebral asociados temporalmente con la aparición de un evento, ya sea un estímulo o un proceso cognitivo. Con esta técnica es posible explorar las representaciones eléctricas de los procesos sensoriales y congnoscitivos con una alta resolución temporal.
Uno de los PREs más estudiados en el TDAH es el P300, un componente positivo que ocurre en una latencia de alrededor de los 300 mseg. El hallazgo más contundente en el estudio del P300 en pacientes con TDAH es un decremento en la amplitud al compararlos con sujetos controles, lo cual suele ser interpretado como expresión de una atención deficiente.
Por otro lado, el TDAH suele presentarse en comorbilidad con diferentes trastornos y siendo la presentación más infrecuente del síndrome es el TDAH <<puro>>. El presente estudio tiene como objetivo analizar si pacientes con el mismo diagnóstico principal, pero con diferente comorbilidad, presentan patrones de activación psicofisiológicos diferentes.
Se evaluaron 16 pacientes diagnosticados con TDAH–M: ocho con comorbilidad EXT y ocho con comorbilidad MIX, así como ocho sujetos controles sanos. Tanto los pacientes como los controles realizaron las dos partes de una tarea de ejecución continua, mientras se registraba la actividad eléctrica cerebral en las 19 derivaciones del sistema internacional 10–20.
En las medidas conductuales, las comparaciones intragrupos no arrrojaron diferencias estadísticamente significativas. Sin embargo, en las comparaciones entre grupos por medio de la prueba ANOVA de una vía sí aparecieron diferencias estadisticamente significativas (F=5.544 y p=0.012) entre los grupos en la media del tiempo de reacción en la parte 1 del CPT y en la variable errores por comisión en la parte 2 (F=3.975 y p=0.034). De las comparaciones electrofisiológicas realizadas entre grupos, sólo dos resultaron estadísticamente significativas. En primer lugar, el grupo EXT presentó mayor amplitud del componente que el grupo CON en una latencia entre 425–445 mseg en la región parietal media. En segundo lugar, el grupo CON tuvo mayor amplitud que el grupo MIX entre los 355–420 mseg en la región temporal anterior izquierda; ambos resultados se obtuvieron en la primera parte de la tarea. Ninguna otra comparación resultó significativa.
Que el tiempo de reacción en la primera parte de la tarea fuera la única variable que distinguió entre pacientes y controles parece sugerir que, a pesar de que los pacientes tenían diferentes comorbilidades, la inatención sigue siendo el problema común a todos los pacientes de la muestra. La comparación de los datos electrofisiológicos entre grupos ofreció perfiles de ejecución característicos para cada subgrupo. Por un lado, el componente P300 fue de menor amplitud en los pacientes MIX que en los sujetos control (aunque sólo fue significativo en una derivación T3), lo cual concuerda con la bibliografía científica al respecto. Por otro, que los pacientes EXT presentaran mayor amplitud del componente P300 en Pz que los sujetos CON parece contrario a otros hallazgos de la bibliografía. Sin embargo, si se toma en cuenta que conductualmente tanto pacientes como controles ejecutaron al mismo nivel se puede sugerir que en los pacientes EXT el déficit de atención subyacente se compensa de manera exitosa y tal proceso se refleja en la amplitud de los PREs. Los resultados de este estudio proporcionan datos sobre cómo la comorbilidad incide en la respuesta electrofisiológica de los pacientes con TDAH.
Palabras clave: Potenciales relacionados con eventos, trastorno por déficit de atención con hiperactividad, comorbilidad externalizada y P300.
INTRODUCCIÓN
El trastorno por déficit de atención con hiperactividad (TDAH) es un trastorno del neurodesarrollo que se caracteriza clínicamente por tres síntomas cardinales: disminución en la atención, dificultades en el control inhibitorio –que se expresan a través de la impulsividad conductual y cognoscitiva– e inquietud motora y verbal. Estas características deben aparecer a edad temprana (antes de los siete años) y ser inapropiadas para la edad o nivel de desarrollo del paciente.1,2
La principal función afectada en esta entidad es la atención, la cual puede considerarse como un estado neurocognoscitivo cerebral de preparación que precede tanto a la percepción como a la acción. La atención focaliza la conciencia para filtrar el constante flujo de información sensorial y resolver la competencia entre los estímulos para su procesamiento en paralelo, así como para reclutar y activar las zonas cerebrales necesarias para lograr respuestas apropiadas .3,4,5
Los potenciales relacionados con eventos (PREs) constituyen una técnica que ha demostrado ser útil en la obtención de información valiosa para el estudio de la atención en esta entidad. Estos pueden definirse como los cambios en la actividad eléctrica cerebral registrada sobre el cuero cabelludo, asociados temporalmente con la aparición de un evento, ya sea un estímulo o un proceso cognoscitivo.6 Con esta técnica es posible explorar las representaciones eléctricas de los procesos sensoriales y congnoscitivos que ocurren en el cerebro en respuesta a un estímulo. Por su alta resolución temporal, los PREs son particularmente útiles para distinguir el momento del procesamiento cognoscitivo en que la actividad eléctrica cerebral de un paciente con TDAH difiere de la normalidad.7
Uno de los PREs más estudiados en el TDAH es el P300, un componente positivo que ocurre en una latencia de alrededor de los 300 mseg y que suele obtenerse con el denominado paradigma oddball en que se presentan aleatoriamente dos estímulos, uno infrecuente y relevante para la tarea y otro frecuente e irrelevante.8
El hallazgo más contundente en el estudio del P300 en pacientes con TDAH es un decremento en la amplitud al compararlos con sujetos controles, lo cual suele interpretarse como expresión de una atención insuficiente.9 Al parecer, tal decremento se normaliza después del tratamiento con metilfenidato 10 y parece diferenciar adecuadamente a niños con TDAH de niños con autismo o dislexia.11
Por otro lado, a pesar de que el TDAH suele ser conceptualizado como un trastorno de inicio en la infancia, entre 50 y 65% de los niños con TDAH presenta alguna continuación de los síntomas hacia la vida adulta, mientras que hasta 30% o más pueden seguir presentando el síndrome completo.12,13 También suele presentarse en comorbilidad con diferentes trastornos; en este sentido se ha afirmado que el TDAH <<puro>> es en realidad la presentación más infrecuente del síndrome y, de acuerdo con Kadesjo y Gillberg,14 87% de los niños con TDAH presenta comorbilidad con algún otro trastorno, mientras que 60 % tiene comorbilidad con algún trastorno conductual o afectivo.15
Dada la amplia variedad de trastornos con que suele asociarse esta entidad, resulta útil el uso de diagnósticos dimensionales, es decir, un paciente con TDAH puede tener comorbilidad con trastornos del espectro externalizado (EXT), como el trastorno de conducta o el trastorno oposicionista desafiante (TOD); con trastornos del espectro internalizado (INT), como el trastorno de ansiedad generalizada o los trastornos del estado de ánimo; o con trastornos de ambos grupos (MIX).16
Esta caracterización de la comorbilidad ha demostrado su utilidad en algunas áreas, como en el estudio de la respuesta al tratamiento 17 o el de la genética de la entidad.18 La comorbilidad parece tener también implicaciones importantes para la electrofisiología del TDAH, aun cuando no hay resultados homogéneos al respecto.19 En un estudio con PREs utilizando la Tarea de Ejecución Continua (CPT, por sus siglas en ingles: Continuous Performance Task), Banaschewski et al. encontraron que en una muestra de 31 niños (15 de ellos sin comorbilidad) con diagnóstico del CIE–10 de trastorno hiperquinético (equivalente al TDAH subtipo mixto del DSM–IV) sufrían un déficit más general que los restantes 16 que tenían comorbilidad con TOD, dado que presentaban reducciones significativas en la amplitud de la onda P3a con respecto a los controles. Sin embargo, este grupo encontró en otros trabajos que los niños con comorbilidad, a diferencia de los niños con el TDAH como diagnóstico único, presentaban una menor capacidad para controlar la preparación de sus respuestas motoras 20 y una deficiencia en el procesamiento automático de la información auditiva.21 Es decir, las alteraciones electrofisiológicas producidas por la comorbilidad son un tema aún por aclarar y sobre el que se requiere mucha investigación.
Teniendo en cuenta estas consideraciones, se diseñó un experimento para responder a la pregunta: ¿Pacientes con el mismo diagnóstico principal, TDAH subtipo mixto (TDAH–M), pero con diferente comorbilidad, con trastornos del espectro externalizado (EXT) y comorbilidad con trastornos tanto del espectro externalizado como internalizado (MIX), presentan patrones de activación psicofisiológicos diferentes ante un paradigma CPT?
MATERIAL Y MÉTODOS
Muestra
Se evaluaron 16 pacientes diagnosticados con TDAH–M por un especialista; los diagnósticos se corroboraron con la entrevista semiestructurada K–SADS–PL–MX22: ocho con comorbilidad EXT y ocho con comorbilidad MIX. También se estudiaron ocho sujetos controles sanos sin ningún diagnóstico psiquiátrico y comparados por sexo con los pacientes. Todos los sujetos tenían entre 13 y 16 años de edad, carecían de antecedentes de daño del Sistema Nervioso Central y presentaban un CI normal (> 80) de acuerdo con la Escala de Inteligencia de Weschler para Niños.23
Método
Tanto los pacientes como los controles realizaron las dos partes de una tarea CPT, configuradas en el programa de Diagnóstico Neuropsicológico Automatizado de la firma Neuronic S.A.,24 con 200 estímulos y una proporción 25:75 de estímulo diana/estímulo no diana. El estímulo diana en la primera parte era la letra <<S>>, mientras que en la segunda parte era la letra <<S>>, siempre y cuando fuera precedida de la letra <<A>>. El estímulo no diana estuvo constituido en todos los casos por las letras <<A>> <<C>> <<E>> y <<T>>. Simultáneamente a la ejecución de la tarea, se llevó a cabo el registro de la actividad eléctrica cerebral en las 19 derivaciones del sistema internacional 10–20.
Las ventanas para promediar y analizar los PREs fueron seleccionadas por dos profesionales entrenados en esta tarea. Los segmentos para el análisis tuvieron una duración de 1 seg con un intervalo preestímulo de 100 mseg. Se editaron los PREs correspondientes a cada subestado restando el valor promedio de la ventana preestímulo. Se usó el programa EP Workstation v1.4 de la firma Neuronic S.A.24 para promediar los PREs.
El análisis estadístico de las diferencias conductuales entre los grupos se realizó mediante una prueba ANOVA de una vía. Para las comparaciones intragrupos (tarea 1 vs tarea 2), se utilizó una prueba t para muestras dependientes; en ambos casos se utilizó el paquete estadístico SPSS v.11.
El análisis de las señales electrofisiológicas se realizó mediante una prueba multivariada no paramétrica de permutaciones. 25 En primer lugar se compararon los potenciales promedio correspondientes a los dos subestados (estímulo infrecuente y estímulo frecuente) en cada paciente con el fin de demostrar la presencia de algún componente asociado a la tarea y obtener sus valores de latencia, la cual se definió como el punto de máxima diferencia entre ambos subestados. La contingencia del componente a los estímulos fue comprobada mediante la aplicación del estadígrafo T2 de Hotelling24 para cada uno de los instantes de tiempo que componían los segmentos de EEG seleccionados en los 19 canales.
Finalmente, para la comparación entre grupos, se obtuvo para cada caso el potencial diferencia, esto es, la respuesta al estímulo infrecuente menos la respuesta al estímulo frecuente, y se analizaron, mediante la prueba no paramétrica de permutaciones, las diferencias entre la tarea 1 y la tarea 2 en cada grupo y entre los grupos en cada tarea, en cuatro ventanas de latencia: 0 a 145 mseg, 150 a 295 mseg, 300 a 445 mseg y 450 a 595 mseg.
RESULTADOS
Conductuales
El cuadro I muestra las medias y desviaciones estándar para las diferentes variables conductuales obtenidas por cada uno de los grupos. Las comparaciones intragrupos no arrrojaron diferencias estadísticamente significativas. Por otro lado, en las comparaciones entre grupos por medio de la prueba ANOVA de una vía sí aparecieron diferencias estadísticamente significativas (F=5.544 y p=0.012) entre los grupos en la media del tiempo de reacción en la parte 1 del CPT y en la variable errores por comisión en la parte 2 (F=3.975 y p=0.034).

Electrofisiológicos
Al comparar, mediante la prueba multivariada no paramétrica de permutaciones, el PRE promedio ante el estímulo infrecuente con el del estímulo frecuente se encontraron diferencias estadísticamente significativas en todos los sujetos (pacientes y controles): en la parte 1 de la tarea, las diferencias se establecieron como un componente positivo entre los 320 y los 480 mseg, con distribución centro–parietal, de mayor amplitud ante el estímulo infrecuente; de manera similar, en la respuesta a la parte 2 de la tarea, el estímulo infrecuente se diferenció del estímulo frecuente en un componente positivo de mayor amplitud entre 290 y 430 mseg, también de distribución centro–parietal (figura 1).
El análisis de la latencia no mostró diferencias estadísticamente significativas entre grupos. Sin embargo, al comparar la respuesta de la primera parte con la de la segunda se observó que las latencias de la última fueron siempre menores. No obstante, este resultado sólo fue significativo en dos de los tres grupos: en los pacientes EXT (t=4.25 y p=0.01) y los sujetos CON (t=4.06 y p=0.01) (figura 2).

Al comparar, mediante la prueba multivariada no paramétrica de permutaciones, los potenciales diferencia de la parte 1 con los de la parte 2 en cada grupo, sólo se encontraron diferencias significativas en dos grupos: el de pacientes con comorbilidades externalizadas y el de sujetos controles. En el caso del grupo EXT, las diferencias entre la parte 1 y la parte 2 se encontraron en dos ventanas de latencia, una desde los 130 hasta los 185 mseg (máxima diferencia en 175 mseg, p=0.027) en la región central derecha (mayor amplitud en la segunda parte) y otra desde los 415 hasta los 475 mseg (máxima diferencia en 455 mseg, p=0.005), en las regiones parietales (mayor amplitud en la primera parte) (figura 3).

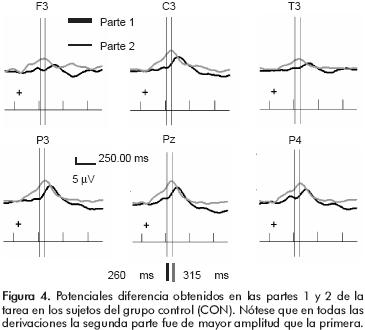
El grupo CON, por su parte, presentó una mayor amplitud significativa ante la parte 2 de la tarea en una ventana desde los 260 hasta los 315 mseg (máxima diferencia en 285 mseg, p=0.024) en las regiones parietales y algunas derivaciones del hemisferio izquierdo (F3, C3 y T3) (figura 4).
De las comparaciones entre grupos realizadas en las dos partes de la tarea, sólo dos resultaron estadísticamente significativas. En primer lugar, en el análisis de la ventana de los 300 a los 445 mseg en la parte 1, el grupo EXT presentó mayor amplitud del componente que el grupo CON en una latencia desde los 425 a los 445 mseg (máxima diferencia en 445 mseg, p=0.005) en la región parietal media. En segundo lugar, también en la parte 1, el grupo CON tuvo mayor amplitud que el grupo MIX entre los 355 y 420 mseg (maxima diferencia en 395 mseg, p=0.003) en la región temporal anterior izquierda (figura 5). Ninguna otra comparación resultó significativa.

DISCUSIÓN
La ausencia de diferencias en las variables conductuales entre la parte 1 y la parte 2 de la tarea en todos los grupos parece sugerir que esta última no es significativamente más difícil, lo cual parece lógico si se toma en cuenta que, mientras la primera parte sólo exige del sujeto que prepare y ejecute respuestas ante estímulos diana predefinidos, esta segunda parte incorpora un elemento de preparación de la respuesta: el estímulo blanco es ahora la <<S>> siempre que ésta vaya precedida de la <<A>>. Este nuevo componente de preparación facilita al parecer en cierta medida la realización de la tarea, ya que en todos los grupos el tiempo de reacción para la segunda parte fue menor que para la primera, aunque dicha diferencia no fue significativa estadísticamente.
En la comparación entre grupos, el tiempo de reacción en la primera parte de la tarea fue la única variable que distinguió entre pacientes y controles, ya que éstos ejecutaron significativamente más rápido; sin embargo, mantuvieron la misma eficacia que los pacientes, pues no existieron diferencias en el número de errores o aciertos cometidos. Este resultado no es sorprendente, pues de acuerdo con Conners,26 los tiempos de reacción largos denotan problemas de inatención y sugiere que, a pesar de que los pacientes tenían diferentes comorbilidades, la inatención sigue siendo el problema común a todos los pacientes de la muestra.
Por su lado, en la parte dos de la tarea, sólo el número de errores por comisión presentó diferencias estadísticamente significativas entre los grupos. En un análisis más detallado se puede observar que tales diferencias estuvieron determinadas por el hecho de que el grupo EXT cometió significativamente más errores que los sujetos CON, mientras que el grupo MIX ejecutó la tarea de manera intermedia. Los errores por comisión, en especial en esta segunda parte, son un reflejo conductual del proceso de inhibición.1,26 Los fallos en el control inhibitorio son uno de los tres síntomas cardinales del TDAH;2 sin embargo, la hipótesis de Barkley27 sostiene que este fallo, y no la inatención, es el verdadero síntoma central del TDAH.
La muestra del presente estudio se formó únicamente con pacientes del subtipo mixto (TDAH–M) del DSM–IV,28 por lo que todos los sujetos de la muestra clínica presentaban como sintomatología la diada hiperactividad–impulsividad. No obstante, sólo se encontraron problemas en la inhibición, medida por medio del CPT, en aquellos pacientes que presentaban comorbilidad con algún trastorno del tipo externalizado.
En resumen, los resultados conductuales de este estudio parecen concordar con los de Levy y Hobbes,29 quienes encontraron que ambas variables, errores por comisión y tiempo de reacción, son las que mejor distinguen a niños con TDAH de niños controles.
En cuanto a los resultados electrofisiológicos, la comparación entre la respuesta a los estímulos frecuentes y los estímulos infrecuentes (o diana) resultó en un componente positivo, de mayor amplitud para el estímulo diana, que aparece alrededor de los 300 mseg (figura 1) y que comparte las características de topografía y latencia del subcomponente P3b.30 Al analizar la latencia de dicho componente en los diferentes grupos, se encontraron diferencias significativas únicamente en los análisis intragrupos y, de manera similar a lo ocurrido con los tiempos de reacción, en todos los grupos la latencia del componente fue menor para la segunda parte de la tarea, aunque contrario a los resultados conductuales. En este caso, las diferencias alcanzaron significación estadística en dos de los grupos: los pacientes EXT y los sujetos CON (figura 2).
Mientras que la amplitud del componente P300 varía de acuerdo con la probabilidad de aparición del estímulo infrecuente,30 la latencia parece reflejar el tiempo necesario para categorizar el estímulo. Aunque es evidente que otros procesos pueden ocurrir en este intervalo, la latencia del P300 proporciona un límite superior al tiempo de evaluación necesario para establecer a qué categoría pertenece una señal.31 Tal idea es sostenida por el hecho de que, a medida que se vuelve más difícil la categorización del estímulo, aumenta la latencia del componente.32
En el presente trabajo, el hecho de que la latencia del componente sea menor para la segunda parte de la tarea parece sugerir que el componente de preparación incorporado en ésta facilita el proceso de categorización de los estímulos en todos los sujetos, pero espacialmente en los pacientes EXT y los sujetos CON. Que los pacientes MIX no se beneficien tanto de este efecto como los otros grupos pudiera deberse a que la ejecución correcta de esta tarea implica, al menos parcialmente, la activación de un componente de memoria de trabajo, ya que el sujeto debe analizar el primer estímulo <<A>>, almacenarlo y después comparar el siguiente con un módelo <<S>> para tomar la decisión de responder o no. Schatz y Rostain33 concluyeron que la comorbilidad del TDAH con ansiedad parece acrecentar los déficit en la memoria de trabajo, por lo que los pacientes con comorbilidad MIX e INT ejecutarían significativamente peor en tareas de este tipo.
Estas diferencias en la latencia se ven confirmadas por los análisis de amplitud llevados a cabo sobre los potenciales diferencia. Los cambios significativos encontrados en los grupos CON y EXT, entre los PREs promedios de las dos partes de la tarea, parecen reflejar, más que diferencias en amplitud, diferencias en la latencia del componente P300 valoradas indirectamente por medio de la amplitud (figuras 3 y 4).
El otro resultado significativo en este análisis fue, para el caso de los pacientes EXT, en la segunda parte de la tarea, una amplitud mayor del componente positivo entre los 130 y los 180 mseg. Sin embargo, esta diferencia no parece referirse a alguno de los fenómenos cognoscitivos estudiados ya que, contrariamente a lo que ocurrió con el P300, la existencia de tal componente no fue validada por la prueba de detección de señal, así, al parecer dicha diferencia no se relaciona con la manipulación experimental llevada a cabo y su interpretación está fuera del contexto del presente estudio.
La comparación entre grupos ofreció perfiles de ejecución característicos para cada subgrupo en lo que respecta a la respuesta electrofisiológica a la primera parte de la tarea. Por un lado, el componente P300 fue de menor amplitud en los pacientes MIX que en los sujetos control. Cabe aclarar que este resultado sólo fue significativo en la derivación T3, aunque otras derivaciones, más asociadas típicamente al componente (C3, C4, P3, P4 y Pz), mostraron tendencias similares que no alcanzaron significación estadística. La menor amplitud del componente en los pacientes con TDAH es el resultado más consistente en el estudio de los PREs en la entidad34 y ha recibido múltiples interpretaciones. Por ejemplo, una reducción en la asignación de recursos de la atención;35 un déficit en el procesamiento central de los estímulos35 o deficiencias en el procesamiento de las características relevantes para la respuesta de los estímulos.36 Sin embargo, es de notar que tales diferencias sólo fueron evidentes en una derivación, la cual no se vincula de forma característica al componente. Una posible explicación es, desde luego, el tamaño de la muestra ya que quizás tales diferencias alcancen en un mayor número de sujetos una significación estadística.
Por otro lado, los pacientes EXT presentaron mayor amplitud del componente P300 en Pz que los sujetos CON. Este resultado parece contrario a lo encontrado en la bibliografía. Sin embargo, si se retoma el resultado conductual respecto a que, en lo que a aciertos se refiere, tanto pacientes como controles ejecutaron al mismo nivel (cuadro I), se puede sugerir que en los pacientes EXT el déficit de atención subyacente se compensa de manera exitosa y tal proceso se refleja en la amplitud de los PREs.37
Los resultados de este estudio aportan información sobre un problema sobre el cual se ha realizado poca investigación y proporcionan datos sobre cómo la comorbilidad incide en la respuesta electrofisiológica de los pacientes con TDAH.
REFERENCIAS
1. Barkley RA. Attention deficit hyperactivity disorder. Nueva York: Guilford Press; 1998. [ Links ]
2. Weiss G. Attention deficit hyperactivity disorder. En: Lewis M (ed). Child and adolescent psychiatry a comprehensive textbook. Baltimore: Williams & Wilkins; 1992;p545–561. [ Links ]
3. Bench CJ, Frith CD, Graby PM et al. Investigations of functional anatomy of attention using the Stroop test. Neuropsicologia 1993;31:907–922. [ Links ]
4. Desimone R, Duncan J. Neural mechanisms of selective visual attention. Ann Review Neuroscience 1995;18:193–222. [ Links ]
5. Estévez–González A, García–Sánchez C, Junqué C. La atención: una compleja función cerebral. Revista Neurología 1997;25: 1989–1997. [ Links ]
6. Picton TW, Bentin S, Berg P, Donchin E, Hillyard SA et al. Guidelines for using human event–related potentials to study cognition: recording standars and publication criteria. Psychophysiology 2000;37:127–152. [ Links ]
7. Capilla–González A, Pazo P, Campo P, Maestú F, Fernández A et al. Nuevas aportaciones a la neurobiología del trastorno por déficit de atención con hiperactividad desde la magnetoencefalografía. Rev Neurol 2005;40:S43–S47. [ Links ]
8. Hegerl U. Event–related potentials in psychiatry. En: Niedermeyer E, Lopes da Silva F (eds). Electroencephalography: basic principles, clinical applications, and related fields. Philadelphia: Lippincott Williams & Wilkins; 2003;p621–636. [ Links ]
9. Zillessen KE, Scheuerpflug P, Fallgatter AJ, Strik WK, Warnke A. Changes of the brain electrical fields during the continuous performance test in attention–deficit hyperactivity disorder–boys depending on methylphenidate medication. Clin Neurophysiol 2001;112:1166–1173. [ Links ]
10. Jonkman LM, Kemner C, Verbaten MN, Koelega HS, Camfferman G et al. Effects of methylphenidate on event–related potentials and performance of attention–deficit hyperactivity disorder children in auditory and visual selective attention tasks. Biol Psychiatry 1997;41:690–702. [ Links ]
11. Kemner C, Verbaten MN, Koelega HS, Camfferman G, Van Engeland H. Are abnormal event–related potentials specific to children with ADHD? A comparison with two clinical groups. Percept Mot Skills 1998;87:1083–1090. [ Links ]
12. Klein RG, Manuzza S. Long–term outcome of hyperactive children: a review. J Am Acad Child Adolesc Psychiatry 1991;30:383–387. [ Links ]
13. Manuzza S, Klein RG, Moulton JL. Persistence of attention–deficit/hyperactivity disorder into adulthood: what have we learned from the prospective follow–up studies?. J Atten Disord 2003;7:93–100. [ Links ]
14. Kadesjo B, Gillberg C. The comorbidity of ADHD in the general population of Swedish scholl–age children. J Child Psychol Psychiatry 2001;42:487–492. [ Links ]
15. Biederman J, SPencer TJ, Newcorn JH, Gao H, Milton DR et al. Effect of comorbid symptoms of oppositional defiant disorder on responses to atomoxetine in children with ADHD: a meta–analysis of controlled clinical trial data. Psychopharmacology (Berl) 2007;190:31–41. [ Links ]
16. Pliszka SR. Psychiatric comorbidities in children with attention deficit hyperactivity disorder: implications for management. Paediatr Drugs 2000;5:741–750. [ Links ]
17. MTA Cooperative Group. National Institute of Mental Health Multimodal Treatment Study of ADHD follow–up: 24–month outcomes of treatment strategies for attention–deficit/hyperactivity disorder. Pediatrics 2004;113:754–761. [ Links ]
18. Barkley RA, Smith KM, Fischer M, Navia B. An examination of the behavioral and neuropsychological correlates of three ADHD candidate gene polymorphisms (DRD4 7+, DBH TaqI A2, and DAT1 40 bp VNTR) in hyperactive and normal children followed to adulthood. Am J Med Genet B Neuropsychiatr Genet 2006;141: 487–498. [ Links ]
19. Banaschewski T, Brandeis D, Heinrich H, Albrecht B, Brunner E et al. Association of ADHD and conduct disorder–brain electrical evidence for the existence of a distinct subtype. J Child Psychol Psychiatry 2003;44:356–376. [ Links ]
20. Banaschewski T, Brandeis D, Heinrich H, Albrecht B, Brunner E et al. Questioning inhibitory control as the specific deficit of ADHD—evidence from brain electrical activity. J Neural Trans 2004;111:841–864. [ Links ]
21. Rothenberger A, Banaschewski T, Heinrich H, Moll GH, Schmidt MH et al. Comorbidity in ADHD–children: effects of coexisting conduct disorder or tic disorder on event–related brain potentials in an auditory selective–attention task. Eur Arch Psychiatry Clin Neurosci 2000;250:101–110. [ Links ]
22. De La Peña F, Ulloa R, Higuera F et al. Interrater reliability of the Spanish version of the K–SADS–PL–MEXPL. En: 49 Annual Meeting of the American Academy of Child Adolescen Psychiatry. San Francisco: 2002;p22–27. [ Links ]
23. Wechsler D. WISC–R español. Escala de inteligencia revisada para el nivel escolar. Manual. México: Editorial el Manual Moderno; 1981. [ Links ]
24. Neuronic SA: EP Workstation: edición y análisis de los PEs version 1.4.0, Centro de Neurociencias de Cuba, Ciudad de la Habana, 2007. [ Links ]
25. Galan L, Biscay R, Rodríguez JL, Pérez–Avalo MC, Rodríguez R. Testing topographic differences between event–related brain potentials by using non–parametric combinations of permutation tests. Electroenceph Clin Neurophysiol 1997;192:240–247. [ Links ]
26. Conners CK, Multi–health Systems Inc. STAFF. Conners' continuos performance test (CPT II). Computer program for windows. Technical guide and software manual. Toronto: Multi–Health Systems Inc; 2000. [ Links ]
27. Barkley RA. Behavioral inhibition, sustained attention, and executive function: constructing a unifying theory of ADHD. Psychol Bull 1997;121:65–94. [ Links ]
28. American Psychiatric Association. Manual diagnóstico y estadístico de los trastornos mentales. Cuarta edición. Barcelona: Masson; 1995. [ Links ]
29. Levy F, Hobbes G. Discrimination of attention deficit hyperactivity disorder by the continuous performance test. J Paediatr Child Health 1997;33:384–387. [ Links ]
30. Polich J, Criado JR. Neuropsychology and neuropharmacology of P3A and P3b. International Psychophysiology 2006;60:172–185. [ Links ]
31. Coles MG, Smid Hgom, Scheffers MK, Otten LJ. Mental chronometry and the study of human information processing. Electrophysiology of Mind: Event–related brain potentials and cognition. En: Rugg M, Coles M (eds). Oxford: Oxford University Press; 1995. [ Links ]
32. Kutas M, McCarthy G, Donchin E. Augmenting mental chronometry: the P300 as a measure of stimulus evaluation time. Science 1997;197:792–795. [ Links ]
33. Schatz DB, Rostain AL. ADHD with comorbid anxiety: a review of the current literature. J Atten Disord 2006;10:141–149. [ Links ]
34. Barry RJ, Johnstone S, Clarke AR. A review of electrophysiology in at–tention–deficit/hyperactivity disorder: II. Event related potentials. Clin Neurophysiol 2003;114:184–198. [ Links ]
35. Steager J, Imhof K, Steinhaussen H–C, Brandeis D. Brain mapping of bilateral interactions in attention deficit hyperactivity disorder and control boys. Clin Neurophysiol 2000;1211:1141–1156. [ Links ]
36. Strandburg RJ, Marsh JT, Brown WS, Asarnow RF, Higa J et al. Continuous–processing–related event–related potentials in children with attention deficit hyperactivity disorder. Biol Psychiatry 1996;40:964–980. [ Links ]
37. Harter MR, Lourdes AV, Wood BF, Schroeder MM. Separate brain potential characteristics in children with reading disability and attention deficit disorder: Color and letter relevance effects. Brain Cognition 1998;6:221–236. [ Links ]














