Introducción
El cultivo de papa (Solanum tuberosum) ocupa el sexto lugar en producción mundial con 470,409,159 t, obtenidas de 23,514,508 h; los principales países productores de esta hortaliza son China, India, Ucrania, Rusia y Estados Unidos (FAO, 2023); México ocupa el lugar 35 con una producción anual de 1,986,198 t, donde los principales estados productores son Sonora con 612,600 t y Sinaloa con 427,587 t anuales, lo que representa el 52.4 % de la producción nacional, con un valor de producción de 17,426,448,000 (SIAP, 2023). El cultivo es afectado por enfermedades que limitan su producción y calidad (Torrance y Talianksy, 2020; Singh et al., 2021). Destaca por su importancia la pudrición blanda causada por Sclerotium rolfsii el cual afecta alrededor de 500 especies vegetales, que se agrupan en 100 familias diferentes, destacando al tomate (Solanum lycopersicum), pepino (Cucumis sativus), cacahuate (Arachis hypogaea), papa, entre otros (Kator et al., 2015; Roca et al., 2016; Kumar et al., 2018; Paparu et al., 2020; Meena et al., 2023). En papa, la pudrición blanda de tubérculos afecta la producción en un 20 %. El hongo presenta hábitos saprofíticos y en el suelo coloniza residuos de cosecha o puede sobrevivir en forma de esclerocios, los cuales se dispersan por medio del agua, maquinaria, residuos vegetales, suelo y animales (Kator et al., 2015; Roca et al., 2016).
El manejo tradicional de la pudrición blanda de tubérculos mediante fungicidas sintéticos contamina el medio ambiente y afectan a los seres vivos (Widmer, 2019), y su uso continuo genera resistencia en los fitopatógenos, lo que conduce al incremento de concentraciones para su control (Ferreira et al., 2020).
En años recientes, han surgido avances relativos a la utilización de estrategias amigables con el ambiente para el manejo de enfermedades en diversos cultivos, donde sobresale el uso de hongos como de agentes de control biológico (Rubayet y Bhuiyan 2016; Yassin et al., 2021; Kim et al., 2023)
Los hongos del género Trichoderma son los agentes biológicos más estudiados y usados, debido a los buenos resultados en el control de enfermedades fungosas; esto se debe a la diversidad de mecanismos de acción que poseen (competencia por espacio y nutrientes, micoparasitismo y antibiosis); además, este tipo de hongo antagonista produce metabolitos secundarios que promueven el crecimiento vegetal y activan los mecanismos de defensa de las plantas, e incrementan la producción y calidad de las cosechas (Yao et al., 2023). Los tratamientos con este hongo se direccionan a la semilla, plántulas, agua de riego y follaje; por otro lado, existen estudios donde se ha comprobado la compatibilidad de Trichoderma con fungicidas sintéticos comerciales, para su uso en mezclas en elcontrol de enfermedades fungosas en diversos cultivos (Gonzalez et al., 2020; Manandhar
et al., 2020; Arain et al., 2022; Dinkwar et al., 2023).
En México no existen estudios sobre la compatibilidad de especies de Trichoderma en mezclas con fungicidas sobre todo dirigidos al control de la pudrición blanda de los tubérculos de papa. Por ello, en el presente trabajo el objetivo fue determinar la efectividad biológica in vitro de diferentes concentraciones de fungicidas sintéticos en la inhibición del crecimiento micelial y formación de esclerocios de S. rolfsii; así como el efecto in vitro de los fungicidas sobre el crecimiento micelial de Trichoderma afroharzianum, T. asperelloides, T. asperellum y T. azevedoi.
Materiales y Métodos
Obtención de aislados. Se utilizaron aislados de S. rolfsii (Scr4) y de Trichoderma afroharzianum (TES24), T. asperelloides (TAM74), T. asperellum (TAF75) y T. azevedoi (TAI73), proporcionados por el banco microbiológico del Laboratorio de Diagnóstico Fitosanitario de la Junta Local de Sanidad Vegetal del Valle del Fuerte. Los aislados se obtuvieron de suelo de parcelas comerciales donde se sembró papa en ciclos agrícolas previos en los municipios de Ahome, Sinaloa y Caborca, Sonora, México en 2019, 2020 y 2021 (Cuadro 1).
Cuadro 1 Especies y aislados de Sclerotium rolfsii y Trichoderma, sitio y año de colecta y código en el Gen Bank.
| Especie/aislado | Localidad | Año de colecta | Código en Gen Bank |
|---|---|---|---|
| Sclerotium rolfsii /Scr4 | Ahome, Sinaloa/ 25.701944 -109.043333 | 2019 | OR514113 |
| T. asperelloides /TES24 | Caborca, Sonora/31.06666 -112.338333 | 2020 | OR521164 |
| T. azevedoi /TAI73 | Ahome, Sinaloa/25.818885 -108.956014 | 2021 | OR521181 |
| T. afroharzianum/TAF75 | Ahome, Sinaloa/25.491445 -108.571659 | 2021 | OR521183 |
| T. asperellum/TAM74 | Ahome, Sinaloa/ 25.491445 -108.571659 | 2021 | OR521182 |
Sensibilidad in vitro de Sclerotium rolfsii a nueve fungicidas sintéticos. En este estudio se evaluó la sensibilidad in vitro de un aislado de S. rolfsii (Scr4) a los siguientes fungicidas: Tifluzamida (Summit Agro México), Tiabendazol (Arysta LifeScience México), Mancozeb (Arysta LifeScience México), Propineb (Bayer Crop Science), Procloraz (Adama, México), Propiconazol (Syngenta Agro), Tolclofos-metil (Valent), Carboxin+Captan (Arysta LifeScience) y Tiofanato de metilo (Arysta LifeScience), contra el crecimiento micelial de S. rolfsii (Scr4).
Las pruebas se realizaron mediante la técnica de alimento envenenado (Dinkwar et al., 2023), en cajas Petri de 90 mm de diámetro, con 20 mL del medio de cultivo Papa Dextrosa Agar (PDA) adicionado con las sustancias de pruebas a las concentraciones: 0.01, 0.1, 1.0, 10 y 100 ppm. Se utilizaron discos de PDA de 5 mm de diámetro con crecimiento micelial activo de tres días de edad de S. rolfsii y se transfirieron al centro de la caja Petri. Los tratamientos se distribuyeron en un diseño completamente al azar con arreglo factorial 9x5, con cinco repeticiones, donde el primer factor del arreglo fue cada uno de los nueve fungicidas y el segundo factor correspondió a las cinco concentraciones. Las cajas se sellaron con papel parafilm y se incubaron a 25 ±2 °C. El tratamiento testigo consistió en cinco cajas Petri con PDA y micelio del hongo sin fungicida.
La efectividad biológica de los fungicidas sobre el crecimiento micelial de S. rolfsii, se determinó mediante la medición de su crecimiento radial cada 24 h, después de la siembra y culminó cuando S. rolfsii llenó las cajas Petri sin fungicida.
El porcentaje de inhibición del crecimiento micelial de S. rolfsii se calculó de acuerdo con la siguiente ecuación: I= C-T/C X 100, donde: I=Porcentaje de inhibición, C=Crecimiento del patógeno testigo, T=Crecimiento del patógeno en tratamiento (Vincent, 1947). El experimento se repitió en dos ocasiones.
Efecto de fungicidas sintéticos sobre la formación de esclerocios de Sclerotium rolfsii. Discos de PDA de 5 mm de diámetro con crecimiento micelial activo de S. rolfsii se transfirieron a cajas Petri de PDA que contenían fungicidas en las mismas concentraciones descritas en la sección anterior. El diseño de los tratamientos fue completamente al azar con arreglo factorial 9x5, con cinco repeticiones, donde el primer factor del arreglo fue cada uno de los nueve fungicidas y el segundo factor correspondió a las cinco concentraciones. El tratamiento testigo consistió en cinco cajas Petri con PDA con crecimiento micelial de S. rolfsii sin fungicida. El número de esclerocios se determinó a los 21 días después de la siembra. El experimento se desarrolló en dos ocasiones.
Sensibilidad in vitro de especies de Trichoderma a 10 fungicidas sintéticos. En este estudio se evaluó la sensibilidad in vitro de T. afroharzianum, T. asperelloides, T. asperellum y T. azevedoi a los fungicidas: 1) Tifluzamida (Summi Agro México), 2) Tiabendazol (Arysta LifeScience México), 3) Mancozeb (Arysta LifeScience México), 4) Propineb (Bayer Crop Science), 5) Procloraz (Adama, México), 6) Propiconazol (Syngenta Agro), 7) Carboxin+Captan (Arysta LifeScience México), 8) Tiofanato de metilo (Arysta LifeScience), 9) Fluazinam (Syngenta Agro) y 10) TCMTB (Summit Agro México).
El ensayo se realizó con base en la técnica descrita por Dinkwar et al. (2023), para lo cual se utilizaron cajas Petri de 90 mm de diámetro, con 20 mL de PDA conteniendo las sustancias de pruebas a las concentraciones: 100, 500, 1000 y 2000 ppm. Como inóculo, se utilizaron discos de PDA de 5 mm de diámetro con crecimiento micelial activo de cada especie de Trichoderma, los cuales se colocaron en el centro de la caja Petri. Los tratamientos se distribuyeron en un diseño experimental completamente al azar con arreglo factorial 4x10x4, con cuatro repeticiones, donde el primer factor del arreglo corresponde a cada una de las especies de Trichoderma, el segundo a los 10 fungicidas y el tercero a las cuatro concentraciones de fungicidas. Las cajas se sellaron con papel parafilm y se incubaron a 25±2 °C. El tratamiento testigo consistió en cuatro cajas Petri con PDA solo con las especies de Trichoderma sin fungicida. El experimento se desarrolló en dos ocasiones.
La efectividad biológica de los fungicidas sobre el crecimiento micelial de las cuatro especies de Trichoderma, se determinó mediante la medición de su crecimiento radial cada 24 h, después de la siembra y culminó cuando cada una de las especies de Trichoderma llenó las cajas Petri sin fungicida.
El porcentaje de inhibición del crecimiento micelial de la especie de Trichoderma se calculó de acuerdo con la siguiente formula: I= C-T/C X 100, donde: I=Porcentaje de
inhibición, C=Crecimiento del antagonista testigo, T=Crecimiento del antagonista en tratamiento (Vincent, 1947).
Análisis estadísticos de datos. Considerando que los datos del experimento 1 y 2 sobre inhibición del crecimiento radial y de la producción de esclerocios de S. rolfsii en las diferentes concentraciones de los fungicidas no mostraron diferencias significativas entre ellos, además de que sus varianzas fueron homogéneas, los datos de los dos experimentos se combinaron y se analizaron como uno solo; en seguida se sometieron a ANOVA en el paquete estadístico (SAS 9.0, SAS Institute Inc., North Carolina, EUA). La comparación de medias fue mediante la prueba de Tukey (P=0.05) (Little y Hills, 1973). Los datos sobre la inhibición del crecimiento micelial de las cuatro especies de Trichoderma por los fungicidas se sometieron a los mismos análisis estadísticos.
Resultados
Efectividad biológica in vitro de fungicidas sintéticos en la inhibición del crecimiento micelial de Sclerotium rolfsii. En el análisis de varianza factorial entre fungicidas mostró diferencias significativas (F=65687.3, P≤ 0.0001). También se reflejaron diferencias significativas (F=141381, P≤ 0.0001) entre las concentraciones de fungicidas. La interacción de fungicidas y sus concentraciones también fue significativa (F=9142.35, P≤ 0.0001), lo que implica una sensibilidad diferencial de S. rolfsii a las concentraciones de los fungicidas en estudio (Cuadro 2).
Cuadro 2 Análisis de varianza factorial del porcentaje de inhibición in vitro del crecimiento micelial de S. rolfsii a cuatro concentraciones de nueve fungicidas.
| Fuente | GL | Suma de cuadrados | Valor de F |
|---|---|---|---|
| Fungicidas | 8 | 174055.4360z | 65687.3b |
| Concentraciones de fungicidas | 4 | 187313.2096 | 141381 |
| Fungicidas X concentraciones de fungicidas | 32 | 96900.0220 | 9142.35 |
zEl análisis de varianza se efectuó con datos transformados a la forma Arc sin-1 usando el tipo III de la suma de cuadrados de los procedimientos de modelo lineal generalizado (GLM) de SAS. b= Efecto significativo a P≤ 0.0001.
La inhibición del crecimiento micelial de S. rolfsii por los fungicidas Tifluzamida, Propineb y Propiconazol a la concentración de 0.01 ppm varió de 5.7 a 32.7 %, con diferencias significativas (P = 0.05) entre tratamientos, mientras que el resto de los fungicidas a las mismas concentraciones no ejercieron inhibición en el crecimiento micelial del hongo, mientras que la inhibición ejercida por los fungicidas Tifluzamida, Carboxin+Captan, Propiconazol, Propineb, Procloraz y Tiabendazol a las concentraciones 0.1 ppm varió de 6.8 a 78.1 %, con diferencias significativas (P=0.05) entre estos; a su vez los tratamientos mostraron diferencias con respecto al resto de los fungicidas, donde no ocurrió la inhibición del crecimiento micelial del hongos (Cuadro 3).
Cuadro 3 Porcentaje de inhibición promedio in vitro del crecimiento radial de Sclerotium rolfsii, causado por varios fungicidas sintéticos.
| Porcentaje de inhibición de crecimiento micelial | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| ppm | |||||||||
| Tifz | Prop | Prp | C+C | Prc | Tia | Tol | Man | Tio | |
| 0.01 | 32.7* a** | 12.2 b | 5.7 c | 0.0 d | 0.0 d | 0.0 d | 0.0 d | 0.0 d | 0.0 d |
| 0.1 | 78.1 a | 15.0 d | 18.2 c | 64.2 b | 14.0 d | 6.8 e | 0.0 f | 0.0 f | 0.0 f |
| 1.0 | 90.7 b | 16.0 e | 48.0 d | 93.1 a | 15.8 e | 7.1 f | 61.4 c | 0.0 g | 0.0 g |
| 10 | 92.4 b | 26.9 d | 100 a | 100 a | 33.0 c | 17.5 f | 100 a | 20.7 e | 6.6 g |
| 100 | 93.0 b | 41.1 d | 100 a | 100 a | 100 a | 20.9 e | 100 a | 75.0 c | 8.1 f |
zTif =Tifluzamida, Pro = Propineb, Prp= Propiconazol, C+C = Carboxin+Captan, Prc = Procloraz, Tia = Tiabendazol, Tol = Tolclofos-metil, Man = Mancozeb y Tio =Tiofanato de metilo.
*El número en las filas expresa el promedio del porcentaje de inhibición del crecimiento micelial de S. rolfsii por cada uno de los fungicidas. **Medias con una letra común en las hileras no son significativamente diferentes (P=0.05) al someterse a la prueba de Tukey.
Los fungicidas Tifluzamida, Propineb, Propiconazol, Carboxin+Captan, Tolclofos- metil Procloraz y Tiabendazol, a la concentración de 1 ppm, ejercieron inhibición del crecimiento micelial de 7.1-93.1 %, con diferencias significativas (P=0.05) entre tratamientos; resaltando Tifluzamida y Carboxin+Captan en su efectividad biológica, mientras que Mancozeb y Tiofanato de metilo no inhibieron el crecimiento micelial del hongo (Cuadro 3).
La concentración de 10 ppm, en todos los fungicidas inhibió el crecimiento micelial del hongo, resaltando por su eficacia Propiconazol, Carboxin+Captan y Tolclofos-metil, los cuales inhibieron el 100 % del crecimiento micelial, sin diferencias significativas (P=0.05) entre estos tratamientos, pero si las hubo con respecto al resto de los fungicidas donde el crecimiento micelial varió de 6.6 a 92.4 %, donde la Tifluzamida mostró el mayor efecto inhibitorio (Cuadro 3).
Fue evidente la inhibición del crecimiento micelial de S. rolfsii por los fungicidas Tifluzamida, Propiconazol, Carboxin+Captan, Procloraz y Tolclofos-metil a la concentración de 100 ppm, con inhibición del crecimiento micelial de 93.0 a 100 %, con diferencias significativas (P=0.05) entre estos tratamientos. La inhibición micelial por los fungicidas Propineb, Tiabendazol, Mancozeb y Tiofanato de metilo varió de 8.1 a 75.0 % con diferencias significativas (P=0.05) entre éstos y a su vez con el resto de los fungicidas (Cuadro 3).
Efecto in vitro de fungicidas sintéticos sobre la formación in vitro de esclerocios de Sclerotium rolfsii. Se reflejaron diferencias significativas (F=2524.74, P≤ 0.0001) en la producción de esclerocios de S. rolfsii en PDA con los diferentes fungicidas químicos. Las cinco concentraciones también mostraron diferencias significativas (F=10146.5, P≤ 0.0001) en la producción de las estructuras de resistencia del hongo. La interacción entre los fungicidas y sus concentraciones, también fue significativa (F=642.22, P≤ 0.0001) (Cuadro 4).
Cuadro 4 Análisis de varianza factorial de producción de esclerocios por S. rolfsii en PDA con cinco concentraciones de nueve fungicidas.
| Fuente | GL | Suma de cuadrados | Valor de F |
|---|---|---|---|
| Fungicidas | 9 | 386.840642* | 2524.74b |
| Concentraciones de fungicidas | 4 | 1554.645170* | 10146.5 |
| Fungicidas X concentraciones de fungicidas | 36 | 98.400870* | 642.22 |
*El análisis de varianza se efectuó con datos transformados a la forma Raíz cuadrada usando el tipo III de la suma de cuadrados en los procedimientos de GLM de SAS. b= Efecto significativo a P≤ 0.0001.
La producción de esclerocios varió de 157 a 180 por caja Petri en PDA con los diferentes fungicidas en la concentración de 0.01 ppm. El menor número de esclerocios ocurrió en el medio de cultivo con Tifluzamida, Propineb y Procrolaz, los cuales no mostraron diferencias significativas (P=0.05) entre ellos, pero si las hubo con respecto al resto de los fungicidas y el testigo sin fungicida donde se contabilizaron 182 esclerocios por caja Petri (Cuadro 5).
Cuadro 5. Producción de esclerocios de Sclerotium rolfsii por caja Petri con PDA adicionado con las diferentes concentraciones de nueve fungicidas.
| Fungicida/número de esclerociosz | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ppm | ||||||||||
| Tify | Prc | Pro | Tol | Prp | C+C | Tia | Man | Tio | Tes | |
| 0.01 | 157 c* | 164 cb | 164 cb | 171 a | 173 ab | 174 ab | 174 ab | 178 a | 180 a | 182 a |
| 0.1 | 147c | 162 cb | 163 abc | 164 abc | 171 ab | 148 c | 167 ab | 161 cb | 162 cb | 182 a |
| 1 | 0 e | 92 c | 69 d | 148 b | 162 b | 93 c | 161 b | 78 d | 148 b | 182 a |
| 10 | 0 g | 75 d | 0 g | 30 e | 129 c | 0 g | 146 b | 22 f | 131 c | 182 a |
| 100 | 0 d | 0 d | 0 d | 9 c | 0 d | 0 d | 132 b | 0 d | 129 b | 182 a |
yTif =Tifluzamida, Prc = Procloraz, Pro = Propineb, Tol = Tolclofos-metil, Prp= Propiconazol, C+C = Carboxin+Captan, TC
= TCMTB, Tia = Tiabendazol, Man = Mancozeb, Flu = Fluazinam, Tio =Tiofanato de metilo y Testigo sin fungicida. zEsclerocios en PDA con diferentes concentraciones de fungicidas a los 21 días después de la siembra. *Medias con una letra común en las hileras no son significativamente diferentes (P=0.05) de acuerdo al procedimiento de Tukey.
A la concentración de 0.1 ppm Tifluzamida y Carboxin+Captan ejercieron el mayor efecto en la inhibición de formación de esclerocios con 147 y 148 de ellos, respectivamente por caja Petri. En el resto de los tratamientos la producción de esclerocios varió de 161 a 171, con diferencias significativas (P = 0.05) entre ellos.
Sclerotium rolfsii no formó esclerocios en la concentración de 1 ppm de Tifluzamida, sin embargo, el número de esclerocios por caja Petri varió de 69 a 162 en el medio de cultivo con la misma concentración en los diferentes fungicidas. Hubo diferencias significativas (P = 0.05) entre estos tratamientos y con el respecto al tratamiento testigo, donde se produjeron 182 esclerocios por caja Petri.
No se formaron esclerocios en PDA con la concentración de 10 ppm de Tifluzamida, Propineb y Carboxin+Captan, pero si se produjeron en el medio con el resto de los fungicidas a la misma concentración, con diferencias significativas (P = 0.05) entre tratamientos, donde el número de esclerocios varió de 22 a 146 por caja Petri. La menor eficacia la mostró el Tiabendazol, pues este tratamiento mostró la mayor cantidad esclerocios.
A la concentración de 100 ppm de Tifluzamida, Procloraz, Propineb, Propiconazol, Carboxin+Captan y Mancozeb inhibieron en su totalidad la formación de esclerocios, sin diferencias significativas (P=0.05) entre tratamientos, pero si las hubo con respecto al número de esclerocios (9 a 132) que se produjeron en el medio con los fungicidas Tolclofos-metil, Tiabendazol y Tiofanato metílico a la misma concentración.
Sensibilidad in vitro de cuatro especies de Trichoderma a 10 fungicidas sintéticos. En el análisis de varianza factorial, las cuatro especies de Trichoderma mostraron diferencias significativas (F=9576.97, P≤ 0.0001) en el porcentaje de inhibición del crecimiento micelial. Las especies del hongo presentaron una respuesta diferencial a los fungicidas incluidos en el presente estudio; de igual forma, los 10 fungicidas mostraron diferencias significativas (F=177350, P≤ 0.0001) en la inhibición de las especies de Trichoderma. También hubo diferencias significativas (F=24772.8, P≤ 0.0001) entre las concentraciones. La interacción entre los 10 fungicidas y sus cuatro respectivas concentraciones también fue significativa (F=5208, P≤ 0.0001); de manera similar, la interacción de las especies de Trichoderma y los 10 fungicidas también resultó significativas (F=4212.90, P≤ 0.0001). La interacción entre las especies de Trichoderma y las cuatro concentraciones de los fungicidas evaluadas arrojó diferencias significativas (F=1173.88, P≤ 0.0001). Por último, la interacción especies de Trichoderma X fungicidas X concentraciones de fungicidas también fue significativa (1211.06, P≤ 0.0001) (Cuadro 6).
Cuadro 6 Análisis de varianza factorial del porcentaje de inhibición in vitro del crecimiento micelial de cuatro especies de Trichoderma por cuatro concentraciones de diez fungicidas.
| Fuente | GL | Suma de cuadrados | Valor de F |
|---|---|---|---|
| Especies de Trichoderma | 3 | 4044.8603* | 9576.97b |
| Fungicidas | 9 | 74904.1540* | 177350 |
| Concentraciones de fungicidas | 3 | 10462.8481* | 24772.8 |
| Fungicidas X concentraciones de fungicidas | 27 | 2199.9104* | 5208.70 |
| Especies de Trichoderma X fungicidas | 27 | 1779.3305* | 4212.90 |
| Especies de Trichoderma X concentraciones de fungicidas | 9 | 495.7913* | 1173.88 |
| Especies de Trichoderma X fungicidas X concentraciones de fungicidas | 81 | 511.4926* | 1211.06 |
*El análisis de varianza se efectuó con datos transformados a la forma Arc sen-1 usando el tipo III de la suma de cuadrados de los procedimientos de GLM de SAS. b= Efecto significativo a P≤ 0.0001.
Los fungicidas Propineb y Tifluzamida a la concentración de 100 ppm no ejercieron inhibición in vitro del desarrollo micelial de T. azevedoi (Figura 1 A y B); el resto de los fungicidas ejercieron inhibición del desarrollo micelial de 30.8 a 100 %, con diferencias significativas entre tratamientos (P=0.05). T. azevedoi mostró sensibilidad a 2000 ppm, particularmente en el caso de Propineb. Al incrementar las concentraciones de 500 a 2000 ppm, ocurrió una marcada inhibición del desarrollo micelial por Tifluzamida, pero sin inhibir el desarrollo micelial en forma total. En contraste, Fluazinam (Figura 1 C) y resto de los fungicidas inhibieron el desarrollo micelial de T. azevedoi de 88.9 a 100 %, con diferencias significativas (P=0.05) entre tratamientos (Cuadro 7).
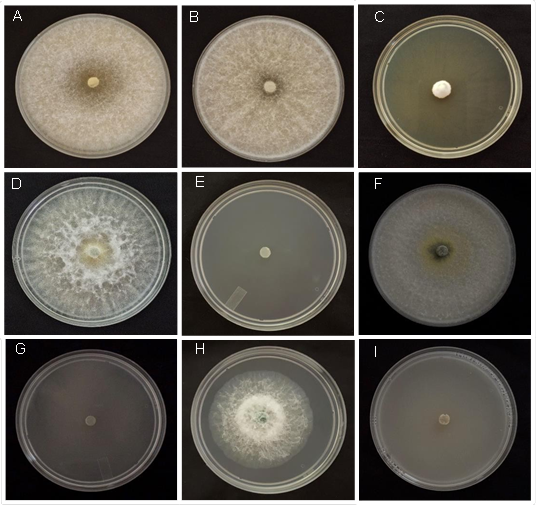
Figura 1 Inhibición del crecimiento micelial de cuatro especies de Trichoderma en PDA adicionado con fungicidas sintéticos. A) T. azevedoi+Propineb 100 ppm; B) T. azevedoi+Tifluzamida 100 ppm; C) T. azevedoi+Fluazinam 100 ppm; D) T. afroharzianum+Propineb 100 ppm; E) T. afroharzianum+Propiconazol 100 ppm; F) T. asperellum+Propineb 100 ppm; G) T. asperellum+Tiabendazol 100 ppm; H) T. asperelloides+Tifluzamida 100 ppm; I) T. asperelloides+TCMTB 100 ppm.
Cuadro 7 Porcentaje de inhibición promedio in vitro del crecimiento radial de cuatro especies de Trichoderma, causado por varios fungicidas sintéticos.
| ppm | Porcentaje de inhibición de crecimiento micelial | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Proz | Tif | Man | C+C | Flu | TC | Prp | Prc | Tia | Tio | ||
| T. azevedoi | 100 | 0.0 e | 0.0 e | 30.8 d | 73.0 c | 88.9 b | 100 a | 100 a | 100 a | 100 a | 100 a |
| 500 | 0.0 e | 33.4 e | 53.0 d | 90.4 c | 90.7 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 1000 | 0.0 e | 54.8 d | 56.5 c | 100 a | 92.2 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 2000 | 58.0 e | 78.9 c | 66.4 d | 100 a | 93.9 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| T. afroharzianum | 100 | 0.0 g | 63.3 e | 37.3 f | 82.2 d | 92.1 c | 97.3 b | 100 a | 100 a | 100 a | 100 a |
| 500 | 0.0 f | 69.6 d | 54.2 e | 85.5 c | 92.9 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 1000 | 0.0 f | 82.0 d | 57.4 e | 87.8 c | 94.3 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 2000 | 88.6 c | 87.0 c | 73.4 d | 97.0 b | 95.5 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| T. asperellum | 100 | 0.0 e | 0.0 e | 36.7 d | 43.7 c | 95.0 b | 100 a | 100 a | 100 a | 100 a | 100 a |
| 500 | 0.0 e | 0.0 e | 42.8 d | 78.3 c | 97.0 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 1000 | 36.2 f | 47.4 d | 45.9 e | 87.6 c | 97.8 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 2000 | 38.5 f | 73.7 d | 48.2 e | 92.2 c | 98.5 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| T. asperelloides | 100 | 54.9 e | 58.0 c | 57.3 d | 23.2 f | 94.6 b | 100 a | 100 a | 100 a | 100 a | 100 a |
| 500 | 56.3 d | 58.7 c | 58.6 c | 100 a | 96.1 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 1000 | 58.1 e | 69.4 c | 62.0 d | 100 a | 97.1 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
| 2000 | 61.1 e | 80.0 c | 68.3 d | 100 a | 97.8 b | 100 a | 100 a | 100 a | 100 a | 100 a | |
zPro = Propineb, Tif =Tifluzamida, Man = Mancozeb, C+C = Carboxin+Captan, Flu = Fluazinam, TC = TCMTB, Prp= Propiconazol, Prc = Procloraz, Tia = Tiabendazol y Tio =Tiofanato de metilo.
*El número en las filas expresa el promedio del porcentaje de inhibición del crecimiento micelial T. azevedoi, T. afroharzianum,
T. asperellum y T. asperelloides por cada uno de los fungicidas.
**Medias con una letra común en las hileras no son significativamente diferentes (P=0.05) Tukey.
Al igual que en T. azevedoi, T. afroharzianum no mostró sensibilidad a Propineb a las concentraciones de 100 (Figura 1 D), 500 y 1000 ppm, pero si mostró sensibilidad a 2000 ppm. La inhibición del crecimiento micelial de T. afroharzianum se incrementó de manera gradual al incrementar las concentraciones de los fungicidas Tifluzamida, Mancozeb, Caboxin+Captan y Fluazinam. Los fungicidas Propiconazol (Figura 1 E), Procloraz, Tiabendazol y Tiofanato de metilo a las concentraciones de 100 a 2000 ppm inhibieron el 100 % del crecimiento micelial del antagonista.
Los fungicidas Propineb (Figura 1 F) y Tifluzamida a la concentración de 100 y 500 ppm no ejercieron efecto inhibitorio in vitro sobre el crecimiento micelial de T. asperellum; el hongo sólo presentó sensibilidad a la concentración de 1000 y 2000 ppm de ambos fungicidas; en cambio, Mancozeb y Carboxin+Captan ejercieron inhibición del crecimiento micelial de 36.7 a 92.2 %. El resto de los fungicidas ejerció inhibición in vitro de 95.0 al 100 % (Cuadro 7; Figura 1 G) independientemente de sus concentraciones.
El crecimiento micelial de T. asperelloides fue inhibido por las diferentes concentraciones de todos los fungicidas. Los fungicidas Propineb, Tifluzamida (Figura 1 H) y Mancozeb redujeron el crecimiento micelial 54.9 a 80.0 %; la mezcla de Carboxin+Captan a la concentración de 100 ppm inhibió el crecimiento micelial en 23.2 %, pero la misma combinación de fungicidas a las concentraciones de 500, 1000 y 2000 ppm inhibió el crecimiento micelial un 100 % (Figura 1 I); resultados similares se observaron cuando se utilizaron el resto de los fungicidas a las mismas concentraciones, donde la inhibición del crecimiento micelial varió de 94.6 a 100 % (Cuadro 7).
Discusión
En el presente estudio Tifluzamida ejerció un mayor efecto in vitro sobre el crecimiento micelial de S. rolfsii sobre todo en la dosis de 0.1 y 0.01 ppm en las cinco concentraciones estudiadas; aun cuando no existen estudios de referencia sobre el efecto de este fungida sobre la inhibición in vitro del crecimiento micelial del hongo, estudios en China indicaron que el mismo fungicida tiene efecto preventivo contra la pudrición blanda en Dendrobium officinale (Yajun et al., 2018).
De igual manera, Propineb inhibió en un 41.1 % el crecimiento micelial del hongo, lo que coincide con estudios previos donde se utilizó la concentración de 100 ppm de dicho fungicida (Shirsole et al., 2019), el cual inhibió el 75.4 % del crecimiento micelial de S. rolfsii obtenido de garbanzo (Cicer arietinum) en la india; por otro lado, Vikram et al. (2023) evaluaron la misma molécula a 150 ppm, e inhibió 17.7 % el crecimiento micelial del hongo de plantas de trigo (Triticum spp.) en la india, lo cual contrasta con los resultados del presente estudio. Por otro lado, Mancozeb mostró inhibición del fitopatógeno un 75.0 % a la concentración de 100 ppm, lo que coincide con Shirsole et al. (2019) quienes encontraron que este fungicida inhibió el crecimiento del hongo en un 100 % a la misma concentración; mientras que Vikram et al. (2023) encontraron que el fungicida a 50 y 150 ppm, inhibió el crecimiento micelial del hongo en un 57 y 100 %, en forma respectiva. En cambio, Das et al. (2014) reportaron una inhibición de 20 % a 100 ppm, lo que contrastó con Chandra et al. (2020), quienes registraron que el mismo fungicida a 250 ppm inhibió 6.3 % del crecimiento micelial del hongo proveniente de plantas de tomate en la India. En este estudio la mezcla Carboxin+Captan inhibió totalmente a S. rolfsii a las concentraciones de 10 y 100 ppm, lo que contrastó con los resultados de Das et al. (2014), quienes determinaron que Carboxin en mezcla con Tiram, inhibió el crecimiento del hongo en un 86.4 y 100 %, respectivamente, a las mismas dosis, lo que podría deberse a una sinergia al combinar ambas moléculas.
Propiconazol ejerció efecto inhibitorio del hongo comparable con resultados consignados por Das et al. (2014) quienes evaluaron a 1, 10 y 100 ppm de dicha molécula, lo que inhibió en 27.2, 55.5 y 88.0 %, respectivamente, del crecimiento de S. rolfsii aislado de plantas de berenjena (Solanum melongena) en la India; resultados similares fueron obtenidos por Prasad et al. (2017) en la India, quienes encontraron que este mismo fungicida inhibió el 100 % del crecimiento micelial del hongo obtenido de plantas de tomate a la concentración de 150 ppm. Lo que contrasta con los resultados de Das et al. (2014) quienes indicaron que el fungicida no inhibió al crecimiento micelial del patógeno a 1, 10 y 50 ppm, pero si inhibió (19.4 %) a la concentración de 100 ppm, lo que coincide con los resultados del presente estudio donde el fungicida inhibió un 100 % a la concentración de 100 ppm.
Con relación a la producción de esclerocios por S. rolfsii en PDA, Tifluzamida, Procloraz, Propineb, Propiconazol, Carboxin+Captan y Mancozeb inhibieron la formación de esclerocios a la concentración de 100 ppm, lo cual contrastó con los fungicidas del grupo de los Benzimidazoles (Tiabendazol y Tiofanato de metilo). Estudios previos indican que el Tiabendazol a la concentración de 4,000 inhibió la formación de esclerocios de S. rolfsii obtenidos de plantas de cebolla (Allium cepa), chile (Capsicum annuum), tomate y cebada (Hordeum vulgare) (Pérez-Moreno et al., 2009), lo que coincide los resultados con esta investigación ya que la disminución en la formación de esclerocios estuvo relacionada con el incremento de las concentraciones del fungicida. Por otra parte, estudios adicionales indicaron que la evaluación in vitro de Mancozeb a 2,000 ppm redujo de 545 a 272 esclerocios de S. rolfsii obtenidos de plantas de berenjena en Bangladesh (Siddique et al., 2016), dichos resultados contrastan con lo obtenido en el presente estudio, ya que a 100 ppm se inhibió completamente la producción de esclerocios, lo cual indica variabilidad en la sensibilidad del hongo a esta molécula. Los resultados del presente estudio sugieren que Tifluzamida, Procloraz, Propineb, Propiconazol, Carboxin+Captan y Mancozeb pueden reducir la producción de esclerocios in vitro, lo que indica que estos fungicidas muestran potencial para la disminución de dichas estructuras en campo.
Los fungicidas, Propineb, Tifluzamida y Mancozeb mostraron el menor efecto en el crecimiento micelial de T. azevedoi, T. afroharzianum, T. asperellum y T. asperelloides, con respuesta diferencial de estas especies a los fungicidas y a sus respectivas concentraciones. En general, T. azevedoi y T. afroharzianum mostraron el menor efecto inhibitorio por las diferentes concentraciones de Propineb. Estos resultados concuerdan con los señalados por Manandhar et al. (2020), quienes, en Nepal, determinaron que T. harzianum y el aislado T22 in vitro a 100 ppm no se inhibieron por Propineb, mientras que T. asperellum, T. viride y el aislado T69 fueron inhibidos en un 13.1, 28.7 y 0.8 %, respectivamente; estos aislados se obtuvieron de la rizosfera de hortalizas en Nepal. Estos mismos autores registraron que Mancozeb a 100 ppm inhibió un 10.8, 16.2, 28.3, 31.2 y
46.6 %, a T. harzianum, T. viride, T. asperellum, T22 y T69, respectivamente, lo que contrasta con los hallazgos de González et al. (2020), quienes registraron que Trichoderma reesei no fue inhibido a 100 ppm.
En el presente estudio Propiconazol inhibió el 100 % del crecimiento micelial de las cepas de Trichoderma a concentración de 100 ppm. En contraste, Zapata et al. (2023), encontraron que después de cinco días del inicio del estudio, el mismo fungicida a 1.25 mL L-1 inhibió 31 % el crecimiento micelial de T. koningiopsis (Tri-cotec® WG en Colombia). Esto mismos autores registraron que Fluazinam inhibió 39.6 % a las dosis de 1 mL L-1, lo que contrasta con lo obtenido en este estudio, ya que la inhibición del crecimiento micelial de las cuatro especies de Trichoderma varió de 88.9 a 98.5 %. También registraron que Procloraz y el Tiabendazol inhibieron completamente el crecimiento micelial, lo cual también coincide con nuestros resultados.
La diferencia en la sensibilidad de los aislados de S. rolfsii y las especies de Trichoderma a los diferentes fungicidas evaluadas en este estudio y comparadas con otros trabajos de investigación podría deberse al uso constante de los fungicidas en los diferentes cultivos, donde la exposición del hongo a estos productos varía de acuerdo a manejo agronómico de la especie vegetal y a través del tiempo el hongo se adapta a altas dosis de fungicidas sintéticos, para el manejo de la enfermedad (Pérez-Moreno et al., 2009; Chaparro et al., 2011).
Los resultados del presente estudio abren nuevas líneas de investigación relacionadas con estudios de efectividad de los fungicidas a nivel de invernadero y campo; en este sentido, se debe determinar la efectividad de las moléculas que resultaron eficientes en la inhibición in vitro de S. rolfsii. También se debe de evaluar la etapa fenológica del cultivo más adecuada, así como la concentración y el número de aplicaciones para el manejo en campo de S. rolfsii causante de la pudrición blanda del tubérculo de papa.
La combinación de las especies de Trichoderma con los fungicidas Propineb y Tifluzamida y el efecto in vitro de éstos contra S. rolfsii representa una opción para el productor en el control de la pudrición blanda del tubérculo de papa. Este enfoque se ha practicado para el control de esta enfermedad en el cultivo de papa (Rubayet y Bhuiyan, 2016). Futuros proyectos deberían de orientarse hacia la disminución de la concentración de los fungicidas al mezclarse con especies antagónicas de Trichoderma, con el objetivo de reducir la contaminación del medio ambiente y sobre todo la de los tubérculos.
Conclusiones
Los resultados indican que Thifluzamide (0.01 ppm) inhibió de manera más eficiente el crecimiento micelial de S. rolfsii (32.7%) que Propineb (12.2%). Ambos fungicidas disminuyeron la producción de esclerocios por del patógeno (157-164 esclerocios/caja Petri), mientras que la media dicha estructura de dicha estructura de resistencia fue de 182 esclerocios por caja Petri. En Trichoderma spp., Propineb (100 ppm) sólo afectó a T. asperelloides (54.9% de inhibición del crecimiento micelial), mientras Thifluzamide mostró efectos variables (0-63%), confirmando su compatibilidad con las especies de Trichoderma. Estos hallazgos sugieren que: 1) Thifluzamide es más efectivo contra S. rolfsii, pero requiere combinarse con otras estrategias para reducir la formación de esclerocios; 2) Ambos fungicidas pueden integrarse con Trichoderma en programas de manejo integrado, al mostrar baja toxicidad sobre Trichoderma spp.; 3) La selectividad de los fungicidas varía según la cepa de Trichoderma, destacando la necesidad de evaluaciones específicas. Se recomienda optimizar dosis y formulaciones para mejorar el control de S. rolfsii sin comprometer los agentes de biocontrol, priorizando esquemas que combinen ambos enfoques para un manejo sostenible.











 texto en
texto en 


