La roya del cafeto es una enfermedad causada por el basidiomiceto Hemileia vastatrix (Uredinales: Pucciniaceae). Desde el 2012 esta enfermedad se catalogó como destructiva en Centroamérica ya que afectó del 30 al 100% de la producción de los cafetales (Henderson, 2020). En México la roya se encuentra presente en toda el área sembrada con variedades susceptibles, y se ha registrado una disminución en la producción de café cereza desde el 2012, cuando se obtuvieron 1 336 882 t, comparado con el 2018 con una producción de 835 380 t (SAGARPA-SENASICA 2016; SAGARPA-SIAP 2018).
El ciclo de la roya inicia por la deposición y germinación de uredosporas en las hojas; la infección depende de varios factores ambientales y fisiológicos de la planta, pero los principales son la cantidad de lluvia, la temperatura, la edad de las hojas y la carga de inóculo (Nutman y Roberts, 1963). Las uredosporas son dispersadas dentro de una plantación a través del viento o por salpique del agua de lluvia (Nutman y Roberts, 1963; Rayner 1961; Arroyo et al., 2018). La roya reduce la capacidad fotosintética de la planta y el desarrollo de los nuevos brotes en el siguiente ciclo de cultivo. La severidad alta de un año afectará directamente el nivel de producción del siguiente, provocando una reducción paulatina del crecimiento, que inicia con defoliaciones y posteriormente con muerte progresiva de brotes y ramas (CABI, 2018).
Una alternativa para el manejo de la roya es la resistencia genética de las variedades. El híbrido Catimor y la variedad Robusta han demostrado ser más tolerantes contra la enfermedad a diferencia de la variedad Arábiga; sin embargo, la tolerancia es raramente efectiva contra todas las razas del patógeno (CABI, 2018). Independientemente de la variedad, para prevenir o controlar esta enfermedad se utiliza con frecuencia la aplicación de fungicidas a base de compuestos de cobre (Haddad et al., 2009; Loland y Singh, 2004); sin embargo, éstos pueden ocasionar problemas al ecosistema ya que el cobre se acumula en el suelo y genera toxicidad en las cadenas tróficas al acumularse en altas concentraciones (Loland y Singh, 2004). Aplicaciones aisladas y tardías, cercanas a la época de cosecha o después de la misma, son ineficientes para el control (Martínez et al., 2013). También se recomiendan aplicaciones de algunos fungicidas sistémicos (Martínez et al., 2013); no obstante, estos productos no son selectivos y afectan a hongos entomopatógenos, como Lecanicillium lecanii (Hypocreales: Cordycipitaceae), que ayuda a reducir las poblaciones plaga del cafeto, como la escama verde (Coccus viridis, Hemiptera: coccidae) (Jackson et al., 2012).
Una alternativa ambientalmente amigable recomendada para el manejo de cualquier enfermedad es el uso de agentes de control biológico. En este sentido, existen insectos micófagos como las larvas del género Mycodiplosis (Diptera: Cecidomyiidae) (Kiel, 2014), que se alimentan de royas (Basidiomycota: Pucciniales) o cenicillas (Erysiphales) (Holz, 1970). Se desconoce el número de especies de Mycodiplosis que se alimentan de esporas de roya, así como su frecuencia y distribución, ya que hay pocos estudios que han examinado la relación entre Mycodiplosis y los hongos de los que se alimentan (Kiel, 2014). Se cree que M. hemileiae es un agente de control biológico potencial de H. vastatrix en Latinoamérica y el Caribe (Hajian-Forooshani et al., 2016). Kaushal et al. (2001) sugieren que la relación ayuda a las plantas hospedantes, ya que la larva reduce la cantidad de esporas del hongo; sin embargo, Kluth et al. (2001) sugiere que los dípteros podrían servir como dispersores del hongo en la planta. Por lo anterior, los objetivos de la presente investigación fueron: 1) Describir en tres diferentes sistemas de manejo del cultivo, el tipo de relación entre la roya del cafeto (H. vastatrix) y Mycodiplosis spp. y 2) Conocer el patrón de distribución de Mycodiplosis spp. y de H. vastatrix en el dosel de la planta.
Materiales Y Métodos
Sitio de muestreo. La investigación se realizó en el municipio de Xochitlán de Vicente Suárez, Puebla, México; en parcelas con plantas de cafeto (Coffea arabiga) de diversas variedades (Costa Rica 95, Caturra, Colombiana y Borbón) y edades (10 a 35 años). Se seleccionaron tres parcelas, la primera se ubicó en la localidad de Santa Lucia (19° 58’ 17” N; 97° 38’ 05” O), a 964 metros sobre el nivel del mar (msnm). La segunda se ubicó en Cuetzinapan (19° 58’ 39” N; 97° 3’ 08” O) a 930 msnm, y la tercera se ubicó en San Bernardino (19° 58’ 44” N; 97° 38’ 26” O) a 903 msnm. En Santa Lucía se realizaron siete aplicaciones de fungicidas de contacto (oxicloruro de cobre y sulfato de cobre pentahidratado), seis de fungicidas sistémicos (Ciproconazol, Epoxiconazol, Flutriazol y Azoxistrobin+Ciproconazol), dos fertilizaciones foliares y cuatro fertilizaciones de nitrógeno al suelo. En Cuetzinapan solo se realizaron seis aplicaciones de fungicidas de contacto (oxicloruro de cobre y sulfato de cobre pentahidratado), tres de fungicidas sistémicos (Ciproconazol, Epoxiconazol y Azoxistrobin+Ciproconazol), una fertilización foliar y tres fertilizaciones de nitrógeno al suelo. En San Bernardino no se realizaron aplicaciones de fungicidas y se hizo una fertilización foliar y tres fertilizaciones de nitrógeno al suelo. En todos los sitios se hicieron podas fitosanitarias y de formación.
Identificación molecular de Mycodiplosis. La identificación se realizó mediante el análisis molecular de secuencias del gen mitocondrial COI, ya que para la caracterización taxonómica a especie es necesario describir morfológicamente a machos adultos (Henk et al., 2011) y su recolección en campo es complicada. Por lo tanto, en cada parcela seleccionada se recolectaron cinco larvas del primer al tercer instar en cada planta de cafeto evaluada para severidad. En total se recolectaron 125 larvas por parcela, las cuales se colocaron en frascos con etanol al 70%, se etiquetaron y se transportaron al laboratorio del Colegio de Postgraduados, campus Montecillo en Texcoco, estado de México.
La extracción de ADN total se hizo con 30 larvas de cada sitio muestreado. Las larvas se enjuagaron tres veces en agua destilada estéril para eliminar el exceso de etanol y posteriormente se transfirieron en un tubo eppendorf que contenía CTAB al 2% + 1% de 2-Mercaptoetanol; se maceraron con ayuda de un micropistilo y se incubaron con proteinasa K al 10% durante 1 hora a 65 °C. La separación de fases se realizó con cloroformo: alcohol isoamílico (24:1) y centrifugación durante 15 minutos a 13000 rpm. Para la precipitación, se colocó a la fase recuperada 1V de etanol al 100% y se colocó por 30 minutos a -20 °C. Posteriormente se centrifugó durante 15 min a 13000 rpm para recuperar la pastilla, la cual fue disuelta en 30 µL de agua HPLC. La concentración e integridad del ADN se corroboró en un Nanodrop. Para la PCR (Polymerase Chain Reaction) se utilizaron los primers (HCO y LCO) y condiciones de amplificación descritos por Vrijenhoek (1994), estos amplifican una región de ⁓710 pares de bases del gen mitocondrial citocromo C oxidasa subunidad I (COI). Los productos de PCR del peso esperado, se purificaron con el kit Wizard® y se enviaron a secuenciar a Macrogen® (Seul, Corea). Las secuencias se limpiaron con el programa BioEdit, y se compararon con la base de datos disponibles en el GenBank. La mejor secuencia se subió en este sistema para obtener el número de acceso.
Evaluación de la severidad por roya. En cada parcela se realizó un muestreo en cinco de oros y se marcaron cinco plantas por punto, para tener 25 plantas en total. El dosel de la planta se dividió en tres estratos: bajo (< 40 cm), medio (41-80 cm) y alto (>80 cm); se eligieron aleatoriamente tres hojas de cada estrato y se evaluaron individualmente con la escala desarrollada por DGSV-SINAVEF-LANREF (2016) con modificaciones, donde 0= hoja sana sin pústulas, 1= 0.5-1% de cobertura con pústulas (más de un punto clorótico en la hoja), 2= 1-5%, 3= 6-20%, 4= 21-50% y 5 >50%. En total se hicieron seis evaluaciones que iniciaron en julio de 2017 y finalizaron en enero 2019.
Evaluación del número de larvas de Mycodiplosis. Se realizó en las mismas plantas y hojas seleccionadas para evaluar la severidad ocasionada por roya. De cada hoja seleccionada previamente se contabilizó y registró el número de larvas de Mycodiplosis por hoja, para tener en total tres mediciones por estrato y nueve por planta marcada. Las evaluaciones se hicieron simultáneamente con la medición de severidad por roya.
Análisis estadístico y determinación de la relación entre severidad y número de larvas. Se realizó una comparación de medias a través de la prueba no paramétrica Kruskal Wallis entre los tres sitios de muestreo, se utilizaron los datos de severidad de roya y el número de larvas de Mycodiplosis evaluados en los tres estratos de la planta (bajo, medio y alto). Se consideró una confiabilidad del 95% y un alfa del 0.05%. También se realizó un análisis de correlación de spearman entre los datos de severidad de roya y Mycodiplosis para identificar si existe una tendencia entre el grado de infección y el número de larvas por cada estrato de la planta (bajo, medio y alto). Los datos se analizaron por sitios de muestreo, mediante el programa JMP 11.0 de SAS.
Resultados Y Discusión
Identificación de Mycodiplosis. La secuencia consenso obtenida se registró en la base de datos del GenBank (número de acceso MK986689) y al compararla con otras secuencias se obtuvo un 95% de similitud con ejemplares de la familia Cecidomyiidae. Existe poca información disponible en las bases de datos sobre especies de Mycodiplosis y en general, es un género poco estudiado. Los miembros de este género son descritos por la morfología de los machos adultos. Existen 49 especies descritas y depositadas en el Museo Nacional de Historia Natural de Jamaica y Estados Unidos de América. Se cree que puede haber un grado de especialización entre las especies de Mycodiplosis y las especies de las cuales se alimentan; aunque se han encontrado a una misma especie alimentándose de diversas especies de royas, como M. rubida que fue descrita en Uromyces pisi (Pucciniales: pucciniaceae) y Puccinia sp. (Pucciniales: pucciniaceae). El grado de especialización entre las especies de Mycodiplosis es incierto (Nelsen, 2013).
El análisis filogenético de este género realizado en el 2013 se hizo con larvas provenientes de 261 colecciones de plantas herborizadas e infectadas por hongos, en este análisis no se contempló a alguna planta de cafeto infectada con Hemileia vastatrix, (Nelsen, 2013). Es necesario hacer investigación más profunda al respecto para poder describir la o las especies micófagas involucradas.
Evaluación de severidad por roya y número de larvas de Mycodiplosis. El clima de Xochitlán de Vicente Suárez está clasificado como Cfa (subtropical húmedo), con temperatura promedio de 19.8 °C y precipitaciones anuales alrededor de 3 293 mm (SMN-CNA, 2018), condiciones que favorecen el desarrollo de roya, ya que la enfermedad es más severa en cafetales ubicados en altitudes menores de 1500 msnm, en temperaturas cálidas y con periodos de humedad prolongados (CABI, 2018); por lo que durante la presente investigación siempre hubo prevalencia de la enfermedad en los sitios seleccionados.
En Santa Lucia y Cuetzinapan se realizaron aplicaciones de fungicidas sistémicos y de contacto, a diferencia de San Bernardo donde no se hicieron aplicaciones. Los datos demuestran que las aplicaciones mantuvieron la severidad de la roya en niveles más bajos que en donde no se realizó un control químico. Los fungicidas actúan directamente sobre la intensidad de esporulación y limitan las áreas con uredosporas (Merle et al., 2019). No obstante, la fluctuación de la severidad fue mayor en Santa Lucia y Cuetizapan a diferencia de San Bernando, en donde se mantuvo estable (Figura 1). Además, se encontró que la severidad por roya en Cuetzinapan fue similar a la de Santa Lucía, aunque se realizaron menos aplicaciones de fungicidas y menos fertilizaciones; indicando que el número de aplicaciones de fungicidas podría reducirse sin reducir la efectividad del control.
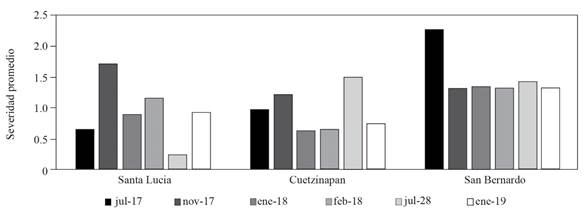
Figura 1 Severidad de la roya del cafeto (Hemileia vastatrix) en tres localidades y seis fechas de muestreo en el municipio de Xochitlán de Vicente Suárez, Puebla.
Referente a Mycodiplosis, también se observó presencia de larvas en todas las evaluaciones realizadas, y el sitio con mayor densidad poblacional fue San Bernardo mientras que Cuetzinapan y Santa Lucía fueron similares (Figura 2). Dado que las larvas de este díptero se alimentan de las uredosporas, parece que entre mayor disponibilidad haya de las mismas habrá una mayor cantidad de larvas. Sin embargo, se necesita mayor evidencia para determinar si la respuesta funcional que tienen las larvas ante la fluctuación de uredosporas es no linear (Davies, 2007).
Severidad y número de larvas. Con el análisis de Kruskall-Wallis se encontraron diferencias significativas entre los sitios de muestreo, tanto en severidad (p<.0001) como en número de larvas (p<.0001) (Cuadro 1). La parcela ubicada en San Bernardo tuvo la mayor severidad y número de larvas, mientras que la ubicada en Cuetzinapan tuvo la menor severidad y número de larvas (Figura 2 y 3); esto debido a las aplicaciones de fungicidas que ayudaron a disminuir la severidad de la roya y, por tanto, hubo menor disponibilidad de alimento para las larvas. Resultados similares fueron reportados por Merle y colaboradores (2019) quienes demostraron que en sitios donde había más roya, su enemigo natural (Lecanicillium lecanii) también fue más abundante.
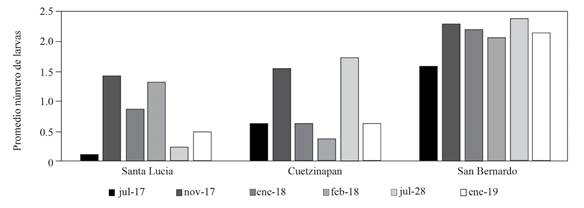
Figura 2. Fluctuación poblacional de Mycodiplosis spp. en tres localidades y seis fechas de muestreo en el municipio de Xochitlán de Vicente Suárez, Puebla.
Suponemos que en todos los sitios la población del díptero ayuda a disminuir las poblaciones de Hemileia vastatrix, al alimentarse de las uredosporas, lo que podría retrasar el inicio de la infección o contribuir a reducir las infecciones iniciales (Nutman y Roberts, 1963). Sin embargo, dado que el nivel de severidad es elevado, se tendría que explorar si una opción de manejo eficaz es el control biológico inundativo.
Cuadro 1 Comparación entre las medias de la severidad y número de larvas (Mycodiplosis spp.) de acuerdo al estrato de la planta y el sitio de muestreo en el municipio de Xochitlán de Vicente Suárez, Puebla.
| Sitio | ||||||||
|---|---|---|---|---|---|---|---|---|
| Santa Lucia | Cuetzinapan | San Bernardo | ||||||
| Media | DE | Media | DE | Media | DE | X2, p | ||
| Severidad | Bajo | 0.95 | 1.19 | 0.97 | 1.24 | 1.49 | 1.58 | 28.89, <0.001 |
| Medio | 1.13 | 1.32 | 0.97 | 1.19 | 1.52 | 1.52 | 34.59, <0.001 | |
| Alto | 0.83 | 1.11 | 0.82 | 1.18 | 1.42 | 1.42 | 49.67, <0.001 | |
| Larvas | Bajo | 0.78 | 1.46 | 0.69 | 1.3 | 2.09 | 2.09 | 93.29, <0.001 |
| Medio | 0.91 | 1.79 | 0.9 | 2.24 | 2.11 | 2.11 | 105.9, <0.001 | |
| Alto | 0.72 | 1.25 | 0.68 | 1.31 | 2.32 | 2.32 | 121.6, <0.001 | |
X 2 derivada de una Prueba Wilcoxon y Kruskall Wallis, DE= Desviación Estándar.
La comparación de medias realizada con los datos de severidad de roya por estrato de la planta (bajo, medio y alto) demostró diferencias significativas (p<0.001). Se determinó que la severidad en el estrato medio es mayor respecto al estrato bajo y alto (Cuadro 2). Esto puede deberse a varios factores, como la disposición de tejido vegetal, la cantidad de luz/sombra y el genotipo y edad de la planta. En general, el estrato medio tiene mayor cantidad de tejido vegetal, mientras que el estrato superior está compuesto de tejido nuevo o en formación y el inferior tiene menor número de ramas. La sombra es diferente en los estratos de la planta y se conoce que tiene efectos antagónicos en la colonización y esporulación de la roya (Toniutti et al., 2017). Además, en genotipos susceptibles, el número de apresorios del hongo disminuye conforme se incrementa la edad de las hojas, mientras en que los genotipos resistentes hay más apresorios en hojas jóvenes y viejas (Coutinho et al., 1994).
Cuadro 2 Distribución de la severidad y número de larvas (Mycodiplosis spp.) según el estrato de las plantas de cafeto muestreadas en el municipio de Xochitlán de Vicente Suárez, Puebla.
| Bajo | Medio | Alto | |||||
|---|---|---|---|---|---|---|---|
| Media | DE | Media | DE | Media | DE | X2, p | |
| Severidad | 1.14 | 1.37 | 1.21 | 1.35 | 1.02 | 1.31 | 18.00, <0.001 |
| No. Larvas | 1.19 | 2.1 | 1.31 | 2.4 | 1.24 | 2.2 | 2.62, 0.2686 |
X 2 derivada de una Prueba Wilcoxon y Kruskall Wallis, DE= Desviación Estándar.
No se encontraron diferencias significativas (p=0.2686) en la distribución de Mycodiplosis en los estratos de la planta (Cuadro 2). Merle y colaboradores (2019) encontraron que en los estratos de plantas de cafeto el área con uredosporas fue similar bajo sombra o en zonas con exposición al sol, lo que refuerza los resultados obtenidos en esta investigación, ya que la larva tuvo la misma disponibilidad de alimento en los tres estratos y por tanto su distribución fue similar.
Correlación entre Mycodiplosis y severidad de roya. Se identificó una correlación positiva en todos los sitios y estratos entre la severidad de la roya y el número de larvas de Mycodiplosis (Cuadro 3). En San Bernardo hubo una tendencia positiva muy clara, donde a mayor severidad presentó un mayor número de larvas (Figura 3). En general, para todos los sitios, el estrato alto mostró tener una mayor correlación. En San Bernardo no se realizaron aplicaciones de fungicidas, lo que permitió una mejor asociación entre la roya y Mycodiplosis. Los fungicidas a base de cobre no solo afectan directamente a la roya, sino también a los enemigos naturales y a la fenología de la planta hospedera (Brinate et al., 2015).
En diversos experimentos se han econtrado correlaciones positivas entre hospedantes/presas y parásitos/depredadores, similares a las observadas en este trabajo; tal es el caso de los diferentes estados del ciclo del coccinelido micófago Illeis cincta y la severidad causada por cenicilla (Oidium sp.) en girasol (Helianthus annuus) (Jagadish et al., 2017); o de la disponibilidad de células de la larva Trichoplusia ni y la multiplicación del virus entomopatógeno Autographa californica multicapsid nucleopolyhedrovirus (AcMNPV) (Tseng y Myers, 2014).
Cuadro 3. Correlación entre la severidad de la roya y número de larvas (Mycodiplosis spp.) según el estrato de la planta y el sitio de muestreo en el municipio de Xochitlán de Vicente Suárez, Puebla.
| Santa Lucia | Cuetzinapan | San Bernardo | |
|---|---|---|---|
| r*, p | r*, p | r*, p | |
| Bajo | 0.4016 | 0.3197 | 0.5054 |
| p=.000 | p=.000 | p=.000 | |
| Medio | 0.4194 | 0.3290 | 0.4943 |
| p=.000 | p=.000 | p=.000 | |
| Alto | 0.4198 | 0.4225 | 0.5287 |
| p=.000 | p=.000 | p=.000 | |
*Correlación de Spearman.
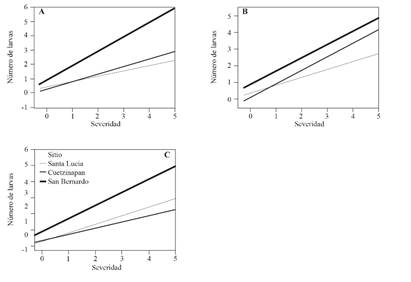
Figura 3. Relación entre el número de larvas de Mycodiplosis spp. y la severidad de roya (H. vatatrix) en el estrato alto (A), medio (B) y bajo (C) de las plantas de cafeto muestreadas en el municipio de Xochitlán de Vicente Suárez, Puebla.
En la presente investigación la correlación positiva entre Mycodiplosis y la severidad de Roya puede ser analizada desde dos perspectivas: la roya como un agente patógeno del cafeto que depende de la disponibilidad de tejido vegetal y Mycodiplosis como un agente biocontrolador (depredador) de la roya, que depende del número de uredosporas disponibles (presas).
Se ha observado en varios patosistemas que el desarrollo del parásito puede ser beneficiado o afectado negativamente por las condiciones generales del hospedante. En algunos casos, si el hospedante es de “baja calidad” y no tiene las condiciones idóneas, bióticas y abióticas para su desarrollo, el parásito podrá infectarlo fácilmente y se reproducirá más, generando que la población del huésped continúe bajo condiciones no idóneas, haciéndolo cada vez más susceptible y por lo tanto con mejor desarrollo del patógeno (Beldomenico y Begon, 2009); sin embargo, también se ha visto que un hospedante bien nutrido y que proporcione mayor cantidad de alimento favorecerá el desarrollo del parásito y hará que este tenga mayor descendencia (Tseng y Myers, 2014).
Por otro lado, se sabe que las poblaciones de presas y depredadores oscilan debido a su interacción, y en este trabajo se encontró siempre una correlación positiva entre la severidad de roya (presas) y el número de larvas (depredadores), lo que supone una regulación mutua entre estas poblaciones; sin embargo, la población de roya varía por razones distintas de las presiones de depredación de la larva, por lo que es difícil determinar si los cambios en la población de roya están o no relacionados directamente con los cambios de densidad de la población de su depredador (Mycodiplosis). Por lo tanto, se puede inferir que la población del díptero tiene potencial para reducir el crecimiento de la población de roya (Davies, 2007).
La interacción Cafeto-Roya-Mycodiplosis es evidentemente más compleja que lo descrito en el presente trabajo; la severidad de la roya es posiblemente determinada por el nivel de desarrollo y susceptibilidad del cultivo y dado que la población de Mycodiplosis es dependiente de la severidad de roya (correlación positiva), la población del díptero aumentará si hay mayor disponibilidad de uredosporas. Una severidad alta de la roya afecta directamente el potencial de producción del café del siguiente ciclo, provocando un decrecimiento paulatino, que iniciará con defoliaciones y posteriormente con muerte progresiva de brotes y ramas (CABI, 2018); no obstante, es posible que el díptero, al estar consumiendo las uredosporas, ayude a mantener en equilibrio los niveles de roya del siguiente ciclo, evitando que la producción disminuya notablemente.
Aunado a esto, otros factores bióticos que podrían hacer más compleja la interacción, como la presencia de Lecanicillium lecanii, otro agente biocontrolador, o la hormiga arbórea Azteca sericeasur (hymenoptera: formicidae) que podría alimentarse del díptero evitando un eficiente control de la roya (Hajian-Forooshani et al., 2016; Vandermeer et al., 2016). Sin embargo, la distribución de A. sericeasur en México es poco conocida (Vásquez-Bolaños, 2011) y al parecer solo se ha reportado en el sureste del país (Hajian-Forooshani et al., 2016; Vandermeer et al., 2016).
Durante la presente investigación se observó en diversas ocasiones que las larvas del díptero se movilizaban dentro de las pústulas alimentándose de las uredosporas, por lo que éstas se encontraban no solo en su tracto digestivo, sino también sobre su tegumento. Hasta ahora se desconoce si esto es suficiente para que el insecto actúe como diseminador de la roya en la misma hoja y contribuya a aumentar la severidad en la planta. Es evidente la necesidad de realizar más investigaciones sobre el ciclo de vida de la larva para poder comprender mejor su función y relación con H. vastatrix.
Conclusiones
La distribución de roya (H. vastatrix) en el dosel de los tres escenarios de manejo del cultivo, fue mayor en el estrato medio de la planta, y la distribución de Mycodiplosis spp. es similar en los tres estratos de la planta. Existe una correlación positiva entre la severidad ocasionada por la roya del cafeto (H. vastatrix) y el número de larvas de Mycodiplosis spp., que es favorecida al no usar fungicidas.











 texto en
texto en 


