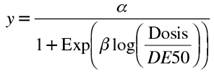En México, la superficie cultivada de fresa (Fragaria × ananassa) supera las 10,000 ha. De esta superficie, cerca del 60 % se encuentra en el estado de Michoacán (SIAP, 2016). Entre los factores fitopatológicos que más impactan en la producción de fresa, se encuentra la antracnosis del fruto, la cual se ha asociado principalmente a la especie Colletotrichum acutatum (Turecheck et al., 2006) especialmente en los sistemas de producción en campo abierto y de nivel tecnológico medio a bajo y en las áreas del cultivo expuesta a la lluvia en los sistemas protegidos, en la cual se favorece la dispersión de conidios por salpique a partir de fuentes de infección primaria y de planta a planta (Smith, 2008).
El manejo de la enfermedad, se basa principalmente en el establecimiento de plantas libres del patógeno (Smith, 2008; Freeman, 2008), la eliminación de plantas y frutos con síntomas, residuos de plantas y remoción de hospedantes alternos (Freeman, 2008; Parikka y Lemmetty, 2009), variedades resistentes y control biológico (Wharton y Diéguez-Uribeondo, 2004; Hammerschlag et al., 2006). Aunque entre los fungicidas usados con frecuencia se encuentran los de efecto preventivo como captan, thiram y diferentes formulaciones a base de cobre, aquellos de modo de acción específica se aplican con frecuencia para el manejo de esta enfermedad, entre ellos el ciprodinil+fludioxonil, pyraclostrobin, azoxystrobin y metil tiofanato (Turechek et al., 2006; Wedge et al., 2007). El modo de acción específica y el uso frecuente de estos fungicida implican riesgo para el desarrollo de resistencia en los hongos por lo que deben ser utilizados bajo ciertos principios para un manejo efectivo de la resistencia como son la dosis correcta, número de aplicaciones, mezclas del modo de acción, alternaciones y los tiempos o momentos de aplicación (van den Bosh et al., 2014). Al respecto, es esencial el monitoreo frecuente de la sensibilidad de las poblaciones de hongos y oomycetes en diferentes zonas a nivel regional o nacional a fin de determinar posibles cambios en la distribución de la sensibilidad originados por diferentes mecanismos y en su caso, tomar las medidas correspondientes para retardar, posponer o evitar el desarrollo de resistencia que resulte en pérdidas significativas en los cultivos por la reducción en la vida efectiva del fungicida (van den Bosh et al., 2014; Corio-Costet, 2015), enfoque que debe formar parte de una estrategia de manejo integrado de enfermedades (Hollomon, 2015).
Al ser C. acutatum uno de los agentes causales de antracnosis en varios cultivos y en especial en cítricos y fresa, conocer la sensibilidad a los fungicidas de mayor uso, permiten una mejor toma de decisiones en el diseño de estrategias de manejo integrado de la enfermedad. En cítricos Mondal et al. (2005) reportaron líneas base (previo al uso de los fungicidas) con DE50 entre 0.09 a 0.77 μg mL-1 y 0.01 a 0.034 μg mL-1 para azoxystrobin y pyraclostrobin respectivamente. Por otro lado, Forcelini et al. (2016) evaluó la resistencia de aislados de C. acutatum a fungicidas estrobilurinas o QoI (Inhibidores Externos de la Quinona) en el cultivo de fresa en Florida con base en crecimiento micelial y la longitud del tubo germinativo. Los valores de las DE50 para azoxystrobin resultaron en 0.22 μg mL-1 en aislados colectados de 1994 al 2011, mientras que para el pyraclostrobin la DE50 media resultó en 0.012 μg mL-1. Aislados obtenidos posteriormente con historial de uso de estos fungicidas mostraron insensibilidad con valores superiores a 10 μg mL-1 y 100 μg mL-1 para pyraclostrobin y azoxystrobin respectivamente. La secuenciación de gen del citocromo b confirmó que los aislados resistentes tuvieron las mutaciones G143A y F129L.
El grupo de fungicidas benzimidazoles, entre ellos en benomil, tiabendazol, carbendazim y metil tiofanato, son ampliamente usados en el cultivo de fresa en México desde hace más de 3 décadas. Asimismo, el grupo de las estrobilurinas, está en el mercado desde mediados de los años 90 y se encuentran registrados para su uso en este cultivo en México, por lo que el uso frecuente de estos ingredientes activos, podría resultar en falta de eficacia en campo. El objetivo de esta investigación fue determinar la sensibilidad de aislados de C. acutatum, obtenidos de fresa de los Valles de Maravatío y de Zamora en el estado de Michoacán, al metil tiofanato y al azoxystrobin con base en el crecimiento de micelio y germinación de conidios. Conocer el estado de la sensibilidad de C. acutatum, causante de la antracnosis de la fresa en dos de las principales zonas productoras de fresa en México permitirá ajustar los programas de manejo de la resistencia para posponer, retardar o evitar el desarrollo de este fenómeno y contribuir a un manejo más eficiente de la enfermedad.
Materiales y métodos
Colecta y obtención de aislados
En la temporada 2009 al 2011 se colectaron hojas, estolones y frutos con síntomas típicos de antracnosis en parcelas comerciales de fresa de las variedades Festival, Albión y Camino Real en los Valles de Maravatío y Zamora. A fin de capturar una mayor variabilidad en las muestras, se consideraron parcelas con una separación entre 1 a 3 km aproximadamente.
El ensayo de sensibilidad se llevó a cabo en el laboratorio de Fitopatología del Centro Regional Universitario Centro-Occidente (CRUCO) de la Universidad Autónoma Chapingo, en Morelia, Michoacán y la identificación molecular del patógeno se realizó en el Laboratorio de Biotecnología y Patología de Semillas del Postgrado en Recursos Genéticos y Productividad (PREGEP) del Colegio de Postgraduados en Montecillo, Estado de México.
Obtención de aislados monoconidiales
De los frutos, hojas o estolones con síntomas, se seleccionaron porciones de tejido de aproximadamente 2 cm del área del área de avance del síntoma, se lavaron con agua, se desinfestaron con una solución de hipoclorito de sodio al 1 % por 2 a 3 min y se enjuagaron con agua destilada estéril. Posteriormente se secaron en una cámara de flujo laminar y se sembraron en medio de cultivo papa-dextrosa-agar (PDA) (Difco, Becton, Dickinson and Company, Sparks, MD 21152, USA). A partir de los cultivos madre se obtuvieron cultivos monoconidiales mediante diluciones seriadas, los conidios se colocaron en agua-agar (AA) al 2 % y se incubaron por 10 a 18 h a temperatura del laboratorio. Posteriormente con una aguja de disección se extrajeron conidios individuales germinados y se pasaron a cajas de Petri con medio PDA. Estos aislados monospóricos (Cuadro 1) se almacenaron a 4 °C y fueron posteriormente usados en las pruebas de sensibilidad a fungicidas.
Identificación molecular
Para cada zona de muestreo, se seleccionaron 8 aislados monoconidiales del valle de Maravatío y 11 del valle de Zamora. La extracción de DNA se realizó de acuerdo al protocolo de Doyle y Doyle (1990) con ligeras modificaciones. Posteriormente por PCR se realizó la amplificación de la región ITS1, 5.8S e ITS2 del DNA ribosomal con los iniciadores ITS5/ITS4 (White et al., 1990) en un termociclador C1000 TouchTM Thermal Cycler (Bio-Rad, USA) con el siguiente programa: desnaturalización inicial de 95 °C por 4 min, seguido por 35 ciclos con 95° por 2 min, 55 °C por 1 min, 72 °C por 2 min y una extensión final a 72 °C por 2 min. Posteriormente, se realizó la limpieza de los productos de PCR con el kit de purificación QIAquick (Qiagen Inc., Chatsworth, CA, USA) de acuerdo a las instrucciones del fabricante. La secuenciación se realizó en Macrogen, (Maryland, USA). Las secuencias se editaron mediante el programa Bioedit Sequence Alignment Editor v.7.0.5 (Hall, 1999) y se crearon secuencias consenso. Estas secuencias se compararon con las secuencias depositadas en la base de datos del Genbank del National Center for Biotechnology Information (NCBI) mediante el programa BLASTNucleotide (Zhang et al., 2000) considerando el valor más alto de las comparaciones realizadas.
Aplicación de Fungicidas
Para los estudios, se usaron formulaciones comerciales de metil tiofanato del grupo químico benzimidazoles (Cercobin M®, BASF Mexicana, Zapopan, Jalisco), a una concentración de 70 % y el azoxystrobin de grupo químico inhibidores externos de la quinona (QoI), Amistar® a una concentración del 50 % de ingrediente activo (Syngenta Agro S.A de C.V. México, D.F.).
Preparación de soluciones madre y medio de cultivo enmendado
Se prepararon soluciones madre de cada uno de los fungicidas, con base en el ingrediente activo en agua destilada estéril. A partir de esta solución concentrada se hicieron diluciones seriales 1:10 para obtener las concentraciones deseadas en forma logarítmica. La solución con la concentración correspondiente de fungicida se adicionó al medio cuando este se enfrió a una temperatura entre 50 y 60 °C, agitando constantemente para un buen homogenizado y se vació inmediatamente en cajas de Petri, con un volumen de 15 mL.
Ensayo de crecimiento micelial
Se evaluaron 6 dosis de cada fungicida: 100, 10, 1, 0.1, 0.01 y 0.001 μg mL-1 para azoxystrobin y 2000, 1000, 100, 10, 1 y 0.1 μg mL-1 para metil tiofanato, más un testigo absoluto al que no se le agregó fungicida. Del margen de colonias activas de 6 días de crecimiento de cada uno de los aislados monoconidiales se obtuvieron discos de 0.5 cm de diámetro y se colocaron en el centro de cajas de Petri de 90 x 15 mm con medio de cultivo adicionado con el fungicida. Se realizaron 3 repeticiones (cajas de Petri) de cada dosis. Las cajas se incubaron en obscuridad a temperatura ambiente (20±4 °C) por 5 días. Transcurrido este tiempo se midió el diámetro de las colonias en dos direcciones en forma perpendicular y se obtuvo el promedio.
Ensayo de germinación de conidios
Se evaluaron las mismas 6 dosis de cada fungicida, más un testigo al que no se le agregó fungicida. Se consideraron tres repeticiones para cada dosis (cajas de Petri de 50 x15 mm). Se prepararon suspensiones monoconidiales a una concentración de 103 a 104 conidios mL-1. Estas suspensiones se sembraron en medio de cultivo AA al 2 % adicionado con fungicida, solo como superficie de germinación, preparado de la misma forma que en la fase de inhibición de crecimiento micelial. Se cuantificó el número de conidios germinados y no germinados en cada una de las repeticiones de una muestra al azar de 100 conidios, 6 horas después de la siembra. Un conidio, se consideró germinado, si la longitud del tubo germinativo fue 2 veces mayor al diámetro del conidio.
Estimación de la dosis efectiva 50 (DE50) y análisis de datos
De las 2 mediciones del diámetro de la colonia en los ensayos de crecimiento micelial se obtuvo el promedio, y después de las 3 repeticiones (cajas de Petri), la cual se usó para calcular el crecimiento o germinación relativa al testigo por cada dosis de fungicida y por cada aislamiento y se procedió al ajuste del modelo y estimación de las DE50 usando para ello el modelo log-logístico con asíntota superior con el procedimiento NLMIXED de SAS (Statistical Analysis System versión 9.3). El modelo se expresa como:
Donde y es el crecimiento relativo de micelio o la germinación relativa de conidios, α la asíntota superior (máximo valor posible de y), β es la pendiente en el punto de inflexión y DE50 es la dosis a la cual el crecimiento/germinación es reducido en 50 % (Schabenberguer y Pierce, 2001; Rebollar-Alviter et al., 2007). Debido a que no todos los valores de inicio resultaron en la convergencia para todos los aislados, se exploraron diferentes conjuntos de valores al inicio de las iteraciones a fin de alcanzar convergencia. El ajuste del modelo se comprobó considerando el patrón de residuales para cada uno de los aislados (Rebollar-Alviter et al., 2007). Una vez que se estimó la DE50 se realizó una análisis exploratorio de los datos, y las distribuciones de la sensibilidad se ilustraron con histogramas de frecuencias.
Previo a la estimación de los momentos estadísticos, se realizaron pruebas de normalidad sobre los datos originales y transformados a logaritmo base 10 los valores de las DE50. El momento estimado, mediciones de dispersión de estadística básica y parámetros de sesgo o desalineado y pruebas de normalidad se realizaron con el Proc univariate incluido en el sofware SAS (ver 9.3). Una vez que se exploró la distribución de la sensibilidad general de las 2 zonas productoras de fresa, los datos de cada zona se analizaron por separado, a fin de determinar diferencias significativas entre las distribuciones de cada valle productor de fresa en relación a la sensibilidad de los aislados de C. acutatum. Lo anterior, en virtud de que ambas zonas de producción podrían ejercer diferentes niveles de presión de selección al tener niveles tecnológicos contrastantes. Esta comparación se realizó con base en la prueba de Kolmogorov-Smirnov, a fin de probar si las distribuciones provenían de una sola población o de poblaciones diferentes usando el procedimiento NPAR1WAY (SAS ver 9.3).
Resultados y discusión
Identificación morfológica y molecular de aislados
Todos los aislados del patógeno asociado a los frutos con síntomas y daños de antracnosis obtenidos de las dos regiones productoras de fresa en Michoacán correspondieron a Colletotrichum acutatum. Los aislados, se caracterizaron por la formación de colonias de color blanco, con el centro gris oscuro, destacando la presencia de coloraciones anaranjadas concéntricas tanto en centro como en las márgenes. Los conidios fueron lisos, unicelulares, aseptados, fusiformes y de 10-14 x 4-6μm, similar a los reportados por Damm et al. (2012). Las secuencias obtenidas producto de la amplificación por PCR de la región comprendida en el Espacio Transcrito Interno (ITS) del rDNA de los 20 aislados tuvieron 99 % de identidad con las accesiones AM991131 y AY266405 depositadas en el GenBank del NCBI.
Estimación de las DE50
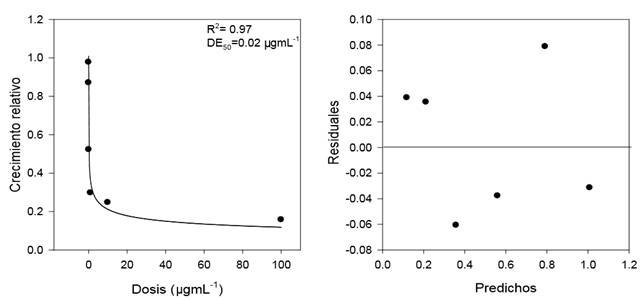
El modelo log-logístico describió adecuadamente los datos de dosis respuesta a los fungicidas usados en este estudio, para cada uno de los aislados usados. Un ejemplo de la estimación de la DE50 en el aislado Ms12 en respuesta al crecimiento micelial con el fungicida azoxystrobin se muestra en la Figura 1. Este modelo se ha encontrado útil para la estimación de DE50 en el estudio de resistencia a fungicidas y la detección del fenómeno de hormesis en estos compuestos (Schabenberger y Pierce, 2001; Rebollar-Alviter et al., 2007; Flores y Garzon, 2013).
Distribución de la sensibilidad de aislados de C. acutatum al metil tiofanato
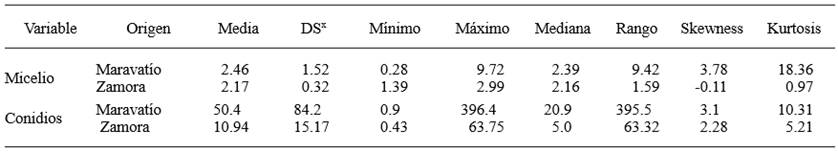
La sensibilidad de las aislados de C. acutatum al metil tiofanato, en etapa de micelio varió entre una dosis DE50 de 0.28 a 9.72 μg mL-1, con una mediana de 2.39 μg mL-1 para el valle de Maravatío, ajustándose a una distribución normal cuando se realizó la transformación de los datos al logaritmo base 10. Por su parte la distribución de la sensibilidad en Zamora se ajustó a una distribución normal y no requirió del uso de ningún tipo de transformación (Figura 2) con valores que variaron desde 1.39 a 2.99 μg mL-1, similar a los obtenidos en Maravatío. En el caso de conidios, las DE50 presentaron una distribución amplia desde 0.9 a 396.4 μg mL-1 con una mediana de 20.9 μg mL-1 para el Valle de Maravatío, mientras que para el Valle de Zamora se obtuvieron valores más bajos variando desde 0.43 a 63.32 μg mL-1 con una media 10.9 y una mediana de 5.0 μg mL-1 (Cuadro 2). Al respecto, no hubo diferencias significativas entre las distribuciones de la sensibilidad en ambos valles para el caso de micelio (Pr>Ksa=0.13), pero si para el caso de los conidios (Pr>Ksa=0.0004). Sin embargo, considerando el modo de acción del metil tiofanato, el crecimiento micelial es el proceso que refleja con mayor precisión la sensibilidad de los aislados, ya que el grupo de los benzimidazoles ejerce su acción al unirse a las subunidades de la proteína β-tubulina (TUB2), lo cual afecta el ensamble de los microtúbulos y por lo tanto, interfiere con procesos como la mitosis y formación del citoesqueleto que se manifiesta más directamente en la división celular (Ishii, 2012), mutaciones puntuales en este sitio, resultan en falta de eficacia en campo (Ma y Michailidis, 2005).
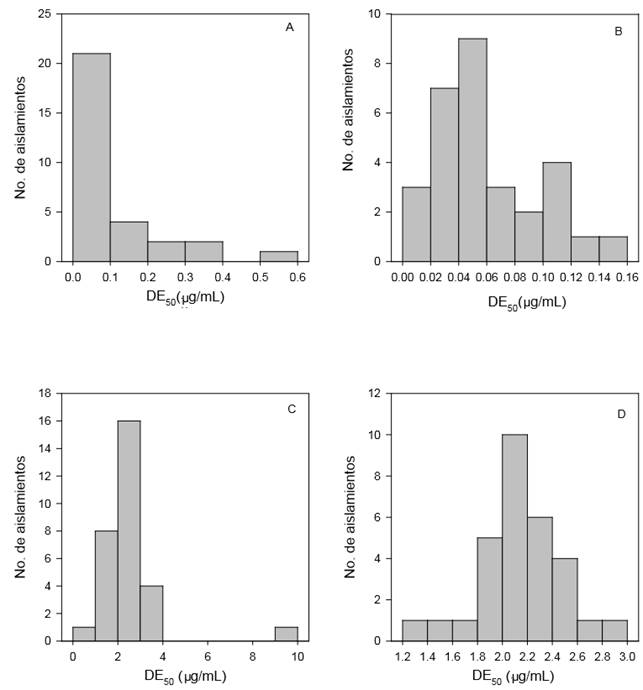
Figura 2. Distribución de la sensibilidad de Colletotrichum acutatum al fungicida azoxystrobin para la prueba de germinación de conidios. A= Valle de Maravatío, B= Valle de Zamora. Distribución de la sensibilidad al metil tiofanato (micelio), C= Valle de Maravatío, D= Valle de Zamora.
Cuadro 2. Estadística básica y momentos de los valores de DE50 (μg mL-1) para el fungicida metil tiofanato en micelio y conidios de Colletotrichum acutatum obtenidos de fresa en los Valles de Maravatío y Zamora, Michoacán.
xDesviación estándar.
Estudios realizado por Peres et al. (2004) en C. gloesporioides y C. acutatum obtenidos de cítricos, encontraron que para el caso del benomil (banzimidazol), los aislados de C. acutamum fueron moderadamente resistentes, pues el crecimiento de alrededor del 55 % se inhibió a una DE50= 0.1 μg mL-1 y de 80 % a DE50=1 μg mL-1, estos últimos aislados tuvieron mutaciones de punto en el gen TUB2. Chung et al. (2006), estudiando diferentes especies de Colletotrichum reportaron que en los aislados de C. acutatum se estimaron DE50 entre 1 y 10 μg mL-1 de metil tiofanato, siendo en general más resistentes que C. gloeosporioides. En el mismo sentido, Kim et al. (2007) reportaron DE50 entre 3.8 y 8.8 μg mL-1 en aislados de C. acutatum de chile con concentraciones de más de 100 μg mL-1, pero no encontraron mutaciones puntuales en el gen TUB2. Los resultados obtenidos en nuestro estudio indican que en los aislados de ambas zonas productoras de fresa con base en el crecimiento micelial, las DE50 no superaron los 3 μg mL-1, por lo que puede considerarse que las poblaciones de C. acutatum manifiestan una resistencia moderada a fungicidas benzimidazoles como el metil tiofanato, y muy probablemente al benomil, dado el mismo modo de acción como se ha demostrado previamente (Peres et al., 2004; Valero et al., 2010). Estos resultados sugieren la necesidad de implementar estrategias de manejo de resistencia a benzimidazoles en las zonas de estudio dada la estabilidad que se ha asociado en algunos hongos como Botrytis cinerea (Hollomon, 2015); entre ellas, el uso de mezclas o alternaciones con fungicidas de modo de acción diferente y evitar el uso con fines erradicantes (postdesarrollo de síntomas) (Brent and Derek, 2007).
Distribución de la sensibilidad de aislados de C. acutatum al azoxystrobin
La distribución de la sensibilidad al azoxystrobin de los aislados de C. acutatum, en micelio varió entre una DE50 de 0.04 a 0.36 μg mL-1 con una mediana de 0.12 μg mL-1 en el valle de Maravatío, mientras que en el valle de Zamora los valores de DE50 variaron desde 0.07 a 0.99 μg mL-1 con el mismo valor de la mediana. Para los conidios, las DE50 estimadas variaron entre 0.01 a 0.56 μg mL-1 y 0.006 a 0.15 con una mediana de 0.05 y 0.04 μg mL-1, para el valle de Maravatío y Zamora respectivamente (Cuadro 3; Figura 2). La transformación de los valores de DE50 a logaritmo base 10, normalizaron satisfactoriamente la curva de distribución excepto para las aislados de Zamora en la prueba de sensibilidad de micelio. La prueba de Kolmogorov-Smirnov, para la comparación de las dos distribuciones de la sensibilidad para conidios y para micelio no indicó diferencias significativas entre las zonas de estudio (Pr>Ks=0.58, para conidios; Pr>Ks=0.79 para micelio).
Cuadro 3. Estadística básica y momentos de los valores de DE50 (μg mL-1) para el fungicida azoxystrobin en micelio y conidios de Colletotrichum acutatum obtenidos de fresa en los Valles de Maravatío y Zamora.
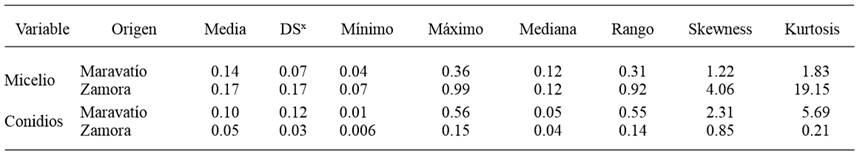
xDesviación estándar.
Mondal et al. (2005) reportaron valores base de DE50 de 0.09 a 0.99 con una media de 0.4 μg mL-1 de azoxistrobin para micelio de C. acutatum obtenidos de cítricos en Florida; con base en estos resultados seleccionaron una dosis discriminatoria de 1 ug mL-1. Posteriormente Forcelini et al. (2016), determinaron que la sensibilidad al azoxystrobin en aislados de C. acutatum obtenidos de fresa en Florida fue de 0.30 μg mL-1. De acuerdo con los autores, los aislados que mostraron inhibición hasta una DE50 =3 μg mL-1 se consideraron sensibles; hasta 100 μg mL-1, se consideraron moderadamente resistentes y superior a 100 μg mL-1, se consideraron completamente resistentes. Los aislados moderadamente resistentes se asociaron a las mutaciones de punto en el codón 129 del gen citocromo bc1 en el cual hay un cambio del aminoácido fenilalanina a leucina (F129L), mientras que en los aislados altamente resistentes, la mutación se asoció a un cambio del aminoácido glicina a alanina (G143A). Con base en estos estudios, es factibles concluir que todos los aislados probados en este estudio son sensibles al azoxystrobin, pues los datos no indican evidencias de resistencia en las dos zonas productoras de fresa estudiadas con base en la distribución de las ED50, a pesar de que este ingrediente activo y otras moléculas del mismo grupo han estado en el mercado en México por más de 10 años. Sin embargo, siendo un grupo considerado como de alto riesgo para la inducción de resistencia en hongos, es necesario la implementación de estrategias de manejo de resistencia (Hollomon, 2015) a fin de prevenir el un cambio en la distribución de la sensibilidad en el corto o mediano plazo. Esta implementación de estrategias de manejo de la resistencia debe tomar en cuenta principios generales que gobiernan el desarrollo de cepas resistentes (van den Bosch et al., 2014).
Conclusiones
La sensibilidad de las aislados de C. acutatum al metil tiofanato basado en micelio varió entre una DE50 de 0.28 a 9.72 μg mL-1 en el Valle de Maravatío y de 1.39 a 2.99 μg mL-1 en el Valle de Zamora, mientras que en conidios varió entre una DE50 de 0.9 a 396.4 μg mL-1 en el Valle de Maravatío y de 0.43 a 63.32 μg mL-1 en el Valle de Zamora.
Con respecto al azoxystrobin en micelio la DE50 varió entre 0.04 a 0.36 μg mL-1 en Maravatío y de 0.07 a 0.99 μg mL-1 en el Valle de Zamora. En conidios, la DE50 varió de 0.01 a 0.56 μg mL-1 para el Valle de Maravatío y 0.006 a 0.15 μg mL-1 para el Valle de Zamora.
Los datos obtenidos con base en la distribución de la sensibilidad (DE50) indican que los aislados de C. acutatum obtenidos del Valle de Maravatío y Zamora Michoacán mostraron resistencia moderada al metil tiofanato y sensibilidad completa al azoxystrobin. En ambos casos se hace necesaria la implementación de estrategias de manejo de la resistencia a fungicidas benzimidazoles y estrobilurinas.











 texto en
texto en