Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de fitopatología
versión On-line ISSN 2007-8080versión impresa ISSN 0185-3309
Rev. mex. fitopatol vol.25 no.1 Texcoco 2007
Artículos científicos
Control de Nacobbus aberrans (Thorne) Thorne y Allen con Pochonia chlamydosporia (Goddard) Gams y Zare
Control of Nacobbus aberrans (Thorne) Thorne and Allen with Pochonia chamydosporia (Goddard) Gams and Zare
Rosalinda Flores-Camacho1, Rosa Helena Manzanilla-López2,Ignacio Cid del Prado-Vera3 y Ángel Martínez-Garza3
1 Dirección General de Inspección Fitozoosanitaria, SENASICA, Municipio Libre 377, Piso 7-B, Col. Santa Cruz Atoyac. Del. Benito Juárez, México, D.F., CP 03310;
2 Biology of the Rhizosphere, Rothamsted Research, Harpenden, Herts, AL5 2JQ, UK;
3 Colegio de Postgraduados, km 36.5 Carr. México-Texcoco, Montecillo, Edo. de México CP 56230. Correspondencia: st.dgif@senasica.sagarpa.gob.mx.
Recibido: Febrero 23, 2003
Aceptado: Junio 24, 2003
Resumen
Se evaluaron cinco aislamientos mexicanos y uno brasileño del hongo Pochonia chlamydosporia como agentes de control biológico de tres poblaciones mexicanas de Nacobbus aberrans. Dos de las poblaciones del nematodo, procedentes de Montecillo (Estado de México) y Tecamachalco (Puebla), se evaluaron en jitomate (Lycopersicon esculentum) y otra de Zacatecas (Zacatecas) en frijol (Phaseolus vulgaris). Los experimentos se realizaron bajo condiciones controladas de temperatura (26°C), humedad relativa (80%) y fotoperíodo (14 h luz/10 h oscuridad) en una cámara de crecimiento. Todos los aislamientos del hongo ejercieron un alto porcentaje de parasitismo sobre las masas de huevos y huevos de N. aberrans por gramo de raíz, reduciendo el número de juveniles de segundo estadío del nematodo disponible como inóculo en el suelo. El número de agallas por sistema radical se redujo significativamente en la población Tecamachalco del nematodo. Los tratamientos con el aislamiento brasileño VC10 tuvieron el menor número de agallas. Los aislamientos mexicanos más eficientes en el control de N. aberrans fueron SMB3 y SC1. La proliferación del hongo en el sustrato (turba-arena de cuarzo 3:1 v:v) fue considerablemente superior a lo reportado por otros investigadores.
Palabras clave: Control biológico, nematodo falso agallador, Verticillium chlamydosporium.
Abstract
Five mexican isolates and a brazilian one of the fungus Pochonia chlamydosporia were evaluated as biological control agents of three mexican populations of Nacobbus aberrans. Two of the nematode populations, Montecillo (Estado de Mexico) and Tecamachalco (Puebla), were evaluated on tomato (Lycopersicon esculentum), and another population from Zacatecas (Zacatecas) on bean (Phaseolus vulgaris). The experiments were carried out in a growth chamber under controlled conditions of temperature (26°C), relative humidity (80%) and photoperiod (14 h light/ 10 h dark). All fungal isolates demonstrated high percentages of parasitism on eggs masses and eggs of N. aberrans per gram of root, thus reducing the number of second-stage juveniles of the nematode available as inoculum in the soil. The number of galls per root system was significantly reduced with the Tecamachalco population of the nematode. Treatments with the brazilian isolate VC10 had the least number of galls. The most efficient mexican isolates for control of N. aberrans were SMB3 and SC1. Proliferation of the fungus on the substrate (peat moss-quartz sand 3:1, v:v) was considerably greater than previously reported by other researchers.
Keywords: Biological control, false root-knot nematode, Verticillium chlamydosporium.
La creciente presión por preservar el ambiente y atender demandas cada vez más estrictas sobre inocuidad alimentaria por parte de los consumidores, ha creado un gran número de restricciones en el uso de pesticidas (incluidos los nematicidas), ya que algunos de éstos, como el bromuro de metilo, saldrán pronto del mercado (Ristaino y Thomas, 1997). Por lo tanto, es necesario implementar alternativas de control compatibles con el ambiente y la sanidad del agroecosistema, tales como el control biológico en hortalizas. En México, Nacobbus aberrans (Thorne) Thorne y Allen o "nematodo falso agallador" es uno de los nematodos más importantes por las pérdidas que causa en la producción de hortalizas tales como chile (Capsicum annuum L.), jitomate (Lycopersicon esculentum Mill.) y frijol (Phaseolus vulgaris L.). Esta especie de nematodo se ha encontrado en diez estados de la República Mexicana, siendo el jitomate uno de los hospedantes más afectados (Cid del Prado et al., 1995; Manzanilla-López et al., 2002). Del total de poblaciones reportadas para el país, únicamente las de Melchor Ocampo (Guanajuato) y Zacatecas no afectan a este cultivo (Arciga, 1995; Toledo, 1990). El jitomate es una de las principales hortalizas que generan divisas para México y tan sólo en el año 2003 aportó a la economía del país $901 millones de dólares, ocupando el primer lugar entre los cultivos de exportación (SAGAR, 2003). Dada la importancia económica de esta hortaliza, es necesario explorar alternativas de control para este nematodo fitoparásito, por ejemplo, los hongos nematófagos. Los trabajos de control biológico que se han desarrollado con N. aberrans en hortalizas son pocos y sólo incluyen a hongos como Arthrobotrys spp. y Paecilomyces spp. El primer género incluye especies que pueden ejercer un control significativo de los juveniles de segundo estadío (J2), destruyéndolos completamente (Mendoza-de Gives et al., 1994). Con respecto al género Paecilomyces, algunas especies se han evaluado en condiciones de invernadero; sin embargo, el control no ha sido satisfactorio (Gómez et al., 1987). Por otra parte, Eguiguren-Carrión (1995) evaluó el efecto conjunto de algunos nematicidas sobre N. aberrans y P. lilacinus (Thom.) Samson, reportando que los nematicidas afectaron negativamente el desarrollo del hongo. Otros hongos, considerados como agentes potenciales en el control biológico de los nematodos agalladores (Meloidogyne spp.), incluyen a la especie Pochonia chlamydosporia (= Verticillium chlamydosporium) (Goddard), Zare, Gams y Evans (Gams y Zare, 2001), la cual es un parásito facultativo que ocurre naturalmente en suelos supresivos (Kerry, 1995), siendo considerada por algunos autores como el agente más promisorio en el control biológico de los nematodos agalladores (Jatala, 1982). Considerando los antecedentes mencionados, se inició la búsqueda y aislamiento de hongos nematófagos nativos, para evaluar y seleccionar los que potencialmente pudieran utilizarse como agentes en el control biológico de N. aberrans, y de esta forma implementar una estrategia compatible con el ambiente, que de ser posible coadyuve a un manejo integrado de la enfermedad causada por el nematodo en parcelas infestadas.
MATERIALES Y MÉTODOS
Inóculo. El experimento se realizó en una cámara de crecimiento del Instituto de Botánica del Colegio de Postgraduados (CP), bajo condiciones controladas de temperatura (26°C ± 1°C), fotoperíodo (14 h de luz por 10 h de oscuridad) y humedad relativa del 80%. Cada unidad experimental constó de una maceta con capacidad de un kg. Los tratamientos consistieron de tres poblaciones de N. aberrans provenientes de la colección de cultivos mantenidos en el invernadero de Nematología del CP. Las poblaciones utilizadas fueron: Montecillo, Tecamachalco y Zacatecas. Las dos primeras se evaluaron en plantas de jitomate cv. Río Grande tipo Saladette y la última en plantas de frijol cv. Canario Criollo. El inóculo del hongo consistió de cinco aislamientos mexicanos de P. chlamydosporia (MHCH, SM4, SMB3, SMB3A, SC1) y uno brasileño (VC10), considerado en el presente trabajo como aislamiento estándar y cuya efectividad se ha evaluado principalmente en Meloidogyne spp. (Bourne et al., 1996). Los aislamientos del hongo fueron proporcionados por el laboratorio de control biológico de nematodos de Rothamsted Research (Inglaterra). SMB3, SMB3A, SC1 y SM4 se obtuvieron a partir de muestras de suelo, y el aislamiento MHCH de las masas de huevos del nematodo que se extrajeron de raíces de chile de una área de cultivo naturalmente infestada con el nematodo. Los aislamientos están depositados también en el cepario del Instituto de Fitosanidad del CP.
Reproducción del inóculo. Los hongos fueron reactivados a partir de muestras conservadas en medio de cultivo harina de maíz-agar con antibióticos y almacenados a 5°C. Cada aislamiento se reprodujo y extrajo a partir de medio selectivo para P. chlamydosporia (Kerry y Bourne, 2002). Los aislamientos se purificaron y posteriormente se procedió a su identificación. Para su reproducción masiva, cada aislamiento se inoculó individualmente en arena de cuarzo y trigo; después de cinco semanas se extrajeron las clamidosporas. Los aislamientos se evaluaron en la producción y viabilidad de las clamidosporas en condiciones de laboratorio.
Establecimiento del hongo en las unidades experimentales. El sustrato estéril utilizado para evaluar la eficiencia del hongo para el control del nematodo fue turba (peat moss), mezclada en una bolsa de plástico con arena de cuarzo, en una proporción de 3:1 (v:v). El inóculo de los hongos consistió de 5,000 clamidosporas g-1 de suelo (Kerry y Bourne, 2002). El medio con las clamidosporas se pasó por dos tamices (apertura de malla de 250 y 53 µm), se lavó con agua de la llave a presión, antes de colectar el residuo en otro tamiz de 10 µm. El exceso de agua se retiró con una esponja y se colectaron las clamidosporas, las cuales se mezclaron con arena fina de cuarzo en una proporción 10:1 (10 de arena:1 de clamidosporas v:v). Para calcular el número de clamidosporas por mL, se suspendió un gramo del inóculo en 9 mL de agua-agar (8.0 g de agar/L de agua destilada), se tomó una muestra de la suspensión y se contaron las clamidosporas en cinco campos del hematocímetro. Después de seis repeticiones se estimó un valor promedio y éste se multiplicó por el coeficiente 2,000. El proceso se repitió en dos diluciones (10-2 y 10-3) para estimar los gramos de arena y clamidosporas que se agregarían a las macetas de los experimentos (Kerry y Bourne, 2002). Las macetas se llenaron con la mezcla del sustrato y el inóculo. En ese momento se tomaron muestras del sustrato por cada maceta, para evaluar el número de unidades formadoras de colonias por gramo de suelo (UFC g-1) presentes en el sustrato inoculado al inicio del experimento. Se dejó transcurrir una semana para trasplantar el jitomate o sembrar el frijol.
Inoculación del nematodo en las unidades experimentales. Las masas de huevos del nematodo se recolectaron de las raíces del jitomate previamente infectadas con las poblaciones Montecillo y Tecamachalco. En el caso de la población Zacatecas, las masas de huevos se recolectaron de plantas de frijol. Las macetas con el hongo se sembraron con plántulas de jitomate de un mes de crecimiento producidas en condiciones de invernadero. Una semana después del trasplante, se inocularon 3,000 juveniles de segundo estadío (J2) de N. aberrans, producidos a partir de las masas de huevos incubadas en agua a 26°C durante una semana. Las semillas de frijol se sembraron directamente y una semana después fueron inoculadas con los J2. Se inocularon cinco macetas por tratamiento.
Tratamientos y diseño experimental. Los tratamientos fueron: testigo (tres poblaciones del nematodo, sin aislamientos del hongo), cinco aislamientos mexicanos de P. chlamydosporia (MHCH, SM4, SMB3, SMB3A, SC1) y uno brasileño (VC10). Estos aislamientos se aplicaron a poblaciones de N. aberrans de diferentes localidades: N1 = Montecillo (Estado de México), N2 = Tecamachalco (Puebla), y N3 = Zacatecas (Zacatecas). Los tratamientos con las poblaciones de Tecamachalco y Montecillo se analizaron con un diseño completamente al azar incluyendo el testigo. La población Zacatecas, por tratarse de un cultivo diferente, se analizó independientemente también con un diseño completamente al azar. El número de repeticiones por tratamiento fue de cinco, por lo que el número total de unidades experimentales fue de 105 (Cuadro 1).
Evaluación. Transcurridas siete semanas de establecido el experimento, se evaluaron dos macetas (equivalente a dos repeticiones) de cada tratamiento, para estimar el desarrollo de las poblaciones del nematodo y las UFC g-1 de suelo y de raíz. Las tres macetas restantes se evaluaron a las 12 semanas.
Variables. La efectividad colonizadora de P. chlamydosporia en el suelo y la rizósfera se evaluó cuantificando las UFC g-1 del suelo y de la raíz (Bourne y Kerry, 2002) a las siete y 12 semanas. Las variables evaluadas a las 12 semanas del experimento fueron: Número de agallas y peso fresco de la planta y de raíz. El parasitismo (huevos infectados con hifas) ejercido por el hongo sobre el nematodo, se evaluó considerando el porcentaje de huevos parasitados en las tres poblaciones de N. aberrans y la cantidad de J2 eclosionados. Para ello, se cuantificó el número de masas de huevos y el número de huevos por masa, ambos evaluados a partir de las masas que se colectaron de un gramo de raíz de cada planta. Para evaluar el número de J2 eclosionados se incubaron 1,000 huevos del nematodo en agua estéril a 27°C durante siete días.
Análisis estadístico. El peso fresco de la planta y de raíz se analizaron directamente por ser variables continuas con una distribución normal. El resto de las variables se transformaron a rangos para hacer una aproximación del análisis estadístico por ser variables no paramétricas. Con los resultados obtenidos se hizo un análisis de varianza (ANAVA) y una comparación de medias (Tukey, p = 0.05) utilizando el paquete estadístico Statistical Analysis System (SAS) de acuerdo a la metodología citada por Martínez-Garza (1980).
RESULTADOS
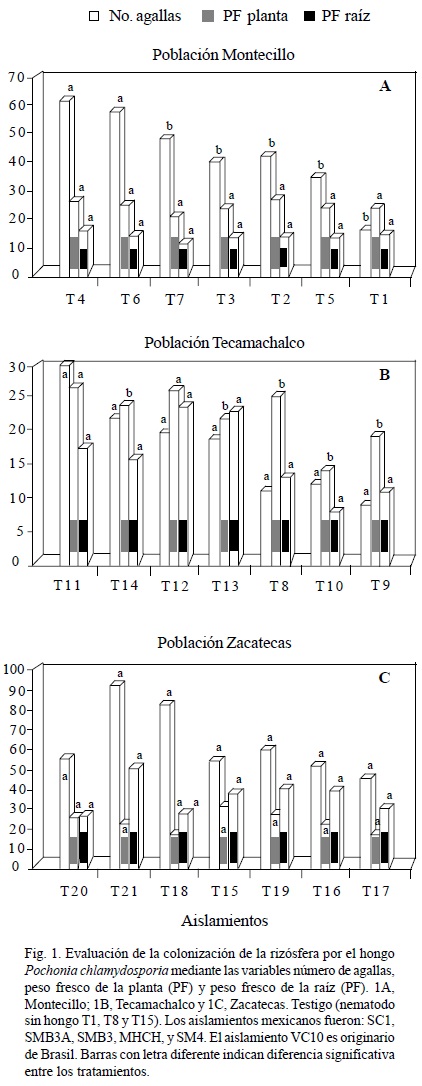
Número de agallas, peso fresco de planta y de raíz. Población Montecillo (N1). El análisis estadístico indicó diferencias significativas (p < 0.05) entre los tratamientos en el número de agallas promedio por planta. El tratamiento con menor número fue el T1 (Testigo: nematodo sin hongo) con 16 agallas, seguido del T5 y del T3 con 34 y 41 agallas, respectivamente. En la variable peso fresco de planta, el T2 registró el mayor peso promedio de 26 g por planta. En este caso no hubo diferencias significativas con respecto al T1 que pesó 24 g. En el peso fresco de raíz, el T4 fue el de mayor peso con 16.5 g, seguido del T1 y del T2 ambos con 14 g. El menor peso lo tuvo el T6 con 10 g, pero no hubo diferencias (p < 0.05) significativas entre los tratamientos (Fig. 1A). Población Tecamachalco (N2). En esta población no hubo diferencias significativas (p < 0.05) para el número promedio de agallas por sistema radical. El mejor tratamiento, es decir, con el menor número de agallas, fue el T9 con 9 agallas, superando al T8 (testigo: nematodo sin hongo) y al T10, los cuales tuvieron 10 y 11 agallas, respectivamente. En los tratamientos inoculados con los nematodos y los hongos se incrementó el agallamiento en general, aunque no hubo diferencia significativa con respecto al testigo. En el peso fresco de la planta se presentaron diferencias significativas entre los tratamientos (p < 0.05), el T12 tuvo la mayor biomasa promedio (26.4 g), seguido del T11 (26 g) y el T8 con 25.5 g. En cuanto al peso fresco de raíz, no hubo diferencias significativas entre tratamientos y al igual que en la variable anterior, el T12 registró mayor peso de raíz (24 g) superando al T8 que pesó 12.6 g. El segundo mejor tratamiento fue el T13 (23 g), seguido del T11 con 17 g. En contraste, el T10 presentó la raíz más pequeña con sólo 8 g de peso (Fig. 1B). Población Zacatecas (N3). Esta población no tuvo diferencias significativas entre los tratamientos para el número de agallas, no obstante, el T17 produjo un promedio de 46 agallas en las raíces de frijol, el valor más bajo entre los tratamientos evaluados con esta población, seguido del T16 y el T15 (testigo: nematodo sin hongo) con 52 y 55 agallas por planta, respectivamente. En la variable peso fresco de raíz el T21 pesó 50 g, seguido del T19 con 41 g y el T16 con 40 g. En la variable peso fresco de la planta, el T15 presentó la mayor biomasa promedio (32 g) por planta, seguido del T20 (28 g) y el T19 (27 g). El T17 registró el menor peso por planta (18 g). En las dos últimas variables no hubo diferencia significativa (p < 0.05) entre los tratamientos para esta población (Fig. 1C).
Porcentaje de parasitismo de huevos de las tres poblaciones de Nacobbus aberrans por los hongos. En general, el ANAVA mostró diferencias significativas (p < 0.05) entre tratamientos para las tres poblaciones. Los tratamientos más efectivos en la población de Montecillo fueron el T3 con 84% de parasitismo, seguido del T4 con 76 y del T2 con 70%. En la población de Tecamachalco, los tres mejores tratamientos fueron el T13 que infectó al 96% de los huevos, el T14 con 94 y el T12 con el 85%. En la población de Zacatecas, el mejor tratamiento fue el T20 con un 92% de parasitismo, seguido del T18 con un 91, y del T21 con 90% de parasitismo (Fig. 2A).
Número de juveniles de segundo estadío (J2) eclosionados. En la población de Montecillo, el tratamiento que tuvo un mayor efecto en la reducción de la eclosión de J2 fue el T4, con únicamente 15 J2 eclosionados por cada 1000 huevos (Fig. 2B). En la población de Tecamachalco, la mínima eclosión (88 J2) ocurrió en el T13, seguido de los tratamientos T8 (testigo: nematodo sin hongo) y T14, con 103 y 107 J2, respectivamente. En ambas poblaciones no hubo diferencias significativas entre tratamientos. En la población Zacatecas, los tratamientos más efectivos fueron el T18 y el T19 sin eclosión, seguidos por el T17 que tuvo 13 J2.
Número de huevos por masa de huevos. El ANAVA del número de huevos por masa se hizo con los datos obtenidos de 10 masas. En la evaluación a las 12 semanas, el T1 (testigo: nematodo sin hongo) de la población Montecillo presentó 269 huevos por masa en promedio, seguido del T7 con 390 huevos y el T6 que tuvo 432 (Fig. 2C). En la población Tecamachalco, los tres mejores tratamientos fueron el T10 con 206 huevos, el T9 con 382 y el T13 con 449 por cada masa. Cabe destacar que el testigo tuvo también el menor número de huevos con 108, y que no hubo diferencias significativas entre los tratamientos para estas dos poblaciones en el jitomate. En cuanto a la población de Zacatecas, el análisis de varianza detectó diferencias significativas (p < 0.05) entre los tratamientos. El T19 fue el más eficiente en la reducción del número huevos por masa, con 126, seguido del T18 con 164 y el T17 con 274.
Número de masas de huevos por gramo de raíz. El ANAVA indicó que los tratamientos con menor número de masas de huevos por gramo de raíz (g-1) para la población Montecillo fueron el T1 (testigo: nematodo sin hongo), el T3, el T5 y el T7 con 2, 5, 5 y 7 masas, respectivamente. En la población de Tecamachalco, los tratamientos T10, T8 (testigo: nematodo sin hongos), T12 y T9, produjeron 2, 3, 3 y 4 masas g-1 de raíz, respectivamente. En la población de Zacatecas, el T17 presentó 6 masas, seguido del T15 (testigo: nematodo sin hongo), T19 y el T21 con 7, 8 y 8 masas de huevos g-1 de raíz, respectivamente. No hubo diferencias significativas entre los tratamientos en las tres poblaciones (Fig. 2D).
Unidades formadoras de colonias (UFC) por gramo de suelo. Al momento de hacer la mezcla con el sustrato, el mayor número (log10) de UFC g-1 de suelo lo registró el T4 con 4.77, seguido del T3 y el T5 con 4.71 y 4.63 UFC g-1, respectivamente (Cuadro 2). A las siete semanas del experimento, los tratamientos con la población Montecillo del nematodo que tuvieron un mayor número de UFC g-1 en el suelo fueron el T5 con 4.92 y el T7 con 4.12, respectivamente. Los tratamientos con población Tecamachalco que tuvieron un mayor número de UFC g-1 fueron el T11 con 4.17, seguido del T12 con 3.82. En la población Zacatecas, el tratamiento con mayor número de UFC g-1 fue el T16 con 3.42, seguido del T19 con 3.32. En ninguna de las tres poblaciones se detectaron UFC en el suelo a las siete semanas con el aislamiento MHCH (T6, T13 y T20). En la evaluación final (12 semanas), el mayor número de UFC g-1 se cuantificó en la población Montecillo en el T5 con 5.22, seguido por el T7 con 5.08. En la población de Tecamachalco, los mejores tratamientos fueron el T11 con 5.26 UFC g-1 y el T12 con 5.23. Para la población Zacatecas, los mejores tratamientos fueron el T18 con 5.21 UFC g-1 y el T19 con 4.85. En todos los tratamientos se observaron diferencias significativas con un p < 0.05 de confiabilidad. El aislamiento MHCH (i.e. T6, T13 y T20), que no había logrado ser detectada a las siete semanas en el suelo, en esta segunda evaluación se encontró en todos los tratamientos.
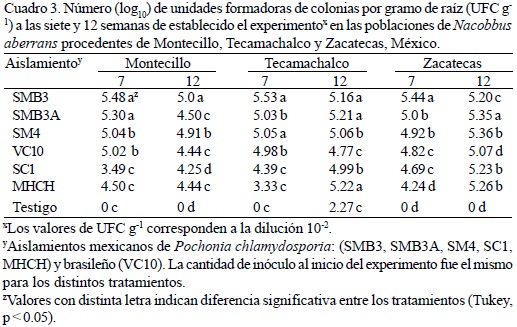
Unidades formadoras de colonias (UFC) cuantificadas a partir de un gramo de raíz macerada. La población de Montecillo mostró diferencias significativas en el ANAVA (p < 0.05) durante la fase intermedia del experimento (siete semanas). Los tratamientos con mayor número de UFC g-1 fueron el T5 con 5.48 y el T4 con 5.30 UFC g-1, respectivamente (Cuadro 3). El mejor tratamiento en la población de Tecamachalco fue el T12 con 5.53 UFC g-1, seguido del T14 con 5.05. En la población Zacatecas, los mejores tratamientos fueron el T19 que tuvo 5.44 UFC g-1, seguido del T18 con 5.0. En la evaluación final, la población Montecillo tuvo los mejores tratamientos en la producción de UFC g-1 a partir del macerado de raíz en el T5 con 5, y el T7 con 4.91 UFC g-1. El análisis estadístico estimó para la población de Tecamachalco al T13 como el mejor tratamiento con 5.22 UFC g-1, seguido del T11 con 5.21. En la población Zacatecas, el tratamiento que mostró la mayor cantidad de UFC g-1 fue el T21 con 5.36 y el T18 con 5.35 (Cuadro 3). En todos los tratamientos se observaron diferencias significativas con un p < 0.05 de confiabilidad. El aislamiento MHCH (i.e. T6, T13 y T20) se encontró en esta segunda evaluación en todos los tratamientos.
DISCUSIÓN
Para poder evaluar el efecto del control biológico del hongo sobre el nematodo, la interacción tritrófica entre nematodos agalladores, el hongo y la planta requiere analizarse a distintos niveles: planta-nematodo, planta-hongo y planta-hongo-nematodo. No obstante lo complejo de este tipo de interacción, en el presente trabajo se obtuvieron resultados que apoyan la colonización de la rizósfera por los aislamientos nativos de P. chlamydosporia, así como su efecto en el control de tres poblaciones mexicanas del nematodo. La respuesta a los distintos tratamientos, sin embargo, fue variable y ello pudo deberse, entre otros factores, a diferencias en la habilidad parasítica de las poblaciones del nematodo en el hospedante, así como a la habilidad colonizadora y parasítica del hongo. Las agallas en el sistema radical son un indicador de susceptibilidad al nematodo que se manifiesta en su número, tamaño de las masas de huevos y el número de huevos del nematodo (Bourne y Kerry, 1999). Es por ello que estos parámetros son de los más utilizados para evaluar el control ejercido sobre la capacidad reproductora de los nematodos agalladores (y en este caso falsos-agalladores). La susceptibilidad del hospedante varía de acuerdo a las poblaciones al nematodo (i. e. número de agallas) y su efecto puede apreciarse también en el desarrollo del sistema radical y partes aéreas del hospedante. Al respecto, el número de agallas en las poblaciones Montecillo y Tecamachalco fue relativamente bajo y no hubo diferencias significativas en el peso fresco de raíz en el jitomate (Fig. 1A y B). Las plantas tuvieron el mayor agallamiento con la población Zacatecas (Fig. 1C). Esto se debió posiblemente a la tolerancia del hospedante a N. aberrans (población Zacatecas). Los presentes resultados con respecto al agallamiento pueden indicar, como lo mencionan Bourne y Kerry (2000), que altas infestaciones de nematodos en las raíces de hospedantes susceptibles pueden producir agallas de mayor tamaño, en respuesta al ataque del nematodo y que las plantas difieren en su habilidad para soportar el desarrollo y reproducción de las hembras del nematodo. El tamaño de las agallas es importante, ya que en las grandes, una proporción significativa de los huevos puede permanecer dentro de la agalla quedando protegida del ataque e invasión del hongo, el cual está confinado inicialmente a la rizósfera. Por otra parte, el control del nematodo puede ser mejor cuando además de agallas pequeñas, el hospedante favorece un desarrollo extensivo del hongo o bien el hospedante es poco susceptible al ataque del nematodo, lo cual puede facilitar o mejorar el control ejercido por el hongo, como se observó en el caso de plantas de frijol inoculadas con la población Zacatecas (e.g. parasitismo de los huevos, eclosión de J2). Los hongos nematófagos, para efectos de control biológico, pueden caracterizarse como parásitos facultativos y obligados. Los facultativos usan a los nematodos como una fuente suplementaria y no primaria de alimento. P. chlamydosporia crece mejor en raíces infestadas con nematodos que en raíces no infestadas y suelo y muestra variación genética relacionada con el hospedante del cual fue aislado (Morton etal., 2004). El efecto colonizador del hongo en las masas de huevos de N. aberrans y el porcentaje de parasitismo en los huevos, requirió más de siete semanas para poder evaluarse, ya que bajo las condiciones experimentales del presente trabajo, las masas de huevos tardaron más tiempo en ser producidas y ser expuestas a la rizósfera en comparación a lo reportado para Meloidogyne spp. (de Leij et al., 1992). En el presente estudio se obtuvieron porcentajes de parasitismo por el hongo en los huevos del nematodo, superiores a lo reportado en la literatura (Bourne et al., 1996), como fue el caso de la población Tecamachalco que tuvo del 60 al 96% de parasitismo, seguida de la población Zacatecas, en la que sus tres mejores aislamientos tuvieron porcentajes por arriba del 90%. Además, los resultados concuerdan con lo señalado por Kerry (2001), quien reporta que en estudios en condiciones de invernadero, las aplicaciones al suelo de P. chlamydosporia reducen en un 87% la cantidad de huevos sanos de M. incognita en la rizósfera de col (Brassica oleracea L. var. capitata L.), maíz (Zea mays L.) y jitomate con respecto al testigo. La población Montecillo presentó los menores porcentajes de parasitismo, con un rango del 60 al 84%. Estos porcentajes también fueron mejores a los reportados por Kerry (2001) para Meloidogyne spp., quien además menciona que si bien el hongo no reduce la invasión inicial de los J2 en las raíces, ni el daño que éstos causan a las plantas, el hongo provee el control de la población del nematodo al parasitar los huevos y reducir significativamente la multiplicación de las generaciones subsecuentes del nematodo. En el presente trabajo, la eclosión de los J2 fue afectada severamente por el hongo ya que por ejemplo, la población Zacatecas, con los tratamientos T19 y T18 registró cero eclosión. En este caso se observó micelio de P. chlamydosporia entre los restos de la matriz gelatinosa adherida a los huevos, el cual posiblemente colonizó a los huevos desde etapas tempranas del desarrollo embrionario, siendo esta fase la más susceptible para la invasión del hongo. El mismo fenómeno se observó en las poblaciones Montecillo y Tecamachalco, en las cuales hubo una eclosión reducida de J2 con varios de los tratamientos (Fig. 2B). Estos resultados pueden estar relacionados con diferencias en la especificidad y/o patogenicidad de los aislamientos del hongo, el tiempo requerido para colonizar la masa de huevos y el hecho de que la mayoría de los aislamientos infectan generalmente a los huevos inmaduros más fácilmente (Bourne y Kerry, 2000). La población Tecamachalco, aún cuando presentó la menor cantidad de masas de huevos por gramo de raíz, tuvo a la vez una buena producción de huevos (Fig. 2C y D). La población Zacatecas incluyó tratamientos tanto con un menor (T19) como con un mayor (T20) número de huevos (Fig. 2C). Esto puede indicar que los nematodos pudieron: a) producir más agallas con masas pequeñas de huevos y b) producir menos masas de huevos, pero con un mayor número de huevos en algunos de los tratamientos y que debido a ello, hubo diferencias en la colonización ejercida por los aislamientos del hongo en los huevos del nematodo. En la fase intermedia del experimento (siete semanas después del trasplante), los aislamientos SMB3 (i.e. T5, T12, T19), SMB3A (i.e. T4, T11, T18) y SM4 (i.e. T7, T14, T21) fueron los más prolíficos, con más UFC g-1 en la raíz por población (Cuadro 3), a pesar de que aún no había un incremento significativo del hongo en esta etapa del experimento. El crecimiento del hongo en la rizósfera es esencial; sin él, los aislamientos del hongo no tendrían un efecto significativo en el control de los nematodos. En el caso de los agalladores, el hongo es más abundante en las raíces infectadas con el nematodo, ya que aparentemente se estimula su crecimiento cuando las masas de huevos empiezan a aparecer en la superficie de la raíz y son expuestas a la rizósfera y a la colonización por el hongo (Bourne y Kerry, 2000). Respecto a las UFC g-1 de suelo a las siete semanas, los aislamientos con los valores más altos y mejor desarrollados fueron SMB3 (i.e. T5, T12, T19), SM4 (i.e. T7, T14, T21) y VC10 (i.e. T2, T9, T16) (Cuadro 2). Al final del experimento (12 semanas), el hongo sobrevivió y se multiplicó considerablemente siendo mucho más abundante con respecto a la tasa de aplicación inicial. Los aislamientos con las cantidades más altas de UFC g-1 de raíz en cada una de las poblaciones, desde la fase intermedia del experimento hasta las 12 semanas (fase final) fueron: SMB3 con un rango de 5.48 a 5.53, SM4 con 5.04 a 5.36 y MHCH con 4.50 a 5.26 UFC g-1 en raíz, densidad que se mantuvo constante de acuerdo a los valores estimados en nuestros resultados (Cuadro 3). En las UFC g-1 de suelo, los mejores aislamientos para propagarse en el sustrato (turba-arena de cuarzo) fueron SMB3 con 4.63 a 4.85, SMB3A con 4.77 a 5.21 y SC1 con 4.71 a 4.79 UFC g-1. Estas cantidades de UFC resultan promisorias para el futuro uso y establecimiento de los aislamientos, ya que son similares a la dosis estándar de aplicación (5,000 clamidosporas g-1) recomendada para permitir el desarrollo del hongo en diferentes especies de nematodos y hospedantes (Bourne y Kerry, 1999). La presencia del hongo a las 12 semanas en los tratamientos testigo (i. e. T1, T8), puede haberse debido a contaminación por salpique entre las unidades experimentales. La colonización de la rizósfera está íntimamente relacionada con la producción de masas de huevos (Bourne y Kerry, 1999) y exudados radicales del hospedante (Ryan y Jones, 2004). Se ha reportado que entre mayor sea el número de nematodos en el suelo, mayor es la cantidad de hongos en la rizósfera y que la eclosión puede ser estimulada por la interacción planta-hongo (Ryan y Jones, 2004). Aunque no se conoce el efecto de P. chlamydosporia sobre la planta en la producción de sustancias estimulantes de la eclosión, se conoce que una mayor eclosión del nematodo (Globodera spp.) puede ser estimulada mediante compuestos químicos exudados por raíces colonizadas por microorganismos, como en el caso de las micorrizas. También se ha sugerido que los hongos micorrízicos pueden incrementar el vigor y tamaño de la raíz del hospedante ayudándole de esta forma a incrementar su tolerancia al nematodo (Hussey y Rancadori, 1982). El incremento en las poblaciones Montecillos y Tecamachalco del número de agallas con respecto al testigo (nematodo-sin hongo) podría ser explicada por este tipo de estímulo a la eclosión e incremento a la tolerancia del hospedante al nematodo.
CONCLUSIONES
El uso del hongo como único método de control no reduce totalmente el daño causado por el nematodo (i.e. agallamiento). En el presente estudio, la inoculación exitosa del suelo y la colonización de la rizósfera por los distintos aislamientos de P. chlamydosporia disminuyó considerablemente los huevos viables y J2 eclosionados del nematodo en varios de los tratamientos. Se obtuvieron porcentajes de parasitismo por el hongo en los huevos del nematodo superiores a lo reportado en la literatura. P. chlamydosporia parasitó hasta en un 96% los huevos del nematodo (T13) y tan sólo 1.5% (15 J2/1000 huevos) J2 eclosionaron en la población Montecillo (T4). Este es el primer trabajo que se realiza con aislamientos mexicanos de P. chlamydosporia, obtenidos a partir de muestras de masas de huevos, suelo y raíces colectadas en áreas de cultivo de jitomate y frijol donde N. aberrans ocurre naturalmente.
AGRADECIMIENTOS
El primer autor agradece el apoyo brindado por CONACYT, el Consejo Británico, y a los Doctores Joanna Bourne, Brian Kerry, Ken Evans y Simon Atkins (Rothamsted Research) en la realización de este trabajo. Rothamsted Research recibe fondos de apoyo del Consejo de Investigación en Biotecnología y Ciencias Biológicas del Reino Unido (BBSRC). Los autores dedican el presente trabajo al Dr. Ángel Martínez Garza (in memoriam).
LITERATURA CITADA
Arciga, F.B. 1995. Caracterización Morfológica, Rango de Hospedantes de la Población de Nacobbus aberrans en Zacatecas y Evaluación de Resistencia de Genotipos de Frijol. Tesis (Maestro en Ciencias). Universidad Autónoma Agraria Antonio Narro. Buenavista, Saltillo, Coahuila, México. 98 p. [ Links ]
Bourne, J.M., and Kerry, B.R. 1999. Effect of the host plant on the efficacy of Verticillium chlamydosporium as a biological control agent of root-knot nematodes at different densities and fungal application rates. Soil Biology and Biochemistry 31:75-84. [ Links ]
Bourne, J.M., and Kerry, B.R. 2000. Observations on the survival and competitive ability of the nematophagous fungus Verticillium chlamydosporium in soil. International Journal of Nematology 1:9-18. [ Links ]
Bourne, J.M., and Kerry, B.R. and De Leij, F.A.A.M. 1996. The importance of the host plant on the interaction between root-knot nematodes (Meloidogyne spp.) and the nematophagous fungus, Verticillium chlamydosporium Goddard. Biocontrol Science and Technology 6:539-548. [ Links ]
Cid del Prado, V.I., Manzanilla, L.R.H., Cristóbal, A.J. y Franco, A.G.E. 1995. Evaluación de algunas estrategias para el manejo de Nacobbus aberrans en el cultivo de jitomate (Lycopersicon esculentum Mill.). pp. 175-177. En: J. Cibrián Tovar, E. Cárdenas Soriano y R. Alatorre Rosas (eds.). Avances en la Investigación. Instituto de Fitosanidad. Colegio de Postgraduados. Montecillo, Edo. de México. [ Links ]
De Leij, F.A.A.M., Dennehy, J.A., and Kerry, B.R. 1992. The effect of temperature and nematode species on interactions between the nematophagous fungus Verticillium chlamydosporium and root-knot nematodes (Meloidogyne spp.). Nematologica 38:65-79. [ Links ]
Eguiguren-Carrión, R. 1995. Control de Meloidogyne incognita y Nacobbus sp. con Paecilomyces lilacinus en invernadero y el efecto de nematicidas sobre el hongo. Biocontrol 1:41-49. [ Links ]
Gams, W., and Zare, R. 2001 A revision of Verticillium sect. Postrata. III. Generic Classification. Nova Hedwigia 72:329-337. [ Links ]
Gómez, R.O., Valencia, A.M. y Castillo, D. 1987. Paecilomyces lilacinus (Thom) Samson, como posible agente de control biológico para Fusarium oxysporum (Schl) f. sp. lycopersici (Sacc.) Snyder y Hansen y Nacobbus aberrans (Thorne y Allen) Sher, 1971 en tomate (Lycopersicon esculentum Mill.). Memorias del XIV Congreso Nacional de la Sociedad Mexicana de Fitopatología. Morelia, Michoacán, México. Resumen. p. 67. [ Links ]
Hussey, R.S., and Roncadori, R.W. 1982. Vesicular-arbuscular mycorrhizae may limit nematode activity and improve plant growth. Plant Disease 16:9-14. [ Links ]
Jatala, P. 1982. Biological control of Meloidogyne species. A special report, CIP. Lima. Perú. p. 4. [ Links ]
Kerry, B.R. 1995. Ecological considerations for the use of the nematophagous fungus, Verticillium chlamydosporium, to control plant parasitic nematodes. Canadian Journal of Botany 73:565-570. [ Links ]
Kerry, B.R. 2001. Exploitation of the nematophagous fungus Verticillium chlamydosporium Goddard for the biological control of root-knot nematodes (Meloidogyne spp.) pp. 155-167. In: T.M. Butt, C. Jackson y N. Magan (eds). Fungi as Biocontrol Agents. CABI International. Wallingford, UK. 390 p. [ Links ]
Kerry, B.R. and Bourne, J.M. 2002. A manual for research on Verticillium chlamydosporium, a potential biological control agent for root-knot nematodes. IOBC/SORP. Darmstadt, Germany. 84 p. [ Links ]
Manzanilla-López, R.H., Costilla, M.A., Doucet, M., Franco, J., Inserra, R.N., Lehman, P.S., Cid del Prado-Vera, I., and Evans, K. 2002. The genus Nacobbus Thorne and Allen, 1944 (Nematoda: Pratylenchidae): Systematics, distribution, biology and management. Nematropica 32:49-227. [ Links ]
Martínez-Garza, A. 1980. Introducción al SAS. Statistical Analysis System. Sistema para Análisis Estadístico. Centro de Estadística y Cálculo. Colegio de Postgraduados. Chapingo, Edo. de México. 176 p. [ Links ]
Mendoza-de Gives, P., Zavaleta-Mejía, E., Herrera-Rodríguez, D., and Quiroz-Romero, H. 1994. In vitro trapping capability of Arthrobotrys spp. on infective larvae of Haemonchus contortus and Nacobbus aberrans. Journal of Helminthology 68:223-229. [ Links ]
Morton, C.O., Hirsch, P.R., and Kerry, B.R. 2004. Infection of plant-parasitic nematodes by nematophagous fungi - a review of the application of molecular biology to understand infection processes and to improve biological control. Nematology 6:161-170. [ Links ]
Ristaino, J.B., and Thomas, W. 1997. Agriculture, methyl bromide, and the ozone hole: can we fill the gaps?. Plant Disease 81:964-977. [ Links ]
Ryan, A., and Jones, P. 2004. The effect of mycorrhization of potato roots on the hatching chemicals active towards the potato cyst nematodes, Globodera pallida and G. rostochiensis. Nematology 6:335-342. [ Links ]
SAGAR, 2003. Anuario Estadístico de la Producción Agrícola de los Estados Unidos Mexicanos. http://www.siap.gob.mx/aagricola_siap/cultivo/index.jsp, consulta: julio 20, 2003. [ Links ]
Toledo, R., J.C. 1990. Caracterización Patogénica de Cinco Poblaciones de Nacobbus aberrans y Evaluación de Daño que Causa a Tomate, Chile y Frijol en México. Tesis de Maestro en Ciencias Agrícolas. Colegio de Postgraduados, Montecillo, Edo. de México, México. 63 p. [ Links ]














