Introducción
Los estudios para el conocimiento sobre la dieta de herbívoros silvestres representan un componente indispensable para el manejo sostenible de la cobertura vegetal nativa, para el control poblacional y para comprender los procesos de competencia entre los herbívoros (Ramírez-Lozano, 2012; Guerrero-Cárdenas et al., 2016; Gastelum-Mendoza et al., 2019). Estudios sobre la composición de la dieta de herbívoros rumiantes como el borrego cimarrón (Ovis canadensis Merriam, 1901; Guerrero-Cárdenas et al., 2016; Tarango et al., 2002) y venado cola blanca (Odocoileus virginianus Zimmermann, 1780; Tajchman et al., 2018; Gastelum-Mendoza et al., 2020), se han desarrollado para determinar los efectos de la presión de la herbivoría y para el conocimiento de la dieta de los ungulados con fines de conservación del hábitat.
Hasta la fecha, en México se conoce poco de los hábitos alimentarios de herbívoros exóticos que se han translocado a ecosistemas nativos del país. Ejemplo de especies de ungulados exóticos introducidas en ambientes naturales del norte de México, es el borrego berberisco (Ammotragus lervia Pallas, 1777), un bóvido originario del norte de África (Nowak, 1999), vulnerable de acuerdo con la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN, 2001), que desde su llegada al Continente Americano en la década de 1930 como una estrategia de conservación de sus poblaciones ex situ, ha expandido su distribución del sureste de Estados Unidos al noreste de México, colonizando los ecosistemas xerófilos principalmente en los estados de Coahuila, Nuevo León y Tamaulipas, en donde se considera una especie invasora, compite directamente por alimento y espacio con especies nativas, y es portadora y transmisora de enfermedades y parásitos (Nowak, 1999; Simpson et al., 1978; Ben Mimoun & Nouira, 2015).
La ampliación en la distribución de A. lervia, representa un problema para los proyectos de reintroducción de O. canadensis en sistemas montañosos de Coahuila, como Mesa de Cartujanos, Sierra La Rata, Sierra Pájaros Azules y Sierra Las Hormigas (Nowak, 1999; Ben Mimoun & Nouira, 2013; 2015). En particular porque este bóvido es una especie de hábitos gregarios, con una tasa de reproducción alta y capacidad para adaptarse a condiciones desfavorables del hábitat (e.g. baja disponibilidad y calidad del forraje que predominan en los matorrales desérticos del norte de México) (Ben Mimoun & Nouira, 2015).
Para evaluar el impacto de los herbívoros exóticos sobre la flora y fauna nativa, se pueden desarrollar estudios básicos que evalúen el impacto de su distribución, uso de hábitat y hábitos alimentarios fuera de su área de distribución natural (Ramsey & Anderegg, 1972; Cassinello, 1998; Ben Mimoun & Nouira, 2013). Por ejemplo, en estudios desarrollados en la región de Edwards Plateau, Texas, Estados Unidos, A. lervia consumió plantas de porte herbáceo; esta selectividad de forraje evidenció el efecto negativo de este herbívoro sobre la diversidad y estructura de la vegetación. Asimismo, al disminuir la cobertura baja del dosel (hierbas y pastos) por el sobrepastoreo, se aceleran los procesos de erosión y desertificación del suelo (Ramsey & Anderegg, 1972; Gastelum-Mendoza et al., 2019).
Para estudiar los tipos de formas biológicas de las plantas que consumen las especies de herbívoros exóticos, la implementación de la técnica microhistológica ha permitido describir la proporción de consumo de las plantas en diferentes épocas del año (Tarango et al., 2002; Guerrero-Cárdenas et al., 2016, Gastelum-Mendoza et al., 2019; Lozano-Cavazos et al., 2020) lo cual es importante evaluar para calibrar el sobrepastoreo de ciertos grupos de plantas (Ramírez-Lozano, 2004; Ben Mimoun & Nouira, 2015), así como estimar atributos de la población como el comportamiento forrajero (Salazar-Ortiz et al., 2022). Debido a los posibles impactos sobre la diversidad y estructura de la cobertura vegetal nativa que genera A. lervia, los estudios sobre la composición y diversidad de su dieta son la base principal para identificar la presión de la especie sobre la flora nativa del noreste de México (Gastelum-Mendoza et al., 2019). Por lo anterior, el presente estudio tiene como objetivo describir los hábitos forrajeros de A. lervia en matorral desértico rosetófilo de Coahuila, México, y representa la primera investigación sobre hábitos forrajeros de A. lervia en el norte de México.
Materiales y métodos
Descripción del área de estudio. El estudio se realizó en Sierra Las Hormigas (26° 48´ 09.96´´ N, 101° 00´ 15.77´´ O), localizada a 38 km en línea recta al este de la cabecera municipal de Monclova, y a 43 km al oeste del municipio de Candela, Coahuila, México (Fig. 1), abarca una superficie de 1,100 ha destinada al manejo de una población aproximada de 300 borregos berberisco. Esta sierra se ubica dentro de la Unidad de Manejo para la Conservación de Vida Silvestre (UMA) Rancho San Juan (clave SEMARNAT DGVS-CR-EX-3133-COA; 26° 49´ 31.11´´ N, 101° 01´ 57.77´´ O), y una elevación entre 600 y 1,000 m. El tipo de vegetación dominante en el área de estudio es matorral desértico rosetófilo y micrófilo, destacando especies suculentas como Agave lechuguilla Torr., 1859, Hechtia glomerata Karw. ex Zuc y nopales del género Opuntia (Miranda & Hernández, 1963). Las principales especies vegetales son arbustos y árboles de entre 3 a 5 m de alto, caducifolios durante la época seca. Presenta un clima semiárido (BS) y una temperatura promedio anual de 21 °C, mayor a 40 °C en verano y menor a 0 °C en invierno (García, 1988), y la precipitación anual varía entre 200 y 900 mm.
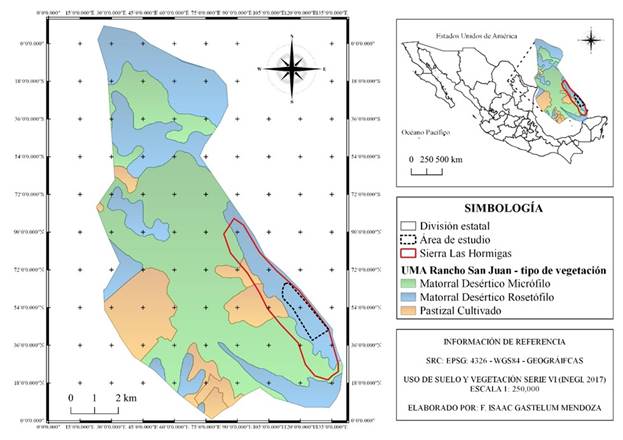
Figura 1 Ubicación y tipo de vegetación de la Sierra Las Hormigas en la UMA Rancho San Juan, Monclova, Coahuila, México.
Estimación de la disponibilidad y diversidad de la dieta. Durante el periodo octubre 2018-agosto 2019, se estimó la disponibilidad de forraje del matorral desértico rosetófilo, mismo que se expresó en frecuencia relativa estacional por especie y forma biológica: arbustivas, herbáceas, pastos y suculentas. Siguiendo el método de líneas de Canfield (1941), se colocaron aleatoriamente y de manera permanente durante todo el estudio, 23 líneas de 25 m de longitud por estación: otoño (octubre 2018), invierno (febrero 2019), primavera (mayo 2019) y verano (agosto 2019). En cada línea se contabilizaron y clasificaron a las plantas que la interseccionaron, mismas que se clasificaron in situ de acuerdo con su forma biológica y especie. De forma preliminar, la diversidad estacional de las especies de plantas en el hábitat de A. lervia, se expresó de acuerdo con el índice de Shannon (1948):
Donde:
n = Número de especies en la estación; Pi = proporción de individuos identificados de la especie i respecto al total de individuos
Además, se utilizaron valores de diversidad verdadera (Hill, 1973), del orden 0 (q0: riqueza de especies); orden 1 (q1 o exponencial del índice de Shannon que, pondera a cada especie de acuerdo con su abundancia en la comunidad y número de especies “comunes” en la comunidad); y orden 2 (q2 o inverso del índice de Simpson, que expresa el número de especies “muy abundantes” en la comunidad) (Jost, 2006). La diversidad verdadera, se comparó a partir de inter y extrapolaciones, con las cuales se obtuvieron intervalos de confianza calculados al 95 % de confiabilidad, y se construyeron con base en 50 réplicas bootstrap en el software iNEXT (Chao et al., 2016). Cuando los intervalos de confianza no se traslaparon, indicó una diferencia en la diversidad estacional (Cumming et al., 2007). Asimismo, se comparó la completitud del inventario de especies entre líneas y estaciones del año, mediante el cálculo del estimador de cobertura de la muestra que, indica la proporción de la comunidad de plantas representada por las especies registradas; cuando la cobertura de la muestra se aproxima al 100 %, el muestreo está completo dado el esfuerzo y la técnica de recolección utilizada (Chao & Jost, 2012), y por lo tanto, esta comparación es para ensambles con un nivel similar de completitud del inventario (Magurran & Henderson, 2010).
Por último, la frecuencia relativa de cada especie en el hábitat se estimó con la siguiente ecuación:
Para identificar la composición de la dieta de A. lervia se utilizó la técnica microhistológica, la cual, consiste en identificar y cuantificar estructuras celulares en muestras fecales frescas (Sparks & Malechek, 1968; Holechek et al., 1982, Gastelum-Mendoza et al., 2019). Para ello, se recolectaron muestras fecales frescas de A. lervia durante las cuatro estaciones del año: otoño (octubre 2018), invierno (febrero 2019), primavera (mayo 2019) y verano (agosto 2019), las cuales se colocaron en bolsas de papel, etiquetaron y secaron en horno INOX. 120VAC. de 60HZ. a 75 °C durante 48 h. Las muestras fecales secas y agrupadas por estación del año, se molieron en molino Wiley con criba no. 10 (1.70 mm de apertura de malla). Posteriormente, se tomó una muestra compuesta por estación, y se aclararon con hipoclorito de sodio. Una vez aclaradas, se fijaron en portaobjetos de acuerdo con lo descrito por Sparks y Malechek (1968). En total se montaron 20 laminillas (5 por estación) y observaron 400 campos (20 por laminilla), con microscopio OMAX M82es 40X 2000X®, objetivo 10X y lente ocular 10X. En dónde se identificaron y contabilizaron fragmentos celulares vegetales. En paralelo a la recolecta y análisis de muestras fecales, se elaboró un catálogo de referencia, en donde se incluyeron fotografías de estructuras celulares (tricomas, estomas, epidermis, células de sílice, cristales, etc.) características de 110 especies vegetales, clasificadas de acuerdo con su forma biológica (arbustivas, herbáceas, pastos y suculentas), familia y especie. El método de secado, aclarado y molido de las muestras vegetales fue similar al utilizado para las muestras fecales.
La composición estacional de la dieta de A. lervia, se expresó en frecuencia relativa mediante el cuadro de Fracker y Brischle (1944), y su diversidad estacional se calculó de acuerdo con el índice de diversidad de Shannon (1948). Para conocer si existe diferencia en la diversidad de la dieta por estación, se aplicó la prueba t-student (α ≤ 0.05) utilizando la plataforma R Studio (RStudio Team, 2016).
El uso y selección de las principales especies en la dieta de A. lervia se expresó con base en la relación que existe entre el aporte de una especie a la dieta y su disponibilidad en el hábitat. Este análisis se calculó mediante el índice de selectividad de Ivlev (1961):
Donde:
Ei = Índice de selectividad del forraje; r(i) = frecuencia relativa de la especie i en la dieta; p(i) = frecuencia relativa de la especie i en el hábitat.
Los valores de selección de Ivlev fluctúan entre -1 (rechazo) y 1 (preferencia). Asimismo, estos valores se categorizaron cualitativamente de acuerdo con Stuth (1991): S (> 0.35), plantas preferidas; P (-0.35 - 0.35) plantas consumidas en proporción a su disponibilidad y E (< -0.35), plantas evitadas. Por último, utilizando un modelo de regresión lineal simple, se correlacionó la diversidad estacional de la dieta con la diversidad de la cobertura vegetal.
Resultados
En el hábitat de A. lervia se identificaron 50 especies de plantas, las cuales se clasificaron de acuerdo con su forma biológica en: arbustos (31 spp.), suculentas (9 spp.), herbáceas (5 spp.) y pastos (5 spp.). De las 22 familias identificadas, las que presentaron un mayor número de registro de especies fueron: Fabaceae (9 spp.), Asteraceae (5 spp.), Poaceae (5 spp.) y Asparagaceae (4 spp.). Las especies arbustivas, predominaron durante las cuatro estaciones del año, mientras que las herbáceas fueron las especies con menor disponibilidad. En virtud de que estuvieron presentes en las cuatro estaciones del año, el hábitat de A. lervia, cuenta con 18 especies vegetales dominantes (Cuadro 1). Aunque las principales especies vegetales, no se consideran especies forrajeras importantes para los herbívoros silvestres del noreste de México (Ramírez-Lozano, 2012; Lozano-Cavazos et al., 2020), sí tienen una importancia en la estructura de la cobertura vegetal. Al igual que el borrego cimarrón, A. lervia es un herbívoro que requiere de una vegetación arbustiva baja, que provea una adecuada visibilidad y terreno de escape (Tarango et al., 2002). En este sentido, A. lechuguilla, H. glomerata y Euphorbia antisyphilitica Zucc. cumplen esa función.
Cuadro 1 Relación entre la disponibilidad de los tipos de forraje y su consumo estacional por Ammotragus lervia, expresados en frecuencia relativa de especies arbustivas, herbáceas, pastos y suculentas en Sierra Las Hormigas, Monclova, Coahuila, México, durante el periodo octubre 2018 - agosto 2019 (1 = forma biológica; 2 = disponibilidad; 3 = consumo; Arb. = arbustiva; Her. = herbácea; Suc. = suculenta; Pa. = pasto).
| Tipo de vegetación: matorral desértico rosetófilo (INEGI, 2017) | Estación 2018 - 2019 (%) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Primavera | Verano | Otoño | Invierno | |||||||
| Familia | Especie | F.b.1 | Dis.2 | Con.3 | Dis. | Con. | Dis. | Con. | Dis. | Con. |
| Achatocarpaceae | Phaulothamnus spinescens | Arb. | 0.59 | |||||||
| Asparagaceae | Agave lechuguilla | Suc. | 9.87 | 8.80 | 6.76 | 7.45 | ||||
| Agave scabra | Suc. | 0.78 | ||||||||
| Dasylirion berlandieri | Suc. | 5.38 | 2.40 | 4.71 | 1.96 | |||||
| Yucca filifera | Arb. | 0.90 | ||||||||
| Asteraceae | Acourtia runcinata | Her. | 0.49 | |||||||
| Ambrosia dumosa | Arb. | 0.26 | 0.29 | 3.73 | ||||||
| Brickellia glutinosa | Arb. | 1.96 | ||||||||
| Flourensia cernua | Arb. | 0.90 | 0.88 | 0.78 | ||||||
| Gochnatia hypoleuca | Arb. | 3.59 | 6.39 | 0.40 | 1.47 | 1.96 | ||||
| Gymnosperma glutinosum | Arb. | 0.29 | ||||||||
| Hymenoxys odorata | Arb. | 0.26 | 0.29 | |||||||
| Parthenium argentatum | Her. | 2.06 | 0.59 | 1.10 | ||||||
| Parthenium incanum | Her. | 3.93 | ||||||||
| Viguiera stenoloba | Arb. | 1.79 | 0.25 | 3.60 | 5.29 | 3.14 | ||||
| Wedelia texana | Her. | 3.24 | ||||||||
| Boraginaceae | Heliotropium confertiflorum | Her. | 0.59 | |||||||
| Tiquilia canescens | Her. | 19.85 | 8.85 | 16.40 | ||||||
| Brassicaceae | Lesquerella fendleri | Her. | 0.74 | |||||||
| Physaria fendleri | Her. | 1.10 | ||||||||
| Bromeliaceae | Hechtia glomerata | Suc. | 8.07 | 6.00 | 6.18 | 5.88 | ||||
| Cactaceae | Ferocactus sp. | Suc. | 0.40 | 0.88 | 0.78 | |||||
| Myrtillocactus geometrizans | Suc. | 0.59 | ||||||||
| Opuntia engelmannii | Suc. | 4.93 | 16.46 | 5.60 | 4.12 | 2.35 | 10.26 | 4.71 | 8.99 | |
| Opuntia leptocaulis | Suc. | 0.45 | 2.21 | 0.80 | 0.29 | 0.88 | 0.78 | 0.88 | ||
| Opuntia microdasys | Suc. | 1.20 | 1.03 | 0.88 | 0.88 | 1.32 | ||||
| Cannabaceae | Celtis pallida | Arb. | 1.79 | 0.80 | 1.18 | |||||
| Convolvulaceae | Dichondra argentea | Her. | 0.45 | |||||||
| Ebenaceae | Diospyros texana | Arb. | 1.79 | 0.40 | 0.42 | |||||
| Ephedraceae | Ephedra pedunculata | Arb. | 0.29 | 1.18 | 0.88 | |||||
| Euphorbiaceae | Cordia parvifolia | Arb. | 0.25 | 4.12 | 3.23 | 0.22 | ||||
| Croton dioicus | Arb. | 6.14 | 2.05 | 2.41 | ||||||
| Croton pottsii | Arb. | 0.59 | ||||||||
| Croton punctatus | Arb. | 1.29 | 2.19 | |||||||
| Croton sp. | Arb. | 0.29 | ||||||||
| Croton torreyanus | Arb. | 1.80 | 1.76 | 8.11 | ||||||
| Euphorbia antisyphilitica | Arb. | 7.62 | 7.20 | 6.47 | 1.76 | 5.88 | 0.44 | |||
| Jatropha dioica | Arb. | 2.69 | 2.80 | 0.88 | 2.35 | |||||
| Fabaceae | Calliandra conferta | Arb. | 6.73 | 6.40 | 4.71 | |||||
| Chamaecrista greggii | Arb. | 1.47 | ||||||||
| Dalea aurea | Her. | 1.55 | 0.29 | 1.75 | ||||||
| Dalea bicolor | Her. | 0.88 | ||||||||
| Dalea greggii | Her. | 1.57 | ||||||||
| Dermatophyllum secundiflorum | Arb. | 2.65 | ||||||||
| Eysenhardtia texana | Arb. | 0.90 | 2.00 | 1.29 | 2.35 | 0.88 | 0.78 | 0.66 | ||
| Medicago sativa | Her. | 0.74 | 13.14 | 9.97 | 13.60 | |||||
| Mimosa zygophylla | Arb. | 0.98 | 1.10 | |||||||
| Prosopis glandulosa | Arb. | 2.69 | 0.80 | 3.14 | ||||||
| Vachellia berlandieri | Arb. | 2.24 | 5.16 | 3.60 | 2.65 | 2.35 | ||||
| Vachellia farnesiana | Arb. | 0.52 | 2.05 | 0.22 | ||||||
| Vachellia greggii | Arb. | 0.78 | ||||||||
| Vachellia rigidula | Arb. | 9.42 | 8.10 | 5.60 | 11.08 | 5.02 | 10.26 | 7.45 | 12.94 | |
| Koeberliniaceae | Koeberlinia spinosa | Arb. | 1.35 | 1.20 | 1.96 | |||||
| Krameriaceae | Krameria erecta | Arb. | 0.25 | 0.29 | ||||||
| Lamiaceae | Salvia coccinea | Arb. | 4.48 | 3.60 | 1.76 | 2.35 | ||||
| Malvaceae | Abutilon wrightii | Her. | 2.06 | 2.93 | ||||||
| Nyctaginaceae | Allionia incarnata | Her. | 0.44 | |||||||
| Oleaceae | Forestiera angustifolia | Arb. | 0.90 | 3.19 | 0.40 | 0.88 | 0.29 | 1.18 | ||
| Poaceae | Aristida adscensionis | Pa. | 0.77 | 0.29 | 0.44 | |||||
| Aristida purpurea | Pa. | 1.29 | 4.11 | 1.97 | ||||||
| Aristida sp. | Pa. | 2.70 | ||||||||
| Astragalus sp. | Pa. | 1.18 | ||||||||
| Bothriochloa laguroides | Pa. | 1.23 | 2.65 | |||||||
| Bouteloua curtipendula | Pa. | 2.70 | 1.20 | 1.80 | 7.94 | 1.47 | 0.78 | 1.10 | ||
| Bouteloua eriopoda | Pa. | 0.26 | 0.29 | 0.44 | ||||||
| Bouteloua gracilis | Pa. | 4.80 | 0.26 | 5.29 | 2.75 | |||||
| Bouteloua hirsuta | Pa. | 0.26 | 3.52 | 0.44 | ||||||
| Cenchrus ciliaris | Pa. | 0.45 | 4.00 | 5.15 | 7.62 | 5.49 | 4.61 | |||
| Erioneuron pulchellum | Pa. | 11.30 | 9.79 | 8.50 | 4.17 | |||||
| Heteropogon contortus | Pa. | 1.03 | 4.11 | 0.66 | ||||||
| Hilaria mutica | Pa. | 0.59 | ||||||||
| Panicum hallii | Pa. | 0.26 | 3.81 | 1.54 | ||||||
| Paspalum notatum | Pa. | 4.00 | 5.88 | 4.71 | ||||||
| Setaria leucopila | Pa. | 0.88 | ||||||||
| Tridens muticus | Pa. | 0.22 | ||||||||
| Pteridaceae | Astrolepis integrifolia | Arb. | 6.39 | 3.35 | 0.44 | |||||
| Rhamnaceae | Karwinskia humboldtiana | Arb. | 7.62 | 6.00 | 4.12 | 6.27 | 0.22 | |||
| Ziziphus obtusifolia | Arb. | 3.14 | 3.60 | 2.65 | 0.78 | |||||
| Rutaceae | Casimiroa edulis | Arb. | 1.97 | 0.29 | ||||||
| Helietta parvifolia | Arb. | 2.69 | 0.59 | 0.39 | ||||||
| Zanthoxylum fagara | Arb. | 0.40 | 2.06 | |||||||
| Scrophulariaceae | Leucophyllum frutescens | Arb. | 2.24 | 4.91 | 2.40 | 0.26 | 0.88 | 0.29 | 1.57 | |
| Simaroubaceae | Castela texana | Arb. | 0.25 | 0.29 | 0.39 | 0.88 | ||||
| Solanaceae | Solanum elaeagnifolium | Arb. | 0.29 | |||||||
| Solanum nigrum | Arb. | 0.74 | 0.22 | |||||||
| Verbenaceae | Aloysia macrostachya | Arb. | 5.65 | 0.26 | 0.29 | 0.44 | ||||
| Aloysia wrightii | Arb. | 0.29 | ||||||||
| Lantana camara | Arb. | 0.25 | ||||||||
| Lippia graveolens | Arb. | 6.40 | 5.00 | 0.29 | 5.88 | |||||
| Zygophyllaceae | Guaiacum angustifolium | Arb. | 4.93 | 1.23 | 3.20 | 1.55 | 3.53 | 2.75 | ||
| Larrea tridentata | Arb. | 1.23 | 1.55 | 0.29 | 0.29 | 0.78 | 0.22 | |||
De acuerdo con los análisis de diversidad de la cobertura vegetal en el hábitat de A. lervia, la cobertura de la muestra entre estaciones del año con base en el número de individuos, indica que solo en primavera existió diferencia en la diversidad de especies (P ≤ 0.05). Sin embargo, al comparar la diversidad y abundancia entre estaciones del año, invierno superó el número de especies, pero presentó menor abundancia en relación con las demás estaciones. En este sentido, las diferencias entre la diversidad de especies por estación, se relacionaron con la presencia de especies raras (con pocos registros de presencia en la muestra de la estación) (Fig. 2). Asimismo, los análisis para determinar si existen diferencias en la diversidad vegetal entre líneas de Canfield, muestran que no existieron diferencias entre los grupos de líneas, y la diversidad estimada entre las líneas (Fig. 3).

Figura 2 Análisis de la diversidad vegetal en el hábitat de Ammotragus lervia: número de individuos (A) y diversidad (B), con base en la cobertura de la muestra; y comparación de la diversidad y abundancia entre estaciones (C), con base en el número efectivo de especies (D).
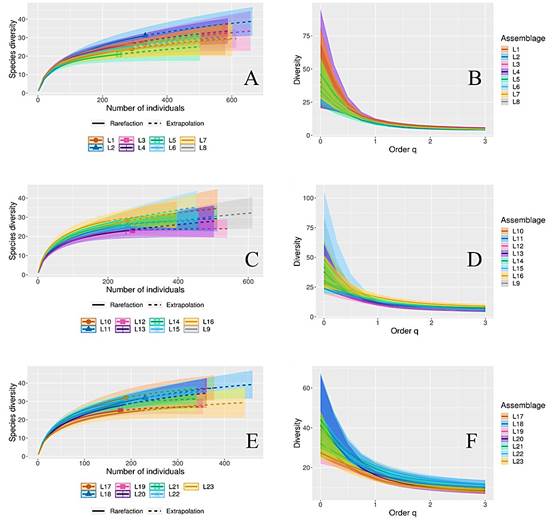
Figura 3 Curvas de rarefacción y extrapolación de la diversidad de especies y número de individuos (A, C y E) y comparación de la diversidad verdadera (B, D y F) de los números de Hill (1973), entre líneas Canfield para evaluar los hábitos forrajeros de Ammotragus lervia en matorral desértico rosetófilo de Coahuila, México.
En cuanto al análisis de dieta de A. lervia, se recolectaron 70 grupos fecales por estación (280 en total): otoño (octubre 2018), invierno (febrero 2019), primavera (mayo 2019) y verano (agosto 2019). La dieta de A. lervia se compuso de 64 especies, incluidas en 21 familias: Poaceae (15), Fabaceae (9 spp.), Asteraceae (8 spp.) y Euphorbiaceae (7 spp.), fueron las más representativas (Cuadro 1). Sin embargo, únicamente cuatro especies (Vachellia rigidula Benth. 1857, Tiquilia canescens (DC.) A.T. Richardson, Medicago sativa L., 1753 y Opuntia engelmannii Salm-Dyck ex Engelm.) representaron el 46.49 % de su dieta. En promedio, la dieta anual de A. lervia se conformó de 36.02 % arbustivas, 29.83 % herbáceas, 22.40 % pastos y 11.76 % suculentas. En primavera predominaron las arbustivas (54.80 %), en verano e invierno las herbáceas (46.39 y 37.90 %, respectivamente) y en otoño los pastos (35.19 %) (Fig. 4). Además de su aporte a la dieta, se identificó una relación alta entre el consumo y disponibilidad de especies arbustivas (Fig. 5). En específico, V. rigidula un arbusto común en matorrales desérticos del noreste de México (Ramírez-Lozano, 2012), representó en promedio el 11.43 % de la dieta anual. Sin embargo, consumió esta especie en proporción a su disponibilidad (Cuadro 2). La diversidad promedio de la dieta de A. lervia fue de 2.89 (± 0.13). En este estudio se identificaron 15 especies de pastos, las cuales representaron el 22.40 % de la dieta anual (Cuadro 1). Por el contrario, solo se identificaron tres especies suculentas en la dieta de A. lervia, y su aporte estacional no fue alto (Fig. 4). Particularmente, seleccionó O. engelmannii y Opuntia leptocaulis (DC.) F. M. Knuth, en primavera y otoño, y en ninguna estación del año evitó su consumo (Cuadro 2). La diversidad promedio de la dieta fue de 2.89 (± 0.13), y se encontró una diferencia (P ≤ 0.05) con la diversidad de la cobertura vegetal (2.56 ± 0.1). Esto indica que A. lervia, no consumió el forraje en función a su diversidad.
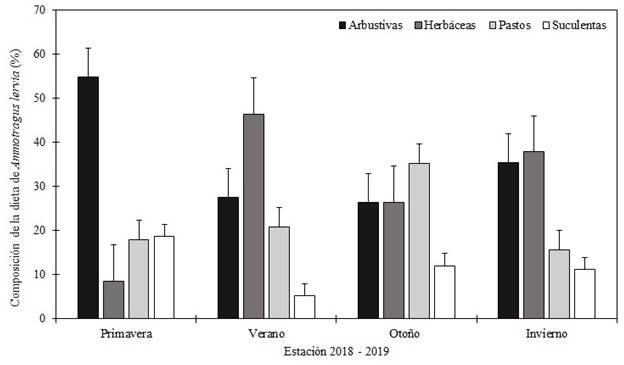
Figura 4 Consumo estacional de arbustos, herbáceas, pastos y suculentas por Ammotragus lervia en Sierra Las Hormigas, Monclova, Coahuila, México, durante el periodo octubre 2018 - agosto 2019 (las líneas verticales sobre las barras indican el error típico).
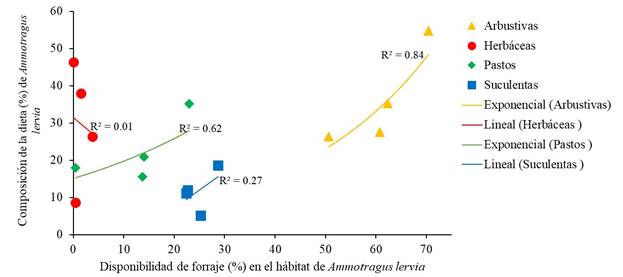
Figura 5 Análisis de regresión simple, entre disponibilidad y consumo estacional de arbustivas, herbáceas, pastos y suculentas por Ammotragus lervia en Sierra Las Hormigas, Monclova, Coahuila, México, durante el periodo octubre 2018 - agosto 2019.
Cuadro 2 Tipo de uso estacional de algunas especies identificadas en la dieta de Ammotragus lervia en Sierra Las Hormigas, Monclova, Coahuila, México durante el periodo octubre 2018 - agosto 2019 (S = preferidas; P = utilizadas con relación a su disponibilidad; E = evitadas).
| Estación (2018 - 2019) | Disponibilidad (%) | Frecuencia en la dieta (%) | Índice de selectivilidad de Ivlev | Tipo de uso |
|---|---|---|---|---|
| Eysenhardtia texana | ||||
| Primavera | ||||
| Verano | 2 | 1.29 | -0.22 | P |
| Otoño | 2.35 | 0.88 | -0.46 | E |
| Invierno | 0.78 | 0.66 | -0.09 | P |
| Guaiacum angustifolium | ||||
| Primavera | 4.93 | 1.23 | -0.6 | E |
| Verano | 3.2 | 1.55 | -0.35 | P |
| Otoño | 3.53 | 0.29 | -0.85 | E |
| Invierno | ||||
| Leucophyllum frutescens | ||||
| Primavera | 2.24 | 4.91 | 0.37 | S |
| Verano | 2.4 | 0.26 | -0.81 | E |
| Otoño | 0.88 | 0.29 | -0.5 | E |
| Opuntia engelmannii | ||||
| Primavera | 4.93 | 16.46 | 0.54 | S |
| Verano | 5.6 | 4.12 | -0.15 | P |
| Otoño | 2.35 | 10.26 | 0.63 | S |
| Invierno | 4.71 | 8.99 | 0.31 | P |
| Opuntia leptocaulis | ||||
| Primavera | 0.45 | 2.21 | 0.66 | S |
| Verano | ||||
| Otoño | 0.29 | 0.88 | 0.5 | S |
| Invierno | 0.78 | 0.88 | 0.06 | P |
| Vachellia rigidula | ||||
| Primavera | 9.42 | 8.11 | -0.07 | P |
| Verano | 5.6 | 11.08 | 0.33 | P |
| Otoño | 5 | 10.26 | 0.34 | P |
| Invierno | 7.45 | 12.94 | 0.27 | P |
Discusión
Los resultados del presente estudio pueden ser comparados con lo reportado en Edwards Plateau, Texas, Estados Unidos, ya que se identificó un número similar de especies en la dieta de A. lervia (69 spp.) (Ramsey & Anderegg, 1972). Sin embargo, en las montañas Boud Hedma, Túnez, África, solo consumió 19 especies (Ben Mimoun & Nouira, 2015). Estas variaciones en el número de especies en la dieta se deben a los cambios en la disponibilidad del forraje, influenciados por factores climáticos intrínsecos regionales (Ramírez-Lozano, 2012; Ben Mimoun & Nouira, 2015). En comparación con otros herbívoros de zonas áridas, A. lervia consumió un mayor número de especies. En la misma región de Coahuila, Lozano-Cavazos et al. (2020) identificaron 39 especies en la dieta de O. v. texanus y Gastelum-Mendoza (2020) reporta que O. c. mexicana consumió 49 especies. Guerrero-Cárdenas et al. (2016), encontraron 47 especies en la dieta de O. c. weemsi en la Sierra El Mechudo, Baja California Sur, y en Caborca, Sonora, O. c. mexicana se alimentó de 41 (Tarango et al., 2002). Asimismo, en Arizona y California, Estados Unidos, la dieta de O. canadensis se compuso por menos especies vegetales (58 y 32, respectivamente) (Krausman et al., 1989). Lo anterior, como consecuencia de que A. lervia ha desarrollado estrategias evolutivas más eficientes para el uso del forraje: la fisiología del tracto digestivo y sus largos dientes molares le permiten procesar un mayor número de especies vegetales (Ben Mimoun & Nouira, 2015).
Los herbívoros silvestres en zonas áridas consumen más arbustos durante la primavera y verano, ya que durante este período contienen más nutrientes digestibles (Bolen & Robinson, 2002). Esto explica que, durante la primavera A. lervia consumió más del 50 % de arbustivas. Además, en matorrales desérticos del norte de México y sur de Estados Unidos, las arbustivas representan la base de la dieta de herbívoros silvestres por estar disponibles durante la mayor parte del año (Watts, 1979; Tarango et al., 2002; Gastelum-Mendoza et al., 2019; Lozano-Cavazos et al., 2020). Asimismo, su consumo funciona como puente nutricional entre periodos de baja disponibilidad de forraje en zonas áridas (Ramírez et al., 1996). Además de su aporte a la dieta, se identificó una relación alta entre su consumo y disponibilidad (Fig. 5).
La diversidad promedio de la dieta de A. lervia (2.89 ± 0.13) fue menor que la de O. c. weemsi en Sierra El Mechudo, Baja California Sur (3.3) (Guerrero-Cárdenas et al., 2016). Sin embargo, fue mayor que la dieta de O. c. mexicana en Sierra El Viejo, Caborca, Sonora (0.51) (Tarango et al., 2002). Además de las arbustivas, los pastos representan una fuente importante de alimento para A. lervia, principalmente en su hábitat natural. En el Parque Nacional Bou Hedma, Túnez, tan solo dos especies de pastos representaron el 63 % de la dieta anual de A. lervia (Ben Mimoun & Nouira, 2015). Al respecto, Nowak (1999) menciona que el consumo de pastos y herbáceas por este bóvido, puede ser un factor de competencia alimentaria con especies nativas como el borrego cimarrón y el venado cola blanca, modificando su dinámica poblacional.
En México y Estados Unidos se ha evidenciado la importancia de pastos y herbáceas en la dieta de O. canadensis: en Nuevo México, Watts (1979) en Big Hatchet, y Elenowitz (1983) en Peloncillo, encontraron un alto porcentaje de pastos en la dieta (46 y 68 %, respectivamente). En Texas, O. canadensis consumió 35 % herbáceas y 11 % de pastos (Brewer & Harveson, 2007). De igual manera, en San Gabriel y Death Valley, California, el consumo de pastos fue alto (60 y 56 %, respectivamente) (Ginnet & Douglas, 1982; Perry et al., 1987). En México, Gastelum-Mendoza (2020) encontró un aporte alto de herbáceas (31.82 %) y pastos (15.83 %) en la dieta de O. c. mexicana en Coahuila. En Baja California Sur, O. c. weemsi consumió 26.9 % herbáceas (Guerrero-Cárdenas et al., 2016), y en Sonora se alimentó de 32 % herbáceas y 4.5 % pastos (Tarango et al., 2002). Esto indica que la disponibilidad de herbáceas y pastos, en las regiones donde A. lervia y O. canadensis convergen, podría ser un factor de competencia. Asimismo, no se encontró una relación alta entre la frecuencia de pastos y herbáceas en la dieta del borrego berberisco y su disponibilidad en el hábitat (Fig. 5).
La alfalfa (Medicago sativa), un cultivo utilizado ampliamente como complemento alimentario en la dieta de algunos herbívoros silvestres y domésticos (Contreras et al., 2019; Gaytán-Valencia et al., 2019), como el caso de O. v. texanus en la UMA Rancho San Juan; representó el 9.36 (± 5.97) % de la dieta anual de A. lervia. En este sentido, se identificó mediante fotografías registradas por cámaras-trampa que, los rebaños de borrego berberisco, utilizan los comederos-abrevaderos artificiales con suministro de agua y alfalfa, aun cuando se ubican en partes bajas o lomeríos, fuera del territorio que comúnmente utilizan dentro de Sierra Las Hormigas (Fig. 6).

Figura 6 Rebaño de Ammotragus lervia durante la estación de verano 2019 en la periferia de Sierra Las Hormigas, Monclova, Coahuila, México. Fotografías registradas por cámaras-trampa revelan que, esta especie frecuenta abrevaderos y comederos con suministro de alfalfa (Medicago sativa), instalados para el manejo de otros herbívoros, principalmente Odocoileus virginianus texanus (fotografía de Alejandro Lozano).
Las especies suculentas, especialmente nopales del género Opuntia, son particularmente importantes en la dieta de herbívoros silvestres en zonas áridas y semiáridas del norte de México, ya que representan una fuente de agua y contienen alto porcentaje de digestibilidad (Espino-Barros & Fuentes, 2005; Ramírez-Lozano, 2012); A. lervia solo seleccionó O. engelmannii durante primera y otoño, estaciones con ausencia de agua en los abrevaderos. Sin embargo, la presencia de fuentes de agua en verano, indican que consumió esta planta suculenta en función de su disponibilidad (Cuadro 2).
Ammotragus lervia consumió 64 especies vegetales, de ellas, 34 fueron de porte arbustivo. La dieta se conformó de 36 % arbustivas, 30 % herbáceas, 22 % pastos y 12 % suculentas. El consumo de arbustivas fue mayor en primavera, el de herbáceas en verano, el de pastos en otoño, y el de suculentas en primavera y verano. En promedio, el 40 % de la dieta se concentró en el consumo de Vachellia rigidula, Tiquilia canescens, Medicago sativa y Opuntia engelmannii. En todas las estaciones del año, Vachellia rigidula fue consumida en proporción a su disponibilidad; O. engelmannii y O. lepotacualis, en primavera y otoño; y Leucophyllum frutescens en primavera, fueron especies preferidas. Únicamente se identificó una relación alta (R2 = 0.84) entre el consumo de arbustivas y su disponibilidad en el hábitat.











 nueva página del texto (beta)
nueva página del texto (beta)



