Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud Pública de México
versión impresa ISSN 0036-3634
Salud pública Méx vol.43 no.6 Cuernavaca nov./dic. 2001
Enrique Acosta-Gío, CD, PhD,(1) Aurelio Herrero-Farías, CD,(2) Víctor Hugo Mata-Portuguez, CD.(2)
Acosta-Gío E, Herrero-Farías A, Mata-Portuguez VH.
El cloruro de benzalconio: inaceptable para esterilizar o desinfectar instrumental médico o dental.
Salud Publica Mex 2001;43:570-573.
El texto completo en inglés de este artículo está disponible en: http://www.insp.mx/salud/index.html
Resumen
Objetivo. Comparar la actividad esporicida del cloruro de benzalconio (CB) con la del glutaraldehído. Material y métodos. Estudio comparativo, hecho en el Laboratorio de Microbiología de la Facultad de Odontología, Universidad Nacional Autónoma de México (UNAM). Se expusieron esporas de Bacillus subtilis ATCC 9372 a estos germicidas (1 espora x µl) sobre un filtro de 0.22 µm. Al completarse el tiempo de contacto, se lavaron las esporas y los filtros fueron incubados sobre agar nutritivo por 72 h a 37ºC. Resultados. El CB no eliminó las esporas de B. subtilis a la concentración de uso, ni aun al incrementar a 15 h su exposición (900 veces el tiempo recomendado). El glutaraldehído al 2% destruyó las esporas después de 10 h. La urea y el cloruro de sodio no mostraron actividad esporicida. Conclusiones. Los resultados confirman que el CB carece de actividad esporicida y ratifican que este compuesto cuaternario de amonio no tiene aplicación como agente esterilizante o como desinfectante de instrumental médico y dental. El texto completo en inglés de este artículo está disponible en: http://www.insp.mx/salud/index.html
Palabras clave: compuestos de benzalconio; esterilización; desinfectantes; México
Acosta-Gío E, Herrero-Farías A, Mata-Portuguez VH.
Benzalkonium chloride is unacceptable to sterilize or disinfect medical or dental instruments.
Salud Publica Mex 2001;43:570-573.
The English version of this paper is available at: http://www.insp.mx/salud/index.html
Abstract
Objective. To compare the sporicidal activity of benzalkonium chloride (BKC) with that of glutaraldehyde. Material and Methods. A comparative study was conducted at the microbiology laboratory of Facultad de Odontología, Universidad Nacional Autónoma de México. Bacillus subtilis ATCC 9372 spores were exposed to these germicides (1 spore x mL) on a 0.22 mm filter. After completing the contact time the spores were washed and the filters were incubated on nutrient agar for 72 h at 37ºC. Results. BKC did not eliminate B. subtilis spores at the concentration used, not even after increasing contact time to 15 h (900-fold the recommended time). Two percent glutaraldehyde destroyed spores only after 10 h of contact. Urea and sodium chloride showed no sporicidal activity. Conclusions. The results confirm that BKC lacks sporicidal activity and confirm that this quaternary ammonium compound is not able to "sterilize" or "disinfect" medical and dental instruments. The English version of this paper is available at: http://www.insp.mx/salud/index.html
Key words: benzalkonium compounds; sterilization; disinfectants; sporicide; germicide; Mexico
El cloruro de benzalconio (CB) es un compuesto cuaternario de amonio (CCA), cuya fórmula condensada es n-alquil metil bencil cloruro de amonio.1
El CB tiene un pésimo historial como desinfectante. Diversas bacterias gram-negativas pueden desarrollarse en CB y se asociaron infecciones nosocomiales, algunas fatales, con instrumental inmerso en CB.2-5
En 1978, la Asociación Dental Americana (ADA) eliminó a los CCA, incluso al CB, de su programa de aceptación.6 Sin embargo, el CB es ampliamente empleado en América Latina.7
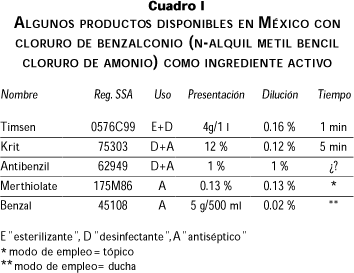
El cuadro I muestra algunos productos, con similares concentraciones de CB, que se anuncian indistintamente como antisépticos de uso externo, desinfectantes de instrumental en frío o esterilizantes efectivos en un minuto.8
La Organización Mundial de la Salud (OMS)9 y la Organización Panamericana de la Salud (OPS)10 emplean la terminología "esterilizante/alto-nivel, nivel intermedio, y bajo-nivel germicida". La OMS define la esterilización como la destrucción de todos los microrganismos, inclusive las esporas bacterianas.9 Un germicida esterilizante deberá destruir esporas de Bacillus subtilis y de Clostridium sporogenes.11
El propósito de este estudio, hecho en noviembre de 2000, fue evaluar la actividad esporicida del cloruro de benzalconio.
Material y métodos
El germicida Timsen (United Chemical Corp. Los Angeles CA) se empleó según las instrucciones de su etiqueta (4 g en 1 l de agua, con una concentración final de 0.16% de CB y 0.24% urea, ingrediente inerte). Otro germicida, el krit (Farmacéuticos Altamirano, México) fue empleado al 0.12 % de CB.
Como testigos se emplearon glutaraldehído al 2 % (Atosteril, A.T.O. Zizine, París), una solución de urea al 0.24 % (Sigma Chemicals. St Louis, MO) y solución salina con 140 mM de cloruro de sodio (Sigma Chemicals). Todas las soluciones se prepararon en agua bidestilada y desionizada.
Cada evaluación de la actividad esporicida se realizó por quintuplicado con 5 x 104 esporas de B. subtilis ATCC 9372 (SPS, Medical, Rush, NY) sobre un filtro de polivinilideno con límite de exclusión de 0.22 µm (Millipore Corp. Bedford, MA), según el método descrito por Collins.12 En breve, las esporas fueron suspendidas en solución salina y depositadas sobre el filtro. Entonces, la solución salina fue removida por succión y se suspendieron las esporas en 50 ml de la solución desinfectante a evaluar (1 espora x µl), durante 1, 20, 360, 600 o 900 minutos a temperatura ambiente. Al completarse el tiempo de exposición, el desinfectante fue removido y se lavaron las esporas en 5 ml de 1 % bisulfito de sodio para inactivar el glutaraldehído, seguido por enjuague en 300 ml de solución salina. Finalmente, los filtros fueron colocados, asépticamente, sobre agar nutritivo (Difco Labs, Detroit MI) e incubados por 72 h a 37ºC. Los resultados se expresaron como crecimiento o no-crecimiento.
Resultados
El cuadro II presenta los resultados de la evaluación esporicida. El CB no destruyó esporas de B. subtilis a la concentración de uso y tiempo de contacto estipulados en su etiqueta, ni al incrementar a 15 h la exposición.

El glutaraldehído al 2 % destruyó las esporas después de 10 h de contacto. La urea y la solución salina no mostraron actividad esporicida.
Discusión
Los resultados confirman que el CB carece de actividad esporicida y de propiedades esterilizantes o desinfectantes. Los desinfectantes para instrumental deben ser esporicidas. 13
Los insumos para la atención a la salud bucal deben cumplir con normas nacionales e internacionales.14 En los Estados Unidos de Norteamérica la Food and Drug Administration (FDA) regula los desinfectantes de alto nivel/esterilizantes que se emplean para reprocesar instrumental.15 La FDA no aprueba ningún CB como esterilizante o desinfectante aplicable al instrumental.
Los germicidas de bajo nivel, como el CB, pueden emplearse para limpiar superficies ambientales,1,6,10 empleando vestimenta protectora, pues existe la hipersensibilidad por exposición al CB.16-18
Las etiquetas de los productos disponibles en México tienen contradicciones y deficiencias, ya que describen al CB, lo mismo como antiséptico, que como desinfectante o esterilizante. Para desinfectar, la dilución del krit es 0.12% de CB y se aplica por 5 min, mientras que para el Antibenzil es 1 % CB, y no se establece el tiempo de contacto.
Los tiempos de contacto no deben ser arbitrarios. La OPS10 y la FDA13 indican la inmersión del instrumental en líquidos esterilizantes hasta por 10 horas. El Atosteril sólo mostró actividad esporicida después de 10 h, mayor tiempo de contacto que el aceptado en Francia (6 h) para este producto.
No se evaluó el CB contra micobacterias o bacterias vegetativas asociadas con infecciones nosocomiales, como Serratia marcensens, Staphylococcus aureus, Enterococcus sp. o Pseudomonas aeruginosa. Los CCA muestran poca o ninguna actividad contra esporas bacterianas, hongos y la mayoría de los virus,1 y no tienen actividad tuberculocida,19 por lo cual son inapropiados para la desinfección de superficies clínicas.
El CB es inadecuado, y hasta peligroso, para reprocesar instrumental.20-22 Recientemente se informó que el CB al 0.1% no es efectivo ni como enjuague bucal para reducir la acumulación de placa dentobacteriana23
La técnica de evaluación descrita por Collins,12 empleada en este estudio, es una modificación de los métodos oficiales.11 Mediante el uso de una membrana filtrante se evitan resultados falso negativos, ocasionados por la pérdida de esporas viables. El bisulfito de sodio sólo neutraliza al glutaraldehído. Se observó que al quedar CB en la membrana, por un lavado insuficiente, no hubo germinación de las esporas; este efecto bacteriostático es conocido desde hace treinta años24 y no debe ser confundido con una verdadera acción esporicida.
En esta investigación los líquidos germicidas fueron evaluados sólo en condiciones óptimas. Para su aprobación, los desinfectantes deben someterse a condiciones de peor escenario, como la presencia de contaminación orgánica e inorgánica, y bajo condiciones de uso simulado.13
La evidente ausencia de actividad esporicida del CB no requirió de confirmación con más réplicas o con C. sporogenes. Los criterios de actividad esporicida (desinfección de alto nivel germicida) sólo permiten dos fallas en 120 acarreadores. Para pasar la prueba de esterilización, no se toleran fallas.13
Para evitar el mal uso de desinfectantes, que pone en peligro vidas humanas, los lineamientos de la OMS9 y la OPS10 para la desinfección y la esterilización deben seguirse de acuerdo con los conceptos y la terminología empleada por la FDA,13,15 y por los expertos en control de infecciones.1,6,25
Referencias
1. Rutala WA. APIC Guideline for selection and use of disinfectants. Am J Infect Control 1996;24:313-342. [ Links ]
2. Schickman MD, Guze LB, Pearce ML. Bacteremia following cardiac catherization. N Engl J Med 1959;260:1164-1166. [ Links ]
3. Ehrenkranz NJ, Bolyard EA, Wiener M, Cleary TJ. Antibiotic-sensitive Serratia marcescens infections complicating cardiopulmonary operations: Contaminated disinfectant as a reservoir. Lancet 1980;2:1289-1292. [ Links ]
4. Sautter RL, Mattman LH, Legaspi RC. Serratia marcescens meningitis associated with a contaminated benzalkonium chloride solution. Infect Control 1984;5:223-225. [ Links ]
5. Nakashima AK, McCarthy MA, Martone WJ, Anderson RL. Epidemic septic arthritis caused by a Serratia marcescens and associated with a benzalkonium chloride antiseptic. J Clin Microbiol 1987;25:1014-1018. [ Links ]
6. American Dental Association. Council on dental therapeutics. Quaternary ammonium compounds not acceptable for disinfection of instruments and environmental surfaces in dentistry. J Am Dent Assoc 1978;97:855-856. [ Links ]
7. Maupomé G, Acosta-Gío E, Borges-Yáñez SA, Díez-de Bonilla FJ. Survey on attitudes toward HIV-infected individuals and infection control practices among dentists in Mexico City. Am J Infect Control 2000;28:21-24. [ Links ]
8. Acosta-Gío E. Olvídese de esterilizar sus instrumentos (Editorial). Practica Odontol 2000;21:2-3. [ Links ]
9. World Health Organization. Guidelines for sterilization and disinfection methods against HIV. 2nd, edition. Ginebra: WHO, 1989; WHO AIDS series 2. [ Links ]
10. Organización Panamericana de la Salud. La salud bucodental: repercusión de VIH/SIDA en la práctica odontológica. Washington, D.C.: OPS/PAHO, 1994. [ Links ]
11. Beloian A. Disinfectants. En: Helrich K, ed. AOAC Official methods of analysis. Arlington (VA): Association of Official Analytical Chemists 1990, 133-146. [ Links ]
12. Collins FM. Use of membrane filters for measurement of mycobactericidal activity of alkaline glutaraldehyde solution. Appl Environ Microbiol 1987;53:737-739. [ Links ]
13. Food and Drug Administration. Guidance for Industry and FDA Reviewers. Content and Format of Premarket Notification [510(k)] Submissions for Liquid Chemical Sterilants/High Level Disinfectants. Rockville (MD): FDA, January 3, 2000. [ Links ]
14. Poder Ejecutivo Federal. Modificación a la Norma Oficial Mexicana NOM-013-SSA2-1994 Para La Prevención de Enfermedades Bucales. México, D.F. Secretaría de Salud. Diario Oficial de la Federación, enero 21, 1999. [ Links ]
15. Memorandum of Understanding Between the Food and Drug Administration, Public Health Service, Department of Health and Human Services and the Environmental Protection Agency. Notice Regarding Matters of Mutual Responsibility - Regulation of Liquid Chemical Germicides Intended for Use on Medical Devices. June 4, 1993. Ammended June 20, 1994. [ Links ]
16. Krogsrud NE, Larsen AI. Airborne irritant contact dermatitis from benzalkonium chloride. Contact Dermatitis 1997;36:112. [ Links ]
17. Kanerva L, Jolanki R, Estlander T. Occupational allergic contact dermatitis from benzalkonium chloride. Contact Dermatitis 2000;42:357-358. [ Links ]
18. Park HJ, Kang HA, Lee JY, Kim HO. Allergic contact dermatitis from benzalkonium chloride in an antifungal solution. Contact Dermatitis 2000;42:306-307. [ Links ]
19. Rikimaru T, Kondo M, Kondo S, Oizumi K. Efficacy of common antiseptics against mycobacteria. Int J Tuberc Lung Dis 2000; 4:570-576. [ Links ]
20. Frank MJ, Schaffner W. Contaminated aqueous benzalkonium chloride: An unnecessary hospital infection hazard. JAMA 1976;236:2418-2419. [ Links ]
21. Dixon RE, Kaslow RA, Mackel DC, Fulkerson CC, Mallison GF. Aqueous quaternary ammonium antiseptics and disinfectants; use and misuse. JAMA 1976;236:2415-2417. [ Links ]
22. Rutala WA, Cole EC. Antiseptics and disinfectants-safe and effective? Infect Control 1984;5:215-218. [ Links ]
23. Moran J, Addy M, Jackson R, Newcombe RG. Comparative effects of quaternary ammonium mouthrinses on 4-day plaque regrowth. J Clin Periodontol 2000;27:37-40. [ Links ]
24. Geftic SG. Heyman H, Adair FW. Fourteen year survival of Pseudomonas cepacia in a salts solution preserved with benzalkonium chloride. Appl Environ Microbiol 1979;37: 505-510. [ Links ]
25. Organization for Safety and Asepsis Procedures. Infection Control Guidelines. Annapolis (MD): OSAP, 1997. [ Links ]
(1) Laboratorio de Microbiología y Control de Infecciones. División de Estudios de Posgrado e Investigación, Facultad de Odontología, Universidad Nacional Autónoma de México (UNAM). México, D.F.
(2) Tesistas, Facultad de Odontología, UNAM. México, D.F
Fecha de recibido: 27 de noviembre de 2000 • Fecha de aprobado: 23 de mayo de 2001
Solicitud de sobretiros: Dr. Enrique Acosta-Gío, Apdo. 70 ¾ 421, Ciudad Universitaria, 04510 México, D.F., México.
Correo electrónico: acostag@servidor.unam.mx














