Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de investigación clínica
versión On-line ISSN 2564-8896versión impresa ISSN 0034-8376
Rev. invest. clín. vol.56 no.1 Ciudad de México feb. 2004
Rev Invest Clín 2004; Vol. 56(1):72-82
ARTÍCULO DE REVISIÓN
Hígado graso no alcohólico. Nuevos conceptos
An update on non-alcoholic fatty liver disease
Nahum Méndez Sánchez
Norberto C. Chávez-Tapia
Misael Uribe
Departamento de Investigación Biomédica, Gastroenterología & Unidad de Hígado. Fundación Clínica Médica Sur. México, D.F, México.
Reimpresos:
Nahum Méndez -Sánchez M.D., Ph.D.
Departamentos de Investigación Biomédica,
Gastroenterología & Unidad de Hígado.
Fundación Clínica Médica Sur
Puente de Piedra 150
Col. Tiruello Guerra, 14050, México, D.F.
Teléfono: (+525) 606-6222,
Ext. 4215 Fax: (+525) 666-4031 y 606-1654;
Correo electrónico: nmendez@medicasur.org.mx
Recibido el 24 de julio de 2003.
Aceptado el 14 de octubre de 2003.
ABSTRACT
Non alcoholic fatty liver disease is a disease of emerging identity and importance. It is frequently associated with obesity, especially visceral fat, and is intimately related to fatty liver and markers of insulin resistance. Both the prevalence and the severity of liver steatosis are related to body mass index, waist circumference, hyperinsulinaemia, hypertriglyceridaemia and impaired glucose tolerance or type 2 diabetes. The identification fatty liver disease in obese patients, is very important in order to prevent complications such as steathohepatitis and cirrhosis. The pathogenesis of non alcoholic fatty liver disease is very complex, there are mitochondrial morphologic and functional alterations, as well as, high sensitivity to injurious stimulus, an increased inflammatory activity, and modifications in cellular metabolism at post-receptor level. Weight reduction is one of the first steps in the treatment of patients with non alcoholic fatty liver disease, as well as the management of associated conditions such as obesity, diabetes mellitus and hyperlipidaemia. Antioxidants, and others drugs such as ursodeoxycholic acid may be beneficial in the treatment of non alcoholic fatty liver disease. These medications, however, need first to be tested in well-controlled trials with clinically relevant end-points and extended follow-up. In this review, we analyze the new concepts in epidemiology, pathophysiology and treatment of this disease.
Key words.Non alcoholic fatty liver disease. Steatohepatitis. Obesity. Insulin resistance. Weight reduction. Antioxidants.
RESUMEN
El hígado graso no alcohólico es una enfermedad emergente de gran importancia en el momento actual. Esta entidad se asocia frecuentemente con obesidad y resistencia a la insulina. Su prevalencia y gravedad están en relación con variables como el índice de masa corporal, cintura, hiperinsulinemia, hipertrigliceridemia y resistencia a la insulina. La identificación de estos pacientes es de capital importancia con el objetivo de prevenir las complicaciones potenciales como la esteatohepatitis no alcohólica o la cirrosis. Dentro de la patogenia del hígado graso no alcohólico se han descrito alteraciones funcionales y morfológicas a nivel mitocondrial, otros factores implicados son una mayor susceptibilidad a estímulos nocivos, incremento en la actividad inflamatoria y modificaciones en la maquinaria celular a nivel postreceptor. Por lo tanto, las modalidades terapéuticas son diversas, siendo la medida más útil el adecuado control del peso, así como el manejo de las enfermedades concomitantes. El uso de antioxidantes y otros fármacos citoprotectores como el ácido ursodesoxicólico han mostrado cierto beneficio, aunque se requieren análisis a largo plazo para corroborar estas observaciones. En esta revisión analizamos los conceptos más recientes sobre epidemiología, fisiopatología y tratamiento de esta enfermedad.
Palabras clave. Hígado graso no alcohólico. Esteatohepatitis. Obesidad. Resistencia a la insulina. Reducción de peso.
INTRODUCCIÓN
La cirrosis criptogénica es la causante de 3 a 31% de todos los casos de hepatopatía, condicionando de 7 a 14% de los trasplantes hepáticos. Interesantemente, el porcentaje de cirrosis criptogénica disminuyó al demostrar que 70% de estos casos eran debidos a hígado graso no alcohólico. 1-3 En 1980 Ludwig y cols. 3 acuñan el nombre de esteatohepatitis a un síndrome clínico-patológico bien reconocido que se presenta predominantemente en personas con obesidad, del género femenino, con diabetes mellitus en los cuales no existe el antecedente de consumo y/o abuso de alcohol, pero en los que la biopsia hepática muestra cambios histopatológicos similares a los que se observan en hepatitis alcohólica. 3 En los últimos 20 años ha existido un interés creciente por determinar las características clínicas, epidemiológicas y fisiopatológicas de este síndrome; en especial ante la adición del síndrome de resistencia a la insulina, el cual parece formar parte de esta entidad patológica y de las enfermedades que lo rodean. El objetivo de esta revisión es analizar las características clínicas, epidemiológicas, fisiopatológicas, y terapéuticas más importantes relacionadas con esta entidad.
DEFINICIÓN
El término hígado graso no alcohólico (NAFLD por sus siglas en inglés) incluye alteraciones mínimas que van desde la esteatosis hepática hasta la cirrosis e insuficiencia hepática. 4 Esta enfermedad ha recibido distintas denominaciones incluyendo hepatitis grasa, enfermedad de Laënnec no alcohólica, hepatitis diabética, hepatopatía parecida a la alcohólica, y esteatohepatitis no alcohólica (NASH por sus siglas en inglés). 5 La diversidad de términos, asociada a la falta de sensibilidad y especificidad de las pruebas no invasivas para el diagnóstico de NAFLD ha dificultado su precisión diagnóstica, así como establecer su incidencia y prevalencia. Desde 1980 y durante los siguientes 20 años surgieron diversos criterios diagnósticos, 3,4,6-8 que en forma global toman en consideración los siguientes aspectos: 9
Histología
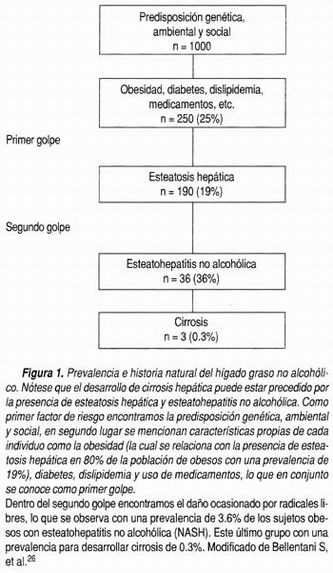
Biopsia hepática con datos de degeneración grasa macrovesicular moderada a avanzada, inflamación (lobular o portal) que se pueden acompañar o no de cuerpos de Mallory, fibrosis o cirrosis (Figura 1).
Uso de alcohol
Falta de consumo de etanol confirmado por miembros de la familia, médicos de atención primaria o pruebas de laboratorio. En el momento actual no existen elementos que determinen la dosis discriminatoria de alcohol.
Enfermedades concomitantes
Ausencia de otras enfermedades hepáticas activas. La falta de un consenso internacional para definir a la NALFD generó diversas definiciones operativas que van desde la rigurosidad histopatológica, 10 hasta la flexibilidad de recientes estudios epidemiológicos. 11La Asociación Americana para el Estudio de las Enfermedades del Hígado, publicó un consenso internacional para el diagnóstico de NASH (Cuadro 1). 12
Considerando que la resistencia a la insulina juega un papel importante en la fisiopatología de la NAFLD y NASH, la determinación de un marcador de resistencia a la insulina en la evaluación de estos pacientes parece ser razonable. Sin embargo, la determinación de resistencia a la insulina merece consideraciones metodológicas importantes que quedan fuera de los objetivos de esta revisión.
Epidemiología
Dependiendo del criterio diagnóstico utilizado la prevalencia de la NAFLD va de 2.8% hasta 25% en la población general. 11,13,14 Recientemente se ha publicado una prevalencia promedio de 16%, considerando poblaciones con características demográficas diferentes. 15 Esta prevalencia es mucho mayor en grupos de alto riesgo, alcanzando valores de entre 70-86%, en pacientes obesos y/o diabéticos. 16,17 La relación NASH/NAFLD se estima de 1:10 aproximadamente, tomando como base estudios histopatológicos, 18 la importancia clínica de estos datos radica en que hasta 90% de los casos diagnosticados como cirrosis criptogénica son consecuencia de NAFLD. 19 Las condiciones asociadas a esta patología fueron descritas hace más de 20 años, y desde entonces se determinó su importancia en el desarrollo y evolución de la enfermedad (Cuadro 2).
Uno de los elementos que juega un papel protagónico es la obesidad, la cual tiene efectos deletéreos en el pronóstico de otras enfermedades hepáticas distintas a la NAFLD. 20-23 A pesar de que la obesidad se encuentra comúnmente asociada a NAFLD, no se observa en 100% de los casos. En diversas cohortes de pacientes obesos la prevalencia de NAFLD varía entre 50 a 90%, observándose una prevalencia mayor en pacientes del género femenino. 14 Se estima que 65% de los pacientes con niveles elevados de alaninoaminotransferasa se pueden explicar por el sobrepeso y obesidad. 11 Los hábitos alimentarios son un factor importante en el desarrollo de NASH, incluso en pacientes no obesos; de los indicadores que se asocian con más frecuencia al desarrollo de NASH, es el porcentaje de energía total y el porcentaje total de grasa ingerida, este último en especial es hasta seis veces más alto en pacientes con NASH. 24 De igual manera se ha observado que los pacientes con NASH tienen un consumo más alto de colesterol al día, un consumo menor de grasa poliinsaturada y fibra. Estos datos sin duda son de gran valor para el desarrollo de estrategias de tipo alimentario que disminuyan la prevalencia de la enfermedad incluso en pacientes no obesos.24 Tomando en consideración los factores genéticos y ambientales que influyen en la historia natural de la NAFLD, se estima que hasta 0.3% de los pacientes con predisposición genética pueden desarrollar cirrosis hepática (Figura 1).
Fisiopatología
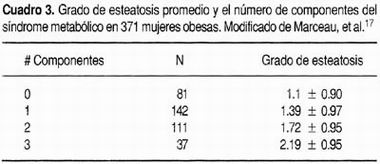
La fisiopatología de la NAFLD no ha sido determinada por completo, tomando en consideración los múltiples factores que intervienen en su desarrollo. Existen cambios muy bien definidos que desencadenan el daño citopático en estos pacientes, tales como la acumulación de lípidos dentro de los hepatocitos, principalmente en forma de triglicéridos. 5Con base en los estudios epidemiológicos se ha observado que los principales factores de riesgo para desarrollar NAFLD guardan relación estrecha con el síndrome de resistencia a la insulina, por lo que la respuesta del hígado al síndrome de resistencia a la insulina ha sido determinante en el entendimiento de esta patología. 24-26La infiltración grasa del hígado surge como respuesta a una gran variedad de estímulos nocivos que incluyen hipoxia, toxinas, inflamación sistémica, neoplasias malignas, ayuno, deficiencias nutricionales y diversas alteraciones metabólicas. 17,18 Aunque el hígado graso es por sí mismo una condición benigna, puede participar en la progresión de fibrosis, hacia cirrosis y la falla hepática. 8 Los efectos de la obesidad y la consecuente infiltración grasa en el hígado afectan de forma deletérea la evolución de las hepatopatías crónicas y de las hepatopatías terminales. Ratziu y cols. 24 demostraron que los pacientes con cirrosis criptogénica y cirrosis por infección por el virus de hepatitis C que presentan obesidad tienen una calificación de Child más alta que aquellos pacientes de las mismas características pero sin obesidad, incluso la mortalidad acumulada es mayor para aquellos que tienen obesidad. 24 En pacientes con infección por el virus de hepatitis C el índice de masa corporal es un predictor independiente tanto de fibrosis y esteatosis; 27 esta misma relación se observa en pacientes sin infección por el virus de hepatitis C. 28Una de las consecuencias más importantes de la obesidad es el hiperinsulinismo 29 que se considera uno de los elementos principales en el desarrollo del síndrome metabólico, 30 existe una relación directa entre el grado de infiltración grasa del hígado y la sensibilidad a la insulina, incluso de forma independiente al índice de masa corporal, distribución de grasa intraabdominal y obesidad general, 31 aunque está determinado que la obesidad visceral guarda relación con el tamaño y contenido de grasa del hígado. 32 En torno a la distribución de grasa corporal, la relación cintura/cadera es uno de los factores que más influyen en el incremento del riesgo relativo de desarrollar esteatosis hepática (OR 3.7). 32Existe una relación clínica directa importante entre el número de componentes del síndrome metabólico y el grado de esteatosis hepática (Cuadro 3). La presencia de cuatro componentes del síndrome metabólico: distribución de grasa corporal, intolerancia a la glucosa, hipertensión y dislipidemia, se correlacionan de forma significativa con el grado de infiltración grasa en el hígado. Los efectos del síndrome metabólico no únicamente influyen en el grado de esteatosis, ya que el grado de fibrosis hepática tiene una correlación directa con las concentraciones de glucosa de ayuno, relación cintura/cadera, índice de masa corporal y la presencia de diabetes mellitus. De hecho, uno de los predictores más importantes para el desarrollo de cirrosis en pacientes obesas es la presencia de diabetes. 17 Diversos mecanismos han sido propuestos para explicar el daño del hepatocito en los pacientes obesos, los cuales se han postulado como mecanismos adaptativos ante el incremento en la capacidad de oxidación de sustratos, observándose un incremento en el transporte de electrones en modelos animales obesos, lo que incrementa las concentraciones locales de especies reactivas de oxígeno. 33 Estas adaptaciones al stress crónico incluyen inhibición del gen de la ciclina D-1, activación aumentada del transductor de señal y activador de la transcripción 3 (Stat-3, por sus siglas en inglés), depleción del ATP hepático e inhibición de los estados replicativos del ciclo celular. 34 En pacientes con NASH y diabetes se observan cambios en el funcionamiento mitocondrial, alteraciones estructurales asociadas a incremento en la liberación de ácidos grasos libres, así como un incremento en la β-oxidación de los ácidos grasos que favorece la formación de radicales libres. 35
Aunado a este incremento en la producción de especies reactivas de oxígeno, en modelos animales se demuestra que el hígado de los animales obesos es mucho más sensible a los estímulos nocivos, en especial ante la respuesta al factor de necrosis tumoral α(TNFα), y a endotoxinas. Existen además alteraciones inmunológicas que pueden influir en el desarrollo de fibrosis, en especial se observa disminución de los fagocitos en las zonas 1 y 2 de los acinos hepáticos de ratas obesas. Los mecanismos moleculares implicados en esta sensibilización no son claros del todo; sin embargo, la sobreexpresión del interferón γ (IFγ) ante la exposición de lipopolisacáridos parece ser uno de los mecanismos más importantes. 36El metabolismo de los ácidos grasos libres muestra ciertas particularidades que influyen en el desarrollo de resistencia a la insulina y se reflejan en las alteraciones hepáticas que condicionan el desarrollo de NAFLD. Es ampliamente aceptado que el incremento en la disponibilidad y utilización de los ácidos grasos libres contribuye al desarrollo de resistencia a la insulina a nivel musculoesquelético, además se ha observado que los ácidos grasos libres incrementan la producción endógena de glucosa y se les ha documentado diversos mecanismos de toxicidad directa e indirecta, que en conjunto pueden influir en el daño ocasionado en NAFLD (Cuadro 4). 12
Los efectos de los ácidos grasos libres también involucran cambios en la producción de factores transportadores de proteínas y factores de transcripción determinantes del funcionamiento, en especial se ha observado una regulación a la baja en el casete transportador A1 unido a ATP (ABCA1 por sus siglas en inglés) debido a la supresión o inhibición del factor de transcripción nuclear del receptor X alfa del hígado (LXRα por sus siglas en inglés), esta inhibición se da tanto a nivel transcripcional y postranscripcional. 37,38Además de los efectos adversos de las altas concentraciones de ácidos grasos libres, otros de los mecanismos involucrados en el síndrome de resistencia a la insulina incluyen aquellos relacionados con el gen Rad (ras asociado con diabetes, por sus siglas en inglés), el cual interfiere con funciones celulares esenciales (crecimiento, diferenciación, transporte vesicular y transducción de señales); PC-1 (una glucoproteína de membrana que participa en la resistencia a la insulina) la cual reduce la actividad de la tirosina cinasa inducida por insulina; leptina, que induce la desfosforilación del sustrato 1 del receptor de insulina, 5,16 este sustrato promueve la translocación de la proteína transportadora de glucosa GLUT4, 12 factor de crecimiento del hepatocito, incrementándose hasta 300% de los valores habituales. 39 El factor de crecimiento de los hepatocitos juega un papel importante en la actividad regenerativa del hígado, pero sus efectos metabólicos son interesantes en especial en el metabolismo de los carbohidratos. En estudios realizados con hepatocitos de rata cultivados, el factor de crecimiento del hepatocito inhibe la utilización de glucógeno estimulada por la insulina, además de favorecer inhibición en la síntesis de glucógeno debido a disminución en la actividad de glucógeno-sintetasa e incremento de la actividad de la glucógeno-fosforilasa. 40La sensibilidad a la insulina también es regulada por otros mediadores peptídicos. El tejido adiposo, especialmente la grasa mesentérica en la cual su flujo de sangre venoso se dirige directamente al hígado, es una fuente importante de citocinas y hormonas peptídicas que regulan a la baja la actividad metabólica. Uno de los ejemplos más importantes es el TNFα, el cual se deriva principalmente del tejido adiposo en ausencia de infecciones activas o alteraciones inflamatorias, bajo condiciones normales los niveles de TNFα se correlacionan con la grasa corporal. 41 En modelos experimentales de ratones con resistencia a la insulina y NAFLD se observa un estado de inflamación crónica caracterizado por niveles elevados de TNFα. 41Sin embargo, los pacientes con NAFLD tienen resistencia a la insulina incluso de forma independiente a la presencia de diabetes, obesidad o dislipidemia, 42 lo cual indica que si bien es cierto comparten características y mecanismos fisiopatológicos similares, existen diferencias intrínsecas importantes. 43Todo parece indicar que la inflamación regula de forma importante la resistencia a la insulina, en especial por la activación del factor de transcripción nuclear κB, que regula la expresión de citocinas proinflamatorias como el TNF-α e IL-8. Otro dato que apoya la importancia de las citocinas proinflamatorias en la NAFLD es el hecho de que el metronidazol y la polimixina pueden prevenir el desarrollo de NAFLD en pacientes obesos con cirugía intestinal de derivación, 44 y que reciben nutrición parenteral, evidenciando el papel de las endotoxinas/citocinas como factor desencadenante de NAFLD. Este dato sugiere que el stress oxidativo y la peroxidación de lípidos pueden ser unos de los factores involucrados en la génesis y progresión de la NAFLD. 48Existen diversos modelos animales para el estudio de la NAFLD, éstos desarrollan resistencia a la insulina por diversas causas, teniendo esto en consideración los distintos modelos animales pueden ser modificados (o no) genéticamente, para desarrollar esteatosis, aunque el desenlace final de todos estos modelos es el desarrollo de esteatosis y en mayor o menor magnitud el desarrollo de fibrosis, los mecanismos por los que ocurren no parecen ser iguales en todos los casos, lo cual debe tenerse presente al considerar datos fisiopatológicos o terapéuticos derivados de éstos (Cuadro 5).
Durante la historia natural de la esteatohepatitis no alcohólica, se han diferenciado dos momentos determinantes en la evolución de la NAFLD. La teoría de la agresión múltiple postula dos agresiones; (Figura 1) la primera surge a partir del incremento del tejido adiposo que ocasiona una elevación de los ácidos grasos libres y la infiltración grasa del hígado (esteatosis), este cambio estructural "sensibiliza" al hígado ante el estímulo de los metabolitos del estrés oxidativo con la consiguiente necrosis e inducción de apoptosis; así como un incremento en la expresión del TNF-α que favorece la apoptosis, quimiotaxis y la activación de las células estelares; y de los requerimientos de energía por alteración funcional y morfológica mitocondrial, lo que ocasiona la transformación de la esteatosis hacia la esteatohepatitis (segunda agresión). 26
Tratamiento
Considerando los diversos procesos fisiopatológicos involucrados en el desarrollo y progreso de la NAFLD, las modalidades terapéuticas comparten esta misma diversidad, con distintos resultados. Las estrategias de tratamiento comparten puntos primordiales, principalmente el contrarrestar los efectos del síndrome de resistencia a la insulina, los medios para lograr este objetivo han sido abordados desde diversas disciplinas (Figura 2). Otro elemento a considerar en el tratamiento de la NAFLD es la divergencia de respuesta a tratamiento entre los modelos experimentales, animales y humanos, los cuales no siempre guardan una adecuada concordancia.
El tratamiento de los pacientes con NAFLD típicamente se ha enfocado al manejo de las condiciones asociadas tales como obesidad, diabetes mellitus y dislipidemia.
REDUCCIÓN DE PESO
La reducción de peso ha demostrado mejorar la sensibilidad a la insulina, 50 por lo que la NAFLD puede mostrar mejoría con un programa de reducción de peso. Existen 14 estudios publicados 48-61 donde se demuestran los resultados del control del peso por medio de la dieta. Estos estudios presentan diversas deficiencias metodológicas, lo que limita la posibilidad de afirmar contundentemente los efectos del control dietético en la NAFLD. Hasta este momento, se ha demostrado que el control dietético ha mejorado las variables bioquímicas de los pacientes con NAFLD, aunque no en todos los casos se pudo corroborar si esta mejora bioquímica se acompañaba de cambios morfológicos demostrados por biopsia. Los cambios histológicos son más evidentes después de una disminución de 11 a 20 kg de peso durante un año, 49 es notable que en casos de disminución de peso de forma abrupta puede existir disminución del daño morfológico documentado por histología sin que muestre una mejoría en marcadores bioquímico. 51 Estos cambios tanto bioquímicos como histológicos se consiguen en condiciones controladas en los que el manejo dietético se basa en dietas muy bajas en calorías (500 calorías/día). Sin embargo, se requiere al menos una disminución de 10% del peso corporal para conseguir modificaciones en las variables bioquímicas. 54 Actualmente se considera que una pérdida gradual de peso es el primer paso (y unos de los más útiles) en el manejo de los pacientes con esteatosis no complicada, 57,60 se debe tener especial consideración en torno a la disminución gradual de peso, ya que hasta una quinta parte de los pacientes, particularmente aquellos con una reducción de peso pronunciada y acelerada, desarrollan fibrosis o inflamación portal. 52 Esta respuesta paradójica puede ser causada por un incremento en los niveles circulantes de ácidos grasos libres derivados de la movilización del tejido adiposo, incrementando sus niveles intrahepáticos favoreciendo el stress oxidativo, peroxidación de lípidos e inducción de citocinas; que en conjunto empeoran el daño hepático. 45 Por lo anterior, se recomienda que el objetivo inicial del control del peso sea una pérdida de 10% en un periodo de seis meses, es decir, una pérdida aproximada de 450-900 g por semana. 61 En aquellos pacientes con NAFLD pero sin obesidad, se debe hacer mayor énfasis en el cambio de los componentes de la dieta y no así en la disminución de la ingesta calórica, además de favorecer la actividad física, 47 al parecer estos pacientes son candidatos a la terapia farmacológica. 45 En el caso de los pacientes con NAFLD, diabetes mellitus y/o dislipidemia, la primera medida terapéutica es el adecuado control del peso, debido a que el control adecuado de la glucemia y los lípidos no siempre se acompaña de mejoría en la condición hepática. 45
OTROS TRATAMIENTOS
El uso de agentes sensibilizadores a la acción de la insulina es una de las estrategias que fisiopatológicamente parece ser más eficaz. El uso de tiazolodinedionas en estudios pilotos de un año de duración muestran resultados positivos con una adecuada tolerancia al tratamiento. Sin embargo, estos resultados deben ser reproducidos en grandes estudios poblacionales, controlados con placebo, con un adecuado seguimiento, para poder determinar su seguridad en pacientes con NAFLD. 45 El uso de rosiglitazona ha mostrado disminución de los niveles de enzimas hepáticas, que van de forma paralela a la disminución de la resistencia a la insulina. 62 Otro de los sensibilizadores de la insulina es el metformin, el cual en modelos animales ha ocasionado disminución de la hepatomegalia y el grado de esteatosis, así como normalización de los niveles de aminotransferasas, 63 resultados similares se han observado en humanos. 64El uso de diversos antioxidantes ha mostrado cierta utilidad en el manejo de la NAFLD, dentro de este grupo de fármacos se incluyen: vitamina E, vitamina C, betaína, N-acetilcisteína y depleción de hierro. 45 La vitamina E es un potente antioxidante particularmente efectivo en contra de la peroxidación de lípidos de membrana, y previene la activación de células estelares, 65 el uso de dosis entre 400-1,200 UI/día mejora los valores bioquímicos de la función hepática y de marcadores de inflamación como el factor transformador de crecimiento β1, 66 el uso concomitante de vitamina D y vitamina C muestra mejores resultados que el uso de placebo. 67La betaína es un componente normal del ciclo metabólico de la metionina que incrementa los niveles de S-adenosilmetionina, protegiendo al hígado del daño que causan los triglicéridos producidos por la ingesta de alcohol. 68 Su uso crónico ocasiona una disminución de los valores de las enzimas hepáticas, pero no se ha observado regresión o detención del daño histológico. 69 El uso de N-acetilcisteína muestra mejorías significativa en los valores de aminotransferasas, la N-acetilcisteína es un precursor del glutation que incrementa los niveles de este compuesto en el hepatocito, lo que limita el daño ocasionado por las especies reactivas de oxígeno y por ende protege del stress oxidativo. 70
El uso de agentes hipolipemiantes (como el clofibrato que disminuye el contenido de triglicéridos hepáticos que se induce por el consumo de alcohol) ha mostrado resultados contradictorios en los pacientes con NAFLD. 71,72
El ácido ursodesoxicólico es un epímero del ácido quenodesoxicólico, debido al reemplazo realizado por los ácidos biliares endógenos, posee propiedades hepatoprotectoras, por la disminución de ácidos biliares hidrofóbicos que origina, disminuye la lesión del hepatocito ocasionada por el stress oxidativo en pacientes con NAFLD, también se ha demostrado que disminuye la producción de TNF-α. 56 El uso de ácido ursodesoxicólico muestra mejoría significativa en los niveles de aminotransferasas cuando se utiliza por periodos de al menos 12 meses, 71 incluso esta mejoría bioquímica sigue siendo importante cuando se compara con pacientes tratados únicamente con dieta. 73 Recientemente nuestro grupo ha observado una mejoría bioquímica y del grado de esteatosis medido por ultrasonido, incluso cuando se compara con pacientes que recibieron manejo dietético a mediano plazo con el uso de ácido ursodesoxicólico. 58
CONCLUSIONES
A pesar de los grandes avances que se han realizado en la patogenia de la NAFLD, aún quedan múltiples interrogantes por resolver. Así como en su historia natural. En el futuro, éstos serán determinantes en el tratamiento y prevención de esta enfermedad emergente de gran importancia en el momento actual.
REFERENCIAS
1. Kodali VP, Gordon SC, Silverman AL, McCray DG. Cryptogenic liver disease in the United States: further evidence for non-A, non-B, and non-C hepatitis. Am J Gastroenterol 1994; 89: 1836-9. [ Links ]
2. Poonawala A, Nair SP, Thuluvath PJ. Prevalence of obesity and diabetes in patients with cryptogenic cirrhosis: a case-control study. Hepatology 2000; 32: 689-92. [ Links ]
3. Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc 1980; 55: 434-8. [ Links ]
4. Mantteoni CA, Younossi ZM, Gramlich T, Boparai N, Liu YC, Mc-Cullough AJ. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology 1999; 116: 1413-19. [ Links ]
5. Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002; 346: 1221-31. [ Links ]
6. Powell EE, Cooksley WGE, Hanson R, Searle J, Halliday JW, Powell LW. The natural history of non-alcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology 1990; 11: 74-80. [ Links ]
7. Lee RG. Non-alcoholic steatohepatitis: A study of 49 patients. Hum Pathol 1989; 20: 595-8. [ Links ]
8. Bacon RG, Farahvash MJ, Janney CG, Neuschwander-Tetri BA. Non-alcoholic steatohepatitis: an expanded clinical entity. Gastroenterology 1994; 107: 1103-9. [ Links ]
9. McCullough AJ. Non-alcoholic liver disease: natural history. In Steatohepatitis (NASH and ASH). Eds: Leushner U, James OFW, Dancygier H. Kluwer Academia Publishers, Netherlands 2001; 11-20. [ Links ]
10. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological fatty liver disease. Am J Gastroenterol 1999; 94: 2467-74. [ Links ]
11. Ruhl CE, Everhart JE. Determinants of the association of overweight with elevated serum alanine aminotransferase activity in the United States. Gastroenterology 2003; 124: 71-9. [ Links ]
12. Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD single topic conference. Hepatology 2003; 37: 1202-19. [ Links ]
13. Falck-Ytter Y, Younossi ZM, Marchesini G, McCullough AJ. Clinical features and natural history of nonalcohlic steatosis syndromes. Semin Liver Dis 2001; 21: 17-26. [ Links ]
14. Clark JM, Brancati FL, Diehl AM. Nonalcoholic fatty liver disease. Gastroenterology 2002; 122: 1649-57. [ Links ]
15. Bellentani S, Saccoccio G, Masutti Flora, Crocè LS, Brandi G, Sasso F, Cristanini G, Tiribelli C. Prevalence of and risk factors for hepatic steatosis in nothern Italy. Ann Intern Med 2000; 132: 112-17. [ Links ]
16. Nakao K, Nakata K, Ohtsubo N, Maeda M, Moriuchi T, Ichikawa T, Hamasaki K, Kato Y, Eguchi K, Yukawa K, Ishii N. Association between nonalcoholic fatty liver, markers of obesity, and serum leptin level in young adults. Am J Gastroenterol 2002; 97: 1796-801. [ Links ]
17. Marceau P, Biron S, Hould FS, Marceau S, Simard S, Thung SN, Kral JG. Liver pathology and the metabolic syndrome X in severe obesity. J Clin Endocrinol Metab 1999; 84: 1513-17. [ Links ]
18. Méndez-Sánchez N, Uribe M. Obesidad. Epidemiología, Fisiopatología y Manifestaciones Clínicas. México: El Manual Moderno; 2002. [ Links ]
19. Hilden M, Christoffersen P, Juhl E, Dalgaard JB. Liver histology in a "normal" population-examinations of 503 consecutive fatal traffic casualties. Scand J Gastroenterol 1977; 12: 593-7. [ Links ]
20. Silverman JF, O'Brien KF, Long S, Leggett N, Khazanie PG, Pories WJ, Norris HT, Caro JF. Liver pathology in morbidly obese patients with and without diabetes. Am J Gastroenterol 1990; 85: 1349-55. [ Links ]
21- Diehl AM, Goodman Z, Isaac KG. Alcohol-like disease in non-alcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology 1988; 95: 1056-62. [ Links ]
22. Angulo P, Keach JC, Batts KP, Lindor KD. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology 1999; 82: 1356-62. [ Links ]
23. Merchesini G, Bugianesi E, Forlani G, Cerrelli F, Lenzi M, Manini R, Natale S, Vanni E, Villanova N, Melchionda N, Rizzetto M. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology 2003; 37: 917-23. [ Links ]
24. Ratziu V, Bonyhay L, Di Martino V, Charlotte F, Cavallaro L, Sayegh-Tainturier MH, Giral P, Grimaldi A, Opolon P, Poynard T. Survival, liver failure, and hepatocellular carcinoma in obesity-related cryptogenic cirrhosis . Hepatology 2002; 35: 1485-93. [ Links ]
25. Musso G, Gambino R, De Michieli F, Cassader M, Rizzetto M, Durazzo M, Fagà E, Silli B, Pagano G. Dietary habits and their relations to insulin resistance and postprandial lipemia in nonalcoholic steatohepatitis. Hepatology 2003; 37: 909-16. [ Links ]
26. Bellentani S, Tiribelli. Epidemiology and risk factors for fatty liver. In: Steatohepatitis (NASH and ASH). Eds: Leuschner U, James OFW, Dancygier H. Netherlands: Kluwer Academic Publishers; 2001, p. 3-10. [ Links ]
27. Friedenberg F, Pungpapong S, Zaeri N, Braitman LE. The impact of diabetes and obesity on liver histology in patients with hepatitis C. Diabetes Obes Metab 2003; 5: 150-5. [ Links ]
28. Poniachik J, Mancilla C, Contreras J, Csendes A, Smok G, Cavada G, Rojas J, Oksenberg D, Burdiles P, Maluenda F, Diaz JC. Obesity: risk factor for steatohepatitis and hepatic fibrosis. Rev Med Chil 2002; 130: 731-6. [ Links ]
29. Bacha F, Saad R, Gungor N, Janosky J, Arslanian SA. Obesity, regional fat distribution, and syndrome x in obese black versus white adolescents: race differential in diabetogenic and atherogenic risk factors. J Clin Endocrinol Metab 2003; 88: 2534-40. [ Links ]
30. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-97. [ Links ]
31. Seppala-Lindroos A, Vehkavaara S, Hakkinen AM, Goto T, Westerbacka J, Sovijarvi A, Halavaara J, Yki-Jarvinen H. Fat accumulation in the liver is associated with defects in insulin suppression of glucose production and serum free fatty acids independent of obesity in normal men. J Clin Endocrinol Metab 2002; 87: 3023-8. [ Links ]
32. Busetto L, Tregnaghi A, De Marchi F, Segato G, Foletto M, Sergi G, Favretti F, Lise M, Enzi G. Liver volume and visceral obesity in women with hepatic steatosis undergoing gastric banding. Obes Res 2002; 10: 408-11. [ Links ]
33. Chavin KD, Yang S, Lin HZ, Chatham J, Chacko VP, Hoek JB, Walajtys-Rode E, Rashid A, Chen CH, Huang CC, Wu TC, Lane MD, Diehl AM. Obesity induces expression of uncoupling protein-2 in hepatocytes and promotes liver ATP depletion. J Biol Chem 1999; 274: 5692-700. [ Links ]
34. Yang SQ, Lin HZ, Mandal AK, Huang J, Diehl AM. Disrupted signaling and inhibited regeneration in obese mice with fatty livers: implications for nonalcoholic fatty liver disease pathophysiology. Hepatology 2001; 34: 694-706. [ Links ]
35. Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology 2001; 120: 1183-92. [ Links ]
36. Yang SQ, Lin HZ, Lane D, Clemens M, Diehl AM. Obesity increases sensitivity to endotoxin liver injury: implications for the pathogenesis of steatohepatitis. Proc Natl Acad Sci USA 1997; 94: 2557-62. [ Links ]
37. Matthaei S, Stumvoll M, Kellerer M, Häring H-U. Pathophysiology and pharmacological treatment of insulin resistance. Endocrine Reviews 2000; 21: 585-618. [ Links ]
38. Uehara Y, Engel T, Li Z, Goepfert C, Rust S, Zhou X, Langer C, Schachtrup C, Wiekowski J, Lorkowski S, Assmann G, von Eckardstein A. Polyunsaturated fatty acids and acetoacetate downregulate the expression of the ATP-binding cassette transporter A1. Diabetes 2002; 51: 2922-8. [ Links ]
39. Rehman J, Considine RV, Bovenkerk JE, Li J, Slavens CA, Jones RM, March KL. Obesity is associated with increased levels of circulating hepatocyte growth factor. J Am Coll Cardiol 2003; 4: 1408-13. [ Links ]
40. Kaibori M, Kwon AH, Teshima S, Nakanishi H, Kitano T, Kamiyama Y, Okumura T. Hepatocyte growth factor inhibits insulin-stimulated glycogen synthesis in primary cultured hepatocytes. J Hepatol 2003; 38: 407-13. [ Links ]
41. Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Increased adipose tissue of tumor necrosis factor-α in human obesity and insulin resistance. J Clin Invest 1995; 95: 2409-15. [ Links ]
42. Li Z, Clark J, Diehl AM. The liver in obesity and type 2 diabetes mellitus. Clin Liver Dis 2002; 6: 867-77. [ Links ]
43. Comert B, Mas MR, Erdem H, Dinc A, Saglamkaya U, Cigerim M, Kuzhan O, Unal T, Kocabalkan F. Insulin resistance in non-alcoholic steatohepatitis. Dig Liver Dis 2001; 33: 353-8. [ Links ]
44. Drenick EJ, Fisler J, Johnson D. Hepatic steatosis after intestinal bypass. Prevention and reversal by metronidazol, irrespective of protein-calorie malnutrition. Gastroenterology 1982; 102: 1363-70. [ Links ]
45. Angulo P. Current best treatment for non-alcoholic fatty liver disease. Expert Opin Pharmacother 2003; 4: 611-23. [ Links ]
46. Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis 2001; 21: 89-104. [ Links ]
47. Jones NL, Killian KJ. Exercise limitation in health and disease . N Engl J Med 2000; 343: 632-41. [ Links ]
48. Drenick EJ, Simmons F, Murphy JF. Effect on hepatic morphology of treatment obesity by fasting, reducing diets and small bowel bypass. N Engl J Med 1970; 282: 829-34. [ Links ]
49. Eriksson S, Eriksson K-F, Bondesson L. Nonalcoholic steatohepatitis in obesity: a reversible condition. Acta Med Scand 1986; 220: 83-8. [ Links ]
50. Andersen T, Gluud C, Franzmann M-B, Christoffersen P. Hepatic effects of dietary weight loss in morbidly obese subjects. J Hepatol 1991; 12: 224-9. [ Links ]
51. Rozental P, Biava C, Spencer H, Zimmerman HJ. Liver morphology and function tests in obesity and during total starvation. Am J Dig Dis 1967; 12: 198-208. [ Links ]
52. Ueno T, Sugawara H, Sujaku K, Hashimoto O, Tsuji R, Tamaki S, Torimura T, Inuzuka S, Sata M, Tanikawa K. Therapeutic effects of restricted diet and exercise in obese patients with fatty liver. J Hepatol 1997; 27: 103-7. [ Links ]
53. Keeffe EB, Adesman PW, Stenzel P, Palmer RM. Steatosis and cirrhosis in an obese diabetic. Resolution of fatty liver by fasting. Dig Dis Sci 1987; 32: 441-5. [ Links ]
54. Palmer M, Schaffner F. Effect of weight reduction on hepatic abnormalities in overweight patients. Gastroenterology 1990; 99: 1408-13. [ Links ]
55. Saksena S, Johnson J, Ouiff SP, Elias E. Diet and exercise: important first steps in therapy of NASH (Abstract). Hepatology 1999; 30: 436ª. [ Links ]
56. Vajro P, Fontanella A, Perna C, Orso G, Tudesco M, De Vincenzo A. Persistent hyperaminotransferasemia resolving alter weight reduction in obese children. J Pediatr 1994; 125: 239-41. [ Links ]
57. Guma G, Viola L, Thomé M, Galdame O, Alverez E. Ursodesoxycholic acid in the treatment of nonalcoholic steatohepatitis results of a prospective clinical controlled trial (Abstract). Hepatology 1997; 26: 387ª. [ Links ]
58. Mendez-Sanchez N, Gonzalez V, Pichardo-Bahena R, Uribe M. Weight reduction and ursodeoxycholic acid in subjects with nonalcoholic fatty liver disease: a randomized, doubled-blind, placebo-controlled trial (Abstract). Hepatology 2002; 36: 412ª. [ Links ]
59. Obinata K, Maruyama T, Hayashi M, Watanabe T, Nittono H. Effect of taurine on the fatty liver of children with simple obesity. Adv Exp Med Biol 1996; 403: 607-13. [ Links ]
60. Angulo P. Treatment of nonalcoholic fatty liver disease. Ann Hepatol 2002; 1: 12-19. [ Links ]
61. Anonymous. Executive summary of the clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults . Arch Intern Med 1998; 158: 1855-67. [ Links ]
62. Neuschwander-Tetri BA, Brunt EM, Bacon BR. Histological improvement in NASH following reduction of insulin resistance with 48-week treatment with the PPAR? agonist rosiglitazone (Abstract). Hepatology 2002; 36: 379A. [ Links ]
63. Lin HZ, Yang SQ, Chuckwaree C, Kuhajda F, Ronnet G, Diehl AM. Metformin reverses fatty liver disease in obese, leptin-deficient mice. Nat Med 2000; 6: 998-1003. [ Links ]
64. Nairs S, Diehl AM, Perrillo R. Metformin in nonalcoholic steatohepatitis (NASH): efficacy and safety: a preliminary report (Abstract). Gastroenterology 2002; 122: 4. [ Links ]
65. Houglum K, Venkataramani A, Lyche K, Chojkier M. A pilot study of the effects of d-α-tocopherol on hepatic stellate cell activation in chronic hepatitis C. Gastroenterology 1997; 113: 1069-73. [ Links ]
66. Lavine JE. Vitamin E treatment of nonalcoholic steatohepatitis in children: a pilot study. J Pediat 2000; 136: 734-8. [ Links ]
67. Harrison SA, Kadakia S, Torgerso, et al. Vitamin E and vitamin C in the treatment of nonalcoholic steatohepatitis. A prospective, randomized, placebo-controlled clinical trial. A preliminary report (Abstract). Gastroenterology 2002; 122: M1332. [ Links ]
68. Barak AJ, Beckenhauer HC, Junnila M, Tuma DJ. Dietary betaine promotes generation of hepatic S-adenosylmethionine and protects the liver from ethanol-induced fatty infiltration. Alcohol Clin Exp Res 1993; 17: 552-5. [ Links ]
69. Abdelmalek M, Angulo P, Jorgensen RA, Silvestre P, Lindor KD. Betaine, a promising new agent for patients with nonalcoholic steatohepatitis: results of a pilot study. Am J Gastroenterol 2001; 96: 2711-17. [ Links ]
70. Gulbahar O, Karasu ZA, Rezos G, Akarca US, Musoglu A. Treatment of non-alcoholic steatohepatitis with N-acetylcysteine (Abstract). Gastroenterology 2000; 118: 6550. [ Links ]
71. Laurin J, Lindor KD, Crippin JS, et al. Ursodeoxycholic acid or clofibrate in the treatment of nonalcohol-induced steatohepatitis: A pilot study. Hepatology 1996; 23: 1464-7. [ Links ]
72. Horlander JC, Kwo PY, Cummings OW, Koukolis G. Atorvastatin for the treatment of NASH (Abstract). Gastroenterology 2001; 120: 2767. [ Links ]
73. Holoman J, Glasa J, Kasar J, et al. FERUM markers of liver fibrosis in patients with non-alcoholic steatohepatitis (NASH). Correlation to liver morphology and effect of therapy (Abstract). J Hepatol 2000; 32: 210. [ Links ]