INTRODUCCIÓN
El síndrome de aplastamiento se define como la alteración sistémica consecuencia de la rabdomiólisis postraumática debido a fuerzas de aplastamiento1;es una alteración que se reporta frecuentemente después de a terremotos catastróficos a nivel mundial2-4, y es debido al trauma en extremidades por fuerza directa o por la posición mantenida altamente estresante para la circulación de una extremidad. En este caso presentamos un paciente con síndrome de aplastamiento ocasionado por el derrumbe de un edificio. El síndrome de aplastamiento (SA) es una patología que se reporta también en medicina de guerra, siendo descrita de manera formal por primera vez en 1941 por Baywaters y Beall, basado en su experiencia durante el bombardeo de Londres; sin embargo, existen referencias en la literatura desde 1908 con el terremoto de Messina-Calabria, donde se reportó la muerte de pacientes por falla renal secundaria al traumatismo de una extremidad, así como durante la Primera Guerra Mundial, por Seigo Minami, quien reportó la muerte de 3 soldados, secundario a falla renal posterior a lesión en extremidades, siendo este último el antecedente más formal a la posterior descripción del síndrome compartimental5.
Hoy en día, en el ambiente urbano se observa en los accidentes automovilísticos a altas velocidades, heridas por arma de fuego o lesiones de guerra formal. Es necesario puntualizar que no siempre existe una lesión ósea o articular que evidencie un trauma mayor en la extremidad, existiendo incluso casos donde se presentan en personas con intoxicación etílica, con contusiones musculares, siendo cualquier factor que obstruya la circulación a la extremidad suficiente para desarrollar síndrome compartimental y posteriormente síndrome de aplastamiento6.
REPORTE DE CASO
Hombre de 30 años quien ingresó a nuestra sala de choque trasladado por ambulancia terrestre sin previo aviso. El paciente fue rescatado de un edificio colapsado después de 23 horas de estar bajo los escombros. Durante la presentación, los paramédicos refieren encontrarlo neurológicamente íntegro y hemodinámicamente estable. Durante la valoración inicial se encuentra con abundante material de construcción en la vía aérea, ansiedad importante, y dolor 10/10, por lo que se decidió realizar secuencia rápida de intubación e instalación de 2 vías para reanimación.
A la exploración física se presentaba deshidratado, con abrasiones en cara y el resto del cuerpo; tórax con auscultación generalizada, no se evidenciaron clínicamente fracturas costales, abdomen blando, sin resistencia muscular; miembro superior izquierdo con presencia de aumento de volumen en codo y en antebrazo, sin deformidad a la inspección; miembro superior derecho con aumento de volumen en tercio proximal de antebrazo por aparente hematoma no expansivo; miembro inferior derecho con aumento de volumen, tenso a la palpación, palidez, pulso pedio disminuido, en cara posterior de pierna presenta desfacelamiento de piel; miembro inferior izquierdo con aumento de volumen en tercio distal de muslo y en rodilla, pulso pedio izquierdo conservado. Treinta minutos después de su ingreso el paciente presentó de manera súbita inestabilidad hemodinámica, con hipotensión, taquicardia, y silencio a la auscultación de hemitórax derecho, por lo que se trasladó a la unidad de cuidados intensivos, se realizó colocación de sello endopleural con drenaje de 500 cm3 de sangre, se solicitó ecografía FAST (focused abdominal sonography for trauma) de abdomen con resultado negativo y placas de tórax con sonda endopleural (SEP) colocado de manera adecuada, tomografía computarizada (TC) de cráneo, sin evidencia de lesiones, TC de tórax con hemotórax derecho, y TC de abdomen sin evidencia de lesión a vísceras.
Al existir datos duros de síndrome compartimental se solicitó valoración al departamento de cirugía ortopédica (figura 1), quien midió la presión intracompartimental por método de Whiteside y encontó 60 mmHg, por lo que se decidió realizar fasciotomía de urgencia con abordaje lateral y medial (figura 2). Se liberaron los compartimentos posterior, posterior profundo y anterolateral, y se cubrió con vendaje. En la rodilla izquierda se encontró con datos ocupativos y articulación a tensión, se realizó artrocentesis evacuando 20 cm3 de líquido serohemático, y se colocó vendaje de Jones en el miembro inferior izquierdo. Se solicitaron estudios de laboratorio de extensión, que reportaron: leucocitos, 20,000; hemoglobina, 17 g/dl; deshidrogenasa láctica, 5,537 IU/L; creatincinasa (CK), 111,217 IU/L; sodio, 139 mmol/L; potasio 5.6, mmol/L; cloro, 104 mmol/L; BUN, 21 mg/dl; creatinina 4.1 mg/dl.
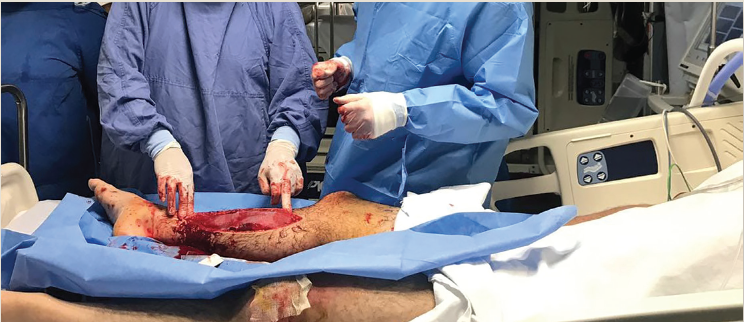
Imagen: De los Santos Montoya et al.
Figura 1 Realización de la fasciotomía de urgencia de la pierna derecha en terapia intensiva
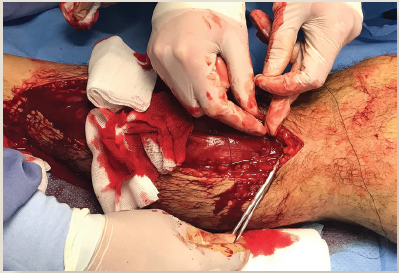
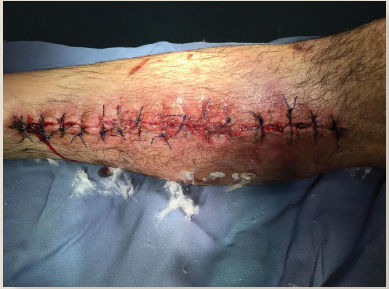
Imagen: De los Santos Montoya et al.
Figura 2 Abordaje medial para fasciotomía de pierna derecha, se realiza apertura roma a fascia
Se continuó con vigilancia y doble esquema antibiótico, al sexto día se decidió cierre progresivo de fasciotomías, durante la intervención se observa lesión en arteria tibial posterior, por lo que se reparó con injerto de safena; posteriormente se realizó angiotac, en donde se observó arteria tibial anterior y peronea permeables en todo su trayecto hasta continuar con arterias plantares. La arteria tibial posterior se observó con trombosis a nivel del tercio medio de la pierna. Se corroboró limitación total con fuerza muscular 0/5 a la flexión, 8 días después de la fasciotomía se logró el cierre definitivo, se continuó con vigilancia y terapia de rehabilitación para arcos de función, a los 10 días de intervención se observó exudado fétido, purulento en fasciotomías de pierna derecha (figura 3); se ingresó nuevamente a quirófano para aseo quirúrgico, y se encontró licuefacción de tejido graso, fascitis generalizada, tejido muscular que no cumple criterios de Scully. Se realizó un cultivo que arrojó resultados negativos para crecimientos bacterianos, y se realizó desbridamiento de tejido necrótico; se realizó aseo quirúrgico y colocación de sistema VAC a -120 mmHg, intermitente cada 72 horas, el paciente presentó evolución tórpida por lo que se decidió referirlo al a centro de tercer nivel, donde se realizó amputación del miembro pélvico derecho. El paciente fue egresado después de 33 días de tratamiento.
DISCUSIÓN
El síndrome de aplastamiento se desarrolla en un 30 a 50% de los casos de rabdomiólisis traumática, es frecuentemente observado después de terremotos catastróficos, y se presenta de un 2 a 5% de todas las víctimas heridas de un terremoto; el número de personas que requieren hemodiálisis después de una catástrofe de esta magnitud varía entre los diferentes estudios8,9. Existe un reporte sobre el terremoto de Kobe, en el cual la necesidad de hemodiálisis se correlacionó directamente con el incremento en la creatincinasa (CK) en pacientes con niveles mayores a 75,000 U/L10.
MANIFESTACIONES CLÍNICAS
La rabdomiólisis puede ocurrir por un daño muscular, ya sea traumático o no; sin embargo, mucha de la información sobre esta patología se conoce gracias a la rabdomiolisis inducida después de un trauma, que forma la base del síndrome de aplastamiento, posterior a un desastre natural11. El tratamiento de la enfermedad renal, ya sea aguda o crónica, requiere un manejo especial, ya que usualmente son necesarios equipos complejos. La falla renal del síndrome de aplastamiento es el padecimiento renal más frecuente después de desastres masivos12. Entre las manifestaciones clínicas más importantes se encuentra el síndrome de aplastamiento, la hipovolemia, orina oscura debido a la necrosis tubular aguda inducida por pigmentos, sepsis, insuficiencia respiratoria, coagulación intravascular diseminada, alteraciones de la coagulación, falla cardiaca, arritmias e insuficiencia renal. La severidad de la insuficiencia renal puede variar desde leves elevaciones de la creatinina, la cual puede deberse a la deshidratación que usualmente acompaña a estos pacientes al no poder ingerir líquidos mientras se encontraban entre los escombros, hasta una falla renal aguda importante, la cual requerirá de hemodiálisis. Esta variabilidad puede explicarse por muchos factores, como el grado de destrucción muscular, deshidratación, estado médico previo, y la presencia de alguna otra comorbilidad como choque séptico o hipovolémico.
De igual manera debemos tener en cuenta que el síndrome es multifactorial, afecta principalmente al sistema cardíaco y renal, siendo el desencadenante el trauma musculoesquelético. Al existir una lesión en el tejido muscular, las células liberan a la circulación mioglobina, uratos, potasio y fósforo, que son elementos nefrotóxicos y vasopresores; al parecer existe una ventana de liberación de estos componentes celulares observada hasta la descompresión de la extremidad, por lo que existe una liberación masiva de estos componentes al sistema sanguíneo, lo que provoca una lesión renal, misma que tiene un ciclo de repetición consecuencia de la lesión por reperfusión en la extremidad, acompañado de la respectiva formación de especies reactivas de oxígeno, tales como radicales libres y peróxidos, con posterior liberación de proteínas proinflamatorias y procoagulantes, lo que da como resultado trombosis de la microvasculatura a nivel local.
SÍNDROME COMPARTIMENTAL
Clásicamente se ha definido por la elevación por arriba de 30 mmHg en un compartimento muscular con posterior daño a la circulación de la región afectada; sin embargo, en la actualidad se pone énfasis en la presión diastólica, y su relación con la presión intracompartimental, siendo esta relación Δp, con una cifra óptima menor de 30 mmHg entre la presión diastólica y la presión intracompartimental. Al demostrar en modelos animales que la alteración es principalmente a nivel de pequeños vasos, al aumentar la presión intracompartimental el gradiente arteriovenoso (AV) disminuye a nivel local y provoca una disminución en la perfusión tisular, con posterior lesión isquémica7: tradicionalmente se ha asociado el síndrome compartimental con lesiones de alta energía; sin embargo, se ha visto en epidemiología reportada en Estados Unidos, que las lesiones de baja energía se pueden asociar a síndrome compartimental, ya que al no haber lesión masiva a tejidos blandos, no existe un efecto de “autodescompresión” por un daño a la fascia muscular.
TRATAMIENTO
La meta general para el tratamiento preventivo del daño renal es aumentar la perfusión del riñón, de tal manera que se minimice el riesgo por isquemia; el inicio de la terapia con líquidos, de ser posible, debe darse desde el primer contacto con el paciente, incluso mientras se encuentre en proceso de rescate, o lo más pronto posible. Idealmente esto debe ocurrir antes de que se liberen los productos del daño celular a la circulación (síndrome de reperfusión), y aumente el volumen de líquidos en el tercer espacio del miembro dañado, ya que esto puede empeorar la hipovolemia13.
Se habla acerca de una ventaja teórica al usar soluciones con poca concentración de potasio por la hiperkalemia, consecuencia de la lesión muscular; debemos tener en cuenta que la terapia con fluidos puede llevar a un secuestro extravasal en los tejidos, además puede haber una alteración cardiaca, ya sea preexistente en el paciente o propia por el traumatismo, por lo que se debe llevar un estricto control de líquidos y monitorización estrecha. La recomendación actual es mantener una infusión inicial de 1-1.5 L por hora de solución salina, manteniendo una excreción urinaria de 8 L por día; existen casos donde se puede llegar hasta cantidades de 20 L13. Se debe alcalinizar la orina por debajo de 6.5 pH, con la administración de 50 mmol de bicarbonato en las soluciones iniciales, ya que al mantener el pH alcalino se precipita la mioglobina y se facilita su excreción, además de ayudar a prevenir el daño oxidativo14. Si existe hipocalcemia se debe tratar solo si repercute clínicamente; la recomendación más fuerte sigue siendo en la hiperkalemia, se debe tratar de forma vigorosa, ya que suele ser mortal15.
Hemodiálisis
Se debe tener presente la hemodiálisis como procedimiento de rescate ante pacientes que presenten oliguria, sobrecarga de volumen, uremia, acidemia o hiperkalemia; así mismo, se debe tener en cuenta la hemodiálisis profiláctica ante pacientes en riesgo de desarrollar hiperkalemia severa hasta que la función renal se normalice, o por un mínimo de 13 días16. Gunal y cols. establecieron que la creatinina sérica de 8 mg/dl; BUN de 100 mg/dl; potasio sérico de 7 mEq/L, y bicarbonato sérico de 10 mEq/L, eran predictores aceptables para diálisis intermitente; así mismo, estableció que solo el 25 % de los pacientes con síndrome por aplastamiento requirieron terapia de reemplazo renal17.
Fasciotomía
En el síndrome compartimental agudo tiene poca cabida el tratamiento conservador, de poco sirven medidas como la elevación de extremidad, colocar vendajes algodonados o la observación de la evolución; el gold standard del tratamiento es la descompresión del compartimento de forma quirúrgica inmediatamente se detecte18, por el método clásico de fasciotomía de extremidad, teniendo especial cuidado en la liberación de todos los compartimentos; se debe tener en cuenta la ventana de tolerancia del tejido musculoesquelético a la isquemia, siendo en miembro pélvico de 6 horas, y en miembro torácico, de 8 horas. Además, al ser un método invasivo en un paciente probablemente inmunocomprometido o en riesgo de desarrollarlo, ya sea por la respuesta metabólica al trauma o por lesión extensa en la región con posterior falla de los mecanismos de defensa, hay aumento en el riesgo de contraer infección con posterior sepsis, que es una complicación catastrófica en este tipo de pacientes19.
Sigue siendo polémico el tiempo de realización de la fasciotomía, aunque existe un consenso de que es preferible realizar una fasciotomía temprana, a exponer al paciente a las terribles consecuencias de un síndrome compartimental no tratado. Como ya comentamos anteriormente, el tiempo límite para la lesión por isquemia irreversible es de 8 horas19; se ha demostrado que las fasciotomías realizadas dentro de las primeras 12 horas al síndrome compartimental podrían cursar con buena evolución. La decisión de realizar el procedimiento no siempre es clara, aunque nos podemos basar en los signos clínicos clásicamente descritos, que son: palidez, disminución o ausencia del pulso, parálisis, parestesias y dolor, estos generalmente son indicativos de un síndrome avanzado y no siempre están presentes de forma clara; además, en un paciente inconsciente estos signos no siempre pueden ser detectados18,20; en hospitales de recursos limitados, la decisión generalmente se basa en el cuadro clínico o la medición intracompartimental directa, utilizando el método de Whiteside, aunque es importante saber que este método puede presentar variaciones por fallas inherentes al mismo; es menester recordar que existen variaciones entre los compartimientos medidos, a razón que pueden existir compartimentos con una medición normal mientras otros pueden presentar hipertensión21. McQueen y cols. establecieron que la monitorización continua de la presión por 2 horas con una presión < 30 mmHg entre la presión diastólica y la compartimental, era el mejor método de diagnóstico con una sensibilidad del 94%22, misma que se ha mantenido en la actualidad, aunque este método no carece de los errores antes mencionados, sumando que se necesita equipo especializado como un monitor continuo de presión y personal experimentado, mismos que usualmente son difíciles de conseguir en situaciones de desastres naturales.
Para la decisión final se deben tomar en cuenta una serie de variables, siendo el primer abordaje definir entre la gravedad de un síndrome compartimental o un síndrome de aplastamiento clínicamente establecido, ya que la estrategia clínica a seguir varía entre ambas. De igual manera, debemos determinar el tiempo de lesión, ya que una extremidad aún en periodo de ventana puede beneficiarse de una fasciotomía temprana; sin embargo, ante la prolongación de la isquemia se aumenta el riesgo de complicaciones. Ante la decisión de una fasciotomía profiláctica se debe ponderar el beneficio teórico del cese de la lesión muscular en un síndrome de aplastamiento, se recomienda establecer los factores y valorar el riesgo-beneficio de forma estricta ante un manejo expectante en comparación con realizar una herida amplia en un paciente frágil, con el potencial riesgo de una grave infección de tejidos blandos23. Así mismo, respecto al manejo del daño renal asociado, es importante considerar que el síndrome de aplastamiento no es la única causa condicionante de una lesión renal aguda. En estos pacientes, particularmente los de larga estancia hospitalaria, debe de considerarse como la causa el uso de medicamentos como antiinflamatorios no esteroideos, aminoglucósidos, hipovolemia, choque hemorrágico o sepsis.
CONCLUSIÓN
Como cirujano, durante estas situaciones es importante conocer la fisiopatología del síndrome de aplastamiento. En la experiencia propia de los autores, concluimos que tendemos a limitarnos a la valoración del trauma músculoesquelético, sin tomar en cuenta las posibles repercusiones de la fisiopatología de la rabdomiólisis masiva.
En este caso en particular, el rápido deterioro de un paciente que se encontraba hemodinámicamente estable, y la elevación de los marcadores de función renal nos alertó ante la posible aparición de un síndrome de aplastamiento, por lo que solicitamos los laboratorios de extensión; sin embargo, es importante recordar que la elevación de la creatinina y valores de CK no necesariamente implican que el paciente esté ante un síndrome de aplastamiento, ya que muchos de estos sujetos, por el hecho de encontrarse bajo los escombros, pueden llegar con alteraciones hidroelectrolíticas y azoemia prerrenal.
El tomar la decisión del tratamiento de descompresión quirúrgica en un paciente cuando no se tiene de forma exacta el tiempo de evolución de insulto isquémico, ni cuánto tiempo se mantuvo el aumento de la presión intracompartimental, de acuerdo con la literatura está justificada la fasciotomía misma que se realizó en este caso; sin embargo, por la evolución podemos intuir que el paciente no se encontraba en el periodo de ventana que ofreciera un mejor pronóstico con la descompresión. Creemos que es preferible realizar, de cualquier manera, una fasciotomía independientemente del tiempo, que lidiar con las consecuencias catastróficas de no realizarla. En víctimas de desastres naturales que generalmente se asocian a traumatismos de alta energía y usualmente presentan lesiones en otros sistemas, además de las alteraciones metabólicas y hemodinámicas, sigue siendo un reto decidir el procedimiento que aporte mayor beneficio al paciente en relación con las posibles complicaciones.
El tratamiento de estos paciente es complicado, no solo por la cantidad de procedimientos y personal requerido inherente a las patologías que presenta, sino por el contexto en que ocurrieron los hechos, ya que las situaciones en las que se han descrito varían desde lugares con recursos sumamente limitados como Haití o regiones rurales de Turquía, hasta países con protocolos bien establecidos ante este tipo de situaciones como Japón, como lo mostró en su reciente experiencia con el terremoto de Kobe, y el terremoto y tsunami de la región de Tōhoku. Se recomienda revalorar de forma integral la viabilidad de los tejidos y el estado general del paciente, así mismo debemos tener en cuenta la implicación ética de realizar una amputación en un paciente joven, explicar con franqueza los beneficios esperados al paciente o familiares, tomar las decisiones con la mayor objetividad posible, basando el tratamiento en la mejor evidencia disponible.











 nueva página del texto (beta)
nueva página del texto (beta)