Introducción
Los organismos del género Phytophthora, pertenecen al reino Cromista o Stramenopila, son habitantes de ambientes acuáticos y terrestres, con alta capacidad de reproducción, diseminación y supervivencia, particularidades que facilita su establecimiento en campos de explotación agrícola o forestal (Erwin y Ribeiro, 1996; Chen et al., 2017, Hon, 2018; Judelson et al., 2019). En ese género, se incluyen especies con amplio rango de hospedantes como P. cinnamomi que es capaz de parasitar alrededor de 5 000 especies de plantas (Hardham et al., 2018) y P. capsici, conocida por originar pérdidas económicas en plantaciones de solanáceae y cucurbitáceae cultivadas alrededor del mundo (Vega et al., 2017).
Alrededor de 30 especies de Phytophthora fueron colectadas en cuerpos de agua como estanques, ríos, canales, reservorios y cultivos hidropónicos (Aram y Rizo, 2018) además, el género Phytophthora al igual que otros oomycetes fitopatógenos requiere estrictamente de agua para su reproducción la cual inicia con la formación de esporangióforos y esporangios, dentro de los cuales se forman las zoosporas para su posterior liberación y diseminación; dichas zoosporas, son capaces de infectar plantas susceptibles e iniciar el ciclo de una enfermedad (Kang et al., 2017).
Las zoosporas son el propágulo infectivo diseminado por agua libre, por ello, es posible recuperarlas con regularidad de aguas superficiales (Hon, 2018). Algunos ejemplos de especies aisladas de agua con frecuencia son: P. cactorum, P. parasitica, P. citrícola, P. gonapodyides, P. cambivora, P. hydropathica y P. drechsleri, entre otras (Loyd, 2014; Redekar y Park, 2018; Ristvey et al., 2019). En México, existen alrededor de 17 especies pertenecientes al género Phytophthora reportadas como parásitos de plantas de importancia agrícola, las más comunes son: P. capsici, P. infestans y P. cinnamomi; sin embargo, es escasa la información sobre la atribución del agua superficial como fuente de inóculo y dispersión de organismos del género Phytophthora.
Así, Álvarez et al. (2016) lograron aislar e identificar las especies P. hydropathica y P. drechsleri de distintos canales de agua de uso agrícola en Culiacán, Sinaloa, México. Por otro lado, comúnmente la identificación de géneros y especies de oomycetes se basaba en sus características morfológicas y culturales; sin embargo, fueron frecuentes identificaciones erróneas, debido a que algunas especies comparten dichas características; actualmente, esas prácticas son complementadas mediante técnicas biotecnológicas basadas en la extracción y secuenciación de ácidos nucleicos, lo cual permite la identificación de organismos de forma eficaz y concreta (Trzewik et al., 2016). Por lo anterior, el objetivo del presente estudio fue determinar la incidencia de especies del género Phytophthora en aguas superficiales de uso agrícola en Culiacán, Sinaloa y determinar su potencial patogénico en plantas cultivadas en México.
Materiales y métodos
Obtención, purificación y conservación de aislamientos Phytophthora spp.
Dispuesto mapa de ubicación de presas, diques, estanques, ríos y canales de almacenamiento y distribución del agua empleada en actividades agropecuarias, de la zona de influencia del distrito de riego número 010 del Valle de Culiacán, Sinaloa, otorgado por la Comisión Nacional del Agua (CONAGUA) (Figura 1), fueron seleccionados al azar 37 sitios de muestreo en 28 localidades (Cuadro 1).
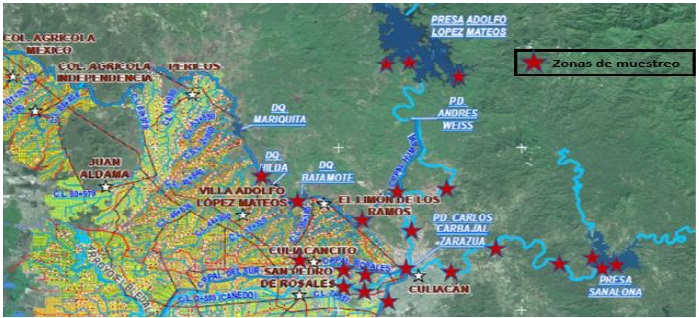
Figura 1 Principales sitios de muestreo en el municipio de Culiacán, Sinaloa. Imagen proporcionada por la CONAGUA.
Cuadro 1 Ubicación geográfica de los sitios de muestro para la obtención de aislamientos de Phytophthora spp., Culiacán, Sinaloa, 2018-2019.
Localidad |
Coordenadas del sitio de muestreo |
Aislamiento |
Presa Adolfo López Mateos (El Varejonal) |
25°10'08'' N 107°26'10'' W 25°09'10'' N107°26'11'' W 25°09'56'' N 107°26'30'' W |
PV1, PV2, PV3, PV4, PV5, PV6, PV7, PV8, PV9, PV10, PV11, PV12 |
La Presita |
24°55'49'' N 107°25'39'' W |
PR13, PR14, PR15, PR16 |
Empaque Castro |
24°55'28'' N 107°31'59'' W |
EC17, EC18, EC19, EC20 |
El Tamarindo |
24°55'07'' N 107°33'32'' W 24°55'11'' N 107°32'57'' W |
TR21, TR22, TR23, TR24 |
Empaque Valle del sol |
24°53'20'' N 107°29'17'' W |
EVS25, EVS26, EVS27, EVS28 |
Presa Sanalona |
24°48'37'' N 107°08'11'' W 24°48'46'' N 107°08'14'' W 24°48'49'' N 107°08'30'' W |
PS33, PS34, PS35, PS36, PS37, PS38, PS39, PS40, PS41, PS2, PS43 |
Río Tamazula |
24°49'00'' N 107°11'16'' W 24°48'53'' N 107°21'29'' W |
RT44. RT45, RT46, RT47, RT48, RT49 |
Río Humaya |
24°51'48'' N 107°24'25'' W |
RH50, RH51, RH52, RH53, RH54, RH55 |
Jardín Botánico |
24°49'23'' N 107°23'06'' W 24°49'24'' N 107°23'04'' W |
JB56, JB57, JB58, JB59, JB60, JB61 |
Imala |
24°51'21'' N 107°13'11'' W |
IMA62, IMA63, IMA64, IMA65 |
Tres Ríos |
24°48'43'' N 107°24'24'' W 24°48'24'' N 107°24'33'' W |
3R66, 3R67, 3R68, 3R69, 3R70, 3R71 |
Bellavista |
24°48'45'' N 107°27'56'' W |
BELL74 y BELL75 |
Bachigualato |
24°46'59'' N 107°26'48'' W |
BACH76 y BACH77 |
Aguaruto |
24°47'49'' N 107°30'24'' W |
AGUA78 y AGUA79 |
Campo Batan |
24°46'10'' N 107°30'19'' W 24°45'40'' N 107°30'45'' W |
CB80 y CB81 |
Campo Moroleón |
24°41'14'' N 107°31'09'' W |
CM82 y CM83 |
Campo Cardenal |
24°45'10'' N 107°28'39'' W |
CC84 y CC85 |
Dique Primavera |
24°43'48'' N 107°24'10'' W |
DP86 y DP87 |
Estación Hazera |
24°43'32'' N 107°27'24'' W |
HAZ88 y HAZ89 |
Estación Enza Zaden |
24°40'58'' N 107°28'47'' W |
EZ90 y EZ91 |
Estación Monsanto |
24°40'37'' N 107°28'50'' W |
MON92 y MON93 |
Campo Divemex |
24°39'46'' N 107°26'58'' W |
DIV94 y DIV95 |
Estación US Agriseeds |
24°38'11'' N 107°26'38'' W |
US96 y US97 |
Estación Syngenta |
24°37'08'' N 107°26'41'' W |
SYN98 y SYN99 |
Estación Rijk Zwaan |
24°36'12'' N 107°26'41'' W |
RZ100 y RZ101 |
Estación Bayer |
24°36'14'' N 107°27'22'' W |
BAY102 y BAY103 |
Dique Costa Rica |
24°35'44'' N 107°18'33'' W |
CR104 y CR105 |
Facultad de Agronomía |
24°37'28'' N 107°26'34'' W |
PP106 y PC107 |
El periodo de muestreo comprendido de septiembre de 2018 a enero de 2019, por sitio de muestreo se colocó una trampa elaborada con bolsa tipo red de polipropileno, cerrada de la parte anterior con una cuerda del mismo material, conjuntamente, esa cuerda se utilizó para fijar la trampa en algún punto del talud (Figura 2).
Esas trampas, en su interior contenían dos frutos de pera libres de lesiones, lavados con agua simple y desinfestados superficialmente con etanol al 96° (Soto et al., 2017). Las trampas permanecieron 48 h en suspensión, posteriormente se colectaron y se transportaron al laboratorio de fitopatología de la Facultad de Agronomía de la Universidad Autónoma de Sinaloa. Los frutos con lesiones evidentes fueron lavados con agua destilada estéril, secados con papel estraza estéril y desinfestados con etanol al 96°.
Los aislamientos se realizaron a partir de cortes de 1 cm2 tomados de las lesiones cafés en los frutos (Figura 2) y cada cinco fragmentos fueron colocados de forma equidistante en cajas de Petri que contenían medio de cultivo selectivo elaborado con harina de maíz-agar (HMA, 17 g L-1), penicilina (10 µg L-1), ampicilina (200 µg L-1), rifampicina (10 µg L-1), pentacloronitrobenceno (PCNB, 25 µg L-1) (PARP) (Jeffers, 2006; Soto et al., 2017).
Las cajas de Petri se dejaron dos días a temperatura ambiente (26 ±2 °C). Con la finalidad de purificar y conservar cepas individuales a partir de las colonias desarrolladas del tejido enfermo, se transfirió a medio de cultivo HMA mediante la técnica de punta de hifa, colocadas 48 h a temperatura ambiente, una vez desarrolladas las colonias, con saca bocado se tomó individualmente de cada aislamiento cinco trozos de 0.5 cm de diámetro de medio de cultivo con crecimiento micelial para posteriormente colocarlos en tubos microviales (5 ml) que contenían agua destilada estéril y se conservaron a 15 °C para posteriores estudios (Jeffers, 2006; Abad et al., 2012; Soto et al., 2017).
Características morfológicas y culturales
Para realizar la caracterización morfológica de los organismos, de las cepas conservadas en tubos microviales se tomó individualmente fragmentos de micelio que fueron sembrados en medio de cultivo que contenía agua destilada (800 ml), jugo V8 (200 ml), CaCO3 (2 g) y agar (15 g) (V8A), con la finalidad de inducir el crecimiento y reproducción del patógeno, las cajas de Petri permanecieron 72 h a temperatura ambiente, posteriormente, con saca bocado se tomó de cada aislamiento cinco fragmentos de 0.5 cm de diámetro que fueron colocados en cajas de Petri de 90 mm de diámetro que contenían agua destilada y extracto acuoso de suelo que sirvió para la inducción a la formación de esporangios.
Las cajas se incubaron temperatura ambiente por 72 h (Martin et al., 2004; Jeffers, 2006; Soto et al., 2017). Con el propósito de inducir otras estructuras morfológicas como: clamidosporas, hinchamientos hifales, anteridios, oogonios y oosporas, de las cepas conservadas en tubos microviales se tomaron individualmente fragmentos de micelio que fueron sembrados en cajas de Petri que contenían medio de cultivo V8Aclarificado (jugo V8 sometido a 4 000 RPM durante 20 min, V8AC) y puestas durante 21 días bajo condiciones de temperatura ambiente y oscuridad.
Se determinó el tipo de compatibilidad sexual reproductiva, para lo cual cada aislamiento se confrontó con linajes de referencia de P. capsici y P. drechsleri con afinidad A1/A2 (organismos proporcionados del cepario de hongos fitopatógenos de la Universidad Autónoma de Occidente Campus Los Mochis, Sinaloa). Todas las cepas conservadas fueron confrontadas en medio de cultivo V8AC, para lo cual se sembró un cilindro de 0.5 cm de diámetro de medio de cultivo con crecimiento micelial en un extremo de la caja y en al extremo opuesto se colocó individualmente un cilindro de la cepa A1 o A2, para después mantenerlas a temperatura ambiente y oscuridad durante veintiún días (Jeffers, 2006; Abad et al., 2012; Soto et al., 2017). La caracterización morfológica de aislamientos se realizó mediante la observación de las estructuras desarrolladas con microscopio óptico (Leica DM100 con medidor ocular) y comparación con una clave pictórica de especies del género Phytophthora (Abad et al., 2012).
Identificación molecular
Extracción del ADN
Para la extracción de ADN se utilizó el método Bromuro de Cetiltrimetilamonio (CTAB), que consiste en una serie de pasos presentados a continuación: Se colectaron 100-200 mg de micelio desarrollado sobre medio papa dextrosa agar (39 g L-1, PDA). El micelio se colocó sobre morteros individuales, se añadió nitrógeno líquido a cada muestra y se trituraron con un pistilo hasta obtener un polvo fino.
El polvo se transfirió individualmente a tubos eppendorf de 2 ml sostenidos en congelación y se añadió 1 ml de buffer de extracción (CTAB 2%, TRISH-HCl 100 mM PH 8, EDTA 20 mM PH 8, NaCl 1.4 M, β-mercaptoetanol 2%). Se colocaron los tubos en vortex durante un minuto. Los tubos se insertaron en una centrifuga a 12 000 RPM por 15 minutos. El sobrenadante se recuperó y se transfirió individualmente a nuevos tubos eppendorf de 2 ml que contenían 1 ml de solución alcohol cloroformo-isoamílico (49:1), se mezcló el contenido de los tubos con la fase recuperada.
Se colocaron las muestras en vortex por 10 min. Se realizó una segunda recuperación de fase acuosa y una segunda transferencia a nuevos tubos eppendorf. Se añadió acetato de sodio 3M con 1 ml de alcohol isopropílico con valor 1/10 del volumen recuperado y se almacenaron los tubos a -20 °C por 20 min (los tubos pueden ser almacenados hasta por 24 h para maximizar la obtención de ADN). Se centrifugaron los tubos a 12 000 RPM por 15 min, posteriormente se decantaron sin desperdiciar el contenido de ADN precipitado. Se añadió 1 ml de etanol individualmente y se centrifugaron las muestras por 3 min. Se extrajo el sobrenadante sin tocar la fase sólida, se colocaron los tubos con la fase solida a temperatura ambiente para la evaporación de líquidos.
El ADN fue disuelto en 50 µl de buffer TE. Las características del ADN se calcularon con Nanodrop a 260 nM, la calidad se estimó con la proporción 280/260, la integridad se visualizó en una cámara de electroforesis en gel de agarosa al 0.8% con una solución amortiguadora de 1X TAE.
Amplificación, purificación y secuenciación del ADN
La mezcla de reacción consistió en 1 µl de ADN (50 ng µl-1), 0.5 µl de dntp’s, 0.25 de Taq ADN polimerasa, 2.5 µl de buffer, 0.625 µl de cada primer, 20.175 µl de agua en un volumen total de reacción de 25 µl. La amplificación del ADN se realizó en un termociclador (Bio rad T100). La secuencia del termociclador fue la siguiente: una inicial desnaturalización a 94 °C por 2 min; 35 ciclos de desnaturalización a 94 °C por 30 s (60 s para COX y NADH), alineamiento por 30 s y extensión a 72 °C por 60 s, la extensión final a 72 °C por 10 min. La temperatura de alineamiento fue de 52 °C para COX, 53 °C para NADH y 62 °C para ITS (Cuadro 2), cuya amplificación exitosa fue confirmada por el gel de electroforesis.
Cuadro 2 Iniciadores utilizados para la amplificación de ADN de Phytophthora spp. (Kroon et al., 2004).
Primer |
Secuencia de primer |
Tamaño (pb) |
ITS4C0569ITS6C0570 |
TCCTCCGCTTATTGATATGCGAAGGTGAAGTCGTAACAAGG |
930 |
COXF4NCOXR4N |
GTATTTCTTCTTTATTAGGTGCGTGAAGTAATGTTACATATAC |
972 |
NADHF1NADHR1 |
CTGTGGCTTATTTTACTTTAGCAGCAGTATACAAAAAGCAAC |
897 |
Los productos de PCR se purificaron mediante el kit wizard SV Gel and PCR CleanUp System (Promega, USA). Ambas cadenas del amplicón se secuenciaron en las instalaciones de Macrogen, Korea. Los resultados de los aislamientos se analizaron por Blast comparando secuencias de aislados depositadas en la base de datos especializada de Phytophthora (http://www.phytophthoradb.org, http://www.phytophthora-ID.org) y en NCBI (http://www.NCBI.com) para determinar el porcentaje de similitud.
Pruebas de patogenicidad
Obtención de plántulas
Con la finalidad de comprobar la patogenicidad de cada uno de los aislados, se produjeron plántulas de tomate saladette (cv SV-3543), chile bell (cv Caravaggio) y pepino tipo slicer (cv Luxell). Las semillas de cada especie se sembraron individualmente en charolas de poliestireno con 256 cavidades rellenas con sustrato peat moss humedecido (Berger), una vez sembradas, las charolas permanecieron en condiciones de invernadero.
Siete días después de la emergencia de plántulas, fueron trasplantadas en macetas de plástico que contenían 2 kg de sustrato peat moss y se fertiregaron cada tres días con una mezcla de agua y Maxigrow (composición porcentual g L-1: extractos orgánicos 112, auxinas 0.09, giberelinas 0.1, citoquininas 1.5, nitrógeno 6.6, fósforo 13.3, potasio 13.3, calcio 2, magnesio 4, hierro 17.2, zinc 26.5, manganeso 13.3 y cobre 13.3).
Pruebas de patogenicidad en plantas
Para la inoculación de las plántulas cada aislamiento se transfirió a cajas de Petri con medio PARP y se incubaron por 10 días, posteriormente, de cada aislamiento se tomaron cortes 1 cm2 de medio de cultivo con crecimiento micelial y se colocó individualmente sobre los tallos de las plantas al ras del sustrato (25 días después del trasplante), inmediatamente se cubrió el inóculo con sustrato; cinco días después de la inoculación, los riegos fueron más abundantes para favorecer la infección. Se determinó la patogenicidad de los aislamientos mediante observación diaria en un periodo de 20 días.
Pruebas de patogenicidad en frutos
Frutos de tomate, chile y pepino con madurez fisiológica (libres de lesiones superficiales), lavados con agua destilada estéril y desinfestados con etanol al 70%, se inocularon y se colocaron dentro de cámaras húmedas en recipientes plásticos, se inocularon con cortes de 1 cm2 de medio de cultivo Parp con 10 días de crecimiento y se les añadió agua destilada estéril para a crear un ambiente favorable al organismo.
Tres días después de la inoculación, la severidad de la enfermedad se determinó en base a la medición de la superficie dañada en cm2 por el patógeno. En las pruebas de patogenicidad de plantas y frutos se utilizaron cuatro repeticiones y su respectivo control (sin inoculación del patógeno). Se realizaron reaislamientos a partir de tejido enfermo tomado de plantas inoculados para comprobar los postulados de Koch.
Resultados y discusión
Se obtuvieron 17 aislamientos pertenecientes al género Phytophthora, los que se clasificaron en dos grupos tomando en cuenta su similitud morfológica (Cuadro 3): el primer grupo lo conformaron 14 aislamientos que desarrollaron esporangióforos simples, esporangios ovoides no papilados con dimensiones promedio largo y ancho 47.5-60 x 26.25-32.5 µm (TR21, PS36, 3R68, CR104 y AGUA79), 47.5-57.5 x 26.25-32.5 µm (PV1, PV11, JB61, CC84 y CC85), 45-60 x 22.5-32.5 µm (RT45 y RT47) y 45-57.5 x 25-32.5 µm (JB61 y 3R70), con proliferación anidada y extendida, esporangióforos simples e hinchamientos irregulares presentes (Figura 3). No se logró identificar el tipo de compatibilidad de esos aislamientos con cepas de afinidad A1 y A2 de P. drechsleri y P. capsici.
Cuadro 3 Características fenotípicas de los aislamientos de Phytophthora spp.
Grupo |
Aislamiento |
Forma de esporangios |
Proliferación de esporangios |
Hinchamientos miceliales |
Dimensiones (largo y ancho) del esporangio (µm) |
Compatibilidad |
Oosporas |
1 |
TR21, PS36, 3R68, CR104 y AGUA79 |
Ovoides no papilados |
Anidada y extendida |
Presentes |
47.5-60 x 26.25-32.5 |
Desconocida |
- |
PV1, PV11, JB61, CC84 y CC85 |
Ovoides no papilados |
Anidada y extendida |
Presentes |
47.5-57.5 x 26.25-32.5 |
Desconocida |
- |
|
RT45 y RT47 |
Ovoides no papilados
|
Anidada y extendida |
Presentes |
45-60 x 22.5-32.5 |
Desconocida |
- |
|
JB61 y 3R70 |
Ovoides no papilados |
Anidada y extendida |
Presentes |
45-57.5 x 25-32.5 |
Desconocida |
- |
|
2 |
PC107, MJB72 y MPV31 |
Ovoides papilados |
Simple |
Ausentes |
40-68 x 17-30 |
A1 |
Pleróticas sin ornamentas (22-31 µm) |
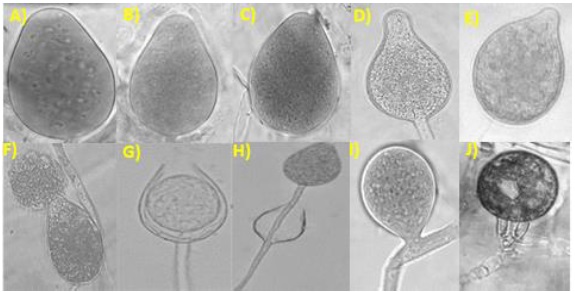
Figura 3 Estructuras sexuales y asexuales de los oomycetes. A-D) esporangios ovoides de Phytophthora spp.; E) esporangio papilado de P. capsici (aislamiento PC107); F) liberación de zoosporas (aislamiento TR21); G) proliferación anidada (aislamiento PV11); H) proliferación extendida (aislamiento JB61); I) hinchamiento del micelio intercalar (aislamiento RT45) y J) oospora de P. capsici (aislamiento MPV31).
El segundo grupo compuesto por tres aislamientos (PC107, MJB72 y MPV31), los que desarrollaron esporangios ovoides papilados, dimensiones promedio largo y ancho de 40.0-68.0 x 17-30 µm, esporangióforos simples, esporangios simples (sin proliferación) y papilados; sin presencia de hinchamientos en las hifas. Reproducción sexual con afinidad A1 de P. capsici, con formación de oosporas pleróticas, sin ornamentas y diámetro promedio de 22-31 µm (Figura 3).
La comparación de esas características con las descritas en las claves taxonómicas de Erwin y Ribeiro (1996) y de Abad et al. (2012), coinciden con las especies Phytophthora parsiana, P. virginiana, P. lagoariana, P. hydropathica y P. capsici. Las reacciones de PCR con los iniciadores ITS (4-6) amplificaron un producto aproximado a 941 pb, con los iniciadores COX 972 pb y con los iniciadores NADH 897 pb.
Las secuencias consenso mostraron resultados con porcentajes de similitud a Phytophthora virginiana: de 99.42 (aislamiento PV1), 99.47 (aislamiento PV11), 99.52 (aislamiento JB61), 99.60 (aislamiento CC84) y 99.78 (aislamiento CC85), para Phytophthora parsiana: de 99 (aislamiento RT45) y 99.22 (aislamiento RT47), para Phytophthora lagoariana: de 98 (aislado JB61) y 98.52 (aislado 3R70), para Phytophthora hydropathica. De 97 (aislamiento TR21), 98 (aislamiento PS36), 98.5 (aislamiento 3R68), 99 (aislamiento CR104) y 99.64 (aislamiento AGUA79) y para Phytophthora capsici de 99.48 (aislamiento PC107), 99.7 (aislamiento MJB72 y 100% (aislamiento MPV31) (Cuadro 4).
Cuadro 4 Especies de Phytophthora identificadas por aislamiento.
Aislamientos |
Género |
Núm. de acceso |
(%) de similitud |
PV1, PV11, JB61, CC84 y CC85 |
Phytophthora virginiana |
MT232849 |
99.42-99.78 |
RT45 y RT47 |
Phytophthora parsiana |
MT232850 |
99-99.22 |
JB61 y 3R70 |
Phytophthora lagoariana |
MT232839 |
98-98.52 |
TR21, PS36, 3R68, CR104 y AGUA79 |
Phytophthora hydropathica |
MT339042 |
97-99.64 |
PC107, MJB72 y MPV31 |
Phytophthora capsici |
MT232875 |
99.48-100 |
Las especies identificadas en esta investigación son encontradas de manera regular en agua superficial (Zappia et al., 2014, Yang y Hong, 2015). Los 17 aislamientos obtenidos fueron patogénicos, debido a que después de la inoculación todos originaron síntomas de marchitez en plántulas y necrosis de raíz; en frutos causaron síntomas de pudrición (Figura 4).

Figura 4 Pruebas de patogenicidad de la especie P. hydropathica. A-C) plantas de tomate, chile y pepino, izquierda plantas inoculadas y derecha plantas testigo. D-F) tallos y raíces de plantas de tomate, chile y pepino, izquierda plantas inoculadas y derecha plantas testigo. G-I) frutos inoculados de tomate, chile y pepino.
Los aislamientos de P. capsici originaron marchitez de plantas tres días después de la inoculación, mientras esos mismos síntomas aparecieron 10 días después de la inoculación con el resto de las especies. Estos resultados corroboran el reporte de patogenicidad de Phytophthora parsiana, P. virginiana, P. lagoariana, P. hydropathica y P. capsici sobre plantas de tomate, chile y pepino descritos por Cline (2008); Álvarez et al. (2016); Lamour et al. (2012).
Esta investigación comprueba la existencia de especies fitopatógenas no reportadas y que representan un riesgo para la sanidad de cultivos hortícolas en la región. La extracción, amplificación y secuenciación de regiones del ADN de los organismos mediante las técnicas moleculares empleadas en esta investigación (Its, Cox y Nadh), permitió su identificación al determinar niveles de homología entre 97 y 100% en la base de datos NCBI y con eso, mayor eficiencia que con la tradicional identificación caracterización morfológica.
Este estudio de agua superficial demuestra la presencia en ese hábitat de Phytophthora virginiana, Phytophthora parsiana, Phytophthora lagoariana, Phytophthora hydropathica y Phytophthora capsici; asimismo, la importancia que juega el agua como fuente inóculo y dispersión de esos patógenos. A su vez, se amplía el rango de estudios para futuras investigaciones sobre la supervivencia de este tipo de patógenos, descubrir nuevos hospedantes naturales en la zona, determinar otros posibles medios de diseminación, la búsqueda de nuevos hospedantes de importancia económica, identificar si existe la presencia de otro tipo de patógenos de importancia agrícola en agua, y de este modo considerar el riesgo potencial que este tipo organismos representa para la agricultura de la región.
Conclusiones
En aguas superficiales de uso agropecuario del distrito de riego número 10 del Valle de Culiacán, Sinaloa, se colectaron 17 aislamientos que correspondieron a los organismos P. virginiana, P. parsiana, P. lagoariana y Phytophthora capsici, todos con capacidad de infectar plantas y frutos de tomate, chile y pepino.











 texto em
texto em 



