Introducción
El trasplante de órganos sólidos es uno de los mayores avances en la medicina moderna, siendo el tratamiento definitivo para muchos pacientes con alguna insuficiencia orgánica terminal. El Instituto Mexicano del Seguro Social (IMSS) ha sido por varios años vanguardia en materia, concentrando la mayor actividad en donación y trasplantes en México.1
Durante el 2019 en México se realizaron 1,136 trasplantes renales y hepáticos de donante fallecido; actualmente, más de 17 mil pacientes se encuentran registrados en lista de espera para recibir un trasplante de alguno de estos dos órganos.2,3
En torno a la crítica situación generada por la pandemia de COVID-19, el Centro Nacional de Trasplantes (CENATRA) emitió en marzo del 2020 las “Recomendaciones al Subsistema Nacional de Donación y Trasplantes sobre la infección asociada al SARS-CoV-2”, sugiriendo la suspensión temporal de todos los programas de donación y trasplante de órganos y tejidos a nivel nacional, exceptuando las urgencias cero y/o asignaciones prioritarias. Lo anterior en consonancia con otras recomendaciones internacionales publicadas por la Organización Nacional de Trasplantes de España (ONT), la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH), la Sociedad de Trasplantes de América Latina y el Caribe (STALYC), la Asociación Panamericana de Infectología (API), así como por el Instituto Nacional Central Único Coordinador de Ablación e Implante de Argentina (INCUCAI).4,5
Como resultado, las procuraciones multiorgánicas en México se desplomaron 94% durante el segundo y tercer trimestre del 2020 en comparación con el mismo periodo del año anterior, con un total de 15 vs 280 procuraciones concretadas, respectivamente.6,7
Contrario a algunas percepciones, los programas de trasplantes son considerados relevantes por su gran impacto en los principales problemas de salud pública, como lo es la insuficiencia renal terminal, convirtiéndolos en programas prioritarios. Motivo por el cual, asociado con una disminución de ingresos y ocupación hospitalaria por casos con COVID-19, el CENATRA publicó en junio de este año el plan para incentivar la reactivación de los programas de donación y trasplantes en nuestro país. En dicho plan, el comité interno de trasplantes debe realizar un diagnóstico de la situación epidemiológica particular del establecimiento, y valorará la disponibilidad de recursos humanos, financieros, tecnológicos y materiales, así como circuitos libres de COVID-19, disponibilidad de camas de hospitalización y en la Unidad de Cuidados Intensivos; realización de estudios de laboratorio y gabinete (pruebas RT-PCR y tomografía de tórax), entre otros.8 Estos últimos dos estudios de screening para SARS-CoV-2 son necesarios tanto para el donante como para los potenciales receptores, lo cual agrega complejidad a la de por sí laboriosa logística.
El objetivo de este artículo es estimar el tiempo real necesario para cumplir con los protocolos vigentes en la toma de RT-PCR y tomografía de tórax, su viabilidad e impacto en el proceso de donación/trasplante; además analizaremos los principales aspectos quirúrgicos de la cirugía de procuración multiorgánica.
Presentación del caso (Tabla 1 y Figura 1)
Tabla 1: Cronograma de acciones realizadas.
| Día | Hora | Evento |
|---|---|---|
| 0 | 16:00 | El Servicio de Urgencias reporta al coordinador hospitalario de donación, sobre paciente masculino de 23 años, con traumatismo craneoencefálico severo secundario a accidente automovilístico 24 horas previas a su ingreso; clínicamente con ausencia de reflejos de tallo y ya con angio-TAC cerebral con ausencia de flujo. En sesión de comité se determina que, por ausencia de condiciones para realizar los trasplantes en el hospital generador, se pondrán a disposición, encontrando receptores en condiciones para los dos riñones y el hígado en la Ciudad de México |
| 0 | 17:00 | Con apoyo del Servicio de Epidemiología y el laboratorio central del hospital generador, se toma prueba RT-PCR oro/nasofaríngea |
| 0 | 19:00 | Toma de TAC de tórax con reporte de neumotórax izquierdo, sonda de derivación pleural y zonas de contusión pulmonar bilaterales sin datos sugestivos de infección por SARS-CoV-2 |
| 1 | 05:00 | Resultado negativo a infección por COVID-19 por medio de RT-PCR |
| 1 | 10:00 | Trámites ante el Ministerio Público |
| 1 | 17:00 | TIME OUT: cirugía de procuración multiorgánica por equipo quirúrgico de trasplantes del hospital generador para evitar traslado de equipos entre estados |
| 1 | 19:00 | Pinzamiento |
| 1 | 20:00 | Traslado de los órganos en vuelo Mérida-Ciudad de México |
| 2 | 03:00 | Despinzamiento hepático |
| 2 | 06:00 | Término exitoso del trasplante hepático |
| 4 | 10:00 | Trasplante exitoso de ambos riñones, durante la mañana del día cuatro (con apoyo de perfusión hipotérmica pulsátil desde la llegada de los riñones al día uno; > 72 h de isquemia) |
RT-PCR = reacción en cadena de la polimerasa con transcriptasa inversa. TAC = tomografía computarizada.
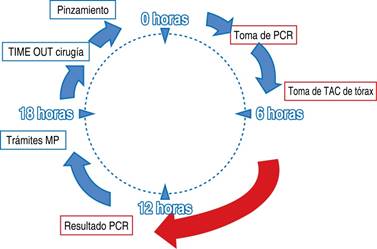
Figura 1: Horas transcurridas entre aviso y certificación de la muerte encefálica y los diversos procesos que culminan en la procuración. Toma de PCR (una hora posterior a inicio), toma de TC de tórax (cuatro horas posterior a inicio), resultado de PCR (13 horas posterior a inicio), trámites ante Ministerio Público (18 horas posterior al inicio), inicio de cirugía de procuración TIME OUT (20 horas posterior a inicio) y pinzamiento aórtico (22 horas posterior a inicio).
Aspectos quirúrgicos
A continuación, se describe la técnica quirúrgica con algunas imágenes y algoritmos, con el fin de facilitar la comprensión del proceso.
1. Preparación y campo
a. Es mandatorio que el cirujano a cargo revise toda la documentación previo a la incisión, en especial: certificación de pérdida de la vida para la disposición de órganos y tejidos con hora del fallecimiento igual a la del estudio de gabinete que demuestre ausencia de flujo cerebral; consentimiento para la disposición de órganos y tejidos de cadáveres con fines de trasplante, con firmas e identificaciones; los resultados de serologías infecciosas negativas y finalmente, si aplica, la anuencia del ministerio público.
b. RT-PCR negativa para SARS-CoV-2, idealmente 24 horas máximo 72 horas previas al evento quirúrgico.
c. En casos en que se cuente con la disponibilidad, se debe tomar tomografía de tórax. Cabe aclarar que una imagen no sugestiva de COVID-19 no descarta el proceso activo de la enfermedad.
d. Se confirma la comunicación entre el cirujano y el anestesiólogo para la administración de medicamentos en las distintas etapas cruciales: para el apoyo hemodinámico durante la cirugía, relajantes para evitar cualquier reflejo medular o reflejo de Lázaro en el donante y anticoagulación previo al pinzamiento.
e. Equipo de perfusión listo con al menos ocho litros de solución de preservación, así como 10 litros de soluciones estériles congeladas.
f. Aseo quirúrgico 5 cm por arriba de xifoides, abarcando abdomen hasta sínfisis del pubis incluyendo tercio medio de ambos muslos.
2. Procedimiento quirúrgico
a. Abordaje abdominal y evaluación clínica. Se realiza incisión en cruz, iniciando con incisión media de xifoides hasta la sínfisis del pubis y se completa con incisión transversa hasta límites de fascia de Toldt. Es opcional la ampliación torácica con estereotomía (Figura 2A).
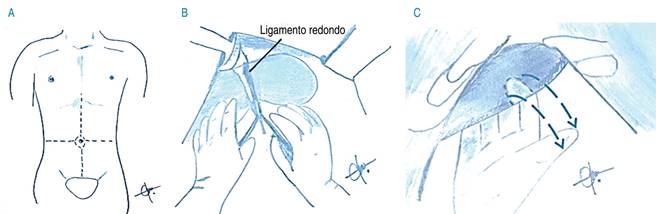
Figura 2: A) Incisión en cruz. B) Incisión ligamento redondo y suspensorio. C) Presión del parénquima hepático.
Posteriormente se liga, secciona y se inciden los ligamentos redondo y suspensorio hasta unos milímetros proximales a las venas suprahepáticas. El examen de los órganos intraabdominales se lleva a cabo para excluir una posible enfermedad maligna (Figura 2B). La evaluación clínica de esteatosis hepática se valora en esta etapa, especialmente si no hay un patólogo disponible. El cirujano valora la coloración, presionando el parénquima, los bordes y la firmeza del hígado (Figura 2C).9
b. Disección de grandes vasos y exposición renal. Se incide con electrocauterio peritoneo parietal a nivel de la bifurcación de la aorta abdominal y se extiende lateralmente hasta el ciego para continuar a lo largo de la fascia de Toldt, ascendiendo hasta el ángulo hepático (Figura 3A).
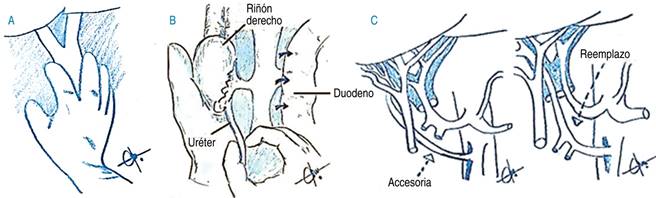
Figura 3: A) Disección bifurcación aórtica abdominal. B) Maniobra de Cattell-Braasch y Kocher. C) Accesoria o reemplazo derecho.
La disección continúa (maniobra de Cattell-Braasch y Kocher) a lo largo del plano avascular retroperitoneal inframesocólico para movilizar y retraer el colon ascendente medialmente, movilización del duodeno y la cabeza del páncreas para exponer la Gerota y la vena renal derecha, la cava inferior y la aorta abdominal. Se identifica el uréter derecho y diseca (Figura 3B).
En esta etapa se diseca la arteria mesentérica superior en su origen desde la aorta, la cual emerge por encima del cruce de la vena renal izquierda a la aorta abdominal, lo anterior en búsqueda de alguna arteria accesoria o reemplazo de la hepática derecha (Figura 3C).
Se procede a realizar la disección retroperitoneal contralateral mediante maniobra de Mattox incidiendo fascia de Toldt izquierda subiendo hasta ángulo esplénico, disección del plano avascular retroperitoneal exponiendo la Gerota y el uréter izquierdo.
c. Referencia para canulación. En preparación para la canulación y perfusión, se diseca el segmento distal de la aorta en búsqueda de la arteria mesentérica inferior, la cual se liga y corta. De igual manera, se diseca y refiere con cinta umbilical, la vena cava inferior a nivel de la afluencia de las venas iliacas (Figura 4A).
Lateral al ángulo de Treitz, se identifica la vena mesentérica inferior, diseca y refiere con seda para la posterior perfusión portal (Figura 4B).
Se prefiere no canular en este momento para evitar que accidentalmente, durante el resto de la disección, se descanalicen los grandes vasos.
d. Disección hepática. Se coloca compresa en el borde inferior del lóbulo izquierdo e incide con electrocauterio sobre los ligamentos triangular y coronario izquierdo, para liberar dicho lóbulo (Figura 5A).
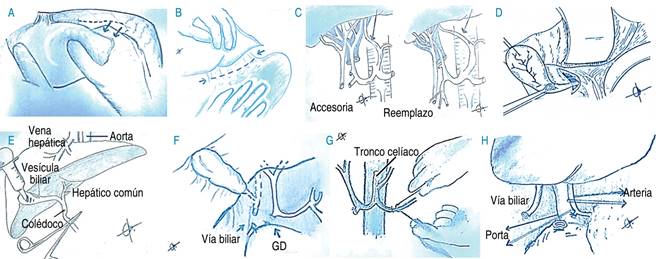
Figura 5: A) Incisión ligamento triangular y coronario izquierdo. B) Incisión omento menor. C) Accesoria o reemplazo izquierdo. D) Disección vía biliar. E) Lavado de vía biliar. F) Dirección de arteria hepática. G) Disección tronco celíaco. H) Disección portal.
Continúa la disección del momento menor o ligamento gastrohepático, con cuidado de preservar alguna arteria hepática accesoria o reemplazo izquierdo que surja de la arteria coronaria estomáquica. Debe conservarse si está presente, procurando el tronco celíaco (Figura 5B y C).
Posteriormente se procede a disecar estructuras del hilio hepático. Inicia la disección del colédoco en el borde lateral derecho, cuidando no desvascularizar los vasos pericoledocianos, los cuales se localizan a las tres y nueve horas de la circunferencia de la vía biliar. Se liga distalmente con seda a nivel del duodeno y se secciona (Figura 5D).
Se incide fondo vesicular e irriga con jeringa asepto hasta observar salida de solución clara por la vía biliar seccionada. Es importante tener presente que los reemplazos o accesorias hepáticas derechas pasan en el borde inferior del colédoco, misma que se tiene que preservar desde su afluencia a nivel de la arteria mesentérica superior previamente disecada. Es fácil su identificación mediante palpación a través del hiato de Winslow, al inicio de la disección (Figura 5E).
Posteriormente se diseca el tejido neurolinfático en el borde izquierdo del hilio para disecar la arteria hepática propia sólo a unos cuantos milímetros de la arteria gastroduodenal. Continuar con la disección proximal de la arteria hepática propia hasta el tronco celíaco. Esta última disección se puede realizar más fácilmente una vez pinzado, en frío (Figuras 5F y G).
Se procede a disecar la vena porta, la cual se encuentra por debajo tanto de la vía biliar como de la arteria hepática, liberando el tejido neurolinfático hasta su emergencia a nivel del páncreas, para que posterior a la perfusión se diseque intrapancreático, cortando unos milímetros por debajo de la afluencia de la vena mesentérica superior con la esplénica (Figura 5H).
La disección del hígado está completa.
e. Canulación y precooling hepático. Previo a que el anestesiólogo administre 35,000 UI de heparina IV, se toman muestras sanguíneas de la vena cava y/o ganglios linfáticos para las pruebas de histocompatibilidad. Se liga la aorta por encima de la bifurcación de las arterias iliacas, y proximalmente se cánula para perfusión retrógrada (Figura 6A).
Posteriormente se liga distalmente la vena mesentérica inferior y cánula de igual forma para perfusión portal con equipo de venoclisis; en esta fase inicia el precooling hepático empezando con infusión a goteo lento de la solución de preservación (Figura 6B).
f. Disección de la aorta supracelíaca e incisión diafragmática. La última disección antes de la perfusión fría consiste en disecar la aorta supracelíaca por debajo del diafragma. Se incide el pilar derecho diafragmático para localizar la aorta supracelíaca y refiere con cinta umbilical. Se incide diafragma derecho para abrir cavidad torácica y extiende medialmente hasta pericardio exponiendo el corazón (Figura 7).
g. Perfusión. Es importante anotar hora de pinzamiento. Se liga o coloca clamp vascular en aorta supracelíaca, se abren por completo los sistemas de infusión de solución de preservación aórtica y portal, secciona aurícula derecha y coloca dos aspiradores en cavidad torácica para exanguinación e instalación de hielo estéril cubriendo por completo ambos riñones e hígado. En promedio se infunden cuatro litros de solución de preservación por aorta y dos litros por sistema portal. La perfusión en frío in situ de los órganos dura aproximadamente 20 minutos (Figura 8).
h. Explante. Para la procuración hepática, se inicia seccionando la vena cava inferior por encima de la afluencia de ambas venas renales y la aorta a nivel de la arteria mesentérica superior, teniendo cuidado de no lesionar la emergencia de las arterias renales, y se despegan los grandes vasos del plano dorsal (Figura 9A).
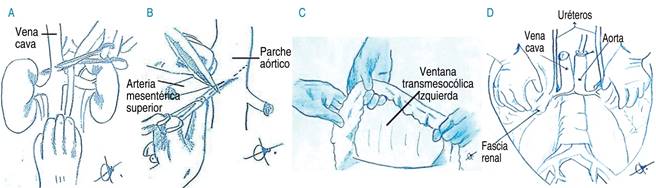
Figura 9: A) Corte de vena cava suprarrenal. B) Corte parche aórtico. C) Ventana transmesentérica. D) Explante en bloque renal.
Continúa la disección del hilio hepático, seccionando la vena porta al nivel descrito. La arteria gastroduodenal se secciona y diseca la arteria hepática propia hasta el tronco celíaco, cortando la arteria esplénica y gástrica izquierda (en el caso de que no tenga alguna arteria accesoria o reemplazo izquierdo, si lo tiene debe preservarse) para seccionar la aorta a nivel del pinzamiento. Se debe extirpar la aorta o un parche aórtico alrededor del ostium del tronco celíaco que incluya la arteria mesentérica superior (en caso de alguna arteria accesoria o reemplazo derecho) (Figura 9B).
Se introduce el dedo índice por la vena cava retrohepática a nivel pericárdico y secciona diafragma que la incluya, cortando el diafragma derecho junto con los ligamentos triangulares y coronarios ipsilaterales. El hígado ahora se extrae libremente del abdomen y se introduce en el recipiente lleno de hielo, para su revisión en la cirugía de banco.
Los riñones se explantan en bloque ya que minimiza el riesgo de lesión vascular. Se cortan ureteros a nivel del cruce de los iliacos, la vena cava inferior a nivel de la afluencia de las iliacas y la aorta a nivel de la canulación. El intestino se retrae anterior y superiormente. Se abre ventana transmesocólica izquierda, para luxar el riñón izquierdo al espacio inframesocólico (Figura 9C).
Se levantan uréteres, polos renales y grandes vasos e inicia sección de los músculos paravertebrales. Ambos riñones se obtienen y se colocan en un recipiente de hielo en la mesa trasera.
Finalmente, se procuran la arteria y vena iliaca común, hipogástrica y externa para su embalaje con el hígado (Figura 9D).
3. Embalaje
Se infunden otros 1.5 litros de solución de preservación por porta y 500 cm3 por arteria hepática y realiza el embalaje con el órgano sumergido en esta solución, con tres bolsas estériles protectoras. Los riñones se separan, seccionando la vena renal izquierda en su afluencia con la cava para preservar esta última con la vena renal izquierda para su aprovechamiento si se requiere elongación. El lado anterior de la aorta se limpia y se hace una incisión a lo largo de su línea media, permitiendo el parche equivalente a cada lado de la arteria renal y/o sus polares. Se infunde con 500 cm3 de solución de preservación por cada arteria renal, y realiza el embalaje de manera similar al hígado (Figuras 10 y 11).
Discusión
Iniciemos la discusión poniendo como contexto una pandemia con cifras epidemiológicas con un discutido subregistro en nuestro país. México continúa estando dentro de la lista de los países con alta transmisibilidad para SARS-CoV-2.10
Aunado a esto, la gran mayoría de hospitales de primer y segundo nivel de atención (centros captadores de donantes), así como los hospitales de tercer nivel y alta especialidad (centros trasplantadores) tuvieron la necesidad de reconvertirse en unidades COVID, lo que afectó severamente la actividad en todo el país, en materia de trasplante.
Este efecto no sólo se observó en México. La mayoría de los centros de trasplante a nivel mundial han reducido el número de procedimientos como consecuencia de la pandemia. A fines de marzo de 2020, una encuesta de 88 instituciones de trasplantes de EE. UU. informó que 71% había suspendido por completo el trasplante de riñón de donante vivo y 84% había implementado restricciones para el trasplante de riñón de donante fallecido.11 Otro reporte informó reducciones en la productividad de 51 y 90% en los procedimientos de trasplante de órganos sólidos en los EE. UU. y Francia.12
El impacto en disminución en donaciones multiorgánicas en España estuvo más afectado durante el periodo marzo-mayo, coincidiendo con los peores meses de la pandemia; sin embargo, según reportes de la ONT, éstas se han recuperado hasta niveles que se aproximan a los registrados en 2019.13 Siendo esta recuperación escalonada, contrario a lo observado en México, donde hasta el momento la actividad es muy limitada.
Lo anterior puede corresponder a que la realidad en países emergentes es muy diferente al primer mundo. Marcelo Cantarovich y colaboradores mencionan varios puntos a considerar, antes de realizar cualquier trasplante de órganos de donante fallecido en países en desarrollo: limitaciones en el equipo de protección personal, alta prevalencia de infecciones asintomáticas, disponibilidad de pruebas RT-PCR, de salas de aislamiento y de camas de unidades de cuidados intensivos, duplicidad de funciones en los trabajadores de la salud, la dinámica cambiante de esta pandemia y finalmente la sobrecarga al sistema de salud existente. Cada unidad deberá estudiar caso por caso, poniendo en una balanza la factibilidad de realizar una procuración y/o trasplante versus los recursos con que cuenta para manejar la pandemia actual.14
Si bien se desconoce el potencial de transmisión del SARS-CoV-2 a través del trasplante, ya contamos con múltiples reportes internacionales en población trasplantada. Domínguez-Gil y colaboradores publicaron, a cuatro meses de la pandemia en España, 363 casos de COVID-19 en pacientes trasplantados de órganos, donde la mayoría fue adquirida en la comunidad con una mediana de tiempo de 56 meses desde el trasplante. Sólo se notificaron 62 (14%) casos de infecciones nosocomiales, en ningún caso con sospecha de infección derivada del donante.15
Series de casos publicados en EE. UU. con más de 400 receptores de trasplantes de órganos sólidos han proporcionado información sobre la presentación clínica del COVID-19 en esta población, arrojando una mortalidad de 6 a 30%.16 Pereira y su grupo reportaron una serie de 90 receptores de trasplantes de órganos sólidos con COVID-19 con los siguientes síntomas: fiebre (70%), tos (59%) y disnea (43%); 76% requirieron hospitalización y 35% ventilación mecánica. La mortalidad global fue de 18%.17 En México CENATRA reporta al mes de diciembre una mortalidad global de 25% de casos confirmados y/o sospechosos.18
Con el fin de continuar la atención de estos programas prioritarios, tratando de disminuir el riesgo sanitario de infección por SARS-CoV-2, tanto en México como a nivel internacional, se emitieron múltiples recomendaciones que coinciden entre sí para la evaluación y la selección de los donantes y receptores de órganos en el contexto actual.19
Una de estas recomendaciones es la realización de RT-PCR y tomografía de tórax a todo potencial donante, motivo por el cual analizamos en este artículo la factibilidad y el tiempo que agregó al proceso de procuración en nuestro medio, siendo éste de 12 horas extras, lo cual no puso en riesgo el evento de donación. Aclarando que esta cirugía se llevó a cabo en una Unidad de Alta Especialidad con la capacidad de correr la reacción en cadena de la polimerasa en su laboratorio, una realidad que no es común en la gran mayoría de hospitales procuradores en el país. La reactivación de nuestro programa de donación fue en función a cinco lineamientos fundamentales:
Valorar recursos para cribaje de potenciales donantes.
Disponibilidad de recursos en terapia intensiva y/o áreas de choque.
Valoración del riesgo/beneficio de someter a un paciente inmunodeprimido al riesgo de infección por SARS-CoV-2 vs el riesgo de mortalidad al permanecer en lista de espera.20
Capacidad de traslado de órganos y tejidos fuera del estado.
Procuración por equipos quirúrgicos locales.
En nuestro país, la obtención multiorgánica será siempre apremiante, por lo cual es imperativo reiniciar actividades cercanas a la normalidad a la brevedad posible.7,8 La realización de una estricta evaluación del potencial donante, antes de proceder a la obtención de los órganos, seguirá siendo la piedra angular del proceso de trasplantes, así como una técnica quirúrgica adecuada, aun en contingencia por COVID-19.
Por último, la comunicación entre los equipos de donación y trasplante del país es muy importante para minimizar el tiempo de isquemia y lograr un buen resultado para el trasplante de órganos. Se debe tener en cuenta que puede presentarse cualquier variación anatómica durante la procuración, por tal motivo se deberá tener extremo cuidado evitando el daño a vasos y órganos que pongan en peligro el trasplante.
Conclusión
Desarrollar la actividad de donación y trasplante de órganos ha resultado extraordinariamente complejo, pero factible como se ha expuesto en el presente caso. El mayor impacto, creemos, no es en la procuración sino en el implante por la situación de saturación y la falta de áreas libres de COVID-19 en los hospitales, que garantice la seguridad del paciente trasplantado.
Aunque es pronto para valorar el impacto en las tasas de mortalidad asociadas a este descenso en la actividad de donación y trasplantes, es presumible que aumentarán los fallecimientos en las listas de espera que habrían sido evitables en circunstancias normales.











 nueva página del texto (beta)
nueva página del texto (beta)








