Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Chapingo. Serie horticultura
versão On-line ISSN 2007-4034versão impressa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.26 no.2 Chapingo Mai./Ago. 2020 Epub 15-Maio-2020
https://doi.org/10.5154/r.rchsh.2020.01.002
Artículo científico
Fijación biológica de nitrógeno en chipilín (Crotalaria longirostrata Hook. & Arn.), una fuente sostenible de nitrógeno para la producción comercial
1Centro International de Mejoramiento de Maíz y Trigo, Programa Mundial de Trigo. Carretera México-Veracruz km 45, El Batan, Texcoco, Estado de México, C. P. 56237, MEXICO.
2University of Massachusetts Amherst, Stockbridge School of Agriculture. Holdsworth Way, Amherst, MA., 01003-9286, UNITED STATES OF AMERICA.
La demanda creciente de productos frescos consumidos tradicionalmente por miembros de la comunidad latina en su país de origen brinda la oportunidad de producir estos cultivos especializados en la región noreste de los Estados Unidos. En Massachusetts, cada vez más agricultores están interesados en cultivar hortalizas comunes en América Latina. Un ejemplo de ello es el chipilín (Crotalaria longirostrata Hook. & Arn.), que es una leguminosa de hoja verde nativa de la parte Sur y Centro de América. Estudios preliminares indican que dicho cultivo requiere aplicaciones de nitrógeno (N) de hasta 200 kg·ha-1 para lograr los estándares de calidad necesarios para su comercialización. El objetivo del presente estudio fue evaluar la capacidad de cepas específicas de Rhizobia para la colonización de raíces de chipilín y estimar el N suministrado por la colonización bacteriana, así como su impacto en la calidad y en el rendimiento económico. Se evaluaron los efectos del suministro de N por la fijación biológica de diferentes especies de Rhizobia en plantas inoculadas. Rhizobium leguminosarum biovar colonizó al chipilín e incrementó el peso fresco total del cultivo en 158 kg·ha-1. Aplicaciones suplementarias de N inorgánico tuvieron poco efecto sobre la eficacia de colonización por las cepas bacterianas. La aplicación de más de 80 kg·ha-1 de N inorgánico únicamente aumentó el color verde de las hojas, y fue económicamente ineficiente para incrementar el peso fresco total del cultivo. Por lo anterior, las inoculaciones con Rhizobium leguminosarum biovar pueden integrarse a sistemas de producción sostenibles para complementar o reemplazar fertilizantes químicos y prevenir efectos nocivos en el medio ambiente.
Palabras clave leguminosas; sostenibilidad del cultivo; fertilizantes fijados químicamente; lixiviación; Rhizobia
The increasing demand for fresh produce traditionally consumed by members of the Latino community in their countries of origin provides an opportunity to produce these specialty crops in the Northeastern region of the United States. In Massachusetts, more commercial farmers are interested in growing vegetables common in Latin America. One example is chipilín (Crotalaria longirostrata Hook. & Arn.), a leguminous leafy green native to South and Central America. Preliminary studies indicate that this crop requires nitrogen (N) applications as high as 200 kg·ha-1 to achieve the quality standards required to market this vegetable. The objective of this study was to evaluate the capacity of specific Rhizobia strains to colonize chipilín roots and estimate the N supplied by the bacterial colonization and its impact on quality traits and economic yield. The effects of N supplied by biological fixation in plants inoculated with different Rhizobia species were evaluated. Rhizobium leguminosarum biovar colonized chipilín and enhanced the total fresh weight of the crop by 158 kg·ha-1. Supplementary applications of inorganic N had little effect on the efficiency of colonization by the bacterial strains. Furthermore, applying more than 80 kg·ha-1 of N increased only the green color of the leaves and was economically inefficient in increasing the total fresh weight of the crop. Thus, inoculations with Rhizobium leguminosarum biovar can be integrated into a sustainable production system for complementing or replacing chemical fertilizers and preventing deleterious effects on the environment.
Keywords legumes; crop sustainability; chemically fixed fertilizers; leaching; Rhizobia
Introducción
De acuerdo con la Oficina de Censo de Estados Unidos de América, 19 % de la población total de dicho país, en 2020, es hispana, y para 2060 esta alcanzará los 11.2 millones de personas (Vespa, Medina, & Armstrong, 2020). Una tendencia reciente entre la comunidad hispana es residir en diferentes áreas además de los típicos estados de “ingreso” de Texas y California. En 2008, los hispanos eran la minoría étnica más grande en Massachusetts, y representaban el 8 % de la población del estado (Mangan et al., 2008). Esta rápida expansión de nuevas comunidades en Nueva Inglaterra ha brindado oportunidades para que los agricultores cultiven y comercialicen productos frescos populares entre estas nuevas y crecientes etnias.
En Massachusetts, todos los años se realizan ensayos de investigación para identificar cultivos que se pueden producir localmente y vender en áreas densamente pobladas por la comunidad latina. Esta transición a la producción de nuevos cultivos especializados es una oportunidad de mercado para que los agricultores aumenten su rentabilidad. Uno de los cultivos producidos actualmente en Massachusetts es el chipilín (Crotalaria longirostrata Hook. & Arn.), también llamado chepil, que es una hortaliza de hoja utilizada en la cocina tradicional de América Central y el Sur de México (Chávez-Quiñones, Roldan-Toriz, Sotelo-Ortiz, Ballinas-Díaz, & López-Zúñiga, 2009). Esta hortaliza crece durante el período libre de heladas, con una producción semanal de 800 kg·ha-1 y un valor mayorista que puede alcanzar los $8.83 USD por kilogramo.
El presente artículo reporta uno de los primeros intentos para producir comercialmente el chipilín en Estados Unidos. En Massachusetts, esta hortaliza se cultiva en condiciones agronómicas similares a las descritas para col (Brassica oleracea) en la Guía de Manejo de Hortalizas de Nueva Inglaterra (Howell, 2011). Aunque la inversión económica inicial para el establecimiento del cultivo es moderadamente alta, el costo es compensado por las múltiples cosechas y su excelente precio de mercado mayorista. En Massachusetts se recomienda cultivar chipilín bajo una cubierta sintética para controlar la infestación de la “chicharra” de la papa (Empoasca fabae), además de suministrar macro y micronutrientes con fertilizantes inorgánicos a través de riego por goteo con dosis similares a las recomendadas para la col. Como leguminosa, el chipilín puede fijar naturalmente el N de la atmósfera; sin embargo, se aplican 200 kg·ha-1 de N inorgánico para lograr los estándares de calidad requeridos por el mercado.
Los cultivos alimenticios requieren fertilizantes con N para mejorar su rendimiento y calidad. Actualmente, la gran mayoría de estos fertilizantes nitrogenados se sintetizan químicamente a través del proceso Haber-Bosch, un proceso de fijación de nitrógeno que requiere grandes cantidades de combustibles fósiles (Olivares, Bedmar, & Sanjuán, 2013). El alto costo ambiental de la fertilización con N sintético requiere de la identificación de fuentes biológicas alternativas de N. La fijación biológica de nitrógeno (FBN) es un proceso sostenible que puede mejorar potencialmente la adaptabilidad del cultivo en ambientes con bajo contenido de N. En general, la FBN suministra una cuarta parte de la cantidad total de N fijada cada año a nivel mundial (Masson-Boivin, Giraud, Perret, & Batut, 2009), y disminuye las emisiones de CO2 emitidas en la producción de fertilizantes nitrogenados inorgánico. Aproximadamente, 80 % de la fijación natural total de N ocurre por la simbiosis entre leguminosas y alphaproteobacteria, especialmente Rhizobia (Olivares et al., 2013).
El nitrógeno en forma de gas (N2) es un recurso ilimitado en la atmósfera, aunque las plantas necesitan crear una relación simbiótica con procariontes para sintetizar estas moléculas en compuestos ricos en N como NH3, NO3 y NO2 (Nasholm, Kielland, & Ganeteg, 2009). La colonización por el simbionte se desencadena cuando los flavonoides de la planta y las proteínas Nod están presentes y desarrollan factores CLOS Nod. Los factores CLOS Nod inducen cambios morfológicos en la planta que permiten a las bacterias invadir la corteza del tallo (Cooper, 2004). Después de la colonización intracelular del sistema radicular, las bacterias especializadas absorben N2 del ambiente y la enzima nitrogenasa rompe el triple enlace en el N2 para convertirlo en NH4 (Havlin, 2014). La eficiencia de la simbiosis en la fijación de N está determinada por la especificidad entre la leguminosa cultivada y el simbionte. Los sistemas de fijación de nitrógeno más eficientes son las simbiosis que involucran bacterias Gram-negativas de los géneros Rhizobium y Bradyrhizobium (Olivares et al., 2013).
Ensayos preliminares identificaron cepas del género Bradyrhizobium como simbiontes del chipilín (Barnish & Spinelli, 2011; Isidoro & Messier, 2009). En estos resultados, Bradyrhizobium USDA 3456 y 3384, así como Bradyrhizobium PNL0i-Brady, colonizaron eficientemente los sistemas de raíz de chipilín e indujeron la fijación de N con potencial para reducir las aplicaciones de N inorgánico (Isidoro & Messier, 2009). Específicamente, inoculaciones con Bradyrhizobium USDA 3456 se asociaron con el incremento en la fijación de N y la mejora de la salud general de las plantas. En América Central, el chipilín es cultivado con los requerimientos mínimos y es infectado por bacterias autóctonas de fijación de N del suelo. En un estudio reciente, se aislaron cepas bacterianas de nódulos de plantas recolectadas en América Central y se evaluó su eficiencia para fijar N. Algunas de las cepas bacterianas fueron tan eficientes como los insumos inorgánicos de N para suministrar este nutriente al cultivo (Guamán-Díaz, Torres-Gutiérrez, Granda-Mora, & Nápoles-García, 2016).
En el presente estudio, se evaluó la capacidad de colonización de un conjunto de cepas de Rhizobia en chipilín y se examinó cómo esta colonización afecta al rendimiento económico y los caracteres específicos de la planta relacionados con el mercadeo. Adicionalmente, se validó el uso de inoculantes bacterianos en sistemas de producción de cultivos a gran escala como una fuente alternativa de N. Para lograr esto, se establecieron los siguientes objetivos específicos: 1) determinar la eficiencia de uso de N del cultivo, 2) evaluar la capacidad de cepas específicas de Rhizobia para la colonización y 3) estimar indirectamente el N suministrado por la colonización bacteriana y evaluar el impacto de la fijación de N en los caracteres de calidad y de rendimiento económico.
Materiales y métodos
Producción de plántula
Las plántulas de un único cultivar se obtuvieron con semillas proporcionadas por el Centro Nacional de Tecnología Agropecuaria y Forestal (CENTA) de El Salvador. Las semillas se sembraron en bandejas de plástico, de 54 por 28 cm, con turba y cubiertas con 1 cm de vermiculita. Veinte días después de la siembra, las plántulas se transfirieron a bandejas de plástico con 72 celdas y se colocaron en condiciones controladas hasta el trasplante a campo o a invernadero. Las condiciones del ambiente controlado fueron: temperatura promedio de 21 °C durante el día, 16 °C por la noche, y 12 h de luz y oscuridad.
Multiplicación de cepas de Rhizobia
Las cepas de Rhizobia evaluadas fueron: Bradyrhizobium sp. (Vigna) (R1), Bradyrhizobium USDA 3384 (R2), Rhizobium leguminosarum biovar (R3) y Bradyrhizobium USDA 2370 (R4). Las cepas R2 y R4 se multiplicaron en medio líquido modificado de gluconato de arabinosa (MAG), con pH ajustado a 6.6. El crecimiento bacteriano se indujo descongelando una pequeña porción de las bacterias en 100 mL de medio líquido MAG y colocando la solución en un agitador rotatorio a 200 rpm. Después de observar un crecimiento suficiente de la bacteria, la solución se diluyó en cuatro concentraciones (1:1, 1:10, 1:100 y 1:1,000) y se transfirió a cajas Petri individuales (100 x 15 mm) con medio MAG sólido. Todo el procedimiento se realizó bajo campana de flujo laminar. El inoculante para las cepas R1 y R3 se obtuvo de dos productos comerciales desarrollados por INTX microbials-llc, Indiana, EUA. La cepa R1 provino del producto comercial inoculante N-DURE® para caupí (Vigna unguiculata L.), y la cepa R3 del inoculante N-DURE® para frijol (Phaseolus spp. L.).
Se preparó una solución de cada una de las cepas bacterianas fijadoras de nitrógeno con concentración mínima de 2 x 108 unidades formadoras de colonias (UFC). La colonización bacteriana del sistema radicular se indujo al aplicar, con jeringa de plástico, 10 mL de la solución al sustrato donde crecían las plántulas.
Experimento en invernadero
En 2012 se realizó un ensayo en invernadero (Experimento de invernadero 1) para evaluar la eficacia de la inoculación de cepas específicas de Rhizobia y determinar la interacción de la colonización bacteriana con aplicaciones de N inorgánico. El experimento se llevó a cabo en las instalaciones del Colegio de Ciencias Naturales de la Universidad de Massachusetts, Amherst. Las condiciones generales del invernadero fueron: 14 h de luz con temperatura promedio de 21 °C durante el día y 16 °C por la noche. Las plántulas se trasplantaron a macetas de vivero de 18.5 cm de altura y 16.2 cm de diámetro, llenadas con una mezcla de arena de río y perlita en proporción 1:1.
El diseño experimental fue bloques completos al azar con cuatro repeticiones. En el ensayo se evaluaron cuatro cepas de Rhizobia (R1, R2, R3 y R4) y un tratamiento testigo (R0), en combinación con siete concentraciones de N (0, 26.25, 52.5, 105, 157.5, 210 y 262.5 mg·L-1).
Las dosis de N se suministraron a través de la solución nutritiva de Hoagland 0.5 M modificada (Hoagland & Arnon, 1950), utilizando nitrato de sodio (NaNO3) como la fuente principal de N. Macro y micronutrientes también se incluyeron en la solución de Hoagland mediante fosfato de potasio (KH2PO4), sulfato de magnesio (MgSO4), cloruro de calcio (CaCl2) y cloruro de potasio (KCl), lo que aportó las siguientes concentraciones (mg·L-1): 234 de potasio (K), 31 de fósforo (P), 48 de magnesio (Mg), 64 de azufre (S), 200 de calcio (Ca) y 525 de cloruro (Cl). Las concentraciones de macro y micronutrientes se mantuvieron constantes en las siete soluciones nutritivas, a excepción del sodio (Na): 0, 44, 87, 173, 259, 345 y 432 mg·L-1.
Los sistemas radiculares de las plantas se lavaron cuidadosamente, y una vez que el ciclo de cultivo finalizó se registró el número de nódulos por planta (NN) y el peso promedio por nódulo (PN, en mg).
Experimentos en campo
En 2011 se realizó una evaluación en campo (Experimento de campo 1) para determinar la respuesta del cultivo a ocho dosis de N inorgánico. En 2012, se llevó a cabo un ensayo experimental adicional (Experimento de campo 2) para evaluar la eficiencia de inoculación de tres cepas de bacterias de Rhizobia fijadoras de nitrógeno con diferentes dosis de N inorgánico. Ambas pruebas se llevaron a cabo en la Granja Experimental de la Universidad de Massachusetts en South Deerfield, Massachusetts. Las características del suelo donde se establecieron los experimentos son: occum limo arenoso fino (grava-arcillosa, mezclado, Fluventic Dystrudept) con pH de 6.5, 2.4 % de materia orgánica, 10 ppm de P2O5, 53 ppm de K, 556 ppm de Ca, 65 ppm de Mg y 91.23 ppm de NO3.
Las parcelas se establecieron en camas elevadas con separación de 1.8 m, cubiertas con plástico de acolchado negro degradable (BioTelo®). Las plántulas se trasplantaron a 30 cm de distancia en doble hilera por cama para obtener una densidad de plantación de 29,000 plantas·ha-1. El riego se proporcionó con un sistema de goteo y se programó de acuerdo con la información recopilada por tensiómetros del suelo (Irrometer®, EUA) colocados a 38 y 76 cm de profundidad del suelo. El fósforo (33.7 kg·ha-1, como P2O5) y el potasio (123.3 kg·ha-1, como K2O) se suministraron con fertilizante inorgánico mediante riego por goteo de acuerdo con las recomendaciones generales para col rizada y acelgas de la Guía de Manejo de Vegetales de Nueva Inglaterra, 2011- 2012 (Howell, 2011).
En el Experimento de campo 1 se evaluaron seis dosis de N inorgánico (40, 80, 120, 160, 200 y 240 kg·ha-1), y en el Experimento de campo 2 se incluyeron dos dosis de N adicionales (0 y 280 kg·ha-1). Cada dosis de N se suministró en cinco aplicaciones, cada una de las cuales correspondió a 12.5 % del total de N. La fuente de N en ambos experimentos fue nitrato de amonio (NH4NO3). En el Experimento de campo 2, las cepas de Rhizobia (R1, R2, R3 y R4) también se evaluaron en combinación con siete concentraciones de N inorgánico. Ambos ensayos experimentales se evaluaron en un diseño de bloques completos al azar con cinco repeticiones.
Los brotes frescos (BF, en kg·ha-1) se cosecharon en cinco ocasiones cuando se alcanzó el tamaño de comercialización del chipilín de entre 15 y 20 cm, y las muestras se secaron en horno durante 48 h a 75 °C hasta obtener el peso seco (PS, en kg·ha-1). El color, el vigor y la uniformidad del cultivo se registraron con una escala visual de 1 a 5, donde 1 fue el peor y 5 el mejor. Asimismo, se midió la altura de la planta (AP, en cm). Los siguientes caracteres se evaluaron solo en el Experimento de campo 2: contenido de clorofila en la hoja, determinado con un medidor Minolta (SPAD-502, México) (unidades SPAD); contenido total de nitrógeno (TN, en mg·L-1) de la materia seca, estimado con el método de combustión de Dumas en un sistema analizador de elementos, y el NN y PN, obtenidos al limpiar el sistema radicular dentro de un radio de 35 cm alrededor de la planta.
Análisis estadístico
Las lecturas de BF, PS, SPAD, AP, TN, NN y PN se sometieron a análisis de varianza con el diseño experimental de bloques completos al azar.
En el modelo, Y ijk es la variable respuesta para la dosis de nitrógeno i, con la cepa Rhizobia j en el bloque k; μ es la media general; N i es el efecto de la i-ésima dosis de N; R j es el efecto de la j-ésima cepa de Rhizobia; R j x N i representa el efecto de interacción de la j-ésima cepa de Rhizobia con la i-ésima dosis de N; β k es el efecto del k-ésimo bloque, y ε ijk es el efecto del error aleatorio para el tratamiento con la i-ésima dosis de N y la j-ésima cepa de Rhizobia en el k-ésimo bloque. Para el análisis estadístico de datos del Experimento de campo 1, los términos R j y R j x N i se excluyeron del modelo lineal.
La prueba de comparaciones de medias de Tukey se usó para los efectos principales de Rhizobia y N. Además, se evaluó la asociación estadística entre las dosis de N y las variables respuesta mediante contrastes ortogonales polinomiales (lineal, cuadrático y cúbico). Este análisis se realizó para el ensayo de invernadero y para ambas pruebas de campo (Experimentos de campo 1 y 2). Adicionalmente, se ajustó un modelo de regresión para BF con las dosis de N. Todos los análisis se realizaron con el programa SAS versión 9.3 (SAS Institute Inc., 2011).
Resultados y discusión
Respuesta del cultivo a aplicaciones de nitrógeno inorgánico
Se detectaron diferencias estadísticas en las dosis de N para BF y AP, con coeficientes de variación de 16.9 y 7.7, respectivamente (Cuadro 1). La BF cosechada durante el ciclo de cultivo varió desde 5.4 hasta 6.2 t·ha-1, con las dosis de N de 240 y 40 kg·ha-1, respectivamente. Se observó una asociación lineal positiva entre el BF y las dosis de N, pero solo para aplicaciones de N entre 40 y 120 kg·ha-1. Cuando las aplicaciones de N fueron altas (240 kg·ha-1), el rendimiento comercial se redujo 25 %, en comparación con la aplicación más bajas (40 kg·ha-1). La AP promedio del cultivo varió de 12.5 a 13.8 cm, pero solo la AP del tratamiento NR6 (240 kg·ha-1) fue diferente estadísticamente del resto de las dosis de N (Cuadro 1). Lo anterior sugiere que el aumento de BF asociado con las aplicaciones de N de 40 a 120 kg·ha-1 (Figura 1) se debió a la acumulación de biomasa, más que a un aumento en la AP.
Cuadro 1 Comparación de medias para diferentes dosis de nitrógeno (N) evaluadas en campo para peso de brotes fresco (BF) y altura de planta (AP). Experimento de campo 1, 2011.
| Tratamiento | Dosis de N (kg·ha-1) | BF (kg·ha-1) | AP (cm) |
|---|---|---|---|
| NR1 | 40 | 6,293 abz | 13.5 ab |
| NR2 | 80 | 6,265 a | 13.6 ab |
| NR3 | 120 | 6,808 ab | 13.8 ab |
| NR4 | 160 | 6,610 ab | 13.8 ab |
| NR5 | 200 | 6,158 ab | 13.3 ab |
| NR6 | 240 | 5,393 b | 12.5 b |
| Significancia del ANOVA | ** | * | |
| Coeficiente de variación | 16.9 | 7.7 | |
| Contraste para dosis de N1 | ** | * |
1Contraste ortogonal que corrobora la relación cuadrática entre las dosis de N y la variable respuesta; ANOVA = análisis de varianza; *, ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
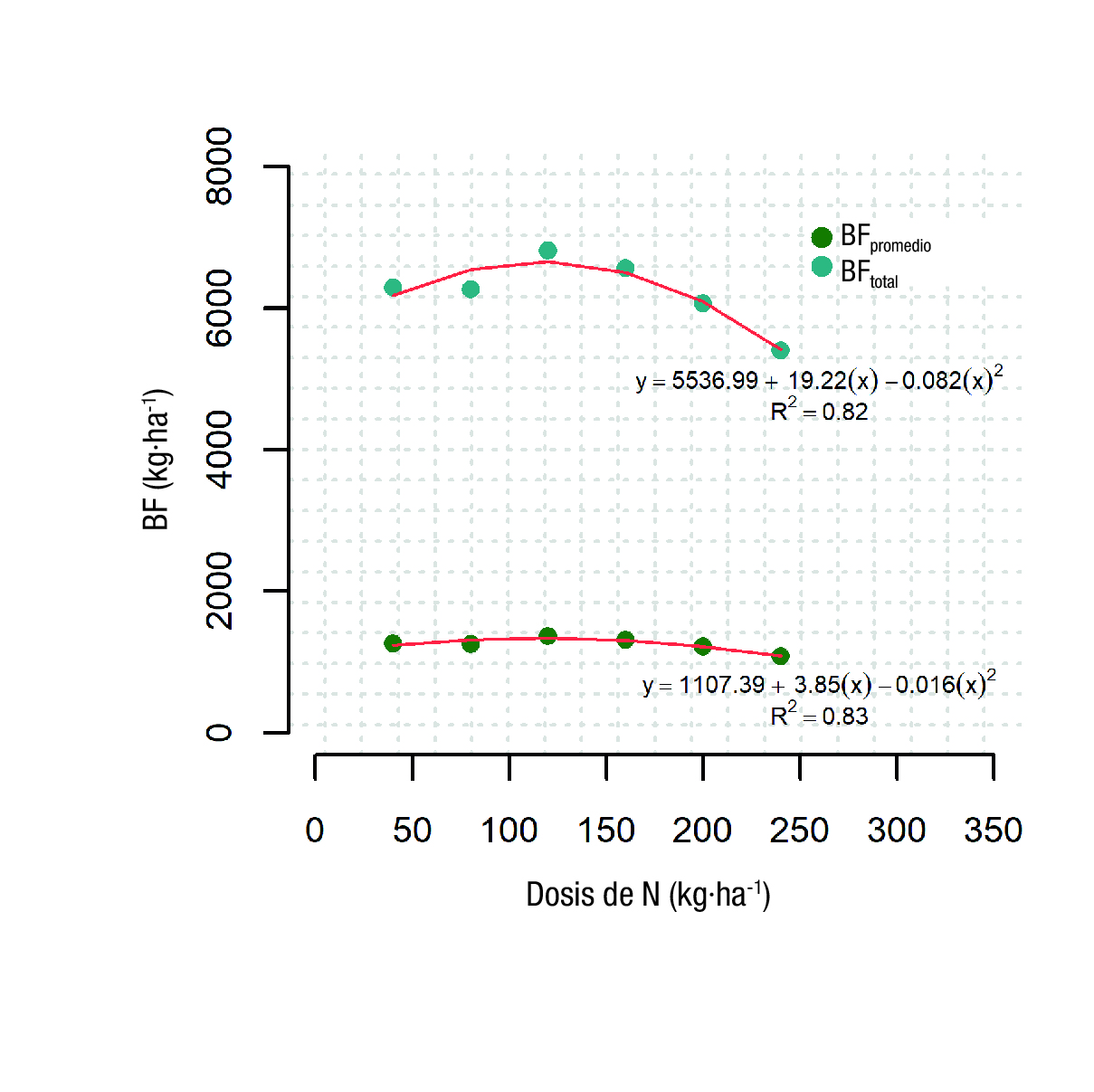
Figura 1 Peso promedio de los brotes frescos cosechados (BFpromedio en kg·ha-1) y peso total de brotes frescos cosechados (BFtotal en kg·ha-1) para seis dosis de nitrógeno (N) inorgánico. Experimento de campo 1, 2011.
Se observó una tendencia polinomial cuadrática entre el BF del cultivo y las dosis de N inorgánico (Figura 1). Si dos funciones lineales independientes se ajustan para las dosis de N y BF, se observa una pendiente positiva para las dosis de N de 40, 80 y 120 kg·ha-1; así como una pendiente negativa para las dosis de 160, 200 y 240 kg·ha-1. Las pendientes de estos modelos fueron 6.45 y -15.2, respectivamente. De esta manera, por cada kg·ha-1 de N inorgánico aplicado hubo un incremento de 6.45 kg·ha-1 de BF; sin embargo, esta tendencia solo se observó para aplicaciones de N por debajo de 120 kg·ha-1. En contraste, hubo una disminución de 15.21 kg·ha-1 de BF por cada kg·ha-1 de N inorgánico aplicado por arriba de 120 kg·ha-1.
Eficiencia de inoculación de cepas de Rizobia
Como se esperaba, las inoculaciones con cepas de Rhizobia modificaron significativamente a NN y NW (P ≤ 0.01), y las aplicaciones suplementarias de N inorgánico solo afectaron el NN. En contraste, el efecto del N inorgánico sobre la eficiencia de inoculación de Rhizobia solo se observó en el NN. El Cuadro 2 presenta el NN promedio por planta y el PN individual en respuesta a la inoculación con las cepas de Rhizobia. De acuerdo con estos resultados, el NN detectado en R1, R2, R3, R4 y R0 fue 51, 38, 128, 39 y 23, respectivamente. Las cuatro cepas de Rhizobia indujeron mayor NN que cepas nativas de América Central, para las cuales el NN promedio fue de 9.4 (Guamán-Díaz et al., 2016). Por lo tanto, Rhizobium leguminosarum biovar indujo el desarrollo de seis veces más nódulos que el testigo, con un PN promedio de 0.8 mg.
Cuadro 2 Comparación de medias de cepas de Rhizobium (R1 a R4) y tratamiento testigo (R0) para número de nódulos por planta (NN) y peso promedio por nódulo (PN, en mg). Experimento de invernadero 1, 2012.
| Cepa de Rhizobium | NN | PN |
|---|---|---|
| R0 = Testigo | 23.0 cz | 3.3 a |
| R1 = Bradyrhizobium sp. (Vigna) | 51.0 b | 2.5 a |
| R2 = Bradyrhizobium USDA 3384 | 38.0 bc | 2.8 a |
| R3 = Rhizobium leguminosarum biovar | 128.0 a | 0.8 b |
| R4 = Bradyrhizobium USDA 2370 | 39.0 bc | 1.6 ab |
| Significancia del ANOVA1 | ** | * |
| Coeficiente de variación | 7.2 | 11.7 |
1ANOVA = análisis de varianza; *, ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
De acuerdo con Isidoro y Messier (2009), Rhizobium leguminosarum biovar es un simbionte superior para el chipilín que induce la producción de una mayor cantidad de nódulos en el sistema radicular. Las cepas R1, R2 y R4 también desencadenan el desarrollo de nódulos con tamaños significativamente mayores; sin embargo, la presencia de nódulos en las raíces no siempre garantiza un proceso eficiente de fijación de N. En el chipilín, solo el 20 % de los nódulos recolectados de plantas colonizadas por cepas bacterianas nativas en América Central contenían leghemoglobina (Barnish & Spinelli, 2011), la cual amortigua la concentración de oxígeno libre y garantiza la función adecuada de los nódulos de la raíz.
Recientemente, se identificó una cepa bacteriana aislada (S.F3.1) con características de la familia Rhizobiaceae que se asoció con un incremento significativo del peso fresco y seco, la altura de la planta y la biomasa de las raíces (Guamán-Díaz et al., 2016). No obstante, se requiere realizar un análisis detallado en un sistema de producción intensivo para comparar la eficiencia de fijación de N del aislado S.F3.1 y Rhizobium leguminosarum biovar.
La presencia de nódulos en el sistema de raíces de las plantas del testigo también fue informado en una investigación reciente (Guamán-Díaz et al., 2016). En este estudio, el desarrollo de nódulos en plantas del testigo se atribuye a la presencia de cepas de Rhizobia desconocidas en el sustrato utilizado para producir las plántulas.
El Cuadro 3 presenta el NN y el PN para las dosis de N, y se observa una asociación negativa entre el NN y la concentración de N de la solución nutritiva. Al comparar las respuestas de HS0 y HS1, el suministro mínimo de N de 26.25 mg·L-1 parece soportar el desarrollo de nódulos. Resultados similares indican un incremento en el NN al suministrar 2 mmol·L-1 de N a alfalfa (Medicago sativa) (Salles-de Oliviera, Anchão-Oliveira, Corsi, Sanches-Duarte, & Mui-Tsai, 2004) y a cáñamo (Crotalaria juncea) (Miranda-Mendonça & Aparecida-Schiavinato, 2005). Esta concentración mínima de N podría ser suficiente para soportar el crecimiento de la planta sin afectar en forma negativa el proceso de fijación simbiótica y biológica del N. En cambio, cuando la dosis de N alcanza 260 ppm (HS6), hay una clara reducción del NN de aproximadamente 82 % en comparación con HS1.
Cuadro 3 Contrastes ortogonales polinomiales de diferentes concentraciones de nitrógeno (N), en la solución nutritiva Hoagland 0.5 M, para el número de nódulos promedio por planta (NN) y el peso promedio por nódulo (PN, en mg).
| Tratamiento | Concentración de nitrógeno (mg·L-1) | NN | PN |
|---|---|---|---|
| HS0 | 0 | 91.0 | 1.5 |
| HS1 | 26.25 | 105.2 | 3.4 |
| HS2 | 52.50 | 62.2 | 2.5 |
| HS3 | 105.00 | 51.3 | 1.9 |
| HS4 | 157.50 | 30.5 | 1.9 |
| HS5 | 210.00 | 40.3 | 1.9 |
| HS6 | 262.50 | 19.6 | 1.8 |
| Significancia | ** | ns | |
| Tendencia (nitrógeno) | **L | ns |
L = relación lineal entre dosis de nitrógeno y el parámetro medido; ns = no significativo; *, ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente.
En la Figura 2 se presenta un análisis del efecto del N inorgánico sobre el NN de las plantas inoculadas con las cepas de Rhizobia. En la gráfica, la concentración estándar de la solución nutritiva Hoagland (210 ppm) se representa como 1.0 en el eje de las abscisas; la mitad del estándar de la concentración (105 ppm) se representa como 0.5, y 1.25 denota 262.5 ppm. Se observa una tendencia clara hacía la disminución en la nodulación y la fijación de N con altas dosis del fertilizante nitrogenado.
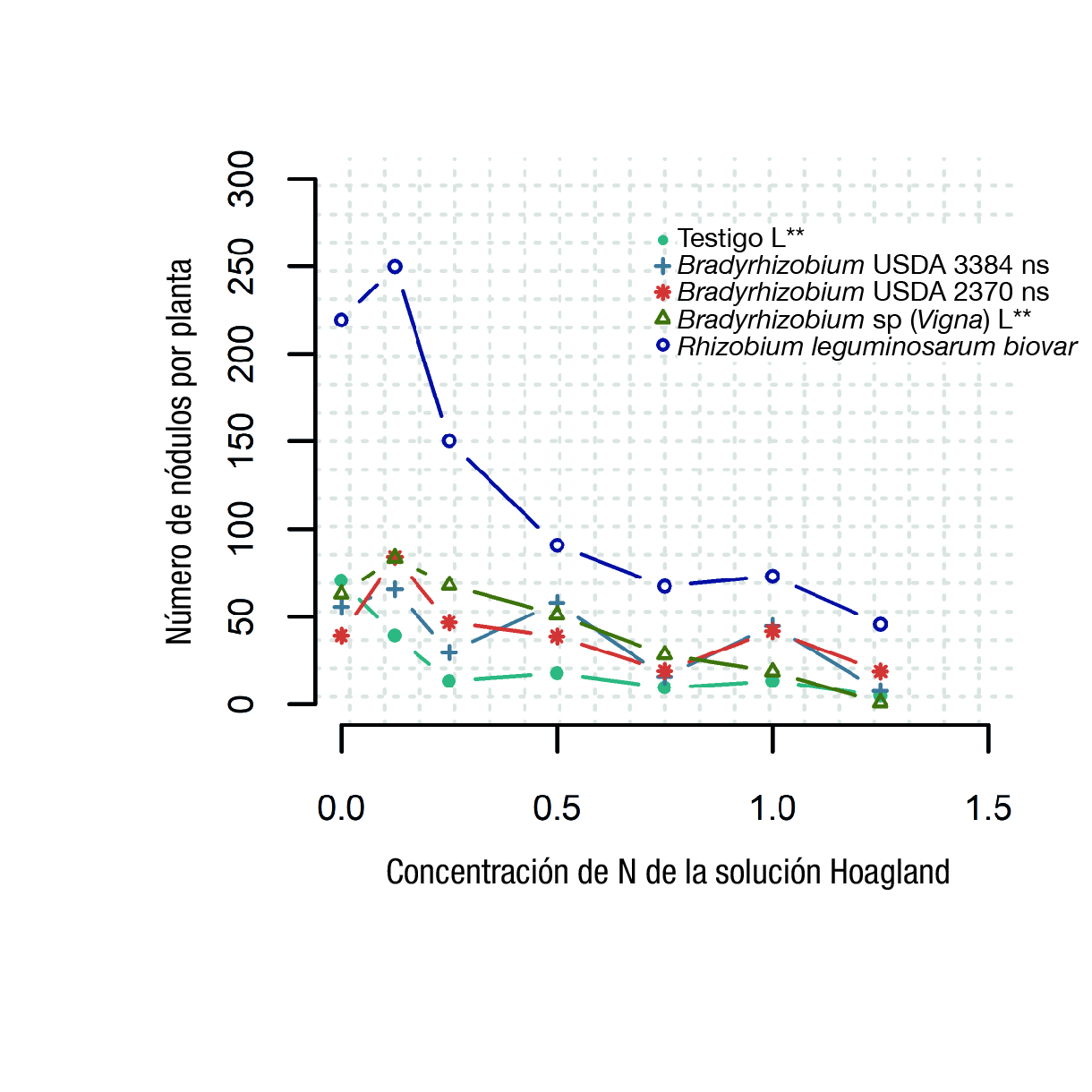
Figura 2 Número de nódulos por planta en respuesta a la inoculación de cuatro cepas de Rhizobia con seis dosis de nitrógeno (N) de la solución nutritiva de Hoagland 0.5 M modificada.
Aunque Rhizobium leguminosarum biovar fue afectado por el gran suministro de N, el alto NN inducidos por la inoculación con esta cepa compensó dicha inhibición (Figura 2). Con concentraciones de N tan altas (260 ppm) hubo una reducción en el NN de aproximadamente 200 nódulos. La capacidad de Rhizobium leguminosarum biovar para soportar la inhibición de la fijación de N bajo altas concentraciones de N inorgánico y para maximizar la fijación bajo concentraciones reducidas de N, resalta la importancia de identificar cepas de Rhizobia específicas al huésped.
Los aumentos constantes en los precios de los fertilizantes y combustibles con N tienen un efecto importante en las decisiones de producción y la rentabilidad. Por ello, se debe hacer hincapié en el desarrollo de nuevos métodos de producción adecuados, tanto agronómica como económicamente. La capacidad de Rhizobium leguminosarum biovar para convertir el gas N estable de la atmósfera en una forma biológicamente útil es una gran ventaja en la producción de chipilín al disminuir los costos de producción y mitigar los efectos sobre el cambio climático al reemplazar todo o la mayor parte del N requerido por el cultivo.
Eficiencia de la fijación de nitrógeno por cepas de Rhizobia en sistemas de producción comercial
La eficiencia de colonización de las cuatro cepas de Rhizobia se validó en campo. El Cuadro 4 presenta las fuentes de variación en N, cepas de Rhizobia (R) y su interacción (N x R) para los caracteres evaluados. El suministro de N inorgánico al cultivo mostró un efecto positivo (P ≤ 0.01) en las principales variables económicas: color, vigor, uniformidad, BF total y color verde de hojas. Dicha respuesta coincidió con observaciones preliminares, donde un suministro constante y abundante de N inorgánico mejoró drásticamente la calidad comercial del cultivo.
Cuadro 4 Significancia estadística del análisis de varianza de los caracteres evaluados en chipilín (Crotalaria longirostrata Hook. & Arn.) bajo diferentes dosis de nitrógeno (N) e inoculaciones de cepas de Rhizobium (R). Experimento de campo 2, 2012.
| Variable dependiente | N | R | (N x R) |
|---|---|---|---|
| Caracteres cuantitativos | |||
| Peso fresco (kg·ha-1) | ** | * | ns |
| Peso seco (kg·ha-1) | ** | * | ns |
| Unidades SPAD | ** | * | ns |
| Altura de planta (cm) | ** | ** | ns |
| Nitrógeno total (mg·L-1) | ** | ns | ns |
| Número de nódulos por planta | ns | * | ns |
| Peso por nódulo (mg) | ns | ns | ns |
| Caracteres cualitativos | |||
| Color | ** | ns | ns |
| Vigor | ** | ns | ns |
| Uniformidad | ** | ns | ns |
ns = no significativo; *, ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente.
Las inoculaciones con las cepas de Rhizobia también tuvieron un efecto positivo (P ≤ 0.01) en el BF de las plantas. Cepas específicas indujeron el incremento de la biomasa total de la planta, pero no mostraron efecto sobre la intensidad del color verde de las hojas. Aunque la colonización con las cepas bacterianas incrementó el NN, no hubo efecto de la colonización sobre el contenido total de N en el BF.
Por su parte, las altas dosis de N inorgánico disminuyeron la fijación de N (Cuadro 2). Este efecto negativo sobre la simbiosis también se reportó para Sinorhizobium meliloti en alfalfa (Medicago sativa) cuando el suministro anual de N alcanzó 450 kg·ha-1 (Salles-de Oliviera et al., 2004), y para Rhizobia en cáñamo (Miranda- Mendonça & Aparecida-Schiavinato, 2005). Sin embargo, el NN no fue afectado por el incremento continuo de la dosis de N en el Experimento de campo 2 (Cuadro 5). Esta discrepancia puede ser causada por diferencias en el número de cosechas del cultivo y el método de aplicación de tratamientos con N. En campo, se aplicó N inorgánico cada vez que se cosechó el cultivo, mientras que en invernadero, el N se aplicó semanalmente y el cultivo se cosechó solo una vez. El crecimiento constante de las plantas en la prueba de campo pudo haber generado la extracción del N del suelo hasta el punto en que no afectara la formación de nódulos o la fijación de N.
Cuadro 5 Contrastes ortogonales polinomiales de ocho dosis de nitrógeno inorgánico (NR0 a NR7). Experimento de campo 2, 2012.
| Dosis de nitrógeno (kg·ha-1) | BF1 (kg·ha-1) | PS (kg·ha-1) | SPAD | TN (mg·L-1) | AP (cm) | NN | PN (mg) |
|---|---|---|---|---|---|---|---|
| NR0 0 | 4,564 | 661 | 44.1 | 4.4 | 33.8 | 16.4 | 1.9 |
| NR1 40 | 5,892 | 838 | 45.5 | 4.9 | 36.9 | 14.1 | 1.4 |
| NR2 80 | 6,974 | 982 | 45.9 | 5.0 | 39.1 | 16.7 | 0.6 |
| NR3 120 | 6,950 | 982 | 46.3 | 5.1 | 38.6 | 13.2 | 1.9 |
| NR4 160 | 7,067 | 982 | 46.8 | 5.2 | 38.0 | 12.5 | 0.5 |
| NR5 200 | 6,870 | 941 | 46.8 | 5.2 | 37.5 | 12.0 | 0.4 |
| NR6 240 | 6,913 | 960 | 47.2 | 5.3 | 38.6 | 11.0 | 0.5 |
| NR7 280 | 7,229 | 1,031 | 48.1 | 5.3 | 38.7 | 12.8 | 0.4 |
| Significancia | ** | ** | ** | ** | ** | ns | ns |
| Contraste polinomial | **L **Q **C | **L **Q **C | **L ns **C | **L **Q **C | **L **Q **C | ns | ns |
1BF = peso de brotes fresco; PS = peso seco de tallos, TN = concentración de N en hojas; AP = altura de la planta; NN = número de nódulos por planta; PN = peso promedio por nódulo; ns = no significativo; * , ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente; L, Q, C = contrastes lineales, cuadráticos o cúbicos, respectivamente, entre el tratamiento con nitrógeno y la variable evaluada.
La respuesta del rendimiento económico del BF a las dosis de N se presenta en el Cuadro 5. Si se analiza el equilibrio entre la aplicación de N y el BF en el Experimento de campo 2, se puede determinar que por cada kg de N suministrado en el intervalo de 0 a 80 kg·ha-1, hay un incremento en BF de 30 kg·ha-1 (P ≤ 0.01). Aplicaciones superiores de 80 kg·ha-1 son menos rentables, ya que presentan un incremento máximo en BF de 1.12 kg·ha-1 por kg de N aplicado. Similarmente, en PS el suministro de N superior a 80 kg·ha-1 proporciona incrementos (P ≤ 0.01) de sólo 0.175 kg·ha-1 por unidad de N. La ausencia de N inorgánico produjo solo 0.61 t·ha-1 de PS por ciclo, mientras que en áreas tropicales, el PS total puede alcanzar 3.4 t·ha-1 por año (Sosa-Rubio, Cabrera-Torres, Rodríguez, & Ortega-Reyes, 2008). Adicionalmente, se observó un incremento simultáneo en el contenido de clorofila y el contenido de TN de las hojas con las dosis de N de hasta 280 kg·ha-1.
La asociación alta entre el contenido de clorofila y la acumulación total de N en las hojas (r = 0.95, P ≤ 0.01) valida el uso del medidor SPAD para estimaciones in situ del contenido de N de la planta. En arroz, maíz, cebada y trigo, se determinó una asociación similar entre las lecturas de SPAD y la concentración de N en la hoja. (Dwyer et al., 1995; Lin et al., 2010; Peltonen, Virtanen, & Haggrèn, 2008; Reeves, Mask, Wood, & Delaney, 2008; Shukla et al., 2004).
Considerando la importancia de los caracteres de calidad en la producción de hortalizas, se examinó la importancia del N inorgánico en la expresión de dichos caracteres de comercialización, y se detectaron diferencias en el color, el vigor y la uniformidad del cultivo. Cuando no se aplicó N, el color, el vigor y la uniformidad fueron 2.3, 2.5 y 2.3, respectivamente, y con 280 kg·ha-1 de N, los valores correspondientes fueron 3.5, 3.5 y 3.3. La adición de N en más de 80 kg·ha-1, y hasta 280 kg·ha-1, resultó en una mejora mínima en el color de 0.2, en vigor de 0.3 y en uniformidad de 0.4. Los análisis para determinar el efecto de las inoculaciones de Rhizobia en estas tres características de calidad no mostraron significancia estadística.
El Cuadro 6 muestra las asociaciones estadísticas entre las cepas de Rhizobia y las variables BF, PS, unidades SPAD, TN, AP, NN y PN. Un incremento no significativo de 158 kg·ha-1 en BF se asoció con la inoculación de plantas con Rhizobium leguminosarum biovar. Mientras que un incremento mínimo en el rendimiento económico en las plantas colonizadas con Bradyrhizobium USDA 3384 presentó una mejora significativa en el color verde de las hojas; aunque esta misma cepa disminuyó significativamente el NN. En promedio, Bradyrhizobium sp. (Vigna) y Rhizobium leguminosarum biovar indujeron el desarrollo de seis nódulos más por planta en comparación con Bradyrhizobium USDA 3384. A pesar de que la colonización con las cepas de Rhizobia modificó el NN, este carácter no afectó el peso por nódulo.
Cuadro 6 Comparación de medias de tres cepas de Rhizobium (R1 a R3) y testigo (R0). Experimento de campo 2, 2012.
| Cepa de Rhizobium | BF1 (kg·ha-1) | PS (kg·ha-1) | SPAD | TN (mg·L-1) | AP (cm) | NN | PN (mg) |
|---|---|---|---|---|---|---|---|
| R0 = Testigo | 6,674.4 az | 934.8 a | 46.6 ab | 5.0 | 38.1 a | 14.3 a | 0.8 |
| R1 = Bradyrhizobium sp. (Vigna) | 6,646.4 a | 941.2 a | 46.0 b | 5.0 | 37.8 a | 15.8 a | 0.8 |
| R2 = Bradyrhizobium USDA 3384 | 6,077.2 b | 858.0 b | 48.0 a | 5.1 | 36.4 b | 9.0 b | 0.4 |
| R3 = Rhizobium leguminosarum biovar | 6,832.4 a | 956.4 a | 46.0 b | 5.1 | 38.3 a | 15.0 a | 1.7 |
| Significancia | * | * | * | ns | ** | ** | ns |
1BF = peso de brotes fresco; PS = peso seco de tallos, TN = concentración de N en hojas; AP = altura de la planta; NN = número de nódulos por planta; PN = peso promedio por nódulo; ns = no significativo; * , ** = significativo con P ≤ 0.05 y P ≤ 0.01, respectivamente. zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
La asociación planta-microbio, de chipilín con Rhizobium leguminosarum biovar y Bradyrhizobium USDA 3384, fue un sistema eficiente de fijación de N, pero se necesitan mayores esfuerzos para desarrollar cultivares adaptados a inoculantes específicos y evaluar cómo los factores bióticos y abióticos pueden afectar su eficiencia de fijación. Además, la presencia de nódulos en el sistema radicular de las plantas en el testigo sugiere una competencia potencial entre el Rhizobia nativo en el suelo y las cepas introducidas. Cuando los competidores del suelo son ineficientes fijadores de N, las tasas de fijación de N y la productividad de la planta pueden disminuir (Olivares et al., 2013). Además, es importante considerar múltiples inoculaciones para asegurar la adecuada colonización del inoculante.
Conclusiones
De acuerdo con los resultados presentados en este estudio, las aplicaciones de N inorgánico mayores de 80 kg·ha-1 proporcionan un retorno económico mínimo en términos del rendimiento económico (BF); sin embargo, aplicaciones adicionales de N pueden aumentar la calidad comercial de chipilín. Las cepas de Bradyrhizobium y Rhizobium colonizaron el cultivo, y específicamente la cepa Rhizobium leguminosarum biovar mejoró la acumulación de BF. No obstante, la relación entre esta colonización y el contenido de clorofila del cultivo no es clara. Cualquier aplicación suplementaria de N inorgánico en condiciones de campo tiene poco impacto en la efectividad de la colonización bacteriana, pero para maximizar el NN y mejorar la fijación de N, se recomienda suministrar N con una dosis no mayor de 80 kg·ha-1. Adicionalmente, es necesario evaluar la efectividad de inoculaciones periódicas con las mejores cepas de bacterias fijadoras de N e identificar la nodulación específica del genotipo para seleccionar un inoculante efectivo y competitivo.
References
Barnish, A., & Spinelli, C. (2011). Analysis of Leghemoglobin present in Chipilin-Rhizobia symbiosis (Bachelor thesis). Worcester Polytechnic Instiute, USA. Retrieved from https://web.wpi.edu/Pubs/E-project/Available/E-project-042811-111107/unrestricted/Chipilin.pdf [ Links ]
Chávez-Quiñones, E., Roldan-Toriz, J., Sotelo-Ortiz, B. E., Ballinas-Díaz, J., & López-Zúñiga, E. J. (2009). Plantas comestibles no convencionales en Chiapas, Mexico. Revista Salud Publica y Nutricion, 10(2), 1-11. Retrieved from https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=22530 [ Links ]
Cooper, J. E. (2004). Multiple responses of rhizobia to flavonoids during legume root infection. Advances in Botanical Research, 41, 1-62. doi: 10.1016/S0065-2296(04)41001-5 [ Links ]
Dwyer, L. M., Stewart, D. W., Gregorich, E., Anderson, A. M., Ma, B. L., & Tollenaar, M. (1995). Quantifying the nonlinearity in chlorophyll meter response to corn leaf nitrogen concentration. Canadian Journal of Plant Science, 75(1), 179-182. doi: 10.4141/cjps95-030 [ Links ]
Guamán-Díaz, F., Torres-Gutiérrez, R., Granda-Mora, K., & Nápoles-García, M. C. (2016). Isolation and characterization of rhizobia from Crotalaria sp. in southern Ecuador. Cultivos tropicales, 37(1), 40-47. doi: 10.13140/RG.2.1.1014.7446 [ Links ]
Havlin, J. (2014). Soil fertility and fertilizers: an introduction to nutrient management. USA: Pearson Education. [ Links ]
Hoagland, D. R., & Arnon, D. I. (1950). The water-culture method for growing plants without soil. Berkeley, California: College of Agriculture, University of California. [ Links ]
Howell, J. (2011). New England vegetable management guide. USA: Agriculture, Food and the Environment. [ Links ]
Isidoro, M., & Messier, R. (2009). Selection of optimal Rhizobia strain for Crotalaria Longirostrata. (Bachelor thesis), Worcester Polythechnic Institute, USA. Retrieved from https://web.wpi.edu/Pubs/E-project/Available/E-project-042910-120441/unrestricted/MQP0914%5B1%5D.pdf [ Links ]
Lin, F. F., Qiu, L. F., Deng, J. S., Shi, Y. Y., Chen, L. S., & Wang, K. (2010). Investigation of SPAD meter-based indices for estimating rice nitrogen status. Computers and Electronics in Agriculture, 71(1), 60-65. doi: 10.1016/j.compag.2009.09.006 [ Links ]
Mangan, F. X., de Mendonça, R. U., Moreira, M., del Vecchio-Nunes, S. D., Finger, F. L., Barros, Z. D., Galvão, H., Almeida, G. C., Silva, R., & Anderson, M. D. (2008). Production and marketing of vegetables for the ethnic markets in the United States. Horticultura Brasileira, 26(1), 6-14. doi: 10.1590/S0102-05362008000100002 [ Links ]
Masson-Boivin, C., Giraud, E., Perret, X., & Batut, J. (2009). Establishing nitrogen-fixing symbiosis with legumes: how many rhizobium recipes? Trends Microbiol, 17(10), 458-466. doi: 10.1016/j.tim.2009.07.004 [ Links ]
Miranda-Mendonça, E. H., & Aparecida-Schiavinato, M. (2005). Growth of Crotalaria juncea L. supplied with mineral nitrogen. Brazilian Archives of Biology and Technology, 48(2), 181-185. doi: 10.1590/S1516-89132005000200003 [ Links ]
Nasholm, T., Kielland, K., & Ganeteg, U. (2009). Uptake of organic nitrogen by plants. New Phytol, 182(1), 31-48. doi: 10.1111/j.1469-8137.2008.02751.x [ Links ]
Olivares, J., Bedmar, E. J., & Sanjuán, J. (2013). Biological nitrogen fixation in the context of global change. Molecular Plant-Microbe Interactions, 26(5), 486-494. doi: 10.1094/MPMI-12-12-0293-CR [ Links ]
Peltonen, J., Virtanen, A., & Haggrèn, E. (2008). Using a chlorophyll meter to optimize nitrogen fertilizer application for intensively‐managed small‐grain cereals. Journal of Agronomy and Crop Science, 174(5), 309-318. doi: 10.1111/j.1439-037X.1995.tb01118.x [ Links ]
Reeves, D. W., Mask, P. L., Wood, C. W., & Delaney, D. P. (2008). Determination of wheat nitrogen status with a hand‐held chlorophyll meter: Influence of management practices. Journal of Plant Nutrition, 16(5), 781-796. doi: 10.1080/01904169309364574 [ Links ]
Salles-de Oliviera, W., Anchão-Oliveira, P. P., Corsi, M., Sanches-Duarte, F. R., & Mui-Tsai, S. (2004). Alfalfa yield and quality as function of nitrogen fertilization and symbiosis with Sinorhizobium meliloti. Scientia Agricola, 61(4), 433-438. doi: 10.1590/S0103-90162004000400013 [ Links ]
SAS Institute Inc. (SAS). (2011). SAS/ QC 9.3 User´s Guide, version 9.3. Cary, N.Y., USA: Author. Retrieved from https://support.sas.com/documentation/cdl/en/qcug/63964/PDF/default/qcug.pdf [ Links ]
Shukla, A. K., Ladha, J. K., Singh, V. K., Dwivedi, B. S., Balasubramanian, V., Gupta, R. K., … & Yadav, R. L. (2004). Calibrating the leaf color chart for nitrogen management in different genotypes of rice and wheat in a systems perspective. Agronomy Journal, 96(6), 1606-1621. doi: 10.2134/agronj2004.1606 [ Links ]
Sosa-Rubio, E. E., Cabrera-Torres, E., Rodriguez, D. P., & Ortega-Reyes, L. (2008). Dry matter seasonal production in grasses and legumes in Quintana Roo, Mexico. Tecnica Pecuaria en Mexico, 46(4), 413-426. [ Links ]
Vespa, J., Medina, L., & Armstrong, D. M. (2020). Demographic turning points for the United States: population projections for 2020 to 2060. Washington, DC: United States Census. Retrieved from https://www.census.gov/library/publications/2020/demo/p25-1144.html [ Links ]
Recibido: 21 de Noviembre de 2019; Aprobado: 13 de Abril de 2020











 texto em
texto em 


