INTRODUCCIÓN
Uno de los principales problemas de contaminación ambiental son los generados por la disposición final de los polímeros sintéticos derivados del petróleo, conocidos comúnmente como plásticos. Ante esta problemática, han sugerido varias biomoléculas biodegradables, como el almidón, celulosa y proteínas, siendo una alternativa de uso de los materiales plásticos convencionales como el polietileno y el poliestireno (Alves, Mali, Beléia & Groomann, 2007).
Entre las biomoléculas más utilizadas está el almidón, debido a su bajo costo, alta taza de biodegradación y abundancia en la naturaleza. Varios estudios han reportado sobre el uso del almidón como fuente principal en la elaboración de películas comestibles y coberturas en alimentos con diferentes propiedades (Alves et al., 2007; Avérous, Fringant & Moro, 2001; Mali, Grossman, García, Martino & Zaritzky, 2004; Müller, Yamashita & Laurindo, 2008). Los materiales poliméricos elaborados a base de biopolímeros como almidón presentan baja resistencia mecánica, pobres propiedades de barrera al oxígeno, permeabilidad al vapor de agua, entre otras (Xie, Pollet, Halley & Avérous, 2013).
Para superar los inconvenientes del almidón nativo, se están utilizado nuevas fuentes de almidón (Mali & Grossman, 2003; Palma-Rodríguez et al., 2012), modificaciones químicas y térmicas (Aila et al., 2013; Palma-Rodríguez et al., 2012), mezclas con polímeros sintéticos biodegradables (Tang & Alavi, 2011; Sin, Rahman, Rahmat & Kham, 2010a), así como con proteínas, lípidos y fibras (Pelissari, Andrade, Sobral & Menegalli, 2013), con el fin de reforzar la matriz estructural de las biopelículas.
En este sentido, el uso de almidones de fuentes no convencionales, como el almidón aislado de plátano macho (Musa paradisiaca L.), ha cobrado gran interés en países como México, donde se busca darle un mejor aprovechamiento a este tipo de material en la producción de películas biodegradables, ya sea como materia prima única o en mezcla con polímeros sintéticos o naturales (Aila et al., 2013). El interés en la mezcla de polisacáridos, proteínas, lípidos y fibras en la elaboración de películas biodegradables proporcionan mejores propiedades térmicas, mecánicas y estructurales (Baldwin, Nisperos & Baker, 1995). La adición de polímeros proteicos a la matriz de la solución filmogénica de almidón podría modificar las propiedades de permeabilidad, mecánicas, térmicas, entre otras. Estos polímeros pueden ser de tipo sérico o globular, y se obtienen a partir de la leche de los bovinos por medio de precipitación ácida o enzimática. Las dos variantes de la β-Lactoglobulina (β-LG), en su estructura molecular, contienen dos puentes disulfuro y un grupo tiol (SH) libre (Hambling, McAlpine & Sawyer, 1992), mientras que la α-Lactoalbúmina (α-LA) en su estructura cuenta con cuatro enlaces disulfuro (Nicolai, Britten & Schmit, 2011). Las características propias de estas proteínas podrían ser una buena alternativa para ser utilizadas en mezclas con polímeros naturales y tener un efecto de reforzamiento estructural.
Así, al estudiar las propiedades de las películas elaboradas a partir de mezclas de polímeros naturales (almidón, proteínas, ceras, etc.), y al comparar sus características físico-mecánicas, térmicas y estructurales, se puede obtener información importante acerca del tipo de interacción química en la matriz poliméricas de estas. Por tal motivo, el objetivo del presente estudio fue investigar el efecto de la adición de proteínas globulares como α-Lactoalbúmina y β-Lactoglobulina en la elaboración de películas biodegradables a base de almidón de plátano.
MATERIALES Y MÉTODOS
Reactivos
Todos los reactivos fueron de grado analítico, los estándares de proteína: α-LA (85% de pureza), β-LG A y β-LG B (100% de pureza), así como el detergente Tween 20, fueron de Sigma Chemical Co. (St.Loui, MO). El amortiguador de boratos (0.3 M, pH 8.5) con polímero modificado fue de Bio-Rad laboratorios (Hercules, CA). El cloruro de sodio y glicerol se adquirieron de la compañía Sigma Aldrich (México).
Identificación y preparación de las muestras de leche
Las muestras de leche obtenidas de vacas proveniente del hato lechero de la Universidad Autónoma del Estado de Hidalgo se identificaron para las proteínas de la β-LG y α-LA por medio de electroforesis capilar en zona (ECZ), utilizando la técnica de Olguín & Vallejo (1999). Estudios previos de caracterización de estas proteínas utilizadas en este estudio fueron reportadas por Meza-Nieto et al. (2010).
Separación y purificación de β-LG y α-LA
A partir del suero obtenido se realizó la separación y purificación de las proteínas β-LG A, β-LG B y α-LA utilizando la técnica de salado a pH ácido (2.0), propuesta por Mailliart & Ribadeau-Dumas (1988). Purificadas las proteínas fueron liofilizadas y almacenadas a -20 °C hasta su utilización.
Elaboración de biopelículas almidón-proteína
El almidón de plátano fue obtenido utilizando la técnica de Flores-Gorosquera et al. (2004). La elaboración de películas a partir de almidón de plátano adicionadas con proteínas séricas α-LA, β-LG A y β-LG B, consistió en formar una mezcla con 4 g de almidón de plátano y 0.5 g de proteína sérica, 1.6 mL de glicerol y 100 mL de agua destilada en cada concentración. La solución se homogenizó en un dispersor marca polytron System (modelo PT 2100) a 11 000 rpm por 10 min, con una temperatura inicial de 40 °C hasta alcanzar 85 °C de temperatura final. Posteriormente, fueron vertidos 30 mL de la mezcla de proteína-almidón en cajas Petri; estas fueron colocadas en el interior de la estufa de aire forzado a una temperatura de 40 °C por 24 h. Pasado este tiempo, las películas fueron retiradas de las cajas Petri con mucho cuidado, y almacenadas a temperatura ambiente en bolsas de plástico selladas (ziploc) por 3 días hasta su utilización.
Porcentaje de solubilidad de las películas
Se cortaron piezas de cada película con dimensiones de 2 cm por 3 cm, las cuales se almacenaron en un desecador a una humedad relativa cercana al 0% (provisto por silica de gel) durante siete días. Los pesos de las películas cortadas fueron registrados y, posteriormente, colocados en un vaso de precipitado con 80 mL de agua destilada con agitación continua 125 rpm, a una temperatura de 60 °C. Terminada la agitación, las piezas de las películas fueron filtradas y se secaron en una estufa de aire forzado a 60 °C por 2 h. Después estas fueron pesadas, para finalmente determinar el porcentaje de materia soluble (% solubilidad), el cual se calculó de la siguiente manera.
Permeabilidad al vapor de agua
Se determinó utilizando el método gravimétrico estándar de la ASTM, E 96 (American Society for Testing and Materials [ASTM], 2000). Se cortaron las películas de forma circular de un diámetro de 7 cm, equilibrándolas a una humedad relativa del 57% durante 48 h. Se midió el espesor con un micrómetro digital 0 - 1 (marca 14 404) en 10 puntos distintos de cada círculo de la película cortada, y posteriormente se colocó la película en la parte superior de cada celda. En el interior de cada celda se colocaron 40 mL de sílica gel para generar una humedad relativa del 0%; cada celda se colocó en un desecador provisto de solución saturada de cloruro de estroncio al 70% de humedad relativa (HR). Se registraron los cambios en el peso de las celdas cada hora durante 8 h continuas.
Propiedades mecánicas
En las propiedades mecánicas se determinó el esfuerzo máximo a la ruptura (MPa), el módulo de Young (MPa) y el porcentaje de elongación (%) de las películas. Estas se realizaron de acuerdo con el estándar ASTM, D-882 (ASTM, 1995), se utilizó un texturómetro TA-HDi (stable micro System, texture analyser), utilizando una celda de carga de 50 kg. Se cortaron rectángulos de cada película con dimensiones de 7 cm de largo por 1 cm de ancho, los cuales fueron almacenados durante 48 h en un desecador a una humedad relativa del 57% provista de solución saturada de bromuro de sodio (NaBr). Se colocaron entre las mordazas de sujeción y la separación entre las pinzas fue de 5 cm. Se colocó 1 cm del rectángulo de la película en cada una de las pinzas de sujeción, utilizando una velocidad de tensión de 24 mm min-1.
Calorimetría Diferencial de Barrido (CDB)
Las propiedades térmicas de las películas se analizaron en un calorímetro diferencial de (TA Instruments, New Castle, DE, Model 2010), equipado con un sistema de refrigeración. Se pesaron 20 mg de muestra en charolas de aluminio, las cuales se sellaron herméticamente. El análisis se llevó a cabo a una velocidad de calentamiento de 10 °C/min con un intervalo de temperatura de 10 °C a 180 °C. Se utilizó una charola de aluminio sellada herméticamente sin muestra como referencia. La temperatura de fusión (Tp) fue considerada en el punto de inflexión en la línea base, provocada por la discontinuidad del calor específico de la muestra. Todas las mediciones se realizaron por triplicado y los resultados se presentan como la media de los valores.
Espectrofotometría de Transformadas de Fourier (ETF)
Las muestras de las películas fueron cortadas en piezas pequeñas (10 mm por 10 mm) y deshidratadas en un desecador que contenía silica gel (~0 % Humedad Relativa) por 3 semanas. Después de este periodo, las muestras fueron analizadas en un espectrofotómetro (Perkin Elmer, model Spectrum two, Ohio, USA) con dispositivo universal de reflectancia atenuada. El análisis se llevó a cabo en la región infrarroja, con 16 barridos, cubriendo longitudes de onda que van desde 400 cm-1 a 4000 cm-1.
Análisis estadístico
Se usó un diseño completamente al azar y se realizó un análisis de varianza (ANDEVA), para probar el efecto de la solubilidad, permeabilidad al vapor de agua y las propiedades mecánicas de las películas elaboradas a partir de almidón de plátano y proteína sérica de la leche. Las propiedades de permeabilidad y solubilidad de las películas se realizaron por triplicado, mientras que las propiedades mecánicas se probaron en 15 repeticiones. Las medias de tratamiento fueron comparadas mediante la prueba de Tukey.
RESULTADOS Y DISCUSIÓN
Solubilidad
En la tabla 1 se muestra el porcentaje de solubilidad de las películas elaboradas con almidón de plátano (control) en mezcla con proteínas séricas.
Tabla 1 Solubilidad y permeabilidad al vapor de agua de películas elaboradas con almidón de plátano en mezcla con proteínas séricas++.
| Muestra | Solubilidad* | Permeabilidad al vapor de agua (g m-1 s-1 Pa-1) |
|---|---|---|
| Control | 7.28 ± 0.19c | 1.32 ± 1.19a |
| AP/α-LA | 32.42 ± 1.29a | 1.20 ± 2.07a |
| AP/β-LG A | 20.27 ± 1.99b | 1.16 ± 1.04a |
| AP/β-LG B | 19.18 ± 2.74b | 1.26 ± 2.04a |
*Estudio realizado a 60 °C; AP = Almidón de Plátano; α-LA= α-Lactoalbúmina; β-LG A = β-Lactoglobulina A; β-LG B = β-Lactoglobulina B. ++Promedios de tres repeticiones + Error Estándar. Medias en las columnas que no comparten la misma letra minúscula son significativamente diferentes (p ≤ 0.05).
Fuente: Elaboración propia.
La película control (AP) mostró una diferencia significativa (p ≤ 0.05) cuando esta fue comparada con las películas que contenían proteínas séricas.Las películas con AP/α-LA presentaron la mayor solubilidad (32.42%), y el control (AP) la menor (7.2%), lo que concuerda con los resultados de FTIR, en donde se observa un incremento en la banda de 3000 cm-1 a 3500 cm-1, que representa el incremento de los grupos -OH en películas que contienen proteínas séricas. Estudios similares reportaron que una previa modificación del almidón o la adición de otro polímero modifica la amplitud de la banda donde vibran los grupos -OH (Chen & Lai, 2008; Zamudio, Torres, Salgado & Bello, 2010). Las películas que contenían proteínas de AP/β-LG-B o β-LG-A mostraron una solubilidad promedio de 20%. Los datos mostraron un incremento en la solubilidad de las películas al adicionar proteínas séricas, debido a la posible interacción entre los grupos -OH presentes en las proteínas, más los grupos -OH del almidón, podría estar incrementando la afinidad por el agua, favoreciendo la solubilidad de estas. Rungsinee & Krochta (2001) reportaron el efecto de diferentes plastificantes en mezcla con β-LG para la elaboración de películas, encontrando una buena compatibilidad entre esta proteína y los plastificantes, atribuyendo este comportamiento al carácter hidrófilico de la proteína sérica y de los plastificantes usados. Los resultados obtenidos por Rungsinee & Krochta (2001) concuerdan con los reportados en este estudio, ya que las películas en mezcla con las proteínas séricas presentaron los mayores valores de solubilidad. Sin embargo, la diferencia de la solubilidad entre las proteínas séricas α-LA y β-LG en la película puede ser debido al tamaño, forma, diferencia en los aminoácidos, peso molecular y estructura química que presenta cada proteína (Rungsinee & Krochta 2001; Nicolai et al., 2011).
Permeabilidad al vapor de agua (PVA)
En la tabla 1 se muestran los valores de PVA, donde se observa que la adición de las proteínas séricas no afectó este parámetro, ya que no es observa una diferencia estadística significativa (p ≤ 0.05) entre las películas elaboras con proteínas séricas y el control. Leuangsukrerk, Phupoksakul, Tananuwong, Borompichaichartkul & Janjarasskul (2014) reportaron el mismo comportamiento que el encontrado en este estudio, atribuyendo este fenómeno químico a la adición de proteínas aisladas del suero de leche, ya que contiene enlaces di-sulfuro, mejorando la adhesión inter e intramolecular entre los polímeros que conforman la película, lo que podría estar provocando un camino más tortuoso a la molécula de agua a través de la matriz polimérica proteína-almidón. En este mismo sentido, estudios realizados en películas de cera de candelilla en mezcla con proteínas de suero de leche elaboradas por un método extrusión y otras películas, reportan una ligera reducción numérica en los valores de PVA para ambos procesos al ser comparadas con su respectivo control, atribuyendo este comportamiento a una mejor distribución de la proteína en la matriz de la película, lo que posiblemente dificulte el paso de las moléculas de agua a través de esta (Janjarasskull, Raunch, McCarthy & Krochta 2014). Dicho fenómeno podría estar pasando en las películas aquí analizadas.
Propiedades mecánicas
Las propiedades mecánicas son mostradas en la tabla 2.
Tabla 2 Propiedades mecánicas de películas elaboradas con almidón nativo o almidón mezclado con proteínas séricas+.
| Muestra | Esfuerzo a la ruptura (MPa) | Módulo de Young (MPa) | Elongación (%) | Dureza (N) |
|---|---|---|---|---|
| Control | 2.78 ± 0.31c | 47.52 ± 0.94d | 36.92 ± 1.17c | ND |
| AP/α-LA | 15.50 ± 2.52a | 203.07 ± 48.67a | 16.81 ± 3.95b | 2.49 ± 0.77a |
| AP/β-LG A | 3.13 ± 0.74c | 60.28 ± 4.49c | 29.17 ± 5.64a | 0.67 ± 0.25c |
| AP/β-LG B | 6.90 ± 0.83b | 127.20 ± 20.20b | 19.63 ± 3.33b | 1.37 ± 0.37b |
ND = no determinado; Mpa = Megapascales; N = Newton; AP = Almidón de Plátano; α-LA = α-Lactoalbúmina; β-LG A = β-Lactoglobulina A; β-LG B = β-Lactoglobulina B. +Promedios de diez repeticiones ± Error Estándar. Medias en las columnas que no comparten la misma letra minúscula son significativamente diferentes (p ≤ 0.05).
Fuente: Elaboración propia.
La adición de proteínas a la matriz de almidón mejoró las propiedades mecánicas, ya que fue observado un incremento en los valores del módulo de Young y esfuerzo a la ruptura en todas las películas, parámetros mecánicos importantes en la caracterización de estas. Sothornvit & Krochta (2001) registraron las propiedades mecánicas de películas elaboradas con β-lactoglobulina en mezcla con diferentes plastificantes, encontrando que el peso molécular del plastificantes afecta las propiedades mecánicas. Ellos reportaron valores para el Esfuerzo a la tensión y módulo de Young de 150 Mpa y 4.98 Mpa, respectivamente, cuando utilizaron glicerol como plastificante. En este estudio se realizó una separación de la proteína β-LG, separándose en proteína β-LG A y β-LG B, encontrando que la película que contenía la β-LG B mostró un incremento en las propiedades mecánicas (tabla 2), al ser comparadas con la β-LG A, indicando que esta proteína (β-LG B) tiene un mayor efecto en las propiedades mecánicas de manera individual que juntas como β-LG. Este puede ser debido a cambio intermolecular de los aminoácidos en la cadena poli-peptídica de la proteína y a la velocidad de agregación de estas presentan (Nicolai et al., 2011). Por otro lado, la película que contiene la proteína α-LA registró un incremento en los valores de esfuerzo a la tensión, módulo de Young y dureza, mayores a los observados en las películas elaboradas con AP/β-LG A y AP/β-LG B, mostrando una diferencia estadística significativa (p ≤ 0.05). Comportamiento inverso fue mostrado en el parámetro elongación al rompimiento, observando el menor valor para este parámetro. El incremento en las propiedades mecánicas en esta película que contiene β-LA puede ser debido al peso molecular de la proteína. Nicolai et al. (2011) reportaron una masa molar de 18.2 kg mol-1 y 14.2 kg mol-1 para β-LG y β-LA, respectivamente. Sothornvit & Krochta (2001) reportaron la dependencia de este tipo de proteína con los plastificantes de diferentes pesos moleculares, apreciando que bajos pesos moleculares producen una mayor plastificación en las películas que los altos pesos moleculares, lo que concuerda con los resultados aquí obtenidos. Otro factor que puede estar influyendo este comportamiento puede ser la diferencia en el número de los enlaces sulfuros, 4 para α-LA y 2 para β-LG (Nicolai et al., 2011). Se ha reportado que este tipo de enlaces mejoran la estabilidad de estas proteínas (Mession, Nicolas, Ali & Remi, 2013), lo que podría estar causando un efecto de reforzamiento en la matriz de la película.
Calorimetría diferencial de barrido
En la tabla 3 se muestran los datos obtenidos de los estudios de calorimetría diferencial de barrido de la película control, y en la mezcla AP/proteína (α-LA, β-LG A, y β-LG B).
Tabla 3 Temperatura de fusión y entalpias de películas elaboradas con almidón nativo o almidón mezclado con proteínas séricas+.
| Muestra | Tp (ºC) | DH (J/g) | Tc - To (ºC) |
|---|---|---|---|
| Control | 129.84 + 1.07b | 31.50 + 1.33c | 43.59 + 3.44b |
| AP/α-LA | 156.95 + 2.33a | 86.33 + 1.47b | 55.34 + 4.97a |
| AP/β-LG A | 127.88 + 1.76b | 96.67 + 0.93a | 52.9 + 3.28a |
| AP/β-LG B | 122.35 + 1.98b | 99.50 + 2.17a | 54.23 + 2.11a |
AP = Almidón de Plátano; α-LA = α-Lactoalbúmina; β-LG A = β-Lactoglobulina A; β-LG B = β-Lactoglobulina B. To = Temperatura inicial; Tp = Temperatura pico; Tc =Temperatura final; Tc - To = Rango de temperatura; ΔH = Entalpia. +Promedios de tres repeticiones ± Error Estándar. Medias en las columnas que no comparten la misma letra minúscula son significativamente diferentes (p ≤ 0.05).
Fuente: Elaboración propia.
Las películas que contenían la proteína α-LA mostraron mayores valores de temperatura de fusión (156 °C), que las películas mezcladas con las proteínas β-LG A y β-LG B (tabla 3). Este comportamiento puede ser debido a que esta proteína (α-LA) en su estructura molecular contiene cuatro enlaces disulfuro, lo que posiblemente podría dar una mayor estabilidad térmica. Mession et al. (2013) reportaron que la presencia de los enlaces disulfuro dentro de la proteína pudiera contribuir a su estabilidad térmica. Por otra parte, existen reportes de que la temperatura induce la disociación de las proteínas globulares, promoviendo la exposición de los enlaces disulfuro, cambiando la estructura de la proteína por uniones de enlaces covalentes (Mession et al., 2013). Este fenómeno podría estar pasando en la matriz interna de las mezclas (películas), lo que puede estar contribuyendo con la estabilidad térmica (Zhang & Zhong, 2012). La película elaborada con AP/α-LA mostraron valores mayores de Tp, observando una diferencia estadística (p ≤ 0.05), al ser comparada con la película control, AP/β-LG A y AP/β-LG B.
Por otro lado, los valores menores mostrados por las películas mezcladas con proteínas β-LG comparadas contra α-LA puede ser debido a que estas presentan un mayor peso molecular (Nicolai et al., 2011), lo que pudiese estar alcanzando el umbral de las propiedades térmicas de las proteínas. Comportamiento similar fue reportado por Sin, Rahman, Rahmat & Khan (2010), encontrando que a medida que incrementaban la concentración de poli-vinil-alcohol (PVOH) en la mezcla con almidón, una reducción de los valores en la temperatura de fusión fue observada, atribuyendo este comportamiento al máximo umbral alcanzado por la adición de PVOH. Comportamientos similares fueron presentados por Sin, Rahman, Rahmat & Samad (2010b). Ellos reportaron mayores valores de temperaturas de fusión en la mezcla α-LA/quitosano que las encontradas en las mezclas de β-LG/quitosano.
La entalpia de fusión (ΔHm) también proporciona información complementaria acerca de las uniones entre las mezclas de almidón-proteína. Existen reportes que mencionan que los valores de ΔHm aumentan debido a una nueva unión física entre los componentes de las películas (Sin et al., 2010a). Los valores más altos de ΔHm fueron encontrados en las películas que contenían las proteínas (α-LA, β-LG A y β-LG B). Este comportamiento puede ser debido a los nuevos enlaces físicos (covalentes, puentes de hidrogeno y enlaces momentáneos en la mezcla) (Nicolai et al., 2011). La diferencia entre las temperaturas (Tc-To) arrojaron valores de 43.59 ºC, 55.34 ºC, 52.9 ºC, 54.23 ºC, para la película control, mezclas PA/α-LA, PA/β-LG A y PA/β-LG B, respectivamente, observando que las películas adicionadas con proteínas presentaron la mayor diferencia en la temperatura. Esto puede ser debido a interacciones por puentes de hidrogeno y/o disulfuro entre las cadenas de almidón y/o proteínas después del enfriamiento de la película (Singh, Singh, Kaur, Sodhi & Gill, 2003; Sin et al., 2010b). Otros autores reportan que este comportamiento es debido a la velocidad de retrogradación del almidón (Atichokudomchaia, Varavinita & Chinachotib, 2002; Hoover, 2000).
Espectrofotometría de Transformadas de Fourier (ETF)
Los espectros de ETF para la muestra control y las mezclas AP/proteínas se muestran en la figura 1.
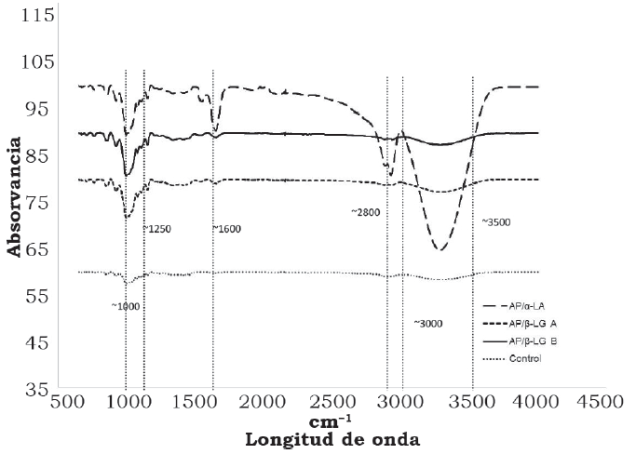
Fuente: Elaboración propia.
Figura 1 Espectros infrarrojos de películas elaboradas con almidón de plátano y/o almidón mezclado con proteínas séricas. AP = Almidón de Plátano; α-LA = α-Lactoalbúmina; β-LG A = β-Lactoglobulina A; β-LG B = β-Lactoglobulina B.
Las películas elaboradas con la mezcla AP/α-LA evidencia un pico en el ancho de banda entre 3000 cm-1 a 3800 cm-1, el cual es mucho mayor que las bandas observadas en las películas control (AP), AP/β-LG A y AP/β-LG B. Pelissari et al. (2013) reportaron que los grupos hidroxilos (-OH) absorben energía entre los 3650 cm-1 y 3584 cm-1. El mayor pico localizado en la longitud de banda de 3500 cm-1 fue en la película AP/α-LA, debido a la vibración de los grupos -OH, provocando por la formación de nuevos enlaces químicos (puentes de hidrogeno) en la matriz de la película. Esta información apoya los resultados reportados en la sección de solubilidad de las películas, los cuales muestran los mayores valores (tabla 1), de solubilidad, debido al incremento de grupos -OH. Los grupos CH2 vibraron en la longitud de onda de ~2800 cm-1. Kizil, Irudayaraj & Seetharaman (2002) registraron diferentes intensidades de bandas entre 2800 cm-1 y 300 cm-1, las cuales son atribuidas a la variación en la cantidad de amilosa y amilopectina. La longitud de banda de 1600 cm-1 aparece solo en las películas AP/ proteínas; esta banda es relacionada con los grupos amino de las proteínas, particularmente las vibraciones de los grupos C = O. La película elaborada con AP/α-LA evidenció un pico mayor en la amplitud de banda 1600 cm-1; este fenómeno puede ser debido a que esta proteína en particular contiene más grupos aminos en su estructura molecular, como es reportado por Nicolai et al. (2011). La longitud de banda observada a 1250 cm-1 corresponde al grupo amida III (Singh, 2000); esta banda es indicativo de la presencia de proteínas remanentes en el almidón o de proteínas séricas. Fue también observado que esta longitud de banda fue mayor en las mezclas AP/proteínas séricas. La longitud de banda localizada a 1000 cm-1 está relacionada con la cantidad de estructuras amorfas en las películas y, de esta manera, el contenido de agua interactúa intermolecularmente por la presencia de puentes de hidrógeno (Van Soest, Tournois, De Wit & Vliegenthart, 1995). Esta banda podría explicar la alta solubilidad de estas películas (AP/proteínas séricas).
CONCLUSIONES
La adición de proteínas séricas en mezclas con almidón de plátano en la elaboración películas comestibles provocó cambios físico-químicos y térmicos. Las películas que contenían las proteínas presentaron un incremento en los valores de solubilidad. Las propiedades mecánicas y la estabilidad térmica fueron mejoradas por la adición de proteínas séricas. Los estudios de ETF mostraron la generación de nuevos enlaces en las mezclas AP/proteínas séricas. La película AP/α-LA mostró mayores valores en las propiedades térmicas, mecánicas y de solubilidad, debido quizá a las características moleculares de esta proteína. La adición de proteínas séricas en elaboración de películas a base de almidón puede ser una alternativa viable para generación de empaques biodegradables en la industria agroalimentaria.











 nova página do texto(beta)
nova página do texto(beta)



