INTRODUCCIÓN
La complejidad de las funciones de la microbiota gastrointestinal permiten considerarla como un órgano que se adquiere inmediatamente al nacimiento; más aún, existe un mayor número de microorganismos que componen la microbiota intestinal que células somáticas y germinales en el cuerpo, diez veces mayor que el total de las células del ser humano1,2 y con un peso entre 1.5 a 2 kg de bacterias. Dentro del útero, el feto tiene un aparato digestivo virtualmente estéril; su colonización inicia con la microbiota desde los primeros momentos del nacimiento.3
La población de bacterias del intestino del recién nacido se origina en la microbiota vaginal y perianal de la madre, así como de la leche humana, donde se ha demostrado su presencia.4,5 La vía de nacimiento y sus variaciones generan diferencias en el tipo de microbiota y en la prevalencia de enfermedades de tipo alérgico que se pueden presentar y prolongar en la vida adulta5 y no sólo las de tipo alérgico, sino que también hay una relación con la variación en la composición de la microbiota intestinal y un aumento en la incidencia de trastornos de la función gastrointestinal, tales como la enfermedad inflamatoria intestinal, síndrome de intestino irritable, cáncer de colon e incluso obesidad.6 Los nuevos métodos que incluyen la metagenómica, entre otros, han permitido conocer el genoma de la microbiota.
Objetivo
Dar a conocer el tipo, la importancia y las funciones de la microbiota gastrointestinal en pediatría; su relación con las funciones de inmunidad y de algunas enfermedades.
Concepto
Se conoce como microbiota al conjunto de bacterias que conviven en el huésped en estado normal sin causar enfermedad; por lo tanto, a las especies que conforman esta microbiota se le conoce como microorganismos comensales.7
Se ha relacionado a la microbiota intestinal con efectos benéficos en el huésped, tales como la promoción de la maduración y la integridad del epitelio intestinal, protección contra patógenos y la modulación inmunológica. Además, parece jugar un papel importante en el mantenimiento del equilibrio inmunológico intestinal y la prevención de la inflamación.7
Las bacterias anaerobias (60-90%) existen en mayor proporción que las aerobias y la mayoría son representantes de dos de las principales familias: los bacteroides en un 23% y las firmicutes 64%.8 Algunas especies de hongos también se han identificado como componentes de la microbiota intestinal.
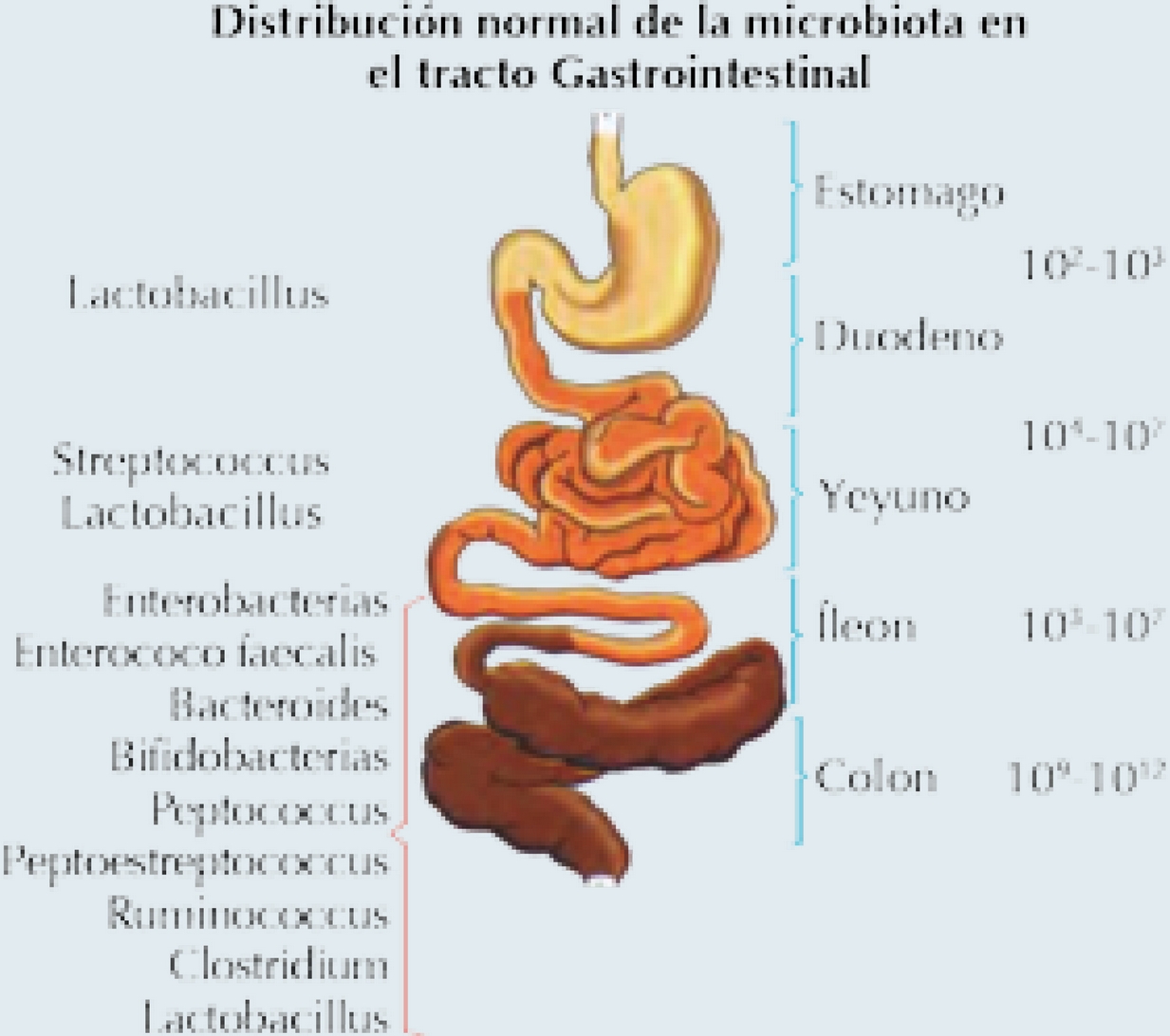
La presencia y distribución de las bacterias a lo largo del tubo digestivo va a estar dada por ciertas acciones como las secreciones biliar, pancreática y el ácido clorhídrico, que impiden la colonización del estómago y el intestino delgado proximal, donde la concentración bacteriana varía entre 102 y 105 ufc/mL. La densidad se va incrementando en la parte distal del intestino delgado con 104 a 107 ufc/mL en yeyuno y en el intestino grueso se eleva a una cifra estimada entre 1011 y 1012 ufc/mL bacterias por gramo de colon. En el estómago las bacterias no sobreviven por el pH bajo del medio (Figura 1).
FUNCIONES
Metabólicas
Además de sintetizar algunas vitaminas como las K y B,9 las bacterias del colon hacen uso de reductasas para convertir bilirrubina en urobilinógeno, también tienen la capacidad de transformar ácidos biliares primarios a secundarios mediante deshidroxilasas bacterianas. Además, ayuda a culminar procesos metabólicos biliares y de carbohidratos, pues pueden separar cualquier ácido biliar conjugado que se escape de la reabsorción activa en el íleon terminal para luego ser nuevamente captado de manera pasiva a través de la mucosa intestinal. Las enzimas bacterianas, como las peptidasas, descarboxilasas y desaminasas conservan nutrimentos que no fueron degradados por las enzimas intestinales, así como la fermentación por las bacterias va a degradar cualquier carbohidrato que se escape de la digestión y absorción en el intestino delgado, como la lactosa en individuos que no la toleran.
Otra de las funciones es el ahorro de energía, que está dado por los ácidos grasos de cadena corta: acetato, propionato y butirato, producto de la fermentación y que pueden ser usados como combustible. Las enzimas bacterianas también pueden eliminar algunos carcinógenos; sin embargo, también pueden ser generadoras de los mismos a partir de compuestos que se encuentran en la luz intestinal; es por esto, que el cáncer de colon es relativamente frecuente.10
Función protectora e inmunológica
Las bacterias generan mecanismos protectores mediante la formación de una barrera secretora para evitar que las bacterias patógenas entren en contacto con la superficie de los enterocitos, y una barrera física por medio de una capa de moco epitelial.11 También aumentan la resistencia de la mucosa intestinal a la colonización con microorganismos patógenos.
En los animales libres de gérmenes se ha visto que con que sólo unas cuantas ingresen por vía oral generan infecciones fatales.12 Otros mecanismos que protegen al huésped de infecciones oportunistas, y que han sido motivo de estudio, son la competencia por sitios de adhesión, competencia por nutrientes y la producción de condiciones ambientales adversas para el crecimiento de patógenos involucrando cambios en el pH, producción de compuestos antimicrobianos como metabolitos tóxicos hasta sustancias bactericidas y la generación de señales que intervienen en la expresión génica.12
En los estudios experimentales con animales con intestino estéril se ha demostrado que el sistema inmunitario mucoso está poco desarrollado, lo que muestra la importancia de la microbiota para estimular el desarrollo y la maduración de las poblaciones linfoides del intestino.13
Se ha demostrado que la microbiota intestinal es clave para la función adecuada de los linfocitos T reguladores inmunosupresores. Múltiples estudios transversales demuestran que en los niños con eccema atópico, comparados con niños sanos, existe una composición diferente de microbiota intestinal.13 En la mayoría de los estudios de seguimiento prospectivos publicados en la actualidad también se ha encontrado que las alteraciones en la microbiota intestinal preceden a la aparición de alergia.13
DIFERENCIAS DE ACUERDO A LA VÍA DE NACIMIENTO Y OTROS FACTORES QUE ALTERAN LA MICROBIOTA
La flora intestinal se comienza a establecer desde el nacimiento. En su desarrollo influyen varios factores,3 entre ellos: el tipo de parto, el tipo de alimentación del recién nacido, la edad del destete y el inicio de la alimentación no láctea (Figura 2).
Se ha demostrado que el recién nacido por parto vaginal tiene una microbiota mucho más abundante en bifidobacterias, firmicutes y lactobacilos debido al paso a través del canal vaginal y el contacto con la región perianal de la madre, lo que permite una colonización más temprana de este tipo de bacterias en comparación con los niños que nacen por cesárea.
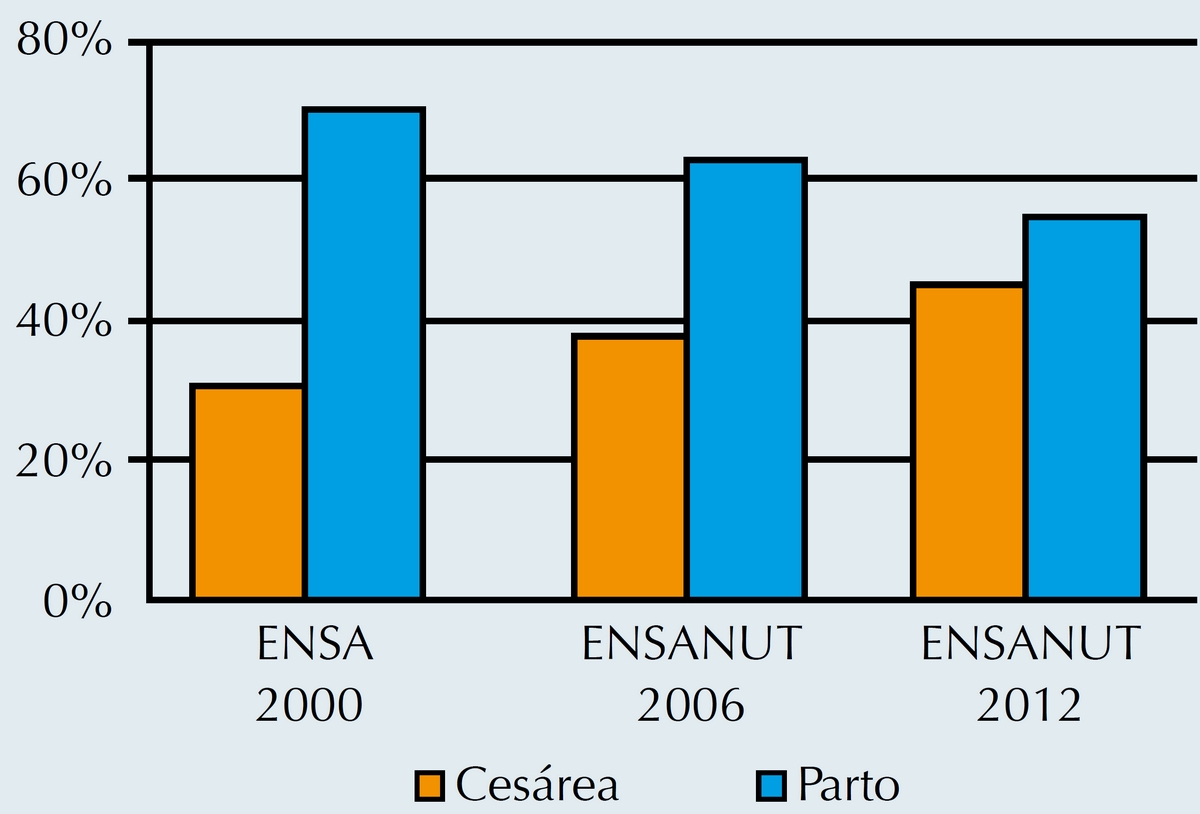
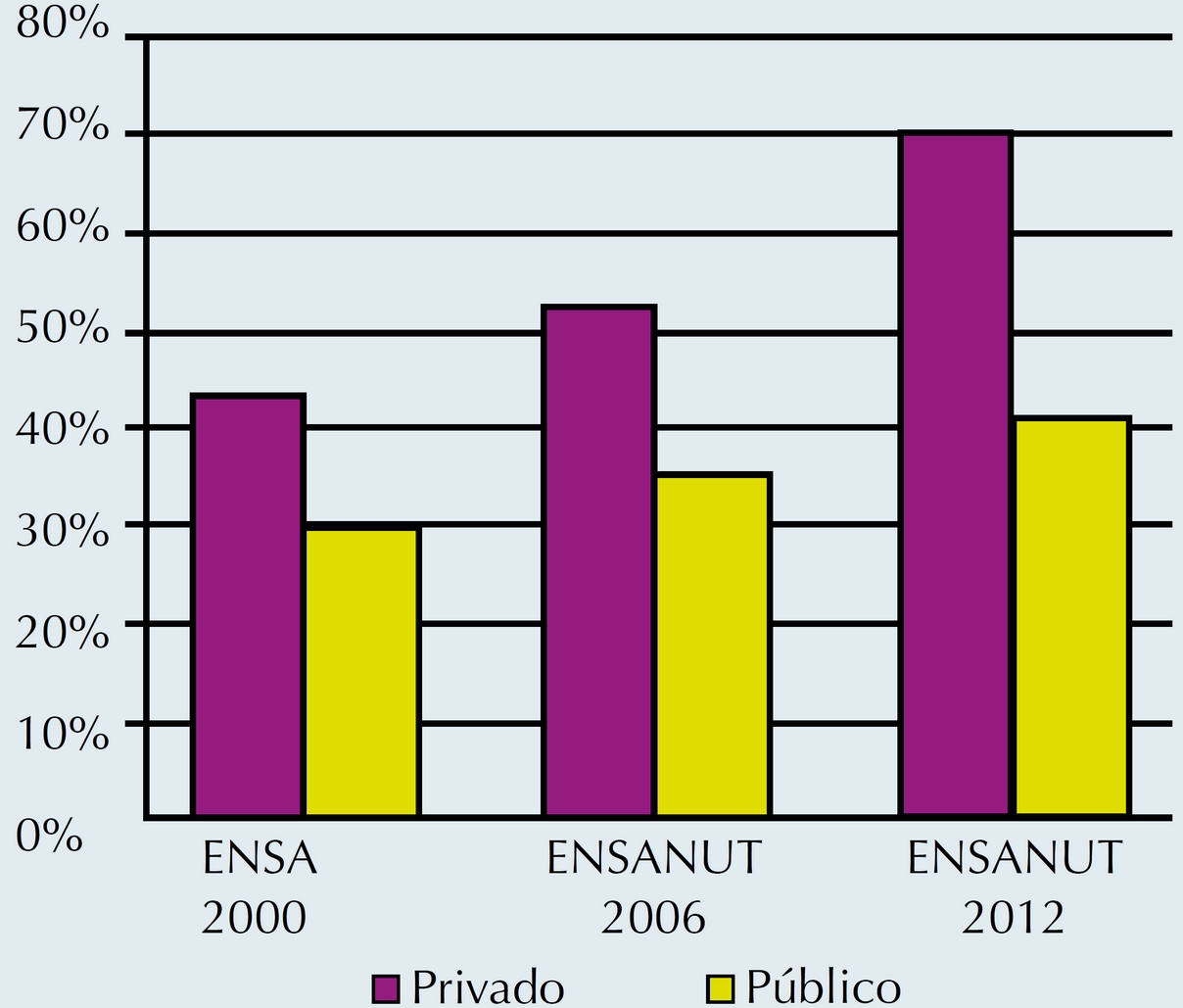
Se ha observado un incremento en los nacimientos por vía cesárea tanto en los países de primer mundo, como Estados Unidos en donde los nacimientos por cesárea se estiman en 24.4%,14 como en nuestro país en donde en los últimos 20 años casi se han triplicado los nacimientos por cesárea, pasando de 12.5% a 46.2%, según se reporta en la última encuesta realizada en los últimos 5 años por ENSANUT (Figuras 3 y 4).
*De los últimos hijos nacidos vivos en los cinco años anteriores a la entrevista
P< 0.001
Figura 3 Distribución de nacimientos por parto en los años 2000, 2006 y 2012. Según la ENSANUT.
*De los últimos hijos nacidos vivos en los cinco años anteriores a la entrevista
P<0.001
Figura 4 Distribución de nacimientos por cesárea en atención privada y pública en los años 2000, 2006 y 2012.
Respecto a especies de bacterias, la microbiota intestinal de los recién nacidos por cesárea parece ser menos diversa y más escasa que la de los niños nacidos por vía vaginal,15 especialmente en especies de Bifidobacterias. Esto influye, de acuerdo con diferentes estudios, en el desarrollo del sistema inmune,16,17 ya que esta microbiota intestinal podría modular la respuesta y el desarrollo de los mecanismos de alergia y tolerancia alimentaria a largo plazo. Además, se ha demostrado que el tiempo para establecerse la microbiota normal puede representar una ventana de riesgo y factor predisponente para la colonización de Clostridium y otros microorganismos, a los que se les ha relacionado como un factor contribuyente al desarrollo de enterocolitis necrotizante.15,18,19
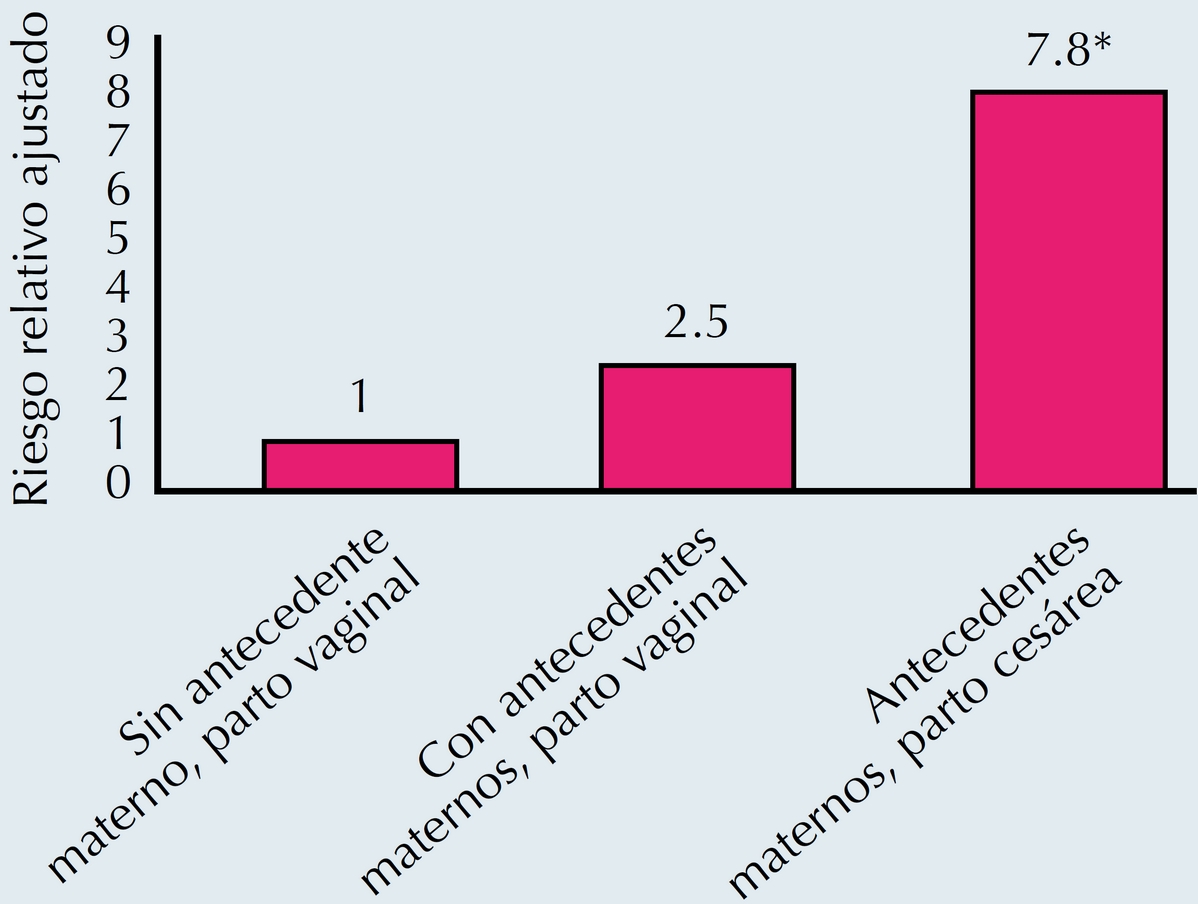
En cuanto a la prevalencia de enfermedades alérgicas y el incremento que se ha observado en los últimos años, no sólo aumenta en los nacimientos vía cesárea, (Figura 5) sino otros factores tales como la diminución de la alimentación con leche humana, el uso temprano de antibióticos (incluidos los perinatales) y factores relacionados con la teoría de la higiene, donde los niños se ven cada vez menos expuestos a agentes infecciosos por vivir en un ambiente "más limpio"; se han visto involucrados en una modificación del desarrollo normal de la microbiota, lo que predispone aún más a este tipo de enfermedades.20
* P < 0.01; Ajustado por covariables
Modificado de: Egges Bo M et al. J Allergy Clin Immunol 2003;112:420-426
Figura 5 Riesgo de alergia según diferentes antecedentes de importancia.
En un estudio en 1999 por Grönlund y sus colaboradores, mediante el cultivo de la microbiota de 30 lactantes sanos, que nacieron por cesárea de madres que habían recibido profilaxis con antibióticos antes del parto, se encontró un retraso en la colonización, alcanzando una tasa de crecimiento de Bifidobacterias y lactobacilos similar a la de los recién nacidos por parto hasta el mes y 10 días de vida respectivamente; también se encontró que fueron colonizados por Bacteroides fragilis en menor cantidad. Se ha visto en otros estudios que dichas alteraciones duran hasta los seis meses de edad.21 Además, los niños nacidos por cesárea desarrollan una flora predominante en Clostridium difficile.22
Es importante señalar que la vía de nacimiento y las variaciones que ocasionan en la microbiota generan diferencias en la prevalencia de enfermedades atópicas que se prolongan por muchos años, incluso hasta en la edad adulta.5
Por otro lado, en estudios recientes se ha demostrado también que la microbiota de los lactantes alimentados al pecho está compuesta casi en forma predominante por Bifidobacterias y lactobaccillus, mientras que en aquellos que recibieron leche de fórmula éstas existen en menor cantidad, además de la presencia también de Bacteroides, Enterobacterias y Streptococcus.1,7,23
Una vez que el niño inicia con la alimentación familiar, sobre todo después del primero o segundo año de vida, la microbiota cambia y comienza a desarrollarse el esbozo de lo que va a ser la del adulto24,25 donde las Bifidobacterias representan sólo 5 a 15% del total de las bacterias, superadas únicamente por las Bacteroides, Eubacterias y Peptococcacea,7 cambio que se va dando a medida que pasan los años, siendo más notorio en los ancianos, en quienes se reduce la motilidad gastrointestinal por menor acidez gástrica, disminución en la síntesis de prostaglandinas, de la secreción mucosa de sodio y de bicarbonato, así como también alteraciones motoras secundarias a efectos discretos en los patrones manométricos con menor frecuencia de contracciones posteriores a las ingestas, reducción en la frecuencia del complejo motor migratorio interdigestivo; disminución de las contracciones en salva, lo que llevan a su vez a cambios en el metabolismo de los nutrimentos26 y ocasiona una alteración en la microbiota con disminución de las especies de Bifidobacterias, aumento de las Enterobacterias, Clostridium perfringes, Staphylococcus, Streptococcus y Candida albicans24 (Figura 6).
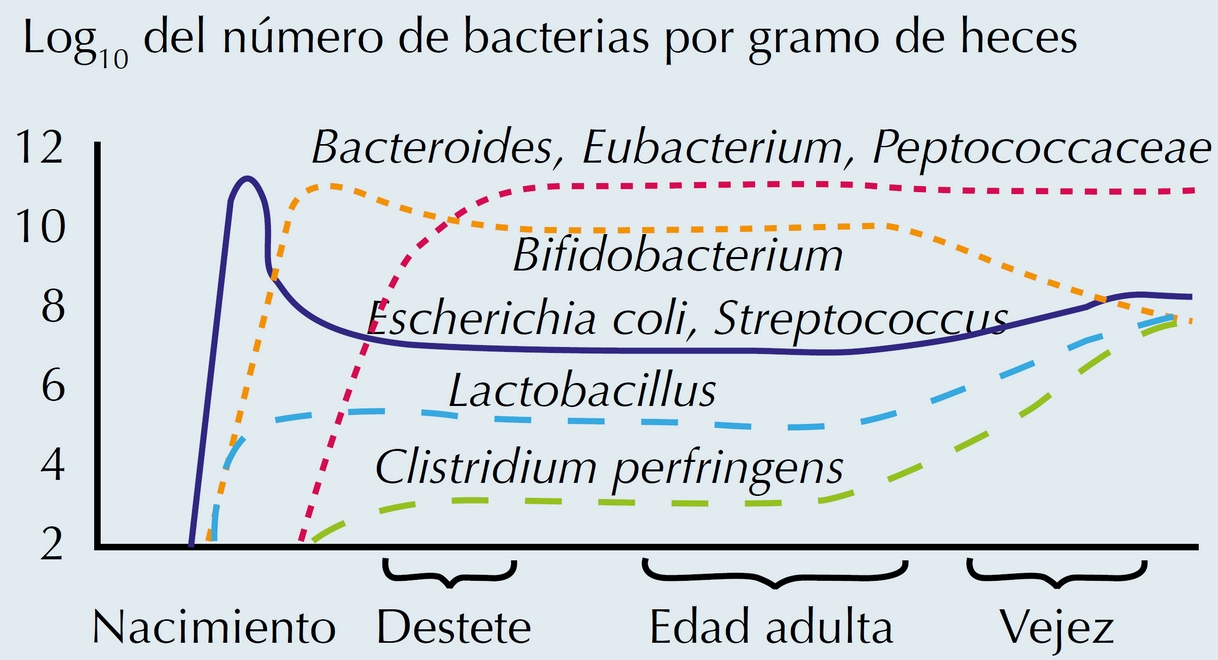
La composición de la flora bacteriana varía a lo largo de la vida del ser humano.
(T.Mitsuoka, 1982)
Figura 6 Cambios que sufre la microbiota según la edad.
Otra situación que puede alterar los componentes de la microbiota es el estrés, ya que cuando se está expuesto a éste se libera noradrenalina en la luz intestinal, lo cual reduce el número de bacterias comensales y hace que los microorganismos con potencial patógeno aumenten su virulencia.27 Estudios en animales han demostrado una disminución importante en la microbiota normal después de cuatro a seis horas de iniciado el proceso de una enfermedad. Hay evidencia de sobre crecimiento bacteriano e inicio de traslocación bacteriana en las seis primeras horas.27
En pacientes críticamente enfermos se ha descrito una pérdida total de la microbiota después de una estancia corta en unidades de cuidados intensivos.27 Esto tiene importancia, ya que es una de las teorías que podrían explicarnos la razón de la traslocación bacteriana, sepsis e inicio de falla orgánica multisistémica en muchos de estos casos.
EJE CEREBRO INTESTINO
El eje cerebro intestino consiste en una comunicación bidireccional entre el sistema nervioso central y el sistema nervioso entérico, lo que permite ligar los estado emocionales y cognitivos del cerebro con las funciones intestinales. El rol principal de este eje es monitorizar e integrar las funciones del tracto gastrointestinal y relacionarlas con los estados emocionales, los centros cognitivos del cerebro, con las funciones periféricas del intestino, así como la activación del sistema inmune, la permeabilidad intestinal, los reflejos entéricos y la señalización entero-endocrina. Todo esto es debido a la presencia de la microbiota gastrointestinal, dada la acción de las diferentes bacterias que regulan, como ya se mencionó, actividades metabólicas, tróficas e inmunes28 (Cuadro 1).
Cuadro 1 Mecanismos del eje cerebro-intestino
|
• De la microbiota gastrointestinal
al cerebro. • Producción, expresión y recambio de neurotransmisores (serotonina, GABA y factor neurotrófico [BDNF]). • Protección de la barrera intestinal y de la integridad de las uniones apretadas. • Modulación de los sensores entéricos aferentes. • Metabolitos bacterianos (ácidos grasos de cadena corta: butírico, propiónico y acético). • Regulación de la inmunidad de la mucosa. |
EL PAPEL DEL TIPO DE LA DIETA EN LA MICROBIOTA
Se considera que los hábitos dietéticos juegan un papel muy importante en la diversidad de la microbiota del humano.29 Los cambios significativos en la dieta y las condiciones en el estilo de vida comenzaron hace aproximadamente 10,000 años, en la llamada "Revolución Neolítica", con la introducción de la agricultura y la crianza de animales como el ganado, cambiando la fibra de la dieta predominantemente vegetariana por la proteína de origen animal.30
En 2010 De Filipo y su equipo publicaron un estudio donde se trata de demostrar la teoría de la diferencia que existe entre la microbiota de niños sanos de una comunidad rural de África (Burkina Faso), donde la dieta es predominantemente a base de fibra vegetal, y la de niños sanos de una comunidad europea en Italia, en la que la dieta tiene mayor contenido de proteína animal y carbohidratos. Se encontraron, mediante la utilización de métodos de secuenciación de 16S rADN y análisis bioquímicos, diferencias en la microbiota intestinal entre los dos grupos. Los niños de Burkina Faso tuvieron mucho mayor contenido de Bacteroides y menor contenido de Firmicutes, con una abundancia única de bacterias del grupo de Prevotella y Xylanibacterm, conocidas por su contenido en grupo de genes para celulosa e hidrólisis de xylan, lo cual es deficiente en los niños europeos. También se encontró una cantidad mucho mayor de ácidos grasos de cadena corta en los niños de Burkina Faso y una cantidad casi indetectable de enterobacterias (Shigella y E. coli)31 (Figura 7).
EVIDENCIA CIENTÍFICA DEL USO DE PROBIÓTICOS
Los probióticos son microorganismos no patógenos que cuando son ingeridos ejercen una influencia positiva en la salud y en la fisiología del huésped.32 Éstos, al igual que la microbiota normal del humano, cuentan con funciones específicas y benéficas para el organismo como: funciones de protección mediante el desplazamiento de patógenos, competencia por nutrimentos y receptores, así como la producción de factores antimicrobianos como bacteriosinas y ácido láctico. Existen otros que van a actuar directamente sobre la estructura inmunológica fortaleciendo la barrera de epitelio, estimulando la producción de IgA, fomentando la compactación apical de las uniones cerradas y, en general, al desarrollo del sistema inmune. Y también funciones sobre el metabolismo de los carcinógenos de la dieta, la síntesis de vitaminas (vitamina K, biotina, folatos), la absorción de iones (Mg, Ca, Fe), la fermentación de residuos dietéticos no digeribles y la producción de energía mediante la síntesis de ácidos grasos de cadena corta.33
Cáncer de colon
Se ha visto una participación de la microbiota intestinal en el cáncer de colon mediante la producción de carcinógenos y procarcinógenos.34 Se ha descrito también que la dieta rica en grasas y carnes, con bajo contenido de fibra vegetal, aumenta la excreción de compuestos nitrosos en las heces, conocidos como sustancias promotoras del cáncer de colon. También se ha visto que las aminas aromáticas heterocíclicas, producto de carnes cocinadas, inducen a cierto tipo de bacterias de la flora bacteriana intestinal que alteran la metilación del ADN de los enterocitos, afectando el uso de butirato por las células, que impiden la síntesis normal de la película de moco epitelial intestinal.35,36 Los Bacteroides y Clostridium aumentan la frecuencia de crecimiento de tumores en el colon según lo que se ha observado en animales de investigación, mientras que géneros como Lactobacillus y Bifidobacterias parecen tener efectos protectores. Aún no hay evidencia concluyente que respalde esta información; sin embargo, se considera a la microbiota intestinal como un factor importante que puede influir en el desarrollo de cáncer de colon en humanos.36
Obesidad
A nivel mundial la obesidad presenta un comportamiento epidémico. En México, para el año 2012, se reportó una prevalencia de 21.7% en niños de 5 a 11 años.37 En el estudio del origen de esta enfermedad, actualmente no sólo se relaciona el factor genético como determinante de la obesidad, sino que la investigación está señalando a la microbiota intestinal como un factor que influye en el desarrollo de esta patología.38
Estudios recientes sugieren que tanto las Bifidobacterias, como los Bacteroides parecen tener un efecto protector contra la obesidad,39 lo que se traduce en un mayor riesgo para los niños nacidos por cesárea. Apoyando estas investigaciones, existen estudios en roedores y en humanos donde la obesidad se relaciona con alteraciones en la composición de la microbiota: una disminución de 50% en la población de Bacteroides y un aumento proporcional en los Firmicutes, comparada con la microbiota de personas sanas no obesas.40 Esto sustenta también la teoría de que una diferencia entre poblaciones de microorganismos que componen la microbiota, el metabolismo de los sustratos y también a la producción y uso de energía.35 Por lo tanto, también se ha relacionado la alteración en la microbiota como factor que puede contribuir a la fisiopatología de enfermedades metabólicas.41
Cólico infantil
El cólico infantil afecta a 20% en los lactantes menores de tres meses,42 lo cual es uno de los mayores factores de riesgo para propiciar abuso infantil.43 La etiología de esta alteración se desconoce; sin embargo, se ha encontrado una fuerte asociación con la inflamación intestinal debida a la alergia a la proteína de la leche de vaca.44 Estudios recientes han mostrado una diferencia en la microbiota de lactantes con y sin cólico45-47 lo que podría explicar los cambios que causa esta patología: inflamación, producción de gas, distensión y alteración en la motilidad intestinal.48 En una revisión sistemática realizada por Valerie Sung y sus colegas, en un meta-análisis de tres estudios, se encontró una marcada reducción en el llanto en un tiempo de 21 días en pacientes alimentados al seno materno con cólico infantil utilizando Lactobacillus reuteri;49 sin embargo, se concluye que aún deben hacerse más estudios al respecto.
Hay estudios que hablan sobre los beneficios del uso de probióticos en múltiples patologías; sin embargo, existen dos patologías en las que su uso ha sido ampliamente estudiado y demostrado: diarrea aguda e inducida por antibióticos.
Diarrea aguda
Con base a la revisión sistemática de nueve estudios de Van Niel y sus colaboradores se recomienda el tratamiento con probióticos en niños con diarrea aguda, ya que se demostró que se reduce la duración de la diarrea en 0.7 días, además de una disminución en la frecuencia de las evacuaciones en el segundo día del tratamiento, demostrando también que a mayor dosis de probióticos hay mayor reducción de la duración de la diarrea.50
Diarrea por antibióticos
La diarrea aguda por antibióticos se analizó en una revisión de seis estudios, en 707 pacientes; 408 fueron tratados con probióticos y 428 recibieron placebo. Se observó que el uso de probióticos redujo significativamente la incidencia de diarrea asociada a antibióticos.51
Es posible que conforme se realicen más estudios sobre el uso de probióticos en diferentes enfermedades se descubra más sobre su función y de manera indirecta la importancia y el papel que juega la microbiota intestinal en el ser humano.
Síndrome de intestino irritable
El tratamiento en esta patología es difícil, prueba de ellos son los múltiples manejos descritos, tanto farmacológicos y no farmacológicos, lo que muestra lo poco que se sabe en cuanto a la causa del síndrome de intestino irritable; sin embargo, recientemente se ha sugerido una anormalidad en la microbiota colónica, similar a lo encontrado en el sobrecrecimiento bacteriano en el intestino, donde se ha visto una disminución en la cantidad de bifidobacteria o lactobacillos relacionado con la producción de gas, anormalidades en la motilidad y sensibilidad.
Estudios realizados en países escandinavos enfatizan el papel que tienen los probióticos en la modulación de la microbiota intestinal, como consecuencia en la regulación de la motilidad e hipersensibilidad del tracto digestivo. A pesar de que existen limitantes en estos estudios, ya que ha sido difícil su comparación por factores como diferencias en las cepas estudiadas, las dosis y la duración del tratamiento, algunos de ellos si han mostrado mejoría en la sintomatología de la enfermedad.
Lactobacillus plantarum es una de las especies aisladas frecuentemente en la mucosa del humano, tiene la particularidad de que al ser ingerida es capaz de sobrevivir al pH ácido del estómago y duodeno y al efecto de las sales biliares en el intestino superior, además de colonizar temporalmente el tracto gastrointestinal adhiriéndose a la mucosa colónica. Dicha colonización disminuye los grupos bacterianos productores de gas como Veillonella spp. y Clostridia spp. Existe evidencia que sugiere la eficacia de ciertos probióticos, como Lactobacillus plantarum 299v puede ser capaz de reducir significativamente el dolor, la distensión y las flatulencias en el síndrome de intestino irritable.52
Enfermedad inflamatoria intestinal
En cuanto a la enfermedad de Crohn y colitis ulcerativa, se refiere que en la primera el uso de probióticos no ha llenado las expectativas que se esperaban; sin embargo, en colitis ulcerativa moderada y severa se han descrito beneficios tanto en la inducción a la remisión como en el mantenimiento de la misma, específicamente utilizando una combinación de especies de Lactobacillus, Bifidobacterium, Streptococcus o Escherichia coli Nissle. También se ha descrito éxito en la utilización de probióticos en la prevención primaria de pouchitis y la reducción del riesgo de recaída, después de un tratamiento exitoso con antibióticos (nivel de recomendación A por Floch y su equipo).53-55
Un acercamiento potencial al manejo de la enfermedad inflamatoria intestinal podría ser el inducir una remisión clínica rápida y la reparación de la mucosa intestinal con el uso corticoides y/o terapia biológica, seguida por intervención de probióticos y/o prebióticos para mantener la remisión. Esta nueva propuesta de manejo permanece sin ser probada; sin embargo, está diseñada para estimular la creación de nuevas directrices de investigación que podrían resultar en el mejoramiento de esquemas de tratamiento, disminuyendo así los costos y la toxicidad a largo plazo de los esquemas actuales.56
Alergias
Los desórdenes alérgicos han sido asociados con alteración en la microbiota,57 en donde los factores ya mencionados en la etapa perinatal juegan un papel importante. En las últimas décadas se ha visto un aumento en el número de niños que desarrollan alergia en la progresión clínica de la llamada: "Marcha Atópica" (eccema®rinitis®asma). Se han estudiado a los probióticos como una posible intervención dietética para interrumpir la progresión de dicha enfermedad. Está descrita una mayor incidencia de atopias en niños nacidos de una familia con historia de alergias, con base en eso se han realizado estudios, sobre todo en la presencia de antecedentes de dermatitis átopica y el uso de probióticos en el último trimestre del embarazo y en la lactancia, como medida de prevención con resultados alentadores; sin embargo, aún es necesario realizar más estudios ya que hasta el momento no existe evidencia suficientemente convincente para recomendar el uso de probióticos de manera rutinaria en este tópico.58
Enterocolitis necrotizante
La diferencia entre la microbiota de bebés nacidos de término y los de pretérmino podría se un factor predisponente para desarrollar enterocolitis necrotizante.59 La microbiota de bebés con dicha afección es diferente a la de otros neonatos con peso bajo al nacer, especialmente en que en los primeros existe una menor cantidad de Firmicutes y una mayor cantidad de gamma proteobacteria.60 Una línea de evidencia que sugiere que podría ser la causa de las diferencias en la microbiota de estos niños es el uso de antibióticos.
Diversas revisiones sistemáticas de estudios que utilizan probióticos como cepas de Bifidobacterium, Lactobacillus, Saccharomyces y/o S. thermophilus para prevenir enterocolitis necrotizante muestran una reducción en la frecuencia y sobre todo en la mortalidad.61 Un estudio realizado en Egipto reportó que L rhmnosus GG, o una preparación de una cepa muerta del mismo probiotico, redujo significativamente la incidencia de enterocolitis.62 A pesar de que la Asociación Americana de Pediatría reconoce que existe evidencia de que los probióticos previenen la enterocolitis necrotizante en neonatos con muy bajo peso al nacer, hacen el llamado a realizar más estudios para aclarar la dosis efectiva y la cepa de probiótico antes de utilizarlos como una recomendación clínica.63 Otros consideran la evidencia existente como suficiente para hacer cambios en la práctica.64 Esta opinión está basada en la falta de opciones terapéuticas y la fuerza en la evidencia existente de que los probióticos pueden prevenir enterocolitis necrotizante severa y así la alta mortalidad de prematuros con dicha afección.
Clostridium difficile
Los antibióticos son ampliamente prescritos y administrados, lo que ocasiona alteraciones en la microbiota intestinal, que puede llevar a resistencias hacia patógenos como Clostridum difficile. Existen diversos trabajos que sustentan que el uso de probióticos previene la infección por C. difficile asociado a antibióticos, uno de ellos es una revisión sistemática realizada por la organización Cochrane de 23 estudios controlados aleatorizados que incluyó a 4,213 pacientes, con una calidad de evidencia moderada, que sugiere que los probióticos son tanto seguros como efectivos en reducir el riesgo de Infección asociada a diarrea por C. difficile en un 64%.65 Una revisión realizada por Na, Kelly y su grupo, concluye que los lactobacillus, que contienen combinación de probióticos y S. boulardii podrían ser efectivos en la prevención de la infección por C. difficile en pacientes en riesgo; sin embargo, comentan que este hallazgo está basado en estudios pequeños y que se requieren más estudios bien controlados para confirmarlo.66
En cuanto al manejo de las infecciones por C. difficile en síndrome de intestino irritable y enfermedad inflamatoria intestinal, existe un campo de estudio muy prometedor con el uso de trasplante fecal para reemplazar las bacterias disbióticas con bacterias protectoras.67
CONCLUSIONES
Se ha considerado a la microbiota intestinal como un órgano que se adquiere desde el nacimiento, esto debido a la complejidad de las funciones que desempeña. Dentro de éstas se encuentran las metabólicas, tróficas e inmunes, que pueden ser alteradas desde el nacimiento según la vía, el tipo de alimentación, el uso y abuso de antibióticos, llevando así a la posible génesis de diversas enfermedades como: cáncer de colon, síndrome de intestino irritable, enfermedad inflamatoria intestinal, enterocolitis necrotizante, atopias, diarrea por antibióticos diabetes, obesidad y, posiblemente, muchas otras que se han y seguirán siendo descubiertas, según la investigación en este campo vaya aumentando.
En los pacientes hospitalizados se debe tener en cuenta el efecto que el uso indiscriminado de antibióticos, las comorbilidades como la hipoperfusión o la desnutrición, causan al equilibrio de la flora bacteriana llevando a graves consecuencias como: sepsis persistente secundaria a translocación bacteriana, disfunción orgánica múltiple y la muerte. Por esto, y por muchas otras acciones que pudieran no haber sido descritas aún, el entendimiento y el estudio de la microbiota gastrointestinal podrían cambiar el enfoque preventivo y terapéutico de muchas enfermedades.
Finalmente, es importante fomentar la alimentación de los niños con leche materna, así como limitar en lo posible los nacimientos vía cesárea.











 nueva página del texto (beta)
nueva página del texto (beta)