Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de fitopatología
versão On-line ISSN 2007-8080versão impressa ISSN 0185-3309
Rev. mex. fitopatol vol.28 no.2 Texcoco Jan. 2010
Artículos científicos
Antagonismo de dos Ascomicetos Contra Phytophthora capsici Leonian, Causante de la Marchitez del Chile (Capsicum annuum L.)
Antagonism of two Ascomycetes Against Phytophthora capsici Leonian, Causing Wilt of Pepper (Capsicum annuum L.)
Roberto Ulises Ramos–Sandoval1, Juanita Guadalupe Gutiérrez–Soto1, Raúl Rodríguez–Guerra2, Sergio Manuel Salcedo–Martínez3, Carlos Eduardo Hernández–Luna3, Hugo Alberto Luna–Olvera3, Juan Francisco Jiménez–Bremont4, Saúl Fraire–Velázquez5, Isidro Humberto Almeyda León6
1 Universidad Autónoma de Nuevo León, Facultad de Ciencias Biológicas, Pedro de Alba y Manuel L. Barragán, Cd. Universitaria, Apdo. Postal 67–F San Nicolás de los Garza, Nuevo León, México. CP 66451.
2 INIFAP–Campo Experimental General Terán, Carretera Montemorelos–China km. 31, General Terán, Nuevo León, México. CP 67400.
3 Universidad Autónoma de Nuevo León, Facultad de Ciencias Biológicas, Pedro de Alba y Manuel L. Barragán, Cd. Universitaria, Apdo. Postal 67–F San Nicolás de los Garza, Nuevo León, México. CP 66451.
4 Instituto Potosino de Investigación Científica y Tecnológica, Camino a Presa San José 2055. Lomas 4ª. Sección. San Luis Potosí, SLP, México. CP 78216.
5 Unidad de Biología Experimental, UAZ., Av. Revolución S/N, Col. Tierra y Libertad, Guadalupe, Zacatecas, México. CP 98600.
6 INIFAP–Campo Experimental General Terán, Carr. Montemorelos–China km. 31, General Terán, Nuevo León, México. CP 67400. Correspondencia: halmeyda30@hotmail.com.
Recibido: Enero 19, 2010
Aceptado: Mayo 07, 2010
Resumen
En esta investigación se evaluó la actividad antagónica y protección de plántulas in vitro del ascomiceto Xylaria poitei, y la actividad antagónica de éste en combinación con un ascomiceto desconocido (AD) contra P. capsici, causante de la marchitez del chile. Xylaria poitei protegió plántulas de chile y permitió la sobrevivencia de un 58.3% de las plántulas, mientras que el oomiceto causó 100% de mortandad; además este hongo inhibió el crecimiento micelial de P. capsici hasta un 49.6% en uno de los experimentos donde se establecieron confrontaciones duales. En confrontaciones triples ambos ascomicetos incrementan ligeramente su inhibición a los 12 días de establecida la confrontación contra P. capsici; y aún mantienen la inhibición del oomiceto cuatro días después. Ambos ascomicetos estimulan o inhiben su crecimiento en alguna fecha de evaluación durante la confrontación entre ellos. El medio líquido papa dextrosa expuesto al crecimiento de X. poitei (filtrado) tiene baja actividad contra el crecimiento micelial de P. capsici. Los resultados anteriores indican que la actividad antagónica de ambos ascomicetos contra P. capsici se incrementa cuando ambos crecen en forma combinada respecto a las confrontaciones duales, y sugieren que la actividad antagónica de X. poitei es estimulada por la presencia del oomicete.
Palabras clave: Xylaria poitei, ascomiceto desconocido, protección de plántulas de chile.
Abstract
In this study we evaluated the antagonistic activity and protection of seedlings in vitro of the ascomycete Xylaria poitei, and its antagonistic activity in combination with an unknown ascomycete (AD) against P. capsici, the cause of wilt in pepper. Xylariapoitei protected pepper seedlings and allowed 58.3% survival of seedlings, while the oomycete caused 100% mortality, besides this fungus inhibited the mycelial growth of P. capsici up to 49.6% in one of the experiments where they settled dual confrontations. In triple confrontations both ascomycetes increase slightly their inhibition at 12 days of confortation against P. capsici, and still maintain the inhibition of the oomycete four days later. It was observed that both ascomycetes stimulare or inhibit each other growth at some time during the evaluation of confortation. The potato dextrose liquid medium exposed to the growth of X. poitei (filtrate) has low activity against the mycelial growth of P. capsici. The above results indicate that the antagonistic activity of both ascomycetes againstbP. capsici increases when they grow in combination with respect to the dual confrontations, and suggest that the antagonistic activity of X. poitei is stimulated by the presence of the oomycete.
Keywords: Xylaria poitei, unknown ascomycete, protection of chilli seedlings.
El cultivo del chile (Capsicum annuum L.) es afectado por diversas enfermedades causadas por microorganismos que limitan el rendimiento y la calidad de su producto; y para su control se aplican diversas estrategias basadas principalmente en el uso de plaguicidas sintéticos. Entre los principales fitopatógenos habitantes del suelo que atacan al chile están los hongos Rhizoctonia solani Kühn y Fusarium spp., y el oomiceto Phytophthora capsici (Leonian) (González–Chavira et al., 2002; Vásquez–López et al., 2002; Velásquez–Valle et al., 2001). Esta última especie es considerada la causante de la marchitez del chile y la más devastadora de esos fitopatógenos, capaz de infectar prácticamente cualquier parte subterránea o aérea de las plantas de chile (Ristaino y Johnston, 1999) e inclusive causar serias pérdidas a otras hortalizas cultivadas en el mundo (Hausbeck y Lamour, 2004; Lee et al., 2001; Tamietti y Valentino, 2001). Las prácticas de control contra fitopatógenos habitantes del suelo en chile están dirigidas principalmente contra P. capsici, e involucran la realización de numerosas aplicaciones de plaguicidas antes y después del establecimiento del cultivo en campo (Hwang y Kim, 1995), debido a la ausencia de cultivares con elevados niveles de resistencia. Se han sugerido prácticas de manejo de la marchitez del chile causada por P. capsici basadas en el comportamiento biológico y ecológico del patógeno (Ristaino y Johnston, 1999). Una de estas prácticas incluye el uso de agentes de biocontrol para reducir las poblaciones del patógeno resistentes a pesticidas y disminuir el número de aplicaciones de estos últimos. Entre los organismos estudiados como agentes de biocontrol contra P. capsici se encuentran Burkholderia cepacia (Palleroni & Holmes) (Ezziyyani et al., 2004), Pseudomonas spp. (Virgen–Calleros et al., 1997), Glomus intraradices (Schenk & Smith) (Zheng et al., 2005), Bacillus spp. (Guillen–Cruz et al., 2006) y Trichoderma spp. (Guigón et al., 2006). Aunque tres especies de bacterias se han evaluado por su eficiencia combinada como agentes de biocontrol contra fitopatógenos asociados a la marchitez del chile (Guillen–Cruz et al., 2006), es importante considerar la especificidad de los mecanismos de acción e interacción de los microorganismos en combinación (Huang, 1992; Camprubi et al., 1995; Girlanda et al., 2001; Whipps, 2001), con el propósito de hacer un uso eficiente de estos agentes de biocontrol. Previamente hemos reportado la actividad antagónica de un ascomiceto desconocido (AD) cuya identidad aun se desconoce debido a que no forma estructuras de reproducción en medio de cultivo; y se considera un ascomiceto debido a la relación de la secuencia de los espaciadores transcritos internos (ITS) ribosomales (Robles–Yerena et al., 2010) con ese grupo de hongos. El AD ha protegido plántulas de chile de la muerte causada por P. capsici e inhibe el crecimiento micelial de este fitopatógeno en confrontaciones duales. El medio de cultivo líquido (filtrado) donde ha crecido el AD muestra actividad antagónica contra el crecimiento micelial de P. capsici en medio sólido, y evita el crecimiento de micelio y formación de esporangios cuando el filtrado remplaza el agua utilizada para la producción de zoosporas del oomiceto en cajas Petri (Robles–Yerena et al., 2010). Durante el 2007 se aisló una cepa de Xylariapoitei (Lév.) Fr. a partir de una punta de hifa de colonias desarrolladas de ascosporas de cuerpos fructíferos creciendo en tocón de un árbol no identificado, ubicado en un parque recreativo de la Ciudad de Guadalupe, Nuevo León. El teleomorfo de esta especie de Xylaria fue descrito en México previamente por San Martín y Rogers (1989). Tanto X. poitei como el AD son de lento crecimiento en el medio de cultivo papa dextrosa agar, mientras que sólo el primero forma cuerpo fructíferos típicos de este género en ese medio de cultivo. Liu et al. (2008), han reportado que Xylaria sp. (aislado de Ginkgo biloba L.), posee un compuesto químico (7–amino–4–metilcumarina) con una amplia actividad antimicrobiana contra bacterias y hongos como Aspergillus niger van Tieghem y Penicillium expansum Link. Lo anterior sugiere que especies de Xylaria podrían tener actividad antagónica por antibiosis contra otros microorganismos, por lo que se consideró posible que la cepa de X. poitei aislada de Nuevo León podría tener actividad contra el oomiceto P. capsici. En esta investigación se describe la actividad antagónica de X. poitei solo y en combinación con el AD, así como la protección de plántulas de chile por X. poitei, contra P. capsici.
MATERIALES Y MÉTODOS
Antagonismo de X. poitei. Se realizó un experimento en confrontación dual entre X.poitei y P. capsici para determinar si el primero poseía actividad antagónica contra el oomiceto. La cepa de P. capsici utilizada fue la PCT–17, la cual proviene de Tacámbaro, Michoacán, y se ha usado en investigaciones previas (Hernández, 2007; Robles–Yerena et al., 2010). Se inoculó un disco de 0.5 cm de una colonia de 15 días de edad de X.poitei a cajas Petri conteniendo el medio de cultivo papa dextrosa agar (PDA; Difco), con siete días de anticipación a la inoculación de P. capsici debido al crecimiento lento que posee el ascomiceto en este medio de cultivo. Al séptimo día se inoculó un disco de 0.5 cm de P. capsici a partir de una colonia de 15 días de edad crecida en PDA, en las placas previamente inoculadas con X. poitei. Se establecieron tres repeticiones bajo un diseño experimental completamente al azar y cada 48 horas se midió el crecimiento radial en milímetros de ambos organismos; los testigos consistieron en confrontaciones de P. capsici y X. poitei consigo mismos y el experimento se dio por concluido cuando en el testigo del fitopatógeno las colonias se pusieron en contacto. Para el análisis estadístico se utilizó el promedio de crecimiento de las dos colonias del testigo. También se midió el crecimiento de X.poitei para determinar un posible efecto antagónico de P. capsici contra este ascomiceto. Considerando que en el experimento anterior los testigos consistieron en confrontaciones consigo mismos y el crecimiento se midió hasta el sexto día, se realizó un nuevo experimento utilizando como testigo la inoculación de P. capsici en un sólo extremo de la caja Petri. Xylaria poitei se inoculó con ocho días de anticipación a placas conteniendo PDA a partir de colonias de 21 días de edad crecidas en PDA. Los tratamientos se establecieron bajo un diseño completamente al azar con cuatro repeticiones y se mantuvieron en laboratorio a 25 °C. Se midió el crecimiento radial de P. capsici cada 48 horas por 12 días.
Antagonismo entre ascomicetos. Se realizó una confrontación dual entre X. poitei y el AD para determinar si existía antagonismo entre ellos y establecer su posible compatibilidad como potenciales agentes de biocontrol. Xylaria poitei se inoculó a cajas Petri conteniendo PDA con tres días de anticipación al establecimiento de las confrontaciones con el AD. Los testigos consistieron en la inoculación de cada ascomiceto individualmente en un extremo de cajas Petri. El experimento se estableció con cuatro repeticiones bajo un diseño completamente al azar y se mantuvieron en laboratorio a 25 °C. Se realizaron seis mediciones del crecimiento radial de cada ascomiceto en 14 días.
Combinación de antagonistas. Se estableció un experimento con el propósito de determinar si la actividad antagónica de X. poitei, junto con la del AD, es igual o mayor de la que causa cada uno por si solo sobre P. capsici. Cajas Petri se marcaron por el lado inferior en cada ángulo de un triangulo equilátero y en cada marca se inoculó X. poitei, el AD o P. capsici. Los tratamientos consistieron en confrontaciones duales de cada antagonista contra P. capsici, de ambos ascomicetos contra el oomiceto, y de este último solo. Se inocularon cajas Petri conteniendo PDA con X. poitei o en combinación con el AD, y a los tres días las placas se inocularon con P. capsici. Los tratamientos se establecieron bajo un diseño completamente al azar con cuatro repeticiones, y se mantuvieron en laboratorio a 25 °C. Cada24 horas (durante 11 días) se midió el crecimiento de P. capsici en dirección de las colonias de cada antagonista.
Filtrado de X. poitei. Debido a la actividad antagónica mostrada por X. poitei en los experimentos anteriores, se evaluó la capacidad del hongo de producir algún factor en medio de cultivo líquido capaz de mantener esa actividad contra P. capsici, como previamente fue reportado por Robles–Yerena et al. (2010) para el ascomiceto desconocido. El hongo X. poitei creció en matraces conteniendo 150 mL de caldo de dextrosa y papa, a 175 rpm por 30 días. El medio liquido se filtró a través de 4 capas de tela para limpieza y finalmente a través de filtros de 0.2 μm. El filtrado s e agregó a PDA esterilizado conteniendo doble cantidad de ingrediente para obtener una concentración final de filtrado al 50%. El medio se vertió a cajas Petri y una vez solidificado se inoculó en el centro con un disco de 0.5 cm de diámetro de una colonia de P. capsici de ocho días de edad crecida en PDA. Como testigo se utilizó PDA elaborado normalmente (3.9 g de medio en 100 mL de agua) y fue inoculado de igual manera con P. capsici. Ambos tratamientos se establecieron bajo un diseño completamente al azar con cuatro repeticiones, y las placas se mantuvieron en laboratorio a 25°C. El crecimiento radial fue medido cada 24 horas durante 6 días y una evaluación final a los 11 días.
Protección de plántulas de chile. Se trataron semillas de chile guajillo con hipoclorito de sodio al 1 % por un minuto, se lavaron con agua destilada estéril y se secaron en papel estéril. Las semillas se colocaron en grupos de 20 en placas conteniendo agar agua (AA; 2.0 %), a 25 °C y fotoperiodo de 12 h luz. Cada 24 h y durante cuatro días, las semillas con crecimiento de microorganismos se mantuvieron en las placas y fueron desechadas, mientras que las semillas aparentemente libres de microorganismos se transfirieron a nuevas placas conteniendo AA y ahí se conservaron para los experimentos. Al cuarto día, grupos de tres semillas libres de microorganismos se transfirieron a nuevas placas que fueron colocadas en forma inclinada sostenidas en fragmentos de unicel, y se mantuvieron a la misma temperatura y fotoperiodo. Semillas germinadas y con raíz (nueve días después de la siembra), se inocularon en el cuello con un fragmento de aproximadamente 2 mm2 de colonia de X. poitei de 14 días de crecimiento en PDA. Tres días después, las plántulas se inocularon con un fragmento de colonia de P. capsici de 10 días de edad, en el lado opuesto del cuello donde se inoculó X. poitei. Como testigos se utilizaron plántulas inoculadas con el patógeno y con X. poitei individualmente, y plántulas sin inocular. Se establecieron cuatro repeticiones de tres plántulas cada una bajo un diseño completamente al azar. Las plántulas de chile inoculadas con X. poitei con tres días de anterioridad, no mostraron ningún daño aparente, y el hongo ya mostraba crecimiento a partir del fragmento inoculado al momento de inocular P. capsici. Los tratamientos se evaluaron a los 12 días después de la inoculación de P. capsici, utilizando una escala con valores del 1 al 5 donde el 1= Sin síntomas visibles; 2= del 1 al 10% de la raíz podrida; 3= Del 11 al 25 % de la raíz podrida; 4= Del 26 al 50 % de la raíz podrida; 5= Más del 50 % de la raíz podrida o planta muerta (Robles–Yerena et al., 2010). Los porcentajes de daño en raíces se obtuvieron visualmente y según el daño se asignó el valor escalar correspondiente. Adicionalmente, se obtuvo el porcentaje de plantas muertas para cada tratamiento.
Análisis de resultados. Los datos de crecimiento radial de los microorganismos se sometieron a un análisis de varianza completamente al azar, y se realizaron comparaciones de medias (DMS) cuando fue necesario. Los porcentajes de inhibición de los microorganismos fueron obtenidos con base a la fórmula de Vincent (1947): % de inhibición = (crecimiento radial de la colonia testigo – crecimiento radial de la colonia con tratamiento/crecimiento radial de la colonia testigo) X100.
RESULTADOS Y DISCUSIÓN
Antagonismo de X. poitei. Al final de ambos experimentos donde se establecieron confrontaciones duales, X. poitei fue capaz de inhibir el crecimiento micelial de P. capsici en un 39.8 y 49.6% (Cuadro 1 y 2) cuando se utilizó como testigo el oomiceto confrontado consigo mismo o solo (Figura 1), respectivamente. Sin embargo, el porcentaje de la inhibición fue contrastante entre ambos experimentos a los seis dÃas de establecidas las confrontaciones. Se encontraron diferencias (p< 0.01) para el crecimiento micelial de P. capsici en las dos últimas evaluaciones en ambos experimentos. Estos resultados sugieren que la inhibición del crecimiento micelial de P. capsici por X. poitei es debida a un factor (posiblemente un metabolito secundario, alguna proteína, etc.) que se difunde en el medio de cultivo donde se establecieron las confrontaciones, como se ha observado con otros antagonistas como Burkholderia cepacia (Ezziyyani et al., 2004) y un ascomiceto desconocido (Robles–Yerena et al., 2010) contra este oomicete.
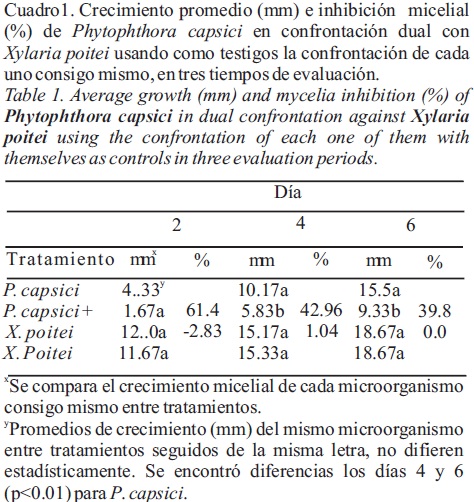
Diversos metabolitos producidos por microorganismos han mostrado actividad antagónica contra P. capsici (Okamoto et al., 1998; Lee et al., 2003; Paul y Sarma, 2006). Se ha reportado que Xylaria sp. tiene actividad antagónica contra otros ascomicetos (Aspergillus niger y Penicillium expansum) y bacterias debido a la producción de 7–amino–4–metilcumarina (Liu et al., 2008); sin embargo se desconoce en estudios previos la actividad de especies del género Xylaria contra P. capsici, y por lo tanto si el metabolito descrito por Liu et al. (2008) es el responsable de la actividad antagónica observada por la cepa de X. poitei usada en esta investigación.
Estos resultados dejan abierta la posibilidad de identificar posteriormente el o los compuestos químicos producidos por esta especie de Xylaria, responsables de la inhibición observada, y determinar si 7–amino–4–metilcumarina tiene actividad contra P. capsici. Debido al desconocimiento de la identidad de la especies de Xylaria reportada por Liu et al. (2008), es posible que distintos factores químicos con actividad antagónica sean producidos y dependientes de las interacciones específicas entre especies del género Xylaria con diversos microorganismos. Este trabajo demuestra que el género Xylaria contiene al menos una especie con actividad antagónica contra P. capsici. El crecimiento micelial de X. poitei se mantuvo con un escaso efecto por la presencia de P. capsici en alguna de las evaluaciones realizadas durante las confrontaciones duales entre ambos en el primer experimento (Cuadro 1), por lo que no se registró el crecimiento de X. poitei en el segundo experimento donde el oomiceto se colocó solo como testigo en el extremo de cajas Petri. En la confrontación de X. poitei con el AD, cada uno estimuló el crecimiento del otro en la mayoría de las evaluaciones, y sólo se encontró diferencias en X. poitei, entre el testigo y la confrontación con el AD a los 5 (p<0.05) y 8 días (p<0.01) (Cuadro 3). Estos resultados sugieren que la actividad antagónica de X. poitei sobre P. capsici no es afectada por este oomiceto, y que tanto X. poitei como el AD pueden coexistir juntos sin un fuerte deterioro del crecimiento de uno sobre el otro.
Lo anterior puede permitir que ambos ascomicetos pudieran ser utilizados de manera combinada contra la marchitez del chile causada por P. capsici, una vez realizados experimentos en invernadero y campo que muestren su potencial como agentes de biocontrol.
Antagonismo de ambos ascomicetos contra P. capsici. El experimento establecido para determinar el efecto de X. poitei y el AD solos y en combinación contra P. capsici, se concluyó a los 11 días de la inoculación del oomiceto debido a que la colonia de éste entró en contacto con alguno de los ascomicetos en al menos alguna repetición (Figura 2A); sin embargo, las placas del experimento fueron conservadas tres días más para observar el comportamiento de las colonias de los organismos confrontados (Figura 2B). Se encontraron diferencias estadísticas entre tratamientos al primer (p<0.05) y del cuarto al onceavo (p<0.01) días, datos no mostrados.
La combinación de ambos ascomicetos en ensayos triples con P. capsici redujeron ligeramente el crecimiento micelial del oomicete respecto a la confrontación dual contra el fitopatógeno (Figura 4), sin embargo, su crecimiento fue inhibido fuertemente aun al catorceavo día (Figura 2B). Lo anterior indica que el crecimiento combinado de ambos ascomicetos no limita la capacidad de uno sobre el otro para inhibir el crecimiento de P. capsici. Previamente se han observado porcentajes de inhibición del 53 al 73% en confrontaciones duales entre el AD y P. capsici, mayores al observado en esta investigación, y se ha demostrado que el AD produce un factor en el medio de cultivo donde crece solo (filtrado), capaz de continuar inhibiendo el crecimiento micelial del oomicete (Robles–Yerena et al., 2010). Considerando que X. poitei inhibió el crecimiento micelial de P. capsici en confrontaciones duales y en combinación con el AD, se evaluó la capacidad de producción de algún factor producido en medio líquido expuesto al crecimiento de este ascomiceto que pudiera explicar la inhibición observada.
Los resultados con el filtrado de X. poitei mostraron baja actividad antagónica sobre el crecimiento micelial de P. capsici, aunque sin diferencias estadísticas entre tratamientos (Cuadro 4). Esto sugiere que la actividad inhibitoria de X. poitei sobre el micelio del fitopatógeno es estimulada por la presencia de este último. Lo anterior puede considerarse como una respuesta activa de X. poitei a la presencia de otro microorganismo, como ha sido señalado por Heilmann–Clausen y Boddy (2005), lo cual indica que el ascomiceto produciría algún antibiótico al percibir la presencia de P. capsici.
Protección de plántulas por X. poitei. La inoculación de X poitei en el cuello de plántulas de chile no causó ningún daño aparente a las plántulas al momento de la inoculación de P. capsici, ni a los 12 días después de la inoculación de P. capsici. Lo anterior indica que el protocolo de inoculación de plántulas in vitro utilizado en esta investigación y previamente reportado por Robles–Yerena et al. (2010), es eficiente para la selección de potenciales agentes de biocontrol contra la marchitez del chile y otros patógenos de la raíz. La inoculación anticipada de X. poitei en plántulas de chile permitió una sobrevivencia cercana al 58.0 % en plántulas inoculadas con el oomiceto; mientras que en las plántulas del testigo inoculadas sólo con P. capsici se observó la muerte del 100 % (Figura 3; Cuadro 5). Lo anterior demuestra que este ascomiceto aparentemente es inocuo hacia la planta de chile y que es capaz de protegerla del daño causado por P. capsici en el tiempo que duró el experimento.
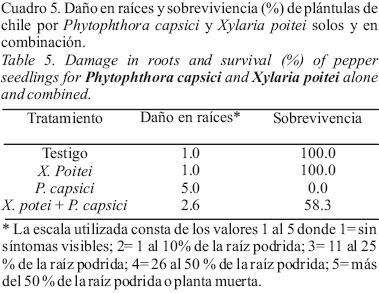
Existe información de campo acerca de la sobrevivencia de plantas de chile protegidas con potenciales agentes de biocontrol, sin embargo, poco se conoce de ensayos in vitro. Previamente hemos reportado que un hongo septado (referido en esta investigación como ascomiceto desconocido) ha mostrado efectos similares de protección contra P. capsici (Robles–Yerena et al., 2010).
CONCLUSIONES
Xylaria poitei es capaz de inhibir el crecimiento micelial del oomiceto P. capsici y reduce la mortandad de plántulas causada por este fitopatógeno. Esto posiblemente se debe a un factor liberado en el medio de cultivo que es inducido por la presencia del oomiceto cuando ambos son confrontados. La coinoculación de X. poitei y el AD incrementan ligeramente la inhibición del crecimiento de P. capsici, y entre ambos ascomicetos no existe una clara actividad de inhibición.
AGRADECIMIENTOS
Se agradece al CONACYT el apoyo financiero para la realización de esta investigación bajo el convenio 091057.
LITERATURA CITADA
Camprubi, A., Calvet, C. and Estaun, V. 1995. Growth enhancement of Citrus reshni after inoculation with Glomus intraradices and Trichoderma aureoviride and associated effects on microbial populations and enzyme activity in potting mixes. Plant and Soil 173: 233–238. [ Links ]
Ezziyyani, M., Pérez S., C., Requena, M.E., Sid, A.A. y Candela, M.E. 2004. Evaluación del biocontrol de Phytophthora capsici en pimiento (Capsicum annuum L.) por tratamiento con Burkholderia cepacia. Anales de Biología 26:61–68. [ Links ]
Girlanda. M., Perotto. S., Moenne–Loccoz, Y., Bergero, R., Lazzari, A., Defago, G., Bonafente, P. and Luppi, A.M. 2001. Impact of biocontrol Pseudomonas fluorescens CHAO and a genetically modified derivative on the diversity of culturable fungi in the cucumber rhizosphere. Applied and Environmental Microbiology 67:1851–1864. [ Links ]
González–Chavira, M.M., Torres–Pacheco, I. y Guzmán M., H. 2002. Patógenos involucrados en la marchitez del chile. Proceedings of the 16th International Pepper Conference, Tampico, Tamaulipas. México. [ Links ]
Guigón L., C., Macías L., B.C., Avila Q., G., Lujan F., M., Quiñones P., F.J., Chavez S., N., Berzoza M., M. y Acosta R., G.F. 2006. Validación y transferencia del uso de Trichoderma sp. en el cultivo del chile en la región de Delicias, Chih. Tercera Convención Mundial de Chile. Chihuahua y Delicias, Chihuahua, México. pp: 173–178. [ Links ]
Guillén–Cruz, R., Hernández–Castillo, F.D., Gallegos–Morales, G., Rodríguez–Herrera, R., Aguilar–González, C.N., Padrón–Corral, E. y Reyes–Valdés, M.H., 2006. Bacillus spp. como biocontrol en un suelo infestado con Fusarium spp., Rhizoctonia solani Kühn y Phytophthora capsici Leonian y su efecto en el desarrollo y rendimiento del cultivo de chile (Capsicum annuum L.). Revista Mexicana de Fitopatología 24:105–114. [ Links ]
Hausbeck, M.K. and Lamour, K.H. 2004. Phytophthora capsici on vegetable crops: Research progress and management challenges. Plant Disease 88:1292–1303. [ Links ]
Heilmann–Clausen, J. and Boddy, L. 2005. Inhibition and stimulation effects in communities of wood decay fungi: Exudates from colonised wood influence growth by other species. Microbial Ecology 49:399–406. [ Links ]
Hernández–González, M.E. 2007. Variabilidad de aislados de Phytophthora capsici en el estado de Guanajuato. Tesis de Maestría en Ciencias. Instituto Tecnológico de Celaya. Celaya, Guanajuato. 100 p. [ Links ]
Huang, H.C. 1992. Ecological basis of biological control of soil borne plant pathogens. Canadian Journal of Plant Pathology 14:86–91. [ Links ]
Hwang, B.K. and Kim, A.H, 1995. Phytophthora blight of pepper and its control in Korea. Plant Disease 79:221–227. [ Links ]
Lee, B.K., Kim, B.S., Chang, S.W. and Hwang, B.K. 2001. Aggressiveness to pumpkin cuitivars of isolates of Phytophthora capsici from pumpkin and pepper. Plant Disease 85:497–500. [ Links ]
Lee, J.Y., Moon, S.S. and Hwang, B.K. 2003. Isolation and antifungal and antioomycete activities of aerugine produced by Pseudomonas fluorescens strain MM–B16. Applied and Environmental Microbiology 69:2023–2031. [ Links ]
Liu X., Dong, M., Chen, X., Jiang, M., Lv, X. and Zhou, J. 2008. Antimicrobial activity of an endophytic Xylaria sp. YX–28 and identification of its antimicrobial compound 7–amino–4–methylcoumarin. Applied Microbiology and Biotechnology 78:241 –247. [ Links ]
Okamoto, H., Sato, Z., Sato, M., Koiso, Y., Iwasaki, S. and Isaka, M. 1998. Identification of antibiotic red pigments of Serratia marcescens F–1 –1, a biocontrol agent of damping–off of cucumber, and antinicrobial activity against other pathogens. Annals of the Phytopathological Society of Japan 64:294–298. [ Links ]
Paul, D. and Sarma, Y.R. 2006. Antagonistic effects of metabolites of Pseudomonas fluorescens strains on the different growth phases of Phytophthora capsici, foot rot pathogen of black pepper (Piper nigrum L.). Archives of Phytopathology and Plant Protection 39:1–6. [ Links ]
Ristaino, J.B. and Johnston, S.A. 1999. Ecologically based approaches to management of Phytophthora blight on bell pepper. Plant Disease 83:1080–1089. [ Links ]
Robles–Yerena, L., Rodríguez–Villarreal, R.A., Ortega–Amaro, M.A., Fraire–Velázquez, S., Simpson, J., Rodríguez–Guerra, R. and Jiménez–Bremont, J.F. 2010. Characterization of a new fungal antagonist of Phytophthora capsici. Scientia Horticulturae 125:248–245. [ Links ]
San Martín, F. and Rogers, J.D. 1989. A preliminary account of Xylaria of Mexico. Mycotaxon 34:283–373. [ Links ]
Tamietti, G. and Valentino, D. 2001. Physiological characterization of a population of Phytophthora capsici Leon. from northern Italy. Journal of Plant Pathology 83:199–205. [ Links ]
Vásquez–López, A., Tlapal–Bolaños, B., Yañez–Morales, M. De J. y Quintos–Escalante M. 2002. An etiology of the rate of wilting of the chile de agua variety chili pepper (Capsicum annuum L) in the central valleys of Oaxaca, México. Proceedings of the 16th International Pepper Conference, Tampico, Tamaulipas, México. [ Links ]
Velásquez–Valle, R., Medina A., M.M. y Luna–Ruiz, J. de J. 2001. Sintomatología y géneros de patógenos asociados con las pudriciones de la raíz del chile (Capsicum annuum) en el Norte–Centro de México. Revista Mexicana de Fitopatología 19:175–181. [ Links ]
Vincent, J.M. 1947. Distoration of fungal hyphae in the presence of certain inhibitors. Nature 159:850. [ Links ]
Virgen–Calleros, G., Vázquez–Vázquez, J.L., Anguiano–Ruvalcaba, G.L. Olalde–Portugal, V. y Hernández–Delgadillo, R. 1997. Aislamiento de bacterias de la rizosfera de Capsicum annuum L. antagónicas al desarrollo de Phytophthora capsici Leo. Revista Mexicana de Fitopatología 15:43–47. [ Links ]
Whipps, J.M. 2001. Microbial interactions and biocontrol in the rhizosphere. Journal of Experimental Botany 52:487–511. [ Links ]
Zheng, H.Z., Cui, C.L., Zhang, Y.T., Wang, D., Jing, Y., Kim, K.Y 2005. Active changes of lignification–related enzymes in pepper response to Glomus intraradices and/or Phytophthora capsici. Journal of Zhejiang University Science 6B:778–786. [ Links ]














