Introducción
En diciembre de 2019, las autoridades de salud en Wuhan, China, reportaron casos de neumonía viral severa de origen desconocido que estaban epidemiológicamente vinculados al mercado de mariscos en Wuhan. La secuenciación de muestras del tracto respiratorio reveló un nuevo coronavirus. La enfermedad se denominó posteriormente como enfermedad por coronavirus-19 (COVID-19) y el virus fue nombrado coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2)1. El 11 de marzo de 2020, la Organización Mundial de la Salud declaró pandemia y hasta la fecha se han alcanzado casi los seis millones de casos notificados en todo el mundo2. En nuestro país se han confirmado, a 24 de junio de 2020, 196,847 casos, de los cuales 5,753 son niños y adolescentes3.
Las principales características clínicas en los pacientes adultos son fiebre, tos seca, disnea, mialgia, fatiga, recuento leucocitario normal o leucopenia, y evidencia radiográfica de neumonía4. Los pacientes con COVID-19 en estado crítico desarrollan manifestaciones de shock, acidosis metabólica grave, algunos presentan insuficiencia hepática y/o renal además de lesión pulmonar severa. Las citocinas proinflamatorias y quimiocinas, incluido el factor de necrosis tumoral (TNF) alfa, la interleucina 1b (IL-1b), la IL-6, el factor estimulante de colonias de granulocitos y monocitos, la proteína 10 inducida por interferón gamma, la proteína-1 monocito quimioatrayente y los macrófagos inflamatorios están significativamente elevados5.
En el ámbito pediátrico se ha recogido una proporción de casos en torno al 1% con respecto a la población general, teniendo la mayoría de nuestros pacientes una sintomatología leve, como fiebre de corta duración6. La mayoría de los niños que han requerido atención hospitalaria son los menores de 3 años. En los casos graves presentan disnea con rápida progresión a síndrome de dificultad respiratoria aguda (SDRA), shock séptico, acidosis metabólica, alteraciones en la coagulación y falla orgánica múltiple. En la radiografía de tórax se observan imágenes radiopacas en parches múltiples y cambios intersticiales en la periferia del área pulmonar, consolidaciones pulmonares en casos severos, el derrame pleural se observa raramente. Se considera población pediátrica de alto riesgo a los niños con historia de contacto con casos severos de COVID-19 y los niños con condiciones subyacentes: cardiopatías congénitas, anomalías del tracto respiratorio, desnutrición grave, disminución de los niveles de hemoglobina, inmunodeficiencia y estados de inmunocompromiso, características que presentan con frecuencia los niños con padecimientos hematológicos7.
Manifestaciones clínicas
Desde los reportes iniciales de China se observaron diferencias en las manifestaciones clínicas de COVID-19 en pediatría comparado con el adulto. La primera diferencia fue el número de pacientes infectados. En un estudio de cohorte de 44,672 pacientes solo el 2.1% fueron menores de 20 años y solo el 1.2% fueron sintomáticos8. Con el paso del tiempo y la diseminación mundial de la enfermedad, se han presentado más casos de pacientes pediátricos, incluyendo neonatos hijos de madres con la infección por SARS-CoV-2, con una evolución a las formas graves más frecuente en menores de 1 año hasta en el 10.6%9.
Es frecuente que en los niños la infección por SARS-CoV-2 no se reconozca debido a que se presenta con manifestaciones leves e inespecíficas tales como hiporreactividad, cefalea, tos, congestión nasal, rinorrea y expectoración; la fiebre puede ser de bajo grado o incluso no estar presente. Diarrea, distensión y dolor abdominal, vómitos y rechazo al alimento son síntomas con los que frecuentemente inician los niños pequeños sin mostrar sintomatología respiratoria10,11. De acuerdo con las recomendaciones de la Chinese Medical Association, las manifestaciones clínicas se pueden clasificar según su gravedad12.
-
- Enfermedad leve:
-
- Enfermedad moderada:
-
- Enfermedad grave. Manifestaciones de enfermedad leve a moderada más alguna manifestación que sugiera progresión de la enfermedad.
Polipnea (> 70 respiraciones por minuto para < 1 año, > 50 respiraciones por minuto para > 1 año).
Hipoxia.
Deshidratación, dificultad para la ingesta, disfunción gastrointestinal.
Daño al miocardio.
Elevación de las enzimas hepáticas.
Pérdida de la consciencia, coma, convulsiones.
Alteraciones de la coagulación, rabdomiólisis o alguna otra manifestación de daño a órganos vitales.
-
- Enfermedad críticamente grave:
Recientemente, una de las formas más graves es similar a la enfermedad de Kawasaki (EK), con datos de enfermedad sistémica y conocido como síndrome pediátrico de inflamación multisistémica temporalmente asociado a SARS-CoV-2, caracterizado por fiebre persistente, eritema de labios, lengua de «fresa», eritema de mucosa oral y/o faríngea, hiperemia conjuntival, exantema, eritema y edema de manos y pies y descamación periungueal. La presentación puede ser con manifestaciones de choque, o muy similar a EK o bien con fiebre e inflamación persistente sin choque y sin criterios de EK13. No hay evidencia de transmisión vertical de SARS-CoV-2, sin embargo, sí hay reportes de neonatos infectados que se han identificado por alteraciones respiratorias, taquicardia, rechazo al alimento, irritabilidad. En la mayoría de ellos el nacimiento ha sido por parto eutócico, por lo que se ha sugerido que el contagio sucede al contacto con secreciones de la madre enferma14.
Alteraciones de laboratorio
La forma de confirmar la enfermedad es por la identificación de las partículas virales mediante la reacción en cadena de la polimerasa en tiempo real (RT-PCR) en hisopado nasofaríngeo, hoy el estándar de oro, pero es posible recuperarlo de secreción broncoalveolar obtenida por lavado bronquial, esputo, saliva e incluso en heces. El virus tiene un periodo de incubación de 2 a 14 días, aunque la mayoría de los casos se pueden identificar a los 3-7 días10,15.
Los exámenes de laboratorio pueden ser totalmente inespecíficos, sin embargo, hay algunas alteraciones que son constantes. Una vez que se ha confirmado el diagnóstico es importante identificar la cuenta de leucocitos y su diferencial; puede haber leucocitosis moderada, sin embargo, es importante identificar la presencia de linfopenia, que se asocia a una reacción inflamatoria pulmonar muy severa que ha inducido apoptosis de los linfocitos, asociado a proteína C reactiva y procalcitonina en valores normales16,17. Las plaquetas habitualmente son normales o discretamente disminuidas, pero la asociación a eventos trombóticos arteriales y venosos, ya sea en la microvasculatura o en vasos de mediano y gran calibre, puede llevar a una disminución moderada más alargamiento del tiempo de protrombina, elevación del fibrinógeno y aparición de productos de degradación de la fibrina y dímeros D (DD). Un DD ≥ 6 veces el valor basal se asocia a un peor pronóstico y si además se añade una elevación de troponina T, péptido natriurético y creatina fosfocinasa, coinciden con el peor pronóstico. La elevación de fosfatasa alcalina, deshidrogenasa láctica y alanina aminotransferasa son hallazgos frecuentes asociados a lesión multiorgánica. En los casos graves de COVID-19 la elevación de marcadores inflamatorios como la ferritina resulta en activación de la vasculatura pulmonar y células endoteliales por la IL-1, IL-6, TNF e interferón gamma juegan un rol importante en el proceso tromboinflamatorio pulmonar; todas estas citocinas pueden medirse con fin de establecer medidas terapéuticas específicas de blanco18,19.
La radiografía de tórax suele mostrar imágenes en «vidrio despulido» que se refuerzan ya sea mostrando zonas neumónicas localizadas o infiltrados difusos que coinciden con los acúmulos de fibrina intraalveolares. La infiltración inflamatoria subpleural es un hallazgo común en los niños, aun con enfermedad leve.
Hallazgos morfológicos
En Italia, la Fondazione Policlínico A. Gemelli de Roma ha reportado, tras la observación de frotis de sangre periférica, antes de tratamiento antiviral y/o antiinflamatorio, presencia de neutrofilia en un inicio con cambios morfológicos importantes como granulación tóxica, desviación a la izquierda, formas pseudo-Pelger y células apoptósicas. Estos cambios desaparecen con el inicio de tratamiento (Fig. 1). Tras el inicio del tratamiento, al presentarse una activación linfocitaria importante se evidencian cambios en los linfocitos, con presencia de polimorfismo: linfocitos grandes granulares, atípicos y formas linfoplasmocitoides. En relación con las plaquetas, puede presentarse tanto trombocitopenia como trombocitosis, y ambas pueden empeorar el pronóstico (Fig. 2)20. La presencia de síndrome de hiperinflamación con liberación descontrolada de citocinas inflamatorias puede producir un fenómeno de hemofagocitosis por proliferación de macrófagos (Fig. 3)21.
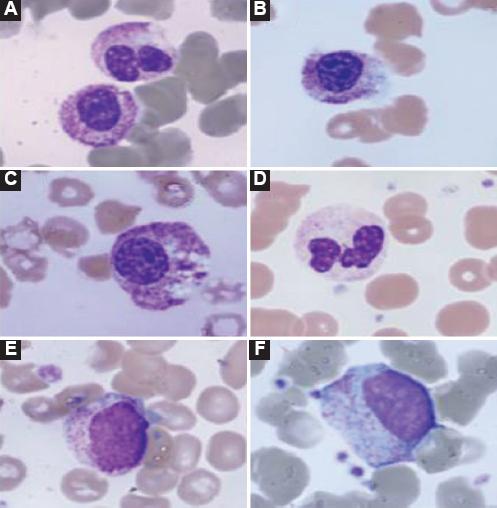
Figura 1 Presencia de anormalidades morfológicas de los neutrófilos. Los neutrófilos presentan granulaciones tóxicas y vacuolas citoplasmáticas (A, B y C) y, en ocasiones, ausencia de segmentación nuclear con formas de pseudo-Pelger (D), además cayados y desviación a la izquierda con mielocitos y metamielocitos (E y F).
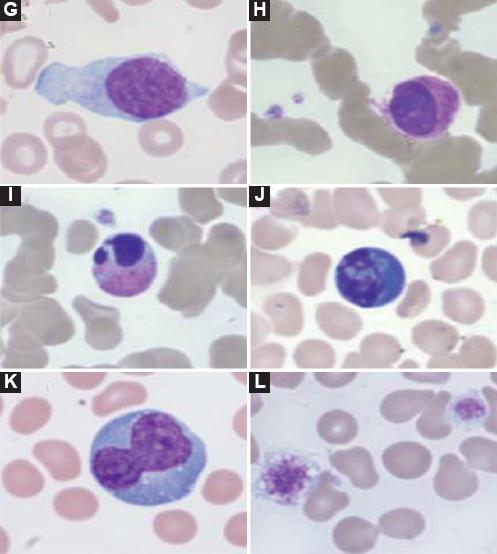
Figura 2 En relación con los linfocitos, se observa polimorfismo importante: células linfocitos grandes granulares, linfocitos atípicos (G, H), células apoptósicas (I, J) linfoplasmocitoides (K), megatrombocitos hipercromáticos (L).
Sospecha diagnóstica en el paciente pediátrico
Definición de caso
La posibilidad de COVID-19 debe considerarse principalmente en niños con fiebre, tos y/o dificultad respiratoria y cualquiera de los criterios de historia epidemiológica (historial de viajes o residencia en comunidades con alto contagio de COVID-19, o de contacto con personas infectadas con SARS-CoV-2 [con PCR positiva] dentro de los 14 días previos al inicio de la enfermedad).
Paciente con enfermedad respiratoria aguda grave que requiere hospitalización en ausencia de un diagnóstico alternativo que explique la presentación clínica y/o paciente con una condición médica crónica subyacente (cardiopatía congénita, enfermedad pulmonar, renal o hepática crónica, en tratamiento inmunosupresor o inmunocomprometido, por ejemplo, estado postrasplante) (Fig. 4)22-24.
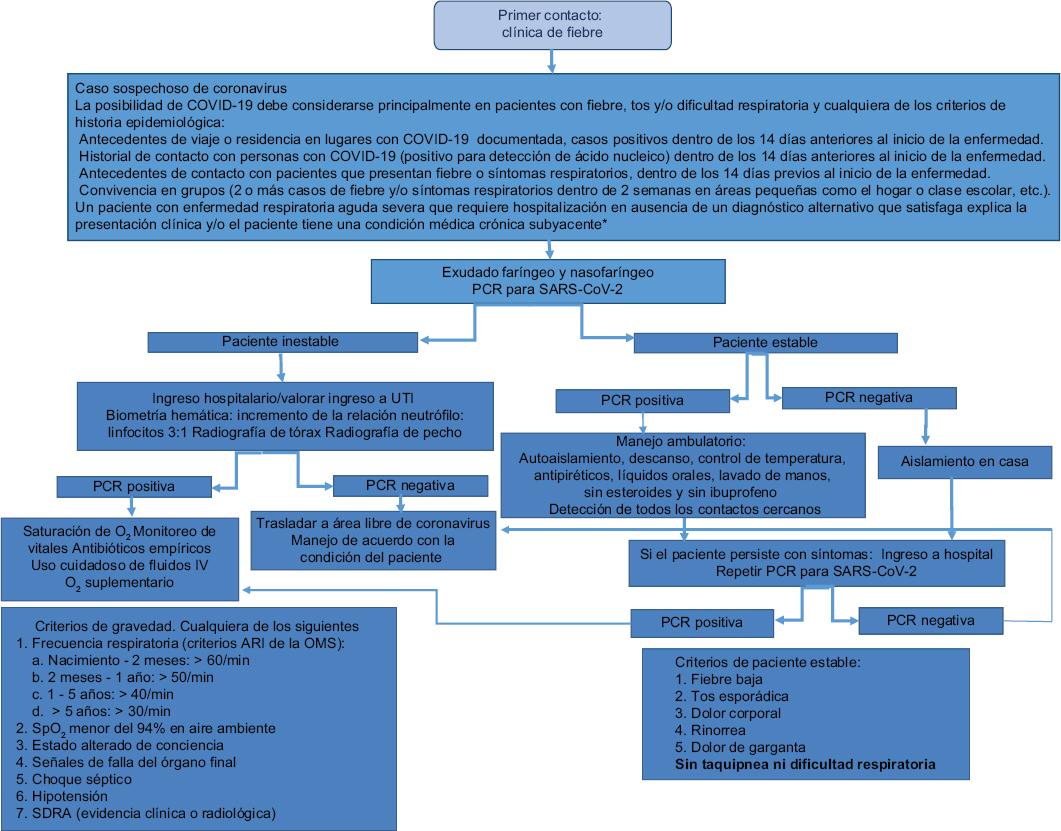
Figura 4 Algoritmo para sospecha diagnóstica en el paciente pediátrico. *Cáncer, inmunosupresión, enfermedades crónicas COVID-19: enfermedad por coronavirus 2019; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; UTI: unidad de terapia intensiva; PCR: reacción en cadena de la polimerasa; ARI: infección respiratoria aguda; OMS: organización Mundial de la Salud; SDRA: síndrome de dificultad respiratoria aguda; SpO2: saturación de oxígeno.
Criterios de sospecha
- Un niño que presenta fiebre persistente, inflamación (neutrofilia, PCR elevada y linfopenia) y evidencia de disfunción de uno o varios órganos (shock, cardiaco, trastorno respiratorio, renal, gastrointestinal o neurológico) con características adicionales. Esto puede incluir a niños que cumplan criterios completos o parciales para EK.
- Exclusión de cualquier otra causa microbiana, incluyendo sepsis bacteriana, estafilococos o síndrome de choque estreptocócico, e infecciones asociadas con miocarditis, como el enterovirus.
- Las pruebas de PCR de SARS-CoV-2 pueden ser positivas o negativas23-25.
Es importante para el diagnóstico de un caso sospechoso de COVID-19 la realización de una historia clínica detallada y usar juicio clínico adecuado. Las coinfecciones pueden ser más comunes en los niños. Los niños inmunocomprometidos pueden estar predispuestos a infecciones graves por coronavirus. La presencia de un copatógeno y factores del huésped, incluido un estado inmunocomprometido, se asociaron con un mayor riesgo de gravedad. Reconocer los factores de riesgo de enfermedad respiratoria grave podría ayudar en la estratificación del riesgo26.
Tratamiento de pacientes ambulatorios (Fig. 5)
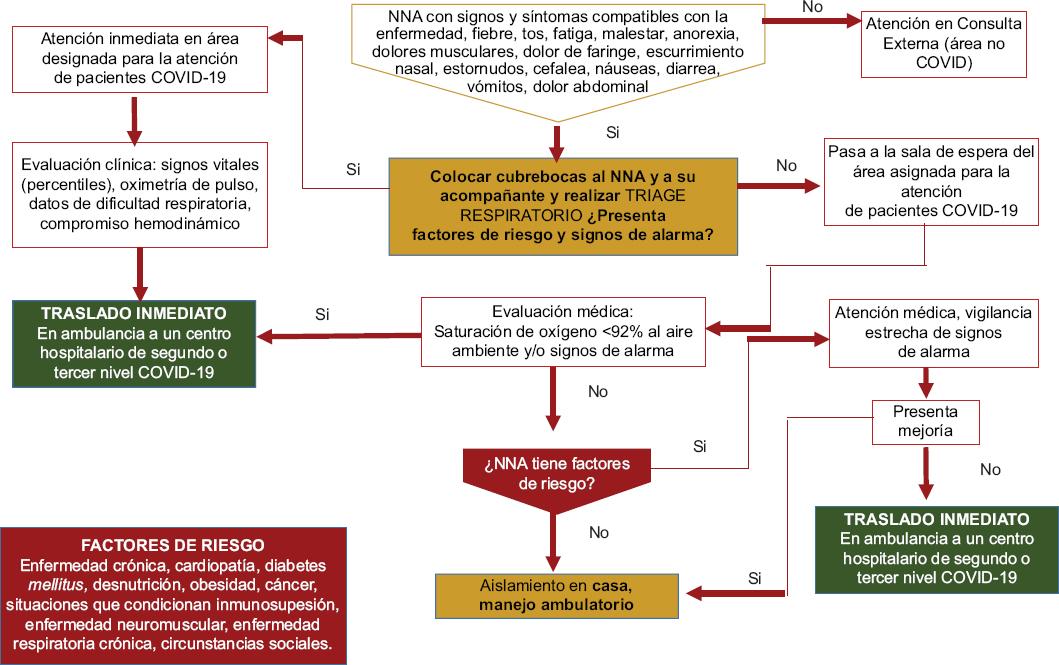
Figura 5 Algoritmo para tratamiento de pacientes ambulatorios. COVID-19: enfermedad por coronavirus 2019; NNA: niños, niñas y adolescentes.
Educación de los responsables sobre los datos de alarma
- Asegurar hidratación adecuada.
- En caso de fiebre: utilizar medios físicos y/o paracetamol 10-15 mg/kg/dosis cada 6 u 8 horas.
- Los lactantes deben continuar con lactancia materna y alimentación propia para la edad. Si presentan datos de alarma acudir inmediatamente a la unidad de salud. Consulta de seguimiento a las 24 horas (niños, niñas, adolescentes con factores de riesgo).
Signos de alarma
-
- Datos de dificultad respiratoria:
- Datos de hipoperfusión tisular: alteración en el estado de alerta (irritabilidad), llenado capilar prolongado, palidez, coloración marmórea, extremidades frías.
- Hipotensión arterial (presión arterial sistólica < percentil 5 o > a 2 desviaciones estándar por debajo de lo normal para la edad).
- Vómitos o diarrea persistente, confusión, letargo, descontrol glucémico27-29.
Tratamiento de pacientes hospitalizados (Fig. 6)
La infección por SARS-CoV-2 ha contribuido a una mortalidad significativa de forma mundial, afectando hasta en un 1.7% a pacientes pediátricos (< 18 años)30. Según reportes en China, en niños la COVID-19 se presenta de forma menos grave31, sin embargo, las alteraciones en la coagulación se han descrito como una complicación asociada frecuente y de gran importancia32. En estudios recientes, entre el 20 y el 55% de los pacientes hospitalizados secundario a infección por SARS-CoV-2 presentaron evidencia de alteraciones hematológicas, siendo la más importante la coagulación intravascular diseminada de predominio protrombótica y encontrando una incidencia del 25% de trombosis venosa profunda en estos pacientes33. Actualmente están surgiendo guías internacionales sobre el papel potencial de la anticoagulación de forma profiláctica para prevenir esta complicación34. Las guías provisionales para el reconocimiento y tratamiento de coagulopatía por COVID-19 de la International Society on Thrombosis and Haemostasis (ISTH) recomiendan que en pacientes con valores de DD elevados de tres a cuatro veces el valor normal y en pacientes pediátricos (menores a 21 años) con valores de DD mayores a 5,000 mg/l se deberá iniciar terapia anticoagulante de forma profiláctica o terapéutica según las condiciones clínicas del paciente, ya que el aumento de DD representa aumento de la generación de trombina y es predictor del desarrollo del SDRA.
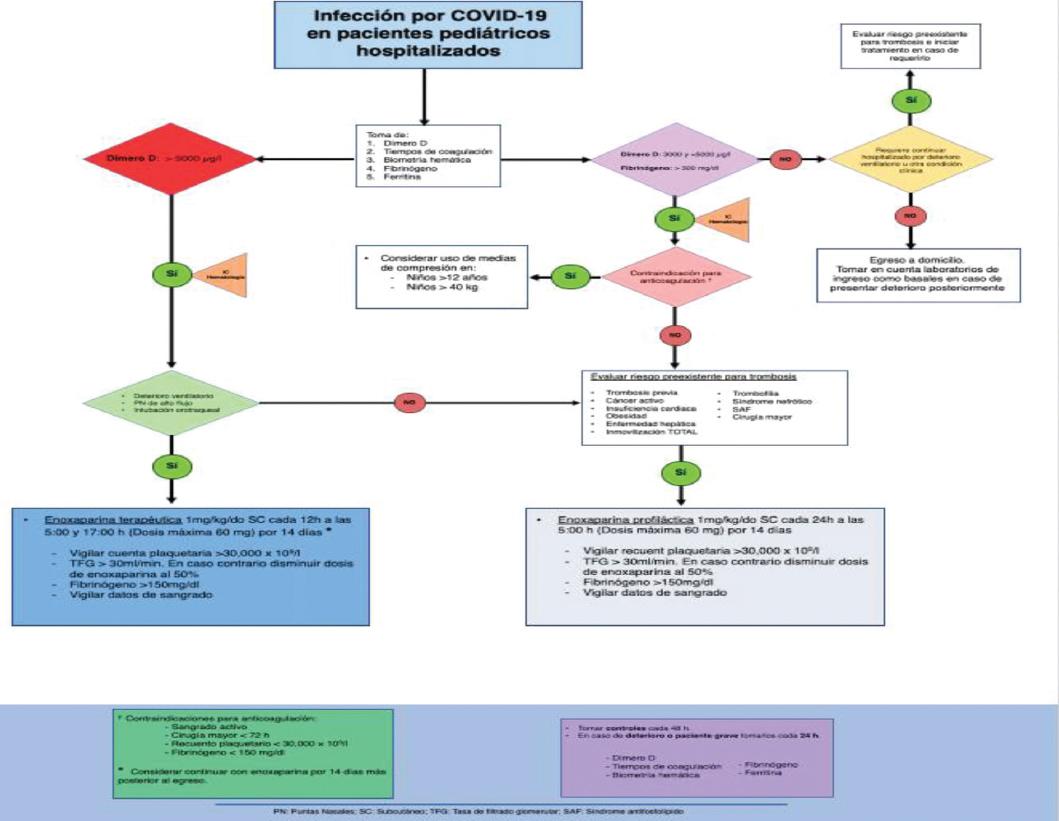
Figura 6 Algoritmo para tratamiento de pacientes hospitalizados. *Considerar continuar con enoxaparina por 14 días más posterior al egreso. †Contraindicaciones para anticoagulación: sangrado activo, cirugía mayor < 72 h, plaquetas < 30,000 x 109/l, fibrinógeno < 150 mg/dl. PN: puntas nasales; SC: subcutáneo; TFG: tasa de filtrado glomerular; IC: insuficiencia cardiaca; SAF: síndrome antifosfolípido.
En cuanto al tratamiento, la heparina de bajo peso molecular (HBPM) es la de elección, ya que se encuentra ampliamente disponible y se ha demostrado que además de funcionar como profilaxis y tratamiento para trombosis, tiene propiedades antiinflamatorias que pueden ser un beneficio adicional en la COVID-19 ante un incremento importante de las citocinas proinflamatorias35.
Anticoagulación en niños con infección por SARS-CoV-2
Los eventos tromboembólicos en niños tienen una baja incidencia. Estudios realizados por Raffini, et al. han reportado una incidencia anual de 34 a 58 por cada 10,000 admisiones hospitalarias y de 5.1 por cada 100,000 en neonatos. Cuando ocurren generalmente se presentan en pacientes hospitalizados con factores de riesgo como las infecciones graves, estados proinflamatorios, cardiopatía, cáncer, deshidratación, eventos quirúrgicos, politraumatismo, inmovilidad, uso de accesos vasculares y trombofilia hereditaria o adquirida36.
Debido a que la infección por SARS-CoV-2 se trata de un nuevo padecimiento, la información reportada está sujeta a constante actualización a medida que avanzan los reportes de casos. Las recomendaciones de la terapia antitrombótica han sido extrapoladas de las de adultos. Sin embargo, el tratamiento anticoagulante en neonatos y niños difiere en diversos aspectos, debido a variaciones ontogénicas de la hemostasia que afectan tanto a la fisiopatología de los procesos trombóticos como a la respuesta a los fármacos antitrombóticas por diferencias farmacocinéticas y farmacodinámicas.
Las HBPM se han convertido en el anticoagulante de elección en pediatría. Tanto para profilaxis como para tratamiento, la dosis se ajusta de acuerdo con la indicación clínica y la edad (Tabla 1).
Tabla 1 En el paciente pediátrico la dosis de heparina de bajo peso molecular (el anticoagulante de elección) se ajusta de acuerdo con la indicación clínica y la edad
| Dosis de enoxaparina según la edad | Tratamiento | Profilaxis |
|---|---|---|
| Paciente | ||
| < 2 meses | 1.5 UI/kg/do cada 12 h | 0.75 UI/kg/do cada 12 h |
| > 2 meses | 1. UI/kg/do cada 12 h | 0.5 UI/kg/do cada 12 h |
Las indicaciones de anticoagulación sugeridas en pacientes con COVID-19 se muestran en la tabla 2.
Tabla 2 Indicaciones de anticoagulación sugeridas en pacientes pediátricos con enfermedad por coronavirus 2019 (COVID-19)
| Recomendaciones para anticoagulación en niños y COVID-19 | |
|---|---|
| Paciente con COVID-19 y clasificación clínica de infección grave y/o algunas de las siguientes condiciones | |
|
Indicaciones para prevención tromboembolia (dosis
profilácticas)
- Todo paciente con COVID-19 grave, ingresado a unidad de cuidados intensivos - Cuadro clínico similar a enfermedad de Kawasaki en el que se documente afección cardiaca - Trombofilia hereditaria y/o adquirida |
Indicaciones para dosis terapéutica de
anticoagulantes
- Cuadro sugestivo de síndrome de shock tóxico o síndrome inflamatorio multisistémico asociado a COVID-19 - Evidencia por estudio de imagen de tromboembolia venosa o arterial en extremidades, microangiopatía, EVC o trombosis asociada a catéter central o tromboembolia pulmonar - Miocardiopatía, valvulopatía, prótesis valvulares - Pacientes que ya recibían anticoagulación oral previo a la infección se sugiere continuar de manera parenteral - Falla multiorgánica - Coagulación intravascular diseminada - Otros: PCR > 15, dímero-D > 1,500 ng/ml o elevación de 4 veces su nivel basal en ausencia de otro hallazgo, IL-6 > 40, ferritina > 1,000, linfopenia < 800 |
EVC: evento vascular cerebral; PCR: proteína C reactiva.
Cuando se utiliza anticoagulación a dosis profilácticas, se sugiere emplearla hasta que el paciente sea egresado de la unidad de terapia intensiva, es decir, cuando se encuentre estable hemodinámicamente y sin afectación de los parámetros hemostásicos. Si la anticoagulación fue terapéutica, el tiempo de anticoagulación va de 3 a 6 meses según el evento subyacente que provocó la trombosis o la resolución del estado de hipercoagulabilidad37-40.
Consideraciones especiales para pacientes pediátricos con enfermedades hematológicas
La mayor parte de las recomendaciones para niños con enfermedades hematológicas han sido presentadas por hospitales y organizaciones del primer mundo (International Society of Paediatric Oncology, Grupo de Oncología Infantil, International Pediatric Surgical Oncology Association, St. Jude Global), por lo que es posible que no se puedan llevar a cabo plenamente por las circunstancias que vivimos en nuestro país, además, estas recomendaciones no cuentan por razones obvias con el mejor nivel de evidencia41.
Las guías hacen hincapié en cuidar tanto la salud de los niños y sus familias como la del personal de salud involucrado en su atención. La coincidencia más importante de la mayor parte de lo publicado es que hasta donde sea posible y de acuerdo con las condiciones de cada país y/o centro de atención, los procesos de diagnóstico, tratamiento y medidas de soporte de los niños con cáncer no se vean afectadas. En nuestro país, como todos ustedes saben, habrá que agregar el muy complicado acceso a los diferentes fármacos quimioterapéuticos.
No obstante las recomendaciones internacionales, los datos obtenidos mediante encuestas realizadas en Latinoamérica muestran un retraso en consultas y principalmente en cirugías, tratamientos de radioterapia y procedimientos ambulatorios42.
Parece razonable sugerir que las modificaciones que pudieran establecerse se lleven a cabo de manera colegiada entre los miembros del equipo. Los cambios y diferimientos serán más frecuentemente realizados en los procedimientos, consultas y tratamiento de pacientes con padecimientos no urgentes.
Imposible detallar en un espacio tan breve recomendaciones precisas a propósito de la emergencia de la pandemia en nuestros pacientes, la información publicada por médicos italianos en la región más afectada de ese país muestra datos de mucha importancia que nos pueden ser de utilidad43.
Finalmente, en niños con leucemias y linfomas se recomienda, como se mencionó arriba, llevar a cabo los procedimientos diagnósticos y de tratamiento de la manera más oportuna posible y realizando el menor número de modificaciones de acuerdo con las necesidades y carencias de cada centro. En las circunstancias actuales de la pandemia en nuestro país, con la problemática de abasto y la muy probable sobreocupación de camas hospitalarias, estaremos enfrentando seguramente todos nosotros un reto mayúsculo en los siguientes meses.
Conclusiones
La infección por SARS-CoV-2 ha causado miles de muertes en todo el mundo. Los niños en todas las edades son susceptibles de contraer la infección y aquellos con enfermedades subyacentes son quienes más comúnmente presentan manifestaciones graves44. Los síntomas son muy variables en este grupo, presentándose portadores asintomáticos, síntomas respiratorios leves a moderados, con tos seca asociada o no a fiebre, fatiga, congestión nasal, dolor abdominal, vómitos, etc. En más del 50% la fiebre con tos y respiración entrecortada se observan al inicio45. El número de pacientes graves es significativamente menor al observado en adultos, teniéndose reportes de que solo el 5% de los infectados presentan hipoxemia o disnea, con progresión a síndrome de insuficiencia respiratoria o falla multiorgánica en solo el 0.6%9,46. Otros autores han reportado frecuencias más altas de complicaciones, con desarrollo de síndrome inflamatorio multisistémico22, síndrome hemofagocítico secundario, etc. Existen diferentes hipótesis para explicar la diferencia en la presentación y gravedad en niños, como son las diferencias del sistema inmunitario (madurez), competición e interacciones virales en la mucosa de la vía aérea que pudiera contener el crecimiento del SARS-CoV-2, diferencias en la expresión del receptor de la enzima convertidora de angiotensina (necesaria para la fijación del virus), y las diferencias en las características fenotípicas y funcionales del sistema inmunitario, pues con la edad existe disminución progresiva de la capacidad inmunitaria que conlleva respuestas inmunológicas más débiles y altera la capacidad de responder a nuevos estímulos47,48. El diagnóstico se establece mediante las características epidemiológicas y clínicas, empleo de la prueba de RT-PCR para SARS-CoV-2 y empleo de pruebas serológicas (inmunoglobulina [Ig] G e IgM)44, encontrándose que a diferencia de los adultos, la tomografía muestra patrones atípicos, con una extensión de la imagen de vidrio despulido más delimitada y rara vez engrosamiento septal interlobar49. Debido a las múltiples complicaciones en los grupos de pacientes que desarrollan la enfermedad, se han realizado recomendaciones de acuerdo con situaciones específicas, como en los recién nacidos de madres con infección50,51, en pacientes con neoplasias hematológicas41, en niños y adolescentes con leucemia52, en pacientes pediátricos con diferentes tipos de neoplasias53, pacientes con lesión renal aguda secundaria54, pacientes con diabetes55, pacientes con enfermedades reumatológicas y terapias biológicas56, pacientes con hemofilia57, etc. Para los pacientes con manifestaciones graves se han empleado diferentes estrategias terapéuticas, como se ha mencionado en el presente artículo, teniéndose mayor experiencia en pacientes adultos por las cuestiones epidemiológicas ya comentadas. El uso de remdesivir ha arrojado resultados iniciales satisfactorios58, para el control de la tormenta de citocinas y el síndrome hemofagocítico secundario se ha empleado ruxolitinib, mostrando utilidad al mejorar variables hematológicas y radiológicas59, y estudios clínicos con empleo de anakinra, tozilizumab, siltuximab y sarilumab están en desarrollo60: Las recomendaciones para anticoagulación se pueden extrapolar a la edad pediátrica, considerándose útil solo en aquellos pacientes hospitalizados, con enfermedad moderada a grave, con factores de riesgo protrombóticos y con un incremento significativo del DD44,61. Existen aún muchas incógnitas en el tratamiento adecuado de la infección por SARS-CoV-2, siendo indispensable el manejo multidisciplinario, considerando los múltiples órganos y sistemas que pueden afectarse en la presentación moderada y grave de la enfermedad. La intervención oportuna y apropiada del médico pediatra y de los especialistas en diversas ramas de la pediatría (terapia intensiva, neumología, infectología, hematología, inmunología, etc.) son esenciales para lograr un mejor pronóstico.











 nueva página del texto (beta)
nueva página del texto (beta)



