Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Gaceta médica de México
versão On-line ISSN 2696-1288versão impressa ISSN 0016-3813
Gac. Méd. Méx vol.141 no.2 Ciudad de México Mar./Abr. 2005
Ejercicio clínico patológico
Mujer de 43 años de edad con deterioro funcional, disnea de reposo y dolor transfictivo de hemitórax derecho
A forty–three year old female with functional deficit, resting dyspnea and right hemitorax pain
Lorenza Martínez Gallardo–Prieto,* Roberto Arriaga–Nava,** Eliseo Espinosa–Poblano,*** Bernardo Cruz–Alonso,**** José Halabe–Cherem*****
Coordinador:
Dr. Manuel de la Llata Romero
Colaboradores:
Dr. Juan Urrusti Sanz
Dr. Jesús Aguirre García
Dr. Roberto Sánchez Ramírez
* R4 de Medicina interna, Hospital de Especialidades.
** Médico de base del Servicio de Urgencias, Hospital de Cardiología.
*** Médico de base del Servicio de Neumología, Hospital de Cardiología.
**** Médico de base del Servicio de Radiología, Hospital de Especialidades.
***** Departamento de Medicina Interna, Hospital de Especialidades.
Todos adscritos al Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social.
Correspondencia y solicitud de sobretiros:
Dra. Lorenza Martínez Gallardo–Prieto
R4 de Medicina interna, Hospital de Especialidades, Centro Médico Nacional Siglo XXI
Instituto Mexicano del Seguro Social. Av. Cuauhtémoc 330, Col. Doctores, 06725 México D. F.
Mujer de 43 años de edad con disnea de reposo y dolor transfictivo de una semana de inicio. Además con fatiga, astenia, adinamia, disnea de medianos esfuerzos y tos con expectoración blanquecina de dos meses de evolución. Presentó, una semana antes de su ingreso, disnea de pequeños esfuerzos acompañada de dolor torácico derecho, de tipo transfictivo, 7/10 en intensidad, que aumentaba con la inspiración. Acudió con un médico particular quien le indicó un antiinflamatorio no esteroideo con lo que disminuyó parcialmente su sintomatología, razón por la que acudió a Urgencias del Hospital de Cardiología del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social.
Entre los antecedentes de importancia destacan los siguientes:
• Aborto espontáneo hace 20 años.
• Insuficiencia venosa periférica (IVP) desde hace 16 años, en tratamiento con Acenocumarina.
• Trombosis venosa profunda(TVP) hace 16 años.
• Evento de tromboembolia pulmonar (TP) hace 3 años con centellograma perfusorio confirmatorio.
En vigilancia por el servicio de Neumología del Hospital de Cardiología del Centro Médico Nacional Siglo XXI desde el 2002 por TEP, IVP ,TVP e insuficiencia respiratoria tipo I. Pendiente el estudio de coagulación en su Hospital General de Zona.
A su llegada al hospital TA 90/60, FC 98x' y FR 31 x', tinte ictérico, ingurgitación yugular grado II, campos pulmonares con ausencia de murmullo vesicular en base derecha, ruidos cardíacos con aumento en frecuencia, rítmicos, de buena intensidad, sin fenómenos agregados; no hay hepato ni esplenomegalia.
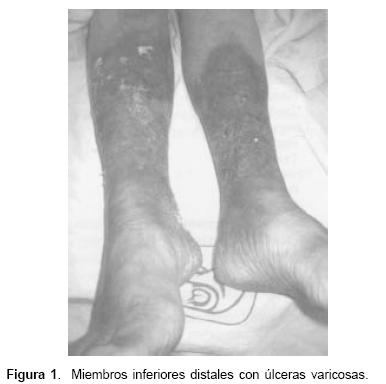
Extremidades hipotróficas, con cianosis periférica 3+, y uñas en vidrio de reloj. Miembros inferiores distales con úlceras varicosas en región anterior, piel de coloración ocre (Figura 1). Pulsos disminuidos en intensidad. Llenado capilar, seis segundos.
Estudios de laboratorio a su ingreso: creatinina l.4, hemoglobina 16.2 g/dL, hematocrito 51.8%, leucocitosis 12,400/uL, plaquetas 51,900, tiempo de trombina 16 segundos y protrombina 92 segundos. Gasometría con pH de 7.39, PCO2 27.3, PO2 27, HCO3 16.7 y saturación de O2 de 52.4%.
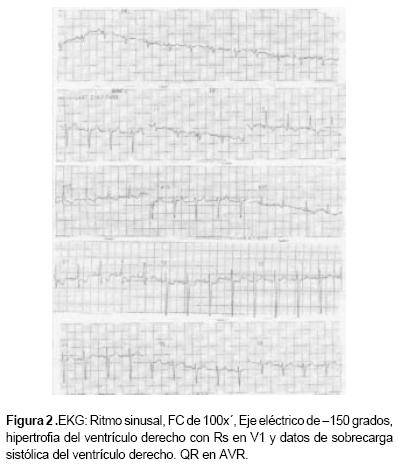
Electrocardiograma a su ingreso con ritmo sinusal, FC de 100x', Eje eléctrico de –150 grados, hipertrofia del ventrículo derecho con Rs en V1 y datos de sobrecarga sistólica del ventrículo derecho. QR en AVR (Figura 2).
La radiografía de tórax mostró cardiomegalia grado II, y zona de oligohemia parahiliar derecha.
Se realizó ecocardiograma transtorácico que mostró dilatación de cavidades derechas y del anillo pulmonar, insuficiencia tricuspídea moderada y movimiento paradójico tipo A del septum. Presión de la arteria pulmonar de 105 mmHg, fracción de eyección del ventrículo izquierdo 77%.
La tomografía helicoidal reveló imagen hipodensa de 79 UH localizada en la porción proximal de la arteria pulmonar derecha, con diámetro aproximado de 75 mm, así como trombosis parcial de la arteria pulmonar izquierda. Dimensión del tronco de la arteria pulmonar de 31 mm, el de la rama derecha de 24 mm y el de la izquierda de 21 mm. El cayado de la vena ácigos ectásico y cardiomegalia a expensas del ventrículo derecho(VD).
El pulmón derecho mostró 2 imágenes densas, amorfas, de localización subpleural, situadas en el lóbulo superior. El pulmón izquierdo sin alteraciones. (Figuras 3 a 6).
Se decide su ingreso a la Unidad Coronaria (UC) del mismo hospital.
En la UC se solicita interconsulta al servicio de Hematología del HE quien solicitó pruebas de coagulación especial (PCE1), anticardiolipina (ACC) y anticoagulante lúpico (AL) (Cuadro I).

Con estos resultados se hizo el diagnóstico de síndrome antifosfolípido.
La paciente fue sometida a cateterismo para colocación de un filtro en la vena cava inferior (VCI), sin éxito por intensa trombosis de la misma.
Comentario
El caso presentado corresponde al de una mujer portadora de trombofilia, con antecedente de TVP y úlceras venosas, quien acude al Servicio de Urgencias por una TEP crónica agudizada a consecuencia de un problema tromboembólico venoso (TEV); con diagnóstico final de trombofilia secundaria a síndrome antifosfolípido.
La trombofilia se define como una condición, hereditaria o adquirida en que, por presentarse con un estado de hipercoagulabilidad, hay predisposición al desarrollo de fenómenos tromboembólicos.1,2
El cuerpo mantiene un estado de hemostasis gracias a un balance delicado entre coagulación, anticoagulación, formación de coágulo y lisis. Existen tres componentes principales para el mantenimiento de esta homeostasis: plaquetas, factores de coagulación y vasculatura.3
En las trombofilias existe pérdida de este balance secundaria a una alteración en alguno de los componentes que participan en la coagulación.
Podemos usar la pnemotecnia CALM SHAPES para recordar las principales causas de trombofilia:
• Deficiencia de proteína C
• Deficiencia de Antitrombina III
• Resistencia a proteína C: factor V de Leiden
• Neoplasias (Malignancy)
• Deficiencia de proteína S
• Homocisteinemia
• Anticuerpos Antifosfolípido
• Embarazo (Pregnancy)
• Elevación del factor VIII
• Plaquetas pegajosas (Sticky platelets)
Debe sospecharse el diagnóstico de trombofilia en las siguientes situaciones:
• Presentación clínica de trombos sin factores predisponentes conocidos
• Historia familiar de trombofilia
• Presentación clínica sugestiva de trombofilia en menores de 30 años
• Más de un episodio de trombosis
• Abortos espontáneos recurrentes4
Las manifestaciones clínicas más comunes en trombofilia son la TVP y la TEP, las cuales son secundarias a la enfermedad TEV.4,5
Las trombofilias son un factor de riesgo conocido para TVP el cual a su vez es un factor de riesgo mayor para úlceras venosas crónicas (UVC).2,6
Los pacientes con UVC tienen una prevalencia de trombofilia de 41%; esto es 30 veces más alto que la población general.6
Se necesitan múltiples pruebas de coagulación e inmunoquímica para demostrar la presencia de una trombofilia específica.
En estos pacientes se deben de hacer los siguientes exámenes de laboratorio: tiempos de coagulación que valoren la vía intrínseca, extrínseca y común de la coagulación; determinación de plaquetas y pruebas de coagulación especial para distinguir entre presencia de inhibidores de la coagulación y deficiencia de factores de coagulación.
En pacientes con tiempos de coagulación prolongados en quienes existe deficiencia de algún factor de la coagulación, esperaríamos que al agregar plasma normal al plasma de nuestro paciente, los tiempos se corregirían, debido a que se requiere menos de 50% del factor de coagulación para que éste haga su efecto procoagulante. Si no lo corrige nos hablaría de la presencia de un inhibidor.
Para corroborar o descartar que nuestro inhibidor es dependiente de fosfolípidos, comparamos tiempos de coagulación a diferentes diluciones de reactivo de fosfolípido, repitiendo la prueba de coagulación después de agregar al sistema fosfolípidos adicionales. Esta prueba, al no estar estandarizada para un porcentaje de corrección indicativo de anticoagulante lúpico, es únicamente orientadora.7
Después de estos estudios se deberán hacer pruebas específicas para la trombofilia que resulte más probable una vez analizados los antecedentes familiares, clínicos y pruebas iniciales de laboratorio.
A pesar del avance en el diagnóstico por laboratorio de hipercoagulabilidad, estados predisponentes a trombofilia sólo se identifican en la minoría de los pacientes con TEV. Por lo tanto, es de suma importancia la historia familiar detallada para asegurar que portadores de genes procoagulantes nunca desarrollen TVP o TEP.8
El síndrome antifosfolípido (SAFF) es un síndrome adquirido en donde se producen anticuerpos (Ac.) que se unen a antígenos de fosfolípidos con carga negativa.9 Recientemente se ha sugerido que estos anticuerpos están dirigidos hacia la beta2 glicoproteína 1.10
Los anticuerpos antifosfolípido son un grupo amplio y heterogéneo de inmunoglobulinas que incluye, entre otras, (AAC) y (AL).4,2,10–12 Los AAC pueden ser IgM o IgG, rara vez IgA. IgG se considera el más patogénico.2,10,11
Este síndrome se asocia con trombosis tanto venosas como arteriales y complicaciones obstétricas.9,11
Los ACC parecen promover la trombosis por medio de un número de diferentes, mal definidos, mecanismos. Éstos incluyen agregación plaquetaría, inhibición de antitrombina y proteína C y estimulación del factor tisular y/o sulfato heparan en el endotelio.2,10 El AL es también, un claro predisponente para eventos trombóticos.11
El SAFF es el estado de hipercoagulabilidad que implica un mayor riesgo para TEP. Anatómicamente, grandes y recurrentes TEV, son la manifestación clínica más común. El aumento en AAC también se ha asociado con infarto al miocardio, infartos cerebrales y abortos espontáneos en el primer trimestre.8
Los signos y síntomas de TEP son inespecíficos. No existe una prueba de laboratorio que muestre evidencia específica para TEP. Su diagnóstico depende de los estudios de imagen. La tomografía helicoidal es una nueva y altamente sensible estrategia para el diagnóstico de TEP.5
Los criterios primarios para el diagnóstico de SAFF son:
Clínicos
• Trombosis vascular
– uno o más episodios clínicos de trombosis arterial, venosa o de pequeños vasos que ocurra en cualquier tejido u órgano.• Complicaciones del embarazo
– una o más muertes inexplicables de fetos morfológicamente normales en o después de la décima semana de gestación (SDG).
– uno o más nacimientos prematuros de neonatos morfológicamente normales durante o antes de las 34 SDG.
– tres o más abortos espontáneos consecutivos, inexplicables, antes de las 10 SDG.
Laboratorio
• Anticuerpos anticardiolipina
– AAC IgG o IgM presentes en la sangre en moderados o altos niveles, en 2 o más ocasiones con seis semanas de separación.• Anticoagulante lúpico
– Detectados en sangre en 2 o más ocasiones con 6 semanas de separación
Para el diagnóstico de SAFF se debe de contar con al menos un criterio clínico y uno de laboratorio.
Si no hay una enfermedad autoinmune subyacente se considera SAFF primario. Si la hay, por ejemplo lupus eritematoso sistémico, SAFF secundario.12,18
Existe controversia en el uso de anticoagulantes en el paciente con SAFF asintomático. Presentamos las siguientes recomendaciones terapéuticas:
1. Primer infarto cerebral confirmado objetivamente, AAC o AL positivos.
—Usar ácido acetilsalicílico (ASA) o anticoagulantes orales (AO) hasta llegar a un INR de 2.0 a 3.0.(7,13)2. Trombosis arterial no cerebral confirmada objetivamente, ACC o AL positivos.
—Usar AO para llegar a un INR de 2.0 a 3.0 + ASA 81mg/día.14–16.3. Primera trombosis venosa objetivamente confirmada, ACC o AL positivos.
—Usar AO para llegar a un INR de 2.0–3.0.15,144. Cualquier trombosis recurrente a pesar del tratamiento sugerido se desconoce. El tratamiento puede incluir AO a más altas dosis para llegar a un INR mayor de 3.0 o heparina de bajo peso molecular.10,13,17,19
Normalmente la TEP se resuelve exitosamente con fibrinólisis. El manejo médico para la TEP crónica, en cambio, es limitado. Recientemente el manejo quirúrgico ha cobrado importancia. La tromboendarterectomía por esternotomía media bajo estado de hipotermia y paro circulatorio, se ha realizado en ocho pacientes con SAFF, Deficiencia de proteína C y de antitrombina III, obteniendo buenos resultados clínicos.20
Referencias
1. Terence W, Hassouna H. Hypercoagulable states. Hematol Oncol Clin N Am 2000;14(2):355–377. [ Links ]
2. Bradbury AW, Mackenzie RK, Burns P, et al. Thrombophilia and Chronic Venous Ulceration, Eur J. Vasc Endovasc Surg 2002;24:97–104. [ Links ]
3. Iskander G, Cheng Y. Fundamentals of normal hemostasis. Ann Clin N Am 1999;17(4):715–731. [ Links ]
4. Hellman M. Thrombophilias: an overview. Prim Care Update Ob/Gyns 2002;9(6):226–230. [ Links ]
5. López–Baret P, Piuto JM, Romero A. Systematic Study of occult pulmonary thromboembolism in patients with deep venous thrombosis. J Vasc Surg 2001;33:515–521. [ Links ]
6. Mackinzie RK, Ludlam CA, Ruckley CV. The prevalence of thrombophilia in patients with chronic venous leg ulceration. J.Vasc Surg 2002;35:718–722. [ Links ]
7. Derksen RHWM, Groot PG. Tests for lupus anticoagulant revisited. Thromb Research 2004; article in press: 1–7 [ Links ]
8. Goldhaber SZ. Pulmonary Embolism. Lancet 2004;363:1295–1305. [ Links ]
9. Wilson W. Classification criteria for antiphospholipid syndrome. Rheum Dis Clin 2001;27(3):499–505. [ Links ]
10. Burns PJ, Mosquera DA, Bradbury AW. Prevalence and significance of thrombophilia in Peripheral Arterial Disease. Eur J. Vasc Endovasc Surg 2001;22:98–106. [ Links ]
11. Gali M. Antiphospholipid antibodies and thrombosis: do test patterns identify the patients risk? Thromb Research 2004; article in press: 1–5 [ Links ]
12. Wisloff F, Jacobsen E, Liestol S. Laboratory diagnosis of the antiphospholipid syndrome. Thromb Research 2003;108:263–271. [ Links ]
13. Crowther MA, Wisloff F. Evidence based treatment of antiphospholipid syndrome II. Optimal anticoagulant therapy for thrombosis. Thromb Research 2004; article in press: 1–5 [ Links ]
14. Crowther MA, Ginsberg JS, Gent M, et al. A randomized trial of two intensities of warfarin for the prevention of recurrent thrombosis in patients with antiphospholipid antibodies. N Engl J Med 2003;349:1133–1138. [ Links ]
15. Finazzi G, Marchioli R, Barbui T. A randomized clinical trail of oral anticoagulant therapy in patients with antiphospholipid antibody syndrome: the WAPS study. J.Thromb Haemost 2003;1(51):OC365. [ Links ]
16. Hurlem M, Abdelnoor M, Smith P, et al. Al. Warfarin, aspirin or both after myocardial infarction. N.Engl J Med 2002;347(13):969–974. [ Links ]
17. Crowther MA. Anticoagulant therapy for the thrombotic complications of the antiphospholipid antibody syndrome. Thromb Research 2004; article in press: 1–4 [ Links ]
18. Wilson WA, Gharavia AE, Koike T, et al. International Consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum 1999;42(7):1309–1311 [ Links ]
19. Levin SR, Brey RL, Tilley BC. Antiphospholipid antibodies and subsequent thrombo–occlusive events in patients with ischemic stroke. JAMA 2004;291:576–584. [ Links ]
20. Ando M, Takamoto S, Okita Y, et al. Operation for Chronic Pulmonary Thromboembolism Accompanied by Thrombophilia in 8 patients. Ann Thorac Surg 1998;66:1919–1924. [ Links ]














