Introducción
La fusariosis de la espiga de trigo (FET) en cereales de grano pequeño es una enfermedad devastadora en el mundo, que disminuye la calidad, el peso y los hidratos de carbono y proteínas de los cereales; comprometiendo así el rendimiento y la calidad de la producción de granos y la salud de los consumidores a través de la producción de micotoxinas asociadas (Bai et al., 2001). El uso de granos infectados puede modificar, además, la producción de pan porque los metabolitos producidos por el hongo inhiben el crecimiento y la actividad enzimática de la levadura (Saric et al., 1997). Los principales agentes etiológicos de FET son Fusarium graminearum, F. culmorum, F. avenaceum, F. poae, Microdochium nivale, y M. majus. La distribución y prevalencia de estos patógenos están determinadas en gran medida por las condiciones climáticas, tales como la temperatura y la humedad. En Argentina, el agente fúngico dominante asociado a la FET es F. graminearum (Schwabe), anamorfo de Gibberella zeae (Schw.) Petch (Galich, 1997; Gilbert y Tekauz, 2000; Lori et al., 2003; Kikot et al., 2011). Las epidemias de FET en Argentina se registraron en 1976, 1978, 1985, 1993, 2001, y 2012 (Moschini y Fortugno, 1996; Kikot et al., 2011). Fusarium graminearum produce micotoxinas, como los tricotecenos deoxinivalenol y sus derivados, 3-acetildeoxinivalenol y 15-acetildeoxinivalenol, y nivalenol. La función de los tricotecenos en las enfermedades de las plantas no está claro, pero Proctor et al. (1995), Gang et al. (1998), Šíp et al., (2011), y Malbrán et al. (2012) reportaron una correlación positiva entre la agresividad y la producción de deoxinivalenol por F. culmorum y F. graminearum.
El grado de agresividad podría resultar de diferencias cualitativas y cuantitativas en la producción de micotoxinas y enzimas que degradan la pared celular de la planta (Ten Have et al., 2002; Jenczmionka et al., 2003; Jenczmionka y Schafer, 2005). Pero los tricotecenos están más relacionados con la propa gación de la enfermedad en la planta que con su establecimiento (Goswami y Kistler, 2005; Nicholson et al., 2007).
La relevancia de la selección de genotipos resistentes a la FET en el trigo se basa en que la resistencia del huésped es considerada el medio más adecuado para controlar la enfermedad. Varios tipos de resistencias genéticas a la FET se describieron en el trigo; por ejemplo, el tipo I se asoció con la resistencia a la infección inicial y el tipo II con la resistencia a la propagación de la infección dentro de la planta; ambos fueron descritos por Schroeder y Christensen en 1963 (Mesterházy et al., 1999; Nicholson et al., 2007). Para distinguir entre estas fuentes de resistencia, los investigadores desarrollaron métodos de inoculación para evaluar los genotipos en los programas de mejoramiento. La pulverización de las espigas de trigo con suspensiones de conidios permitió evaluar la resistencia del tipo I; pero la inoculación de una sola inyección por espiga con conidios (una inoculación puntual) permite un seguimiento de la propagación de la enfermedad entre las espigas y, por lo tanto, una evaluación de la resistencia del tipo-II (Bai y Shaner, 1994; Bai et al., 2001).
El objetivo de este estudio fue identificar fuentes nuevas de resistencia a la FET en cultivares y líneas de trigo argentinos en relación con cultivares resisten tes internacionales conocidos. La hipótesis fue que la caracterización de la resistencia a la FET en líneas y cultivares locales, y en el germoplasma internacional proporcionaría información relevante respecto a las diferencias en el comportamiento genotípico contra la enfermedad.
Materiales y Métodos
Inóculo fúngico
El aislamiento de F. graminearum usando para la producción del inóculo se obtuvo de espigas de trigo infectadas en Marcos Juárez (62° 6’ 7”O, 32° 41’ 39” S; 116 msnm), provincia de Córdoba, Argentina, a través de la metodología usada por Kikot et al (2011). El aislamiento monospórico se conservó en tubos con 2 % (w/v) de agar sintético nutritivo bajo una capa de aceite mineral a 4 °C (Leslie y Summerell, 2006).
Producción del inóculo
En cultivos de F. graminearum cultivados en agar sintético nutritivo, se cortaron piezas de 0.5 x 0.5 cm se inocularon en 50 mL de un medio de agar de afrecho de trigo (40 g afrecho de trigo, 20 g agar, 1000 mL agua; hervida durante 1 h) en frascos Erlenmeyer de 250 mL. Los cultivos se mantuvieron 2 d a 22 °C y después 10 d a temperatura ambiente (25 °C) con iluminación fluorescente. Los conidios se extrajeron de cada frasco con agua destilada esterilizada, se lavaron con Tween 20 (1 gota 100 mL-1 agua), y se filtraron a través de una gasa estéril (metodología usada por el Instituto Nacional de Tecnología Agropecuaria Marcos Juárez, INTA). Una suspensión con 3 x 105 de conidios mL-1 se usó para inocular espigas de trigo (Galich, 1997).
Variedades de trigo
Los genotipos de trigo fueron 215: 76 cultivares argentinos, 42 cultivares internacionales pertenecientes al Centro Internacional de Mejoramiento del Maíz y Trigo (CIMMYT; Scab Resistance Screening Nursery), 92 líneas de trigo avanzadas de diferentes ciclos de crecimiento obtenidas del programa de cultivo del INTA y cinco cultivares testigo. Los genotipos testigo fueron: los resistentes Sumai 3 y YMI 6-26B, los moderadamente resistentes ProINTA Granar y ProINTA Oasis, y el susceptible Buck Halcón.
Prueba de patogenicidad
El experimento se realizó durante la primavera de 2010 en Marcos Juárez en condiciones similares a las del campo, pero con control parcial de la humedad facilitado por un equipo de microaspersión que opera automáticamente a través de un temporizador (Green Mist, NaanDanJain) para proporcionar riego por 5 min cada 25 min. Las plantas de trigo estaban cubiertas con una mediasombra para evitar daños causados por aves. La cama de siembra fertilizada (50 kg de urea ha-1) y tratada con insecticida de clorpirifos (500 mL ha-1), se preparó con motocultivadores. El desmalezado se hizo con máquina o a mano.
Las plantas, que incluyen los cultivares de trigo nacionales e internacionales junto con las líneas de trigo avanzadas, se sembraron por duplicado. El diseño experimental fue de bloques completos aleatorios y las unidades experimentales fueron parcelas colina (Frey, 1965). La siembra se realizó en invierno (30 de julio del 2010), colocando 5 a 10 semillas por surco en una disposición escalonada. Las espigas de trigo se inocularon con Fusarium usando un pulverizador de mano cuando al menos 5 espigas estaban en la etapa de la antesis (determinada por la presencia de anteras expuestas). Las espigas de trigo de cada cultivar o línea se inocularon dos veces en cuatro días para asegurar la infección. Cada experimento tuvo cinco cultivares testigo: dos resistentes, dos moderadamente resistentes, y uno susceptible. Todas las espigas para cada variedad o línea de cada una de las tres fuentes de genotipo de trigo sembradas por duplicado, se cortaron y se almacenaron en sobres para su posterior observación y evaluación del grado de infección. La resistencia se evaluó utilizando las variables patométricas y de rendimiento (Galich, 1997).
Evaluación y determinación
Las variables evaluadas fueron: 1) incidencia, como el porcentaje de espigas enfermas entre un total de 20 espigas seleccionadas; 2) severidad, como el porcentaje de espiguillas enfermas por espiga entre un total de seis espigas enfermas examinadas; 3) granos dañados, como el porcentaje de granos dañados por espiga entre un total de seis espigas enfermas inspeccionadas; 4) el peso de mil granos (TGW) se determinó contando y pesando todos los granos del grupo evaluado, luego normalizando el valor obtenido para el peso por cada 1000 granos; 5) el índice ISK (es decir, la incidencia, la severidad y los granos dañados) calculado como: (% de incidencia x 0.3) + (% de severidad x 0.3) + (% de granos dañados x 0.4), de acuerdo con Gilbert y Woods (2007).
Intervalos de severidad
Los siguientes intervalos de severidad se usaron de acuerdo a la escala japonesa y brasileña basadas en la severidad de las espigas (Kohli, 1989): 0, inmune; 1, resistente (1-5 % de severidad); 2, moderadamente resistente (5-25 % de severidad); 3, moderadamente susceptible (25-50 % de severidad), 4, susceptible (50- 75 % de severidad); 5, muy susceptible (>75% de severidad).
Análisis estadístico
Las variables incidencia, severidad, porcentaje de granos enfermos, y peso de 1000 granos se analizaron con ANDEVA y el test de Fisher-LSD (p≤0.05). También se realizó un análisis de correlación de Pearson entre las variables y un gráfico de histograma de frecuencia para la variable de severidad desarrollada. En los cultivares nacionales e internacionales se evaluaron todas las variables mediante ANDEVA con InfoStat 2008. En las líneas avanzadas de trigo, el índice de Fusarium se calculó de las variables de incidencia y severidad estimadas (porcentaje de incidencia x porcentaje de severidad/100).
Resultados y Discusión
La patogenicidad en los cultivares argentinos mostró diferencias estadísticas significativas en todas las variables analizadas, excepto la incidencia, mientras que en los cultivares internacionales sólo se observaron diferencias significativas en TGW (Cuadro 1). Cowger et al. (2009) encontraron diferencias significativas en las variables de incidencia, severidad, porcentaje de granos dañados, y el contenido de deoxinivalenol entre cultivares de trigo de invierno.
Cuadro 1 Análisis estadístico de las pruebas de patogenicidad en cultivares argentinos e internacionales infectados con Fusarium graminearum.

TGW: peso de mil granos. *Testigos.
En los cultivares argentinos, las correlaciones de Pearson fueron positivas para las asociaciones entre la incidencia y la severidad (p≤0.01), la incidencia y el porcentaje de granos dañados (p≤0.01), la severidad y el porcentaje de granos dañados (p≤0.01), la severidad y TGW (p=0.01), y el porcentaje de granos dañados y TGW (p≤0.01). Pero la correlación fue negativa entre el porcentaje de granos dañados y TGW, y entre el índice de ISK y TGW. En un estudio similar, Hernández (2010) observó una correlación positiva entre la severidad y el porcentaje de granos dañados.
Los síntomas mostraron asociación alta con el nivel de infección en los granos. Además, el TGW se redujo debido a un incremento en la incidencia, la severidad y el índice ISK, de acuerdo con el aumento en los granos infectados. En el Cuadro 2 se muestra que el peso del grano fue más afectado en los cultivares con mayor susceptibilidad a la enfermedad.
Cuadro 2. Correlación entre las variables analizadas en cultivares argentinos infectados con Fusarium graminearum.
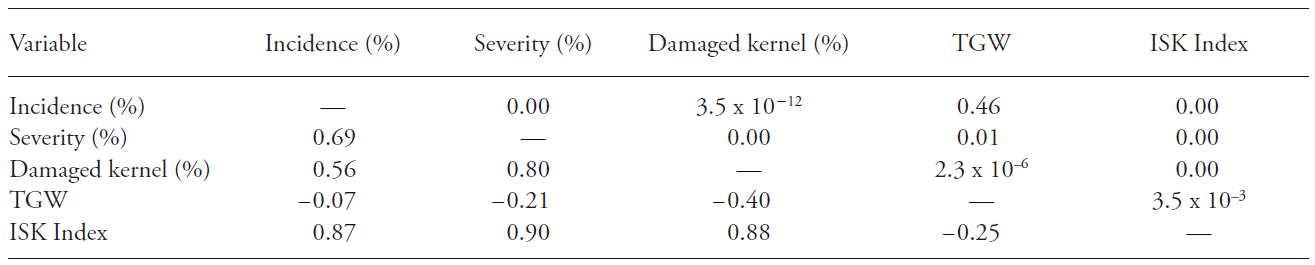
x TGW: peso de mil granos. índice ISK: incidencia, severidad y granos dañados.
Los valores sobre la diagonal de correlaciones redundantes en identidad, demarcadas por guiones, expresan la correlación de Pearson entre las variables, mientras que los valores debajo de la diagonal indican la significancia (p≤0.05).
Con los valores de severidad obtenidos en los cultivares argentinos, se construyó un histograma de frecuencias de FET (Figura 1). La respuesta a la enfermedad de 21 cultivares (Cronox, LE 2357, Klein Proteo, Buck Huanchen, BioINTA 2005, Buck Puelche, Klein Castor, Buck AGP rápido, Arex, Klein Nutria, BioINTA 1005, Klein Carpincho, Klein Rayo, Buck Chacarero, Klein Zorro, Atlax, Buck 75 Aniversario, Buck Meteoro, BioINTA 1002, Klein Tigre, ACA 906, y Buck 55 CL) no fue diferente (p>0.05) a los testigos resistentes Sumai 3 y YMI 6-26B y mostró niveles de severidad inferiores a 20 %. Pero Baguette P 11 y Baguette 18 fueron susceptibles, ya que mostraron un grado de severidad mayor al 50 %. Mergoum et al. (2007) caracterizaron el comportamiento de diferentes cultivares ante FET en Dakota del Norte en condiciones de infección natural y artificial durante diversos años y observaron diferencias significativas entre los cultivares.
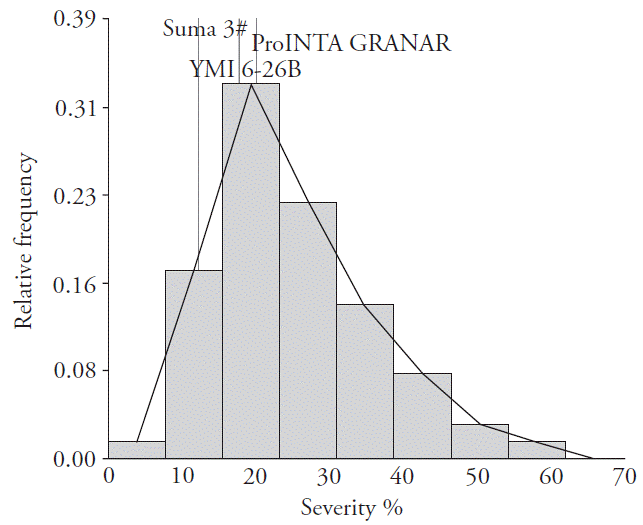
Figura 1 Histograma de frecuencias de los cultivares argentinos infectados con Fusarium graminearum. Las barras ilustran el grado de severidad como un porcentaje en el eje de abscisas frente a la frecuencia relativa de los cultivares que pertenecían al correspondiente grado de severidad trazado como ima fracción en la ordenada. Los respectivos valores de severidad versus frecuencia de los cultivares de control Sumai 3, YMI 6-26B у ProINTA Granar, que se muestran por encima de las barras, se indican mediante líneas verticales que delimitan su posición dentro del esquema.
En el Cuadro 3 están los valores de incidencia, severidad y granos dañados de los cultivares argentinos susceptibles, con niveles de severidad inferiores a 15 %. Los 11 cultivares incluidos en este grupo y el testigo Sumai 3 registraron valores más bajos para todas las variables analizadas, en comparación con los promedios observados ya sea en los cultivares susceptibles o en los internacionales; estos últimos se evaluaron previamente como susceptibles. Los cultivares susceptibles argentinos son los cinco, que mostraron el nivel mayor de severidad de la enfermedad: Baguette P 11 (61.9 %), Baguette 18 (53.6 %), Buck Mangrullo (48.5 %), Klein Guerrero (44.1 %), y BioINTA 3000 (42.5 %). Los cultivares argentinos con mayor resistencia a las enfermedades (Cuadro 3) tenían niveles medios de las tres variables analizadas que fueron inferiores a los promedios de los cultivares nacionales e internacionales.
Cuadro 3 Cultivares argentinos con mayor resistencia a la FET en comparación con los valores promedios de los cultivares argentinos e internacionales susceptibles.
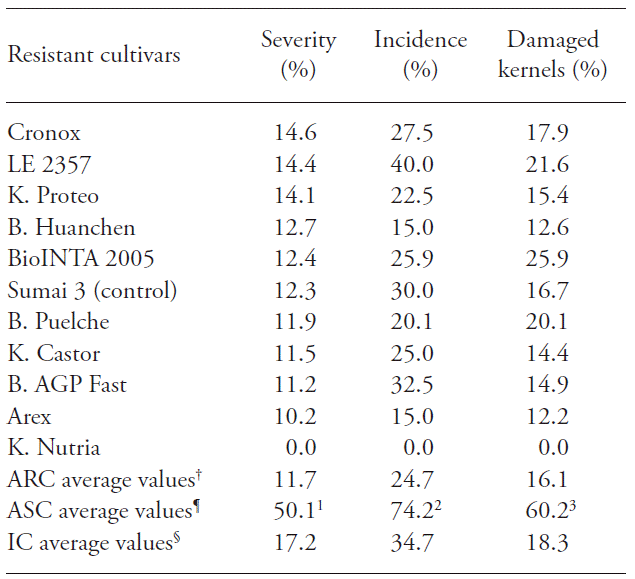
x ARC: cultivares resistentes argentinos; ASC: cultivares susceptibles argentinos; 1С: cultivares internacionales, †ProINTA Granar y Klein Don Enrique. ⁋Baguette p 11, Baguette 18, Buck Mangrullo, Klein Guerrero y BioINTA 3000. §Nobeoka Bouzu Komugi, Catbird y Frontana. 1Grupo de valores promedio de cinco cultivares con altos niveles de severidad (de 42.4% a 61.9%). 2Grupo de valores promedio de cinco cultivares con altos valores de incidencia (de 71.3% a 96.6%). 3Grupo de valores promedio de cinco cultivares con un alto número de granos dañados (de 45.8% a 91.7%).
La caracterización y evaluación de las variedades de trigo internacionales preseleccionadas para la resistencia a FET se realizó para verificar la respuesta a la enfermedad en condiciones climáticas de Argentina y con una cepa local del patógeno. Se confirmó la evaluación de los especímenes considerados resistentes a la enfermedad, según la información dada por el vendedor, proque no hubo diferencias significativas entre los cultivares.
También fue útil un estudio de las líneas de trigo avanzadas con ciclos diferentes de crecimiento obtenidos del programa de mejoramiento del INTA, en la búsqueda de genotipos resistentes a la FET. La progresión de la enfermedad se registró de acuerdo con el índice de Fusarium que integra los valores de incidencia, severidad, y la combinación de los dos, expresado como (incidencia x severidad)/100 (Hernández, 2010), y las líneas con valores bajos del índice de Fusarium fueron consideradas resistentes. El nivel más alto de los valores del índice de Fusarium fue para las líneas del ciclo de crecimiento largo, y el nivel menor para las líneas del ciclo de crecimiento corto, mientras que los valores de las líneas de crecimiento intermedio están en el intermedio. A pesar de cierto grado de superposición entre los grupos adyacentes, los valores medios de los tres grupos mostraron una clara diferencia entre las respuestas de estas tres categorías de la cinética del ciclo de crecimiento. Todas las líneas mostraron niveles de infección (severidad) menores a 20 %, excepto T 00212, P 05375 (ciclo de crecimiento largo), T 00219 (ciclo de crecimiento medio) y T 00224 (ciclo de crecimiento corto). Las líneas registraron la mayor resistencia a la infección por la FET, y los niveles de severidad menores a 30 % se caracterizaron como moderadamente resistentes (Cuadro 4). De acuerdo con Jin et al. (2013), para 363 líneas de los EE.UU., 43 % fueron susceptibles, 32 % moderadamente susceptibles, y 7.0 % resistentes.
Cuadro 4 Grupos (según el ciclo de crecimiento) de las líneas avanzadas del programa de mejoramiento del INTA caracterizadas como resistentes a la fusariosis de la espiga.
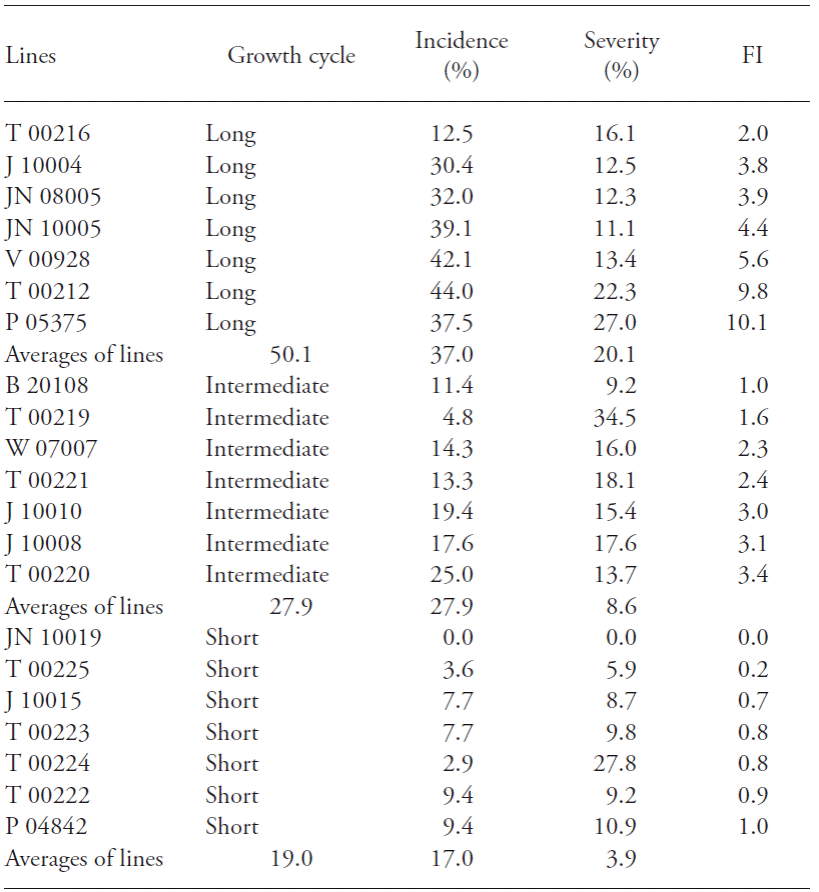
x FI: Índice de Fusarium.
Esta evaluación de la resistencia a la penetración del patógeno en la espiga (tipo I) en un número alto de genotipos de trigo, de los tres grupos de trigo de diferente origen, es relevante para el control de FET e implica mejores resultados en el manejo de la enfermedad, debido a que la información permite caracterizar el comportamiento de los genotipos de trigo frente al patógeno en condiciones similares a las de la naturaleza. Por lo tanto, esta investigación permite identificar nuevas fuentes de resistencia (Xu et al, 2001; Brennan et al., 2007; Vogelgsang et al., 2008).
Nuestros resultados sugieren que el aislamiento de F. graminearum utilizado en la evaluación del comportamiento de los diferentes genotipos de trigo a la infección fue altamente infectivo y permitió evaluar la enfermedad en un gran número de líneas y cultivares. La inoculación artificial usada en los experimentos aseguró el contacto entre el patógeno y el huésped, lo que facilitó una infección exitosa y la consiguiente progresión de la enfermedad.
Conclusiones
El aislamiento de Fusarium usado en esta investigación fue apropiado, ya que el inóculo altamente infectivo nos permitió analizar la progresión de la enfermedad en 210 genotipos nacionales e internacionales. Nosotros observamos y registramos diferencias significativas entre los cultivares de trigo de Argentina en respuesta a la enfermedad, medida como nivel de severidad, el peso de mil granos, y el porcentaje de granos dañados.
El grupo de germoplasma internacional evaluado mostró resistencia a la enfermedad, ya que no se observaron diferencias significativas entre los cultivares. Con respecto a los cultivares argentinos, se detectaron nuevas fuentes de resistencia a la FET, porque estos ejemplares se evaluaron previamente, pero para otras enfermedades de detección más fácil y rápida que la FET.
El grupo de líneas de trigo avanzadas del INTA, Argentina, respondió al desafío de la FET con niveles bajos de incidencia y severidad, como se expresó en los valores de los índices de Fusarium. Entre estas líneas, las de mejor resistencia a la FET fueron las de ciclo corto de crecimiento, seguidos por las intermedias, y finalmente los genotipos de ciclo largo de crecimiento. Este gradiente de respuesta podría indicar que el ciclo de crecimiento per se afecta la resistencia a la infección, probablemente como resultado de un menor tiempo de exposición entre la antesis y la madurez; esto hace que esas líneas sean una opción de preferencia durante los años con una amenaza mayor de infección de la FET.











 texto em
texto em 


