Introducción
En Sinaloa, México se cultivan 34,560 ha de mango; de esta superficie, los municipios de Escuinapa y El Rosario, en el sur del estado, contribuyen con 75 % (SIAP, 2021). En esta región se cultivan las variedades Ataulfo y Tommy Atkins de maduración temprana, Kent de maduración intermedia y Keitt de maduración tardía; la variedad Kent predomina con 48 % de la superficie plantada. De acuerdo con los productores, dicho patrón de maduración de los frutos no se observa actualmente, concentrándose la cosecha en los meses de junio y julio. Se considera que el problema es ocasionado por las temperaturas altas que aceleran el crecimiento y desarrollo de los frutos. Makhmale et al. (2015) en sus estudios con mango, concluyeron que las temperaturas altas influyen en los procesos de transpiración y respiración de los frutos, reduciendo el tiempo de maduración, lo que ocasiona cosechas más tempranas.
Una estrategia para ampliar el periodo de cosecha del mango es adelantar la floración con paclobutrazol (PBZ) y prohexadiona de calcio (P-Ca), sustancias inhibidoras de la síntesis de giberelinas (Pérez-Barraza et al., 2018); con el mismo fin se usan nitrato de potasio (KNO3) y etefón (Ramírez et al., 2010). Por su parte, Sarkhosh et al. (2018) plantearon que con la poda de panículas apicales de la primera floración se promueve la formación de panículas axilares para una segunda floración, teniendo como resultado el retraso de cosecha. Issarakraisila y Considine (1991) presentaron los primeros reportes sobre la poda manual de panículas apicales para promover una segunda floración en mango Kensington Pride. Ellos plantearon que en cada brote decapitado se forman 2.7 panículas a partir de yemas axilares, y después de cinco a seis semanas se presenta la antesis, con retraso de cosecha de seis semanas. Sauco et al. (1991) consignaron que la destrucción de panículas y el desarrollo de una segunda floración a partir de yemas axilares se logró con la aplicación de etefón 0.8 mL L-1 en mangos Haden y Zill y, que las nuevas panículas llegaron a antesis entre seis y nueve semanas. Oosthuyse y Jacobs (1997) realizaron podas manual y química con Dinoseb 1.0 mL L-1 en panículas apicales logrando retrasar 48 y 50 días la floración, respectivamente. Los autores señalan que Dinoseb puede tener restricciones por su toxicidad, por lo que el uso de etefón podría ser una alternativa mejor.
En diversos estudios se ha documentado que las temperaturas frescas son necesarias para estimular la floración del mango (Davenport, 2007). Bajo condiciones subtropicales, se requiere un periodo de 10 días de temperaturas inferiores a 25 ºC durante el día y de 15 ºC durante la noche para el inicio de la floración (Rodríguez y Fernández, 2008). Por su parte, McConchie (2018) señaló que el clima fresco (<20 °C) durante 300 horas (unidad) es necesario para la inducción floral de yemas axilares en mangos Honey Gold y B74. El frío acumulado fue obtenido mediante la ecuación: [(temp max + temp min)/2] - 12 (Moore, 2013). Jameel et al. (2018) hipotetizaron que las temperaturas frescas promueven la formación de un promotor florígero en las hojas del mango, que se transporta por el floema a las yemas vegetativas para inducir floración. Chowdhury et al. (2010) señalaron que una segunda floración, provocada por la poda manual de panículas apicales en enero, superó en rendimiento a árboles que se podaron en febrero. Ambas fechas de podas superaron en producción al testigo sin poda y tuvieron frutos de mejor calidad de acuerdo con las variables de firmeza y sólidos solubles totales. Kumar et al. (2021) reportaron que las floraciones tardías en mango son afectadas por temperaturas altas, afectando la viabilidad del polen y el amarre de frutos. Oosthuyse y Jacobs (1997) manifestaron que árboles de mango Sensation con podas manual y química de panículas apicales tuvieron menos frutos, pero de mayor tamaño que los árboles testigo, sin afectar el rendimiento.
En México se cuenta con avances importantes en la estrategia para adelantar floración y cosecha de mango (Pérez-Barraza et al., 2018); sin embargo, para el retraso de floración la información es escasa; por tal motivo, el objetivo del presente trabajo fue evaluar el efecto de las podas manual y química de panículas apicales de mango Kent en la emergencia de panículas axilares, con el consecuente retraso de la floración y cosecha; asimismo, determinar el efecto en la productividad y la calidad del fruto.
Materiales y métodos
Sitio, tratamientos y diseño experimental
Se establecieron dos experimentos de mango Kent. En 2018 en el huerto La Aviación, Escuinapa (22° 48’ 10’’ N; 105° 44’ 29’’O y 11 msnm), Sinaloa, México y en 2019 en el huerto Cajón Verde, El Rosario (22° 55’ 14’’ N; 105° 49’ 50’’ O y 43 msnm), Sinaloa, México. Ambos huertos de cinco años de edad; con sistema de riego por goteo y fertilización química con NPK (250-25-40 kg ha-1); la maleza se eliminó con rastreo y chaponeo. El clima es cálido subhúmedo (Aw). Los tratamientos fueron: poda manual, poda química con etefón a 1.0 mL L-1 y 1.2 mL L-1 y testigo sin poda; las podas se aplicaron a panículas apicales en todo el árbol. En 2019 se excluyó el tratamiento de 1.2 mL L-1 considerando los resultados del año anterior. Los tratamientos se distribuyeron en un diseño completamente al azar con cinco réplicas y un árbol como unidad experimental. Las dosis de etefón se fijaron de acuerdo con un estudio preliminar en 2017, cuyo propósito fue determinar las dosis que dañaran más las inflorescencias de mango, se probaron 0.6, 0.8, 1.0 y 1.2 mL L-1 de etefón. Los resultados de 1.0 y 1.2 mL L-1 dañaron 98 y 100 % las inflorescencias, respectivamente, dosis que se seleccionaron en los experimentos de 2018 y 2019.
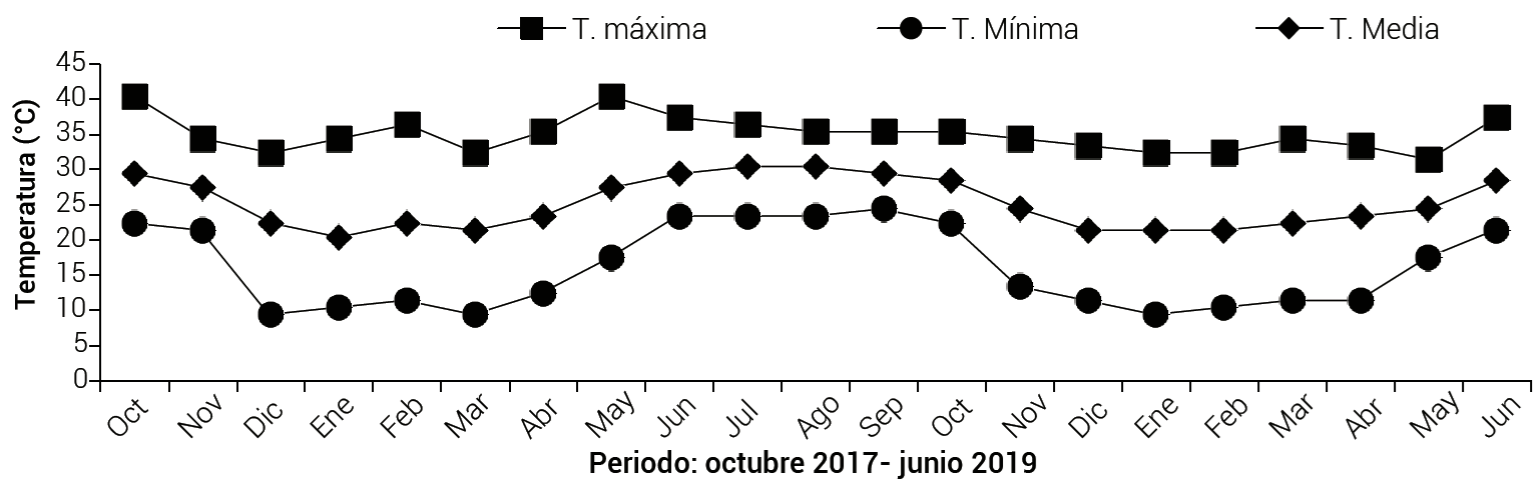
Las temperaturas máxima, mínima y media bajo las cuales se desarrollaron los experimentos se presentan en la Figura 1 (Estación Climatológica del Aeropuerto Internacional Rafael Buelna, Mazatlán, Sinaloa, México, ubicada en las coordenadas 23° 09′ 41″ N y 106° 15′ 58″ O y 11 msnm).
Podas
Las panículas apicales se eliminaron en antesis. La poda manual consistió en ejercer presión en la base de la panícula hasta lograr su desprendimiento (Yeshitela et al., 2003), mientras que para la poda química (Sauco et al., 1991) las panículas se asperjaron con etefón (Ethrel®, ácido 2-cloroetilfosfónico 240 g i.a L-1. Bayer) con una bomba de motor (Arimitsu® modelo SD-260DII, Arimitsu Pumps, Anoka, Minnesota, EUA). En 2018 las podas se realizaron el 13 y 17 de febrero, mientras que en 2019 éstas fueron el 10 y 17 de febrero. La segunda poda tuvo el propósito de eliminar panículas de emergencia tardía; una semana después de la segunda poda se incluyó una aplicación de KNO3 4 % asperjado al follaje para uniformizar la brotación floral de las yemas axilares (Ramírez et al., 2010). En los árboles testigo no se practicó poda de las inflorescencias apicales.
Variables de estudio
Se evaluó el tiempo (días) de retraso de floración y cosecha. Para retraso de floración se contaron los días de la primera floración apical de los árboles testigo (sin poda) a la segunda floración ocurrida en las yemas axilares de los brotes donde se eliminó la primera inflorescencia. El tiempo de retraso de cosecha se obtuvo contando los días de la cosecha del testigo a la cosecha de los árboles podados.
El porcentaje de floración se evaluó mediante apreciación visual de la intensidad de floración al momento de antesis en la copa del árbol; la copa se dividió en dos secciones opuestas y, de acuerdo con la cobertura de las inflorescencias en cada sección, se registró el porcentaje de floración en escala de 0 a 100. Se sumaron los valores de ambas secciones y el producto se dividió entre dos, para obtener el porcentaje de floración del árbol.
Las variables número de panículas axilares por brote (NPAB), longitud de panículas, diámetro del escapo y número de frutos por panícula se evaluaron en una muestra de cinco inflorescencias axilares por árbol podado y cinco inflorescencias por árbol no podado (testigo), distribuidas a una altura media de la copa y en diferentes puntos cardinales. El muestreo se repitió en cinco árboles por tratamiento.
El peso del fruto se evaluó al momento de cosecha en una muestra de 10 frutos por árbol, cada fruto se pesó en una báscula digital (Sartorius GF-2000, Göttingen, Alemania); se cuantificaron los frutos por árbol, y la producción se estimó multiplicando el número de frutos por árbol por el peso promedio del fruto. En ambos experimentos la cosecha se realizó cuando los frutos alcanzaron madurez fisiológica.
Se evaluaron variables de calidad de frutos a los 0, 5 y 10 días de almacenamiento en condiciones ambientales de mercadeo (20 ± 2 °C y 85-90 % HR). En una muestra de 10 frutos se midió la firmeza con un penetrómetro digital (Chatillon® DFGS 100, Largo, Florida, EUA) adaptado a una base Chatillon® TCD 200 y un punzón de 8 mm de diámetro; se realizaron tres lecturas (observaciones de muestreo) en la base, centro y ápice del fruto, los valores se registraron en newtons (N). La acidez titulable (AT) y sólidos solubles totales (SST) se determinaron con la metodología de la AOAC (1998). Se tomó una muestra de 10 frutos en cada muestreo y de cada fruto se licuaron 10 g de pulpa en 50 mL de agua destilada, la mezcla se filtró en tela de organza y se tomaron 50 mL para medir AT en un titulador (Mettler Toledo Mod. DL-50, Columbus, Ohio, EUA), los resultados se expresaron en porcento de ácido cítrico; del filtrado se tomó una muestra para determinar el contenido de SST en un refractómetro (Mettler Toledo Mod. RE40D, Columbus, Ohio, EUA), los resultados se expresaron en °Brix considerando la dilución (50 mL). Con los valores de SST y AT se calculó la relación sólidos SST/AT (RSA).
Resultados y discusión
Retraso de floración y cosecha
En 2018 y 2019 las aplicaciones de etefón dañaron 100 % las panículas de la primera floración (datos no presentados). La poda manual de panículas apicales retrasó la floración 40 días en 2018, mientras que con poda química el retraso fue de 45 días; asimismo, en 2019 la poda manual y la poda química retrasaron la floración en 42 y 47 días, respectivamente. El retraso de cosecha en 2018 y 2019, independientemente del tipo de poda, fue de 33 y 31 días, respectivamente (Cuadro 1).
Cuadro 1 Retraso de floración y cosecha en árboles de mango Kent por efecto de las podas manual y química a las panículas apicales de la primera floración. 2018 y 2019.
| Tratamientos | Fecha primera floración | Fecha segunda floración | Retraso de floración (d) | Fecha de cosecha | Retraso de cosecha (d) |
| 2018 | |||||
| Poda manual | 22 de marzo | 40 | 15 de julio | 33 | |
| Etefón 1.0 mL L-1 | 27 de marzo | 45 | 15 de julio | 33 | |
| Etefón 1.2 mL L-1 | 27 de marzo | 45 | 15 de julio | 33 | |
| Testigo (sin poda) | 10 de febrero | 12 de junio | |||
| 2019 | |||||
| Poda manual | 30 de marzo | 42 | 18 de julio | 31 | |
| Etefón 1.0 mL L-1 | 05 de abril | 47 | 18 de julio | 31 | |
| Testigo (sin poda) | 16 de febrero | 17 de junio | |||
Issarakraisila y Considine (1991) reportaron retraso de floración entre 35 y 42 días en un estudio de poda manual de panículas en mango Kensington Pride en Australia. Otros estudios señalan entre 48 y 50 días de retraso de floración con poda química y manual (Oosthuyse y Jacobs, 1997). Estos resultados son parecidos a los obtenidos en el presente estudio.
En los dos años de estudio, las temperaturas bajas, antes y después de las podas, favorecieron la inducción floral de yemas axilares. En la Figura 1 se muestran temperaturas mínimas de alrededor de 10 °C en el periodo de las podas, las cuales, de acuerdo con Jameel et al. (2018), proporcionan estrés para la inducción de floración en mango. Aunado al estímulo por frío para la inducción floral, la eliminación de la panícula apical reduce la síntesis de auxinas, provocando el transporte de fotosintatos y citocininas a las yemas axilares, condiciones que favorecen la brotación de éstas (Taiz y Zeiger, 2010).
Desarrollo de panículas en yemas axilares
Floración
En 2018 el porcentaje de floración de la primera floración en árboles testigo y segunda floración de árboles podados no fue diferente (P ≤ 0.05) entre tratamientos (Cuadro 2). Con poda manual los árboles florecieron 100 %, mientras que con etefón a 1.0 y 1.2 mL L-1 y testigo la floración fue de 86, 92 y 90 %, respectivamente. En 2019 la floración fue menos abundante que en 2018; el valor más alto fue con etefón (81 %), diferente (P ≤ 0.05) a la floración más baja en el testigo (61 %). La menor floración de 2019 en los árboles podados pudo estar relacionada con la baja floración del periodo normal de ese año.
Cuadro 2 Floración y características de panículas en mango Kent, originadas de yemas axilares al aplicar podas manual y química de panículas apicales de la primera floración. 2018 y 2019.
| Tratamiento | Floración (%) | NPAB | Longitud de panículas (cm) | Diámetro de escapo floral (mm) |
| 2018 | ||||
| Poda manual | 100 ± 0.0a | 2.5 ± 0.3a | 25.66 ± 3.1a | 4.8 ± 0.2b |
| Etefón 1.0 mL L-1 | 86 ± 11.4a | 2.7 ± 0.4a | 21.32 ± 1.8a | 5.3 ± 0.3b |
| Etefón 1.2 mL L-1 | 92 ± 5.8a | 3.8 ± 0.5a | 20.52 ± 1.7a | 4.7 ± 0.2b |
| Testigo (sin poda) | 90 ± 5.5a | 1.0 ± 0.0b† | 20.96 ± 2.2a | 7.2 ± 0.6a |
| DSH (0.05) | 14. 9 | 1.3 | 8.2 | 1.3 |
| CV (%) | 28 | 51 | 23 | 23 |
| 2019 | ||||
| Poda manual | 66 ± 2.6ab | 4.8 ± 0.4a | 27.63 ± 1.1b | 4.5 ± 0.07b |
| Etefón 1.0 mL L-1 | 81 ± 4.1a | 3.8 ± 0.2a | 28.52 ± 2b | 4.6 ± 0.1b |
| Testigo (sin poda) | 61 ± 7.1b | 1.0 ± 0.0b† | 43.10 ± 1.8a | 6.8 ± 0.3a |
| DSH (0.05) | 15 | 0.7 | 5.2 | 0.6 |
| CV (%) | 20 | 54 | 25 | 23 |
†Panícula apical del testigo. NPAB: número de panículas axilares por brote. DSH: diferencia significativa honesta, CV: coeficiente de variación. Medias con letras iguales en la misma columna no son estadísticamente diferentes (Tukey, P ≤ 0.05). ± es el error estándar de la media.
Número de panículas axilares por brote (NPAB)
Las podas de inflorescencias apicales provocaron la diferenciación de nuevas panículas en yemas axilares. El número de panículas en los tratamientos de poda varió entre 2.5 y 3.8 por brote en 2018, sin diferencias (P ≤ 0.05). Comportamiento similar ocurrió en 2019, con valores de 4.8 y 3.8 para podas manual y química, respectivamente (Cuadro 2). Sarkhosh et al. (2018) eliminaron la yema apical de brotes vegetativos maduros de mangos Honey Gold y B74, formándose de dos a cinco panículas laterales; asimismo, Oliveira et al. (2017) observaron entre 2.6 y 3.3 panículas axilares posterior a la eliminación de la yema apical de brotes de mango Uba. Resultados parecidos se observaron en el presente estudio. La poda de la inflorescencia apical redujo la concentración de auxinas y rompió la latencia de las yemas laterales, debido a que se favoreció la concentración de citocininas (Srivastava, 2002).
Longitud de panículas
La longitud de las panículas no fue diferente (P ≤ 0.05) entre tratamientos en 2018, con valores entre 20.52 y 25.66 cm. En 2019 la longitud de las panículas apicales en árboles testigo sin podar fue de 43.10 cm, diferentes (P ≤ 0.05) de las panículas axilares de los árboles con podas manual y química, con 27.6 y 28.5 cm, respectivamente (Cuadro 2). Elkhishen (2015) en mango Alphonso reportó longitud de 35 cm en panículas apicales del testigo (sin poda) y 32 cm en panículas laterales de brotes podados. Sarkhosh et al. (2018) informaron menor talla de las panículas laterales en mangos Honey Gold y Calypso (B74) y, que este comportamiento se debe a la mayor competencia por fotosintatos entre panículas.
Diámetro del escapo
El diámetro del escapo en panículas de los árboles testigo en 2018 y 2019 fue de 7.2 y 6.8 mm, respectivamente, mientras que en los árboles con poda el diámetro del escapo en las panículas axilares fue diferente (P ≤ 0.05), entre 4.5 y 5.3 mm (Cuadro 2). En general, el vigor de las panículas apicales de los árboles testigo fue mayor que el vigor de las panículas laterales de los árboles podados. El comportamiento puede ser explicado por una mayor competencia de asimilados entre las panículas axilares de los árboles podados (Sarkhosh et al., 2018; Taiz y Zeiger, 2010).
Productividad
Frutos por panícula
En 2018, el número de frutos por panícula fue similar entre tratamientos (P ≤ 0.05), fluctuó entre 0.4 y 0.6. En 2019 el testigo registró 0.5, diferente (P ≤ 0.05) de los valores de 0.1 en poda química y 0.2 en poda manual (Cuadro 3). Hagemann et al. (2014) señalaron una caída alta de frutos de mango durante su crecimiento y desarrollo, con retención final entre 0.1 y 0.8 frutos/panícula. La menor retención de frutos en los árboles podados puede estar relacionado con el incremento de temperatura (Figura 1) posterior a la antesis. Al respecto, Kumar et al. (2021) mencionaron que temperaturas altas durante la floración del mango provocan disminución de la viabilidad del polen afectando la fecundación y el amarre de frutos. Liu et al. (2023), en un estudio con cinco variedades de mango apuntan que el polen fue difícil de germinar por debajo de 20 °C, y que la tasa de germinación aumentó gradualmente con el incremento de temperatura, alcanzando el máximo a 28 °C, con una tasa de germinación promedio de 28.3 %, pero disminuyó hasta 10 % con temperatura superior a 32 °C. El crecimiento del tubo polínico también mostró una tendencia similar, a 28 °C crecieron 50.1 μm y se redujo a 34.7 μm a 34 °C. Por su parte, Hagemann et al. (2014) señalaron que la división celular al inicio del crecimiento de los frutos de mango va acompañada por una alta demanda de carbohidratos. Las plantas de mango utilizan en la floración los fotosintatos almacenados y, al ocurrir una segunda floración, el nivel bajo de reservas provoca desequilibrios en el árbol, con efecto en el amarre de frutos (Oosthuyse y Jacobs, 1997), situación que pudo ocurrir en el presente estudio.
Cuadro 3 Productividad en árboles de mango Kent, al efectuar podas manual y química de panículas apicales de la primera floración. 2018 y 2019.
| Tratamiento | Frutos por panícula | Frutos por árbol | Peso de fruto (g) | Producción/árbol (kg) |
| 2018 | ||||
| Poda manual | 0.4 ± 0.05a | 41 ± 12.7b | 501 ± 12b | 20.4 ± 6.4a |
| Etefón 1.0 mL L-1 | 0.6 ± 0.1a | 56 ± 9.4b | 582 ± 19a | 32.5 ± 5.5a |
| Etefón 1.2 ML L-1 | 0.5 ± 0.07a | 55 ± 7.2b | 537 ± 14ab | 29.4 ± 3.9a |
| Testigo (sin poda) | 0.6 ± 0.05a | 94 ± 17.1a | 417 ± 10c | 39.1 ± 7.2a |
| DSH (0.05) | 0.27 | 44.5 | 52 | 21.3 |
| CV (%) | 33 | 53 | 17 | 46 |
| 2019 | ||||
| Poda manual | 0.1 ± 0.03b | 52 ± 15.4b | 611.0 ± 15.5a | 35.4 ± 8.7b |
| Etefón 1.0 mL L-1 | 0.2 ± 0.06b | 80 ± 14.5b | 612.8 ± 15a | 49 ± 9b |
| Testigo (sin poda) | 0.5 ± 0.1a | 120 ± 9.1a | 626.3 ± 9.2a | 75.3 ± 5.7a |
| DSH | 0.21 | 41 | 38.1 | 24.3 |
| CV (%) | 54 | 48 | 10 | 44 |
Medias con letras iguales en las columnas no son estadísticamente diferentes (Tukey, P ≤ 0.05). DSH: diferencia significativa honesta, CV: coeficiente de variación. ± es el error estándar de la media.
Frutos por árbol
El número de frutos cosechados por árbol en 2018 fue mayor en el testigo (94), diferente (P ≤ 0.05) de los árboles con poda química (55.5 en promedio) y poda manual (41); asimismo, en 2019 el número de frutos de los árboles testigo (120) fue mayor (P ≤ 0.05) que en los árboles con poda manual (52) y poda química (80) (Cuadro 3). El menor amarre de frutos en la segunda floración de los árboles podados se atribuye al incremento de la temperatura durante la polinización, que pudo afectar la germinación de los granos de polen y el crecimiento del tubo polínico (Kumar et al., 2021; Liu et al., 2023), así como a una reducción de fotosintatos al forzar los árboles a una segunda floración (Oosthuyse y Jacobs, 1997).
Peso del fruto
En 2018 el peso del fruto superó los 500 g en los árboles podados, contra 417 g en árboles sin poda (Cuadro 3). Sobre este comportamiento, Taiz y Zeiger (2010) documentaron que la distribución de fotosintatos en la planta es producto de la competencia entre puntos de crecimiento (sumidero), y que, la eliminación de un sumidero incrementa el transporte de fotosintatos al sumidero activo. El peso del fruto en 2019 no fue diferente (P ≤ 0.05) entre tratamientos, superó los 600 g (Cuadro 3). Chowdhury et al. (2010) evaluaron la poda de panículas para retraso de cosecha en mango Amrapal, encontrando que tanto el amarre como el peso de los frutos fueron diferentes entre años de estudio, como sucedió en el presente estudio.
Producción
La producción de los árboles en 2018 no tuvo diferencias (P ≤ 0.05) entre tratamientos; sin embargo, la disminución de la producción en los árboles podados, respecto a los árboles sin poda fue de 48, 17 y 25 % para poda manual, etefón 1.0 y 1.2 mL L-1, respectivamente. En 2019, los árboles testigo tuvieron la mayor producción (75.3 kg/árbol), diferente (P ≤ 0.05) de árboles con poda química (49 kg/árbol) y poda manual (35.4 kg/árbol) (Cuadro 3). En este año la reducción de la producción respecto al testigo fue de 53 y 35 % para podas manual y química, respectivamente. En los dos años de estudio, la producción fue 25 % menor en árboles con poda química y 50 % en árboles con poda manual respecto al testigo. Una respuesta de los tratamientos con etefón es que el etileno liberado por este compuesto podría influir en la retención de frutos, ya que regula la biosíntesis, el transporte y la señalización de auxinas (Ma et al., 2014). Las auxinas reducen la caída de fruto en mango, ya que regulan la formación de tejido vascular y el control de la división y elongación celular (Hagemann et al., 2014).
Calidad del fruto
En 2018 los frutos se cosecharon con mayor firmeza en los árboles podados (180-200 N), diferentes (P ≤ 0.05) de los frutos de los árboles no podados (160 N). Al día 5 de almacenamiento la firmeza descendió en alrededor de 18 % en todos los tratamientos, mientras que al día 10 fue de 69 %. La firmeza de los frutos concluyó con 60 N con etefón 1.2 mL L-1 y 40 N en el resto de los tratamientos (Figura 2A). En 2019 los frutos de todos los tratamientos, al momento de cosecha, tuvieron firmeza superior a 200 N. En los días 5 y 10 de almacenamiento la firmeza disminuyó en los frutos de todos los tratamientos, siendo menor en el testigo (Figura 3A). La pérdida de firmeza es uno de los procesos más característicos durante la maduración de los frutos de mango, y es debido a la hidrólisis del almidón y la degradación de la pared celular (Islas-Osuna et al., 2022). De acuerdo con los resultados de firmeza en 2018, los frutos de los árboles podados con etefón 1.2 mL L-1 fueron los de mejor calidad, mientras que en 2019 los frutos del testigo (sin poda) mostraron el mejor comportamiento en firmeza.
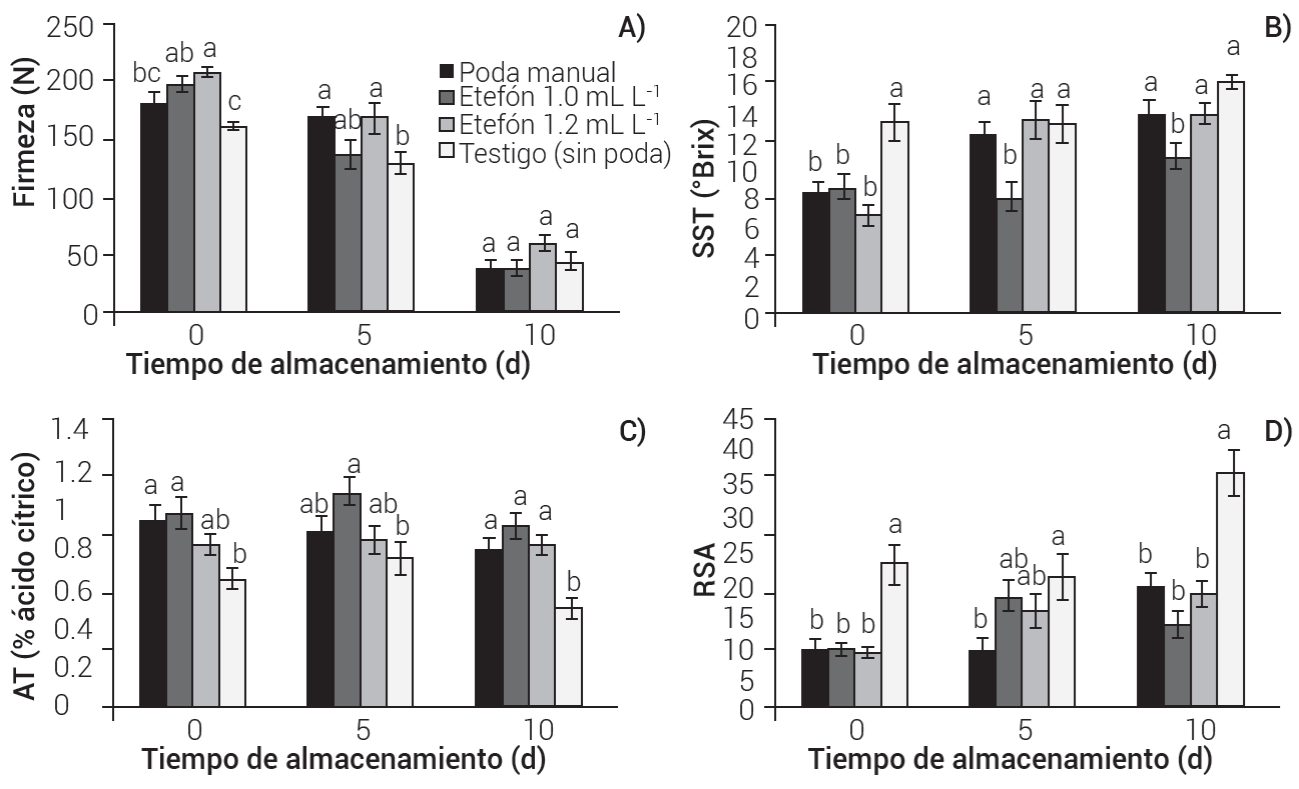
Figura 2 Indicadores de calidad en frutos de mango Kent, con poda manual y química de panículas apicales de la primera floración. 2018. A) firmeza, B) sólidos solubles totales (SST), C) acidez titulable (AT) y D) relación sólidos/acidez (RSA). Medias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). Las barras sobre las medias indican error estándar.
En 2018 se registró un nivel alto de SST (13.6 °Brix) en frutos del testigo (sin poda) al momento de cosecha, diferente (P ≤ 0.05) del resto de los tratamientos, con valores alrededor de 8.0 °Brix. En los días ٥ y 10 de almacenamiento se tuvieron niveles de SST bajos en el tratamiento con etefón 1.0 mL L-1, con incrementos en el resto de ellos (Figura 2B). En 2019, al momento de cosecha, los frutos de los tratamientos registraron valores de 7.2, 6.7 y 7.7 °Brix para poda manual, química y testigo, respectivamente. En los muestreos de los días 5 y 10 los SST se incrementaron en todos los tratamientos (Figura 3B). Según Kader (2008), el contenido de SST de mango Kent oscila entre 7 y 10 °Brix para mangos verdes en madurez fisiológica, y se incrementa conforme aumenta la maduración a cosecha, llegando a valores entre 14 y 16 °Brix, nivel que cumplieron los frutos de los tratamientos en este estudio, excepto en 2018 en el tratamiento con etefón 1.0 mL L-1 que mostró un valor de 11.0 °Brix (Figura 2B), La degradación de almidón contribuye al incremento de SST por la acumulación de azúcares en el mesocarpio del fruto de mango, siendo sacarosa, fructosa y glucosa los azúcares más abundantes (Islas-Osuna et al., 2022).
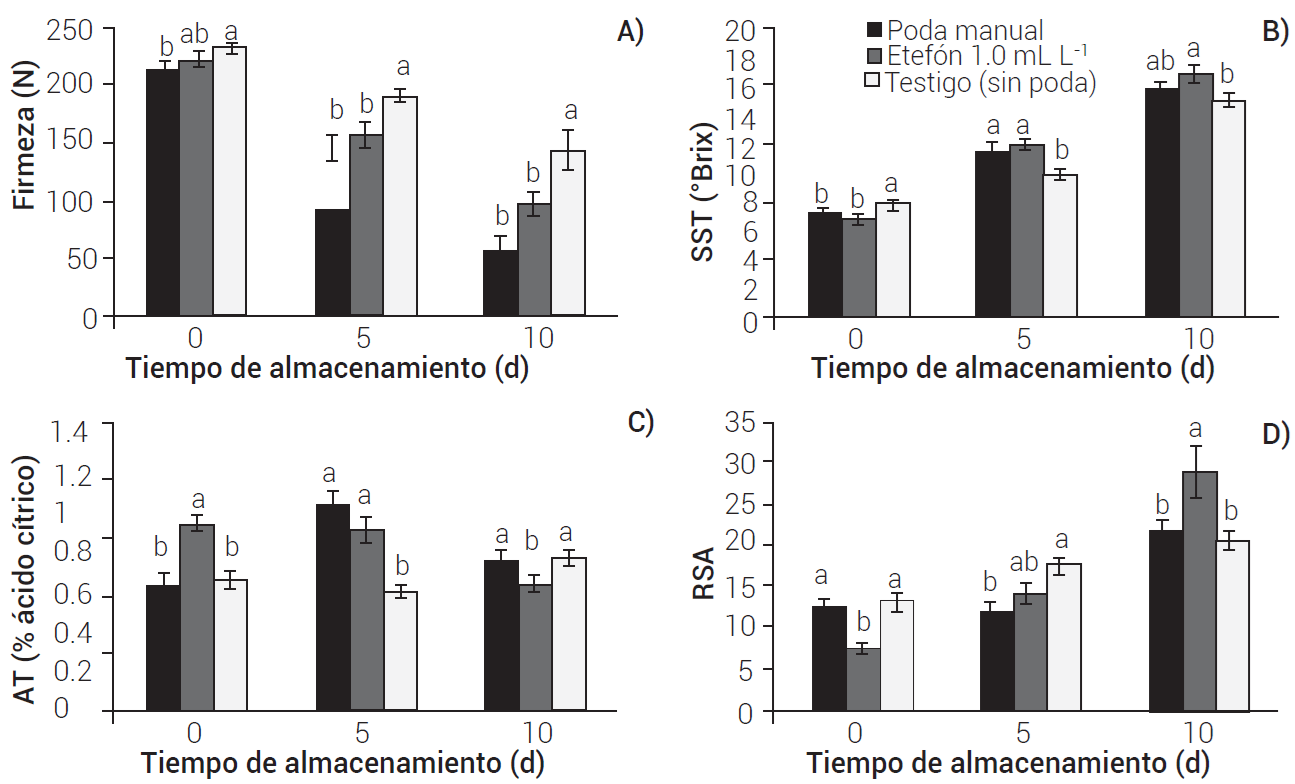
Figura 3 Indicadores de calidad en frutos de mango Kent, con poda manual y química de panículas apicales de la primera floración. 2019. A) firmeza, B) sólidos solubles totales (SST), C) acidez titulable (AT) y D) relación sólidos/acidez (RSA). Medias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). Las barras sobre las medias indican error estándar.
En 2018 la AT no sufrió cambios relevantes durante 10 días de almacenamiento en los frutos de los tratamientos; para podas fue entre 0.82 y 1.1 % y para el testigo sin poda entre 0.5 y 0.64 % (Figura 2C). En 2019 la AT de los frutos fue de 0.91 % al momento de cosecha en árboles podados con etefón, diferente (P ≤ 0.05) de poda manual y testigo (sin poda) con 0.61 y 0.62 %, respectivamente. En el día 10 la AT concluyó con 0.74, 0.61 y 0.74 % en los tratamientos de podas manual, química y testigo, respectivamente (Figura 3C). Los frutos suelen tener niveles altos de ácidos orgánicos antes de madurar, que disminuyen durante la maduración, con cambios en el sabor (Yahia, 2019). Osuna-García et al. (2022) indicaron que los niveles de AT tuvieron cambios ligeros durante cinco días de almacenamiento con temperaturas entre 12 y 22 °C en mango Kent, como se observó en el presente estudio.
En 2018 la relación sólidos/acidez (RSA) fue similar en los frutos de los árboles con podas al momento de cosecha, con valores alrededor de 10, mientras que en los árboles sin poda ésta fue de 23. Al día 5 la RSA se incrementó en los frutos de todos los tratamientos, excepto en el testigo que disminuyó. Al décimo día de almacenamiento la RSA tuvo el valor más alto (37.0) en los frutos de los árboles testigo sin poda; valores menores, 19.4, 13.4 y 18.1 se observaron en poda manual y poda química con etefón 1.0 y 1.2 mL L-1, respectivamente (Figura 2D). En 2019 la RSA al momento de cosecha fue de 12.5 y 13.0 en poda manual y testigo sin poda, respectivamente, diferente (P ≤ 0.05) de poda con etefón (7.6). Al día 5 de almacenamiento la RSA se incrementó sólo en frutos de poda química y testigo. Al día 10, fue más alta en poda química (29.0), diferente (P ≤ 0.05) de poda manual y testigo, con valores de 21.7 y 20.0, respectivamente (Figura 3D). Los ácidos orgánicos y los azúcares son los principales componentes solubles de los frutos maduros, y la relación de éstos determina su sabor. El contenido de ácidos orgánicos disminuye a medida que el fruto de mango madura y, en consecuencia, la acidez titulable baja, mientras que los azúcares se incrementan con el consiguiente aumento de los SST (Islas-Osuna et al., 2022); por ello, a medida que los frutos maduran se incrementa la RSA.
Conclusiones
La poda manual o química con etefón en panículas de la primera floración de mango Kent provocó una segunda y abundante floración con retraso de cosecha de alrededor de un mes. En 2018 la producción de árboles con retraso de floración fue 25 % menos que en árboles testigo sin poda, mientras que en 2019 la reducción fue de 50 %; ante esta situación, se deberá valorar la conveniencia de retraso de cosecha mediante poda de la primera floración. La firmeza, sólidos solubles totales y la relación sólidos/acidez fueron los mejores indicadores de la calidad de los frutos. Estos indicadores tuvieron un comportamiento mejor en frutos de árboles testigo y en frutos de árboles podados con etefón 1.2 mL L-1. Se sugiere la realización de estudios enfocados a mejorar la retención de frutos de la segunda floración.











 nova página do texto(beta)
nova página do texto(beta)