Introducción
La isquemia crónica que amenaza la extremidad representa la manifestación clínica más grave de la enfermedad arterial periférica (EAP), se refiere a una disminución repentina en la perfusión de las extremidades, esto produce síntomas o signos nuevos o empeora otros preexistentes y puede amenazar la extremidad afectada1,2. El bypass ha sido el tratamiento de reperfusión durante muchos años. Posteriormente, la angioplastia transluminal percutánea (ATP) se ha convertido en una opción de tratamiento para pacientes seleccionados1,2.
Metodología
Para la realización de la presente revisión bibliográfica se han utilizado diferentes fuentes bibliográficas primarias y secundarias obtenidas de motores de búsqueda como PubMed, Trip, Scopus y Google Scholar, con las siguientes palabras clave y términos MeSH: “lower limb critical ischaemia”, “peripheral arterial disease”, “lower-limb revascularization”, “endovascular intervention”, “peripheral bypass”. Adicionalmente se formularon preguntas PICO en la búsqueda de los estudios relacionados con terapéutica utilizando el motor de búsqueda Trip. Como filtros adicionales se utilizaron en el tipo de artículo: “meta-analysis”, “randomized controlled trial”, “clinical trial”, “review”, “systematic review” y se filtró por los trabajos publicados en los últimos cinco años. La búsqueda arrojó 6,957 resultados y se los discriminó de acuerdo con la pertinencia y relevancia del título de los artículos. Luego de este proceso, se descartaron 6,905 trabajos y 52 artículos continuaron en el proceso de análisis. Finalmente, se descartaron 28 trabajos y 24 fueron seleccionados para la realización de este artículo de revisión. El análisis final se realizó en formato de conclusión de acuerdo con los subtemas: epidemiología, diagnóstico y tratamiento de isquemia crónica que amenaza la extremidad (ICAE).
Definición
La ICAE se considera una de las manifestaciones de la EAP y se caracteriza por dolor en reposo y/o necrosis de los tejidos. Por ende, el término debe usarse solo para pacientes con patología con componente isquémico crónico, con síntomas de más de dos semanas (dolor isquémico crónico de reposo, úlceras o gangrena) y por enfermedad arterial oclusiva demostrada objetivamente. El dolor isquémico en reposo se describe como aquel que afecta la parte delantera del pie y, a menudo, empeora con el decúbito. Debe estar presente durante más de dos semanas y estar asociado con uno o más parámetros hemodinámicos anormales. Estos parámetros incluyen un índice tobillo-brazo (ITB) < 0.4 (usando la parte superior de las arterias dorsalis pedis [DP] y tibial posterior [TP]), o una presión sistólica absoluta más alta en el tobillo < 50 mmHg, presión sistólica absoluta más alta a nivel del dedo < 30 mmHg1,2.
Epidemiología
En 2010, las estimaciones sugirieron que más de 200 millones de personas en todo el mundo vivían con EAP. Esto representó un aumento del 23.5% desde el año 2000, un aumento que se cree que es en gran parte atribuible al envejecimiento de la población y la creciente prevalencia de factores de riesgo, en particular la diabetes mellitus3.
La prevalencia de la ICAE se estima en aproximadamente 2 millones de personas en EE.UU.; además, se prevé que su incidencia crecerá debido al aumento en el desarrollo de los factores de riesgo: edad, tabaquismo, diabetes mellitus, hipertensión arterial y dislipidemia, entre otros. La hospitalización de pacientes con esta entidad es común y hasta el 60% son readmitidos dentro de los seis meses4,5.
El consenso entre sociedades transatlánticas para el manejo de la enfermedad arterial periférica (TransAtlantic Intersociety Consensus [TASC II]) ha estimado que la incidencia de ICAE, como se deduce de la historia natural de la EAP y las tasas de amputación, sería de aproximadamente 500 a 1,000/millón/año en la población europea y norteamericana (150,000 casos/año en los EE.UU.). Además, es importante mencionar que el 80% de las amputaciones no traumáticas se deben a ICAE5.
Finalmente, el estudio TASC II señaló que del 5 al 10% de los pacientes con EAP asintomática o claudicación progresarán a ICAE dentro de los cinco años. Hasta el 1 al 3% de los pacientes con EAP presentan inicialmente ICAE5.
Factores de riesgo
En la mayoría de los casos, la aterosclerosis causa ICAE. Por lo tanto, los factores asociados con la aterosclerosis también aumentan el riesgo de ICAE, incluida la hipertensión, la hiperlipidemia, la diabetes, el consumo de tabaco, los antecedentes familiares de enfermedad cardiovascular y la enfermedad renal crónica (ERC)6,7. Otras etiologías conocidas incluyen enfermedad quística de la adventicia, enfermedad de Beurger, disección, displasia fibromuscular, atrapamiento poplíteo, tromboembolia y traumatismo7.
Diagnóstico
La isquemia crónica que pone en peligro las extremidades se sospecha en pacientes con factores de riesgo ateroscleróticos que tienen dolor característico, pérdida de tejido o ambos en la parte distal de la pierna o el pie6,7. El dolor isquémico ocurre en reposo y afecta el antepié; suele empeorar por la noche, algunos pacientes tienen entumecimiento en lugar de dolor. El dolor empeora con la elevación y disminuye con la dependencia (colocación del pie por debajo del nivel del corazón). Los síntomas típicamente se desarrollan en pacientes que están en cama y se puede obtener alivio colgando el pie afectado6,7. El dolor es causado por una combinación de isquemia, neuropatía isquémica y pérdida de tejido, si está presente. En los pacientes con diabetes, las heridas del pie suelen ser indoloras debido a la neuropatía periférica concomitante6,7.
La evaluación clínica debe centrarse en los síntomas del paciente, los factores de riesgo cardiovasculares y las comorbilidades8.
El examen vascular incluye inspección, auscultación de estructuras vasculares y palpación de pulsos axiales o evaluación con Doppler manual. El objetivo de las pruebas diagnósticas en pacientes con ICAE es confirmar la presencia de EAP, identificar la distribución y el significado hemodinámico de la enfermedad y proporcionar información anatómica para planificar un procedimiento de revascularización8,9.
Índice tobillo-brazo e índice dedo del pie-brazo
El índice tobillo-brazo (ITB) es una prueba simple y no invasiva que se puede usar en la mayoría de los entornos clínicos para establecer un diagnóstico de EAP. El ITB es una relación entre la presión arterial sistólica del tobillo y la presión arterial braquial9. Un rango normal para el ITB es de 0.91 a 1, valores de 1.3 o más son anormales y se consideran falsamente elevados o no comprimibles, generalmente debido a vasos tibiales muy calcificados. En estos pacientes, el ITB no puede utilizarse como índice diagnóstico. Un ITB de 0.41 a 0.9 es compatible con EAP de leve a moderada, y un ITB < 0.4 es compatible con EAP grave. Además, los pacientes con un ITB < 0.4 tienen más probabilidades de tener ICAE con dolor en reposo o pérdida de tejido9,10.
El ITB es un índice útil, pero tiene algunas limitaciones, por ejemplo, tiene una confiabilidad limitada en pacientes que tienen una presión de tobillo falsamente elevada; en estos casos, el resultado es la ilusión de un ITB normal cuando en realidad hay una isquemia significativa. Además, los pacientes con diabetes mellitus o ERC avanzada pueden tener un ITB falsamente elevado debido a vasos tibiales severamente calcificados10.
Otra prueba no invasiva, el índice dedo del pie-brazo (IDB), puede utilizarse en pacientes con ITB no comprimible para evaluar y controlar la enfermedad a lo largo del tiempo porque las arterias digitales rara vez no son comprimibles. Un IDB de 0.70 es anormal y diagnóstico de EAP10.
También los valores de ITB superiores a 1.4 se correlacionan con eventos cardiovasculares adversos mayores y podrían interpretarse como calcificación o endurecimiento de las arterias de las extremidades inferiores, especialmente en pacientes diabéticos9,10.
Evaluación de la microcirculación de la piel
La perfusión tisular inadecuada es la etiología subyacente de la ICAE y el objetivo de la revascularización es restaurar la perfusión tisular para adaptarse a las demandas del tejido afectado11. Hay que considerar dos aspectos importantes con respecto a la funcionalidad de la microcirculación cutánea: una serie de mecanismos de defensa y un complejo sistema de regulación del flujo microvascular. En la ICAE hay una alteración en la microcirculación de la piel además de la reducción del flujo sanguíneo total. Se han desarrollado varias técnicas no invasivas, como la presión de oxígeno transcutánea y la presión de perfusión cutánea (clase IIa) para evaluar la calidad de la perfusión tisular en pacientes con ICAE11.
La oximetría transcutánea (TcPO2) mide el oxígeno que se ha difundido desde el lecho capilar hacia el espacio intersticial y que no se consume durante el metabolismo celular. Se colocan pequeñas sondas en el pie o la pierna. Una TcPO2 normal es > 60 mmHg12. Una TcPO2 < 30 mmHg indica una perfusión severamente reducida al tejido objetivo. La mayoría de los estudios sugieren que una TcPO2 > 40 mmHg favorece la cicatrización de heridas, mientras que los valores < 20 mmHg se asocian con tasas más bajas de cicatrización de heridas12. La fiabilidad de la TcPO2 no se ve influida por vasos muy calcificados y, por lo tanto, es especialmente útil en pacientes diabéticos y con nefropatía avanzada, en los que el ITB suele ser poco fiable13,14.
En la tabla 1 se detallan las demás herramientas hemodinámicas que pueden utilizarse para el diagnóstico de la ICAE.
Tabla 1 Pruebas vasculares no invasivas en la isquemia crónica que amenaza las extremidades
| Prueba | Descripción | Hallazgos normales | Hallazgos consistentes con isquemia crónica que amenaza las extremidades | Ventajas | Desventajas |
|---|---|---|---|---|---|
| Presión de tobillo e índice tobillo-brazo | Las presiones arteriales sistólicas se miden con el uso de manguitos para extremidades en el tobillo (arterias dorsal del pie y tibial posterior) y con una sonda Doppler | Índice tobillo-brazo > 0.9 | Presión en el tobillo < 70 mmHg para pérdida de tejido y < 50 mmHg para dolor isquémico en reposo; índice tobillo-brazo < 0.5 | Ampliamente disponible, simple de realizar, barato | Puede ser falsamente elevada o normal en pacientes con arterias tibiales calcificadas |
| Presión del dedo del pie e índice dedo del pie-brazo | La presión sistólica en el dedo del pie (generalmente el primer dedo del pie) se obtiene con el uso de un manguito oclusivo pequeño y el flujo distal se mide con un sensor de flujo | Índice dedo del pie-brazo > 0.75 | Presión en los dedos del pie < 50 mmHg para pérdida de tejido y < 30 mmHg para dolor isquémico en reposo; índice dedo del pie-brazo < 0.3 | Simple de realizar, barato, útil en pacientes con arterias tibiales no comprimibles | Los puños de los dedos no están disponibles siempre, las arterias digitales pueden ser incompresibles |
| Registros de volumen de pulso | Los cambios en el volumen de las extremidades con el ciclo cardiaco se registran con el uso de manguitos de extremidades conectados a un pletismógrafo | Formas de onda de gran amplitud con muesca dicrótica | Formas de onda de baja amplitud en el tobillo y pie | Útil en pacientes con arterias poco compresibles o no compresibles | No ampliamente disponible, subjetivo, cualitativa y puede ser anormal con insuficiencia cardiaca grave |
| Formas de onda Doppler | Se evalúa el flujo Doppler de onda continua en el tobillo (arteria dorsal del pie y tibial posterior) | Formas de onda Doppler trifásicas o bifásicas | Formas de onda monofásicas de baja amplitud en el tobillo | Ampliamente disponible, simple de realizar, útil en pacientes con mal arterias compresibles o no compresibles | Subjetivo y cualitativo |
| TcPO2 | La medición de TcPO2 se realiza en el miembro distal con el uso de electrodos y se compara con un valor de referencia (tórax) | TcPO2 > 60 mmHg | TcPO2 < 40 mmHg para pérdida de tejido y < 20 mmHg para dolor isquémico en reposo | Útil para evaluar la perfusión y el potencial de curación, no afectado por la calcificación arterial | Depende de múltiples factores (temperatura ambiente y de la piel, edema, obesidad e hiperqueratosis) |
TcPO2: oximetría transcutánea.
Imágenes anatómicas
La angiografía por sustracción digital (ASD) (Fig. 1) se considera el método de referencia para la obtención de imágenes arteriales. Sin embargo, la angiografía por tomografía computarizada (ATC), la angiografía por resonancia magnética (ARM) y la ecografía dúplex (ED) también pueden ser útiles para guiar la planificación del procedimiento y, con frecuencia, representan las herramientas iniciales de mapeo en muchos centros13.
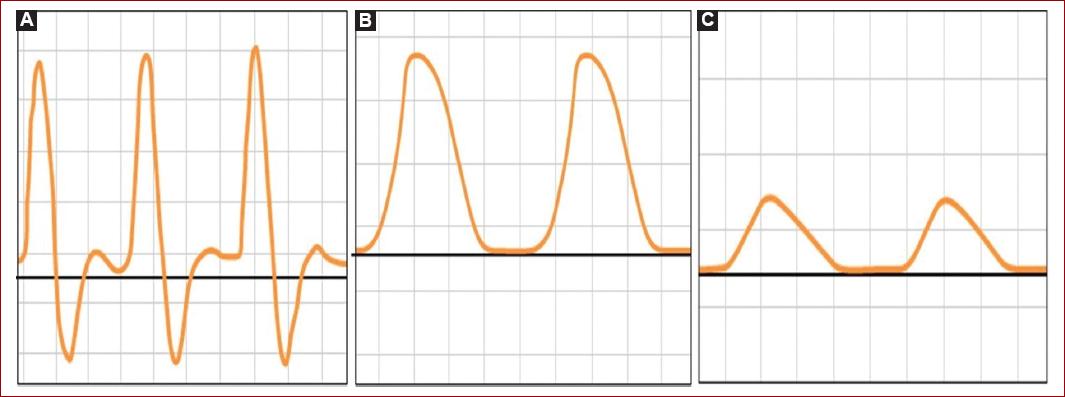
Figura 1 Espectro Doppler en la isquemia crónica que amenaza la extremidad. A: la forma de onda Doppler normal tiene una carrera ascendente rápida, un pico pronunciado, una carrera descendente rápida, inversión del flujo y reanudación del flujo directo. B: la señal bifásica tiene una carrera ascendente rápida, un pico agudo y una carrera descendente bastante rápida, con un periodo breve de flujo anterógrado en la diástole. Se observa una forma de onda Doppler arterial bifásica con enfermedad oclusiva arterial de un solo nivel. C: la señal Doppler monofásica tiene un movimiento ascendente lento, un pico redondeado, un movimiento descendente lento, sin inversión del flujo y no es pulsátil. Se observa una forma de onda Doppler arterial monofásica en la enfermedad arterial obstructiva multinivel (creada por los autores).
La ED es una modalidad de imagen no invasiva y económica que puede proporcionar tanto datos fisiológicos como imágenes anatómicas en una variedad de entornos clínicos (imagen en modo B/Doppler de onda pulsada)13. Las imágenes en modo B deben realizarse en orientación longitudinal y transversal para permitir una imagen adecuada de la pared del vaso13,14. La adición de Doppler de flujo de color permite la identificación de áreas de turbulencia. El análisis espectral y de forma de onda Doppler pulsado debe realizarse sistemáticamente en todos los segmentos del vaso, con especial atención a las áreas donde el modo B y el Doppler color identifican anomalías. Las ondas Doppler arteriales periféricas normales son trifásicas. En presencia de placa o estenosis se observa ensanchamiento espectral y formas de onda alteradas en las imágenes arteriales periféricas13,14.
La ATC (Fig. 2) es una modalidad de imagen no invasiva que se ha vuelto ampliamente aceptada como técnica de imagen primaria en pacientes con ICAE. Tiene una alta precisión para identificar, caracterizar y medir la enfermedad oclusiva arterial periférica, con una sensibilidad del 91% y una especificidad del 93 al 96% en comparación con la ASD13,14. También hay varios inconvenientes; por ejemplo, los agentes de contraste yodados utilizados para la ATC son nefrotóxicos y, por lo tanto, deben usarse con precaución en pacientes con insuficiencia renal14.

Figura 2 Diagrama de flujo para la investigación de pacientes que se presentan con sospecha de isquemia crónica que amenaza la extremidad (ICAE). ITB: índice tobillo-brazo; EAP: enfermedad arterial periférica; IDB: índice dedo del pie-brazo; WIfI: herida, isquemia e infección del pie (Wound, Ischemia, and foot Infection).
La ARM ha surgido como otra modalidad diagnóstica no invasiva que proporciona imágenes de alta resolución de la aorta y el árbol vascular periférico en pacientes con ICAE. Los agentes de contraste a base de gadolinio son los agentes de contraste más utilizados para la ARM. Aunque es raro, se ha descrito en la literatura el riesgo de desarrollar insuficiencia renal aguda y fibrosis sistémica nefrogénica después de la ARM con gadolinio13,14. La ARM ha demostrado tener una sensibilidad del 73 al 98% y una especificidad del 64 al 97% para la detección de lesiones estenóticas periféricas > 50% y oclusiones.
La elección de ultrasonido Doppler, ATC o ARM dependerá de la experiencia local, la disponibilidad y el costo, y su uso debe adaptarse a las necesidades de cada paciente13,14.
La angiografía invasiva sigue siendo el método de referencia para el diagnóstico de ICAE. La ASD con el potencial concomitante para la intervención endovascular ofrece una opción atractiva con morbilidad reducida, especialmente en pacientes de alto riesgo con arteriopatía coronaria coexistente14. Sin embargo, es la estrategia de imagen más costosa, requiere contraste yodado nefrotóxico, expone al paciente a radiación y es invasivo, con posibles complicaciones locales y sistémicas (p. ej., hematoma, pseudoaneurisma, fístula arteriovenosa). Actualmente se están investigando otras tecnologías de vanguardia, pero es posible que su disponibilidad sea limitada10,11.
Tratamiento
Se han desarrollado sistemas de clasificación para la gravedad de la ICAE para predecir el riesgo de amputación y los resultados del tratamiento. Los esquemas de clasificación de Fontaine y Rutherford clasificaron históricamente a los pacientes en función de los síntomas clínicos solos o en combinación con hallazgos hemodinámicos objetivos13 (Tabla 2). El sistema de clasificación de la Society for Vascular Surgery Wound, Ischemia, and foot Infection (WIfI)13 (Tabla 3) estratifica de manera más integral el riesgo de los pacientes con ICAE, incorporando otros factores que amenazan la extremidad, incluida la extensión de la herida y la infección. Los estudios de validación demostraron que la puntuación WIfI se correlaciona con el riesgo de amputación, los resultados del tratamiento, la necesidad de reintervención y los costos de atención médica13,14.
Tabla 2 Clasificación y graduación de la isquemia de las extremidades
| Clasificación de Fontaine | Clasificación de Rutherford | |||
|---|---|---|---|---|
| Grado | Síntomas | Grado | Categoría | Síntomas |
| Grado I | No síntomas | 0 | 0 | Asintomático |
| Grado II | Claudicación intermitente subdividida en: | I | 1 | Claudicación leve |
| Grado III | A una distancia > 200 m (2a) | I | 2 | Claudicación moderada |
| Grado IV | A una distancia < 200 m (2b) | I | 3 | Claudicación severa |
| Dolor nocturno y/o de reposo | II | 4 | Dolor en reposo | |
| Necrosis tisular y/o gangrena en la extremidad | III | 5 | Ulceración isquémica que no exceda la | |
| III | 6 | úlcera de los dedos del pie | ||
| Úlceras isquémicas severas o gangrena franca | ||||
Adaptada de Fabiani, 201714.
Tabla 3 Sistema de clasificación de extremidades amenazadas de las extremidades inferiores de la Society for Vascular Surgery Wound, Ischemia, and foot Infection (SVS WIfI)
| Herida | ||
|---|---|---|
| Grado | Úlcera | Gangrena |
| 0 | No úlcera | No gangrena |
| 1 | Úlcera pequeña y poco profunda en la parte distal de la pierna | No gangrena |
| 2 | o el pie; sin hueso expuesto, a menos que se limite a la falange distal | Cambios gangrenosos limitados a los dedos |
| 3 | Úlcera más profunda con hueso, articulación o tendón expuesto, generalmente sin involucrar el talón; úlcera de talón superficial, sin afectación del calcáneo Úlcera extensa y profunda que afecta el antepié y/o la parte media del pie; úlcera profunda de espesor total en el talón+afectación del calcáneo | Gangrena extensa que afecta el antepié/mediopié; necrosis de espesor total del talón + afectación del calcáneo |
| Grado de isquemia | ||
| ITB | Presión sistólica del tobillo PP | |
| 0 | ≥ 0.80 | > 100 mmHg 60 mmHg |
| 1 | 0.6-0.79 | 70-100 mmHg 40-59 mmHg |
| 2 | 0.4-0.59 | 50-70 mmHg 30-39 mmHg |
| 3 | ≤ 0.39 | < 50 mmHg < 30 mmHg |
| Grado de infección | ||
| Manifestación clínica de la infección | ||
| 0 | Sin síntomas ni signos de infección. | |
| Infección presente, definida por la presencia de al menos 2 de los siguientes elementos: | ||
| Hinchazón o induración local | ||
| Eritema 0.5-2 cm alrededor de la úlcera | ||
| Sensibilidad o dolor local | ||
| Calidez local | ||
| Secreción purulenta (secreción espesa, opaca a blanca o sanguínea) | ||
| I | Infección local que involucra solo la piel y el tejido subcutáneo | |
| Excluir otras causas de una respuesta inflamatoria de la piel (trauma, gota, Charcot aguda, fractura, trombosis, estasis venosa) | ||
| II | Infección local con eritema > 2 cm, o que involucra estructuras más profundas que la piel y los tejidos subcutáneos, y sin signos de respuesta inflamatoria sistémica | |
| Sin signos de respuesta inflamatoria sistémica | ||
| III | Infección local con los signos de SIRS, manifestada por 2 o más de los siguientes: | |
| Temperatura > 38 o < 36 ºC | ||
| Frecuencia cardiaca > 90 latidos/min | ||
| Frecuencia respiratoria > 20 respiraciones/min o PaCO2 < 32 mmHg | ||
| Recuento de glóbulos blancos > 12,000/o < 4,000/mm3 o 10% de bandas inmaduras | ||
ITB: índice tobillo-brazo; PaCO2: presión parcial de dióxido de carbono; PP: presión del dedo del pie; SIRS: síndrome de respuesta inflamatoria sistémica. Adaptada de Fabiani, 201714.
El reconocimiento temprano y la modificación de los factores de riesgo en arteriopatía son esenciales para disminuir la gravedad de los síntomas y reducir la incidencia de ICAE13,14. Un resultado primario en ICAE es extender la supervivencia sin amputación. La amputación mayor (por encima del tobillo) en ICAE es necesaria e indicada en presencia de una infección que amenaza la vida, cuando no se puede controlar el dolor en reposo o cuando se ha producido una necrosis extensa que destruyó el pie13,14.
Los pacientes con ICAE a menudo tienen enfermedad multinivel y el grado de revascularización depende de los objetivos de la revascularización. Las pautas de las guías globales de cirugía vascular enfatizan la importancia de un enfoque que se adapte al paciente individual en función de numerosos factores que incluyen la presencia y el grado de pérdida de tejido; anatomía vascular específica del paciente; disponibilidad de conducto vascular; comorbilidades como el riesgo cardiaco, que impacta en la magnitud de la intervención; y presencia de diabetes o ERC, lo que afecta las opciones con respecto al uso de agentes de contraste y la probabilidad de éxito del procedimiento15,16. Para aliviar el dolor de reposo isquémico, la restauración del flujo hacia la extremidad inferior (es decir, el flujo de entrada) mediante el tratamiento de la enfermedad de la arteria aortoilíaca y/o femoral común puede ser adecuada15,16.
La terapia de revascularización puede ser quirúrgica o endovascular. Tanto el bypass quirúrgico como la ATP son enfoques potenciales para la revascularización de la extremidad. Sin embargo, estos enfoques no proporcionan los mismos resultados. Aunque es muy utilizado el esquema desarrollado por el TransAtlantic Intersociety Consensus II, mediante el cual se puede abordar cada lesión desde una perspectiva anatómica15,16 (Tabla 4).
Tabla 4 Esquema de abordaje según el TransAtlantic Intersociety Consensus II
| Tipo | Abordaje |
|---|---|
| A | Lesiones que dan excelentes resultados y deben ser tratadas por medios endovasculares |
| B | Ofrecen resultados lo suficientemente buenos con los métodos endovasculares como para que este abordaje sea el primero que se prefiera, salvo que se requiera una revascularización abierta para otras lesiones asociadas |
| C | Producen resultados superiores a largo plazo con la revascularización abierta, y los métodos endovasculares deben usarse solo en pacientes con alto riesgo de reparación abierta |
| D | Las más adecuadas para la revascularización quirúrgica y cuando no se justifica el abordaje endovascular |
La revascularización es la piedra angular de la terapia para ICAE y tiene una recomendación de clase I por todas las guías internacionales. Sin revascularización, hasta el 40% de los pacientes con ICAE requerirán amputación de miembros inferiores en un año17. Los objetivos de esta son: aliviar el dolor de descanso, curar heridas y mejorar el funcionamiento físico17,18.
Las técnicas endovasculares incluyen angioplastia (en la que un globo desplaza la placa intraluminal), colocación de stent o injerto de stent (en la que un andamio mantiene la ganancia luminal después del desplazamiento de la placa), o aterectomía (en la que se elimina o elimina la placa)18,19. Los avances más recientes incluyen el uso de balones recubiertos de fármaco, stents liberadores de fármaco, nuevas plataformas de stent, complementos para cruzar oclusiones largas y la capacidad de volver a entrar en la luz del vaso si el cruce de la lesión se produjo por debajo de la íntima18,19. Es importante tener en cuenta que muchos de los dispositivos fueron aprobados para su uso en pacientes con claudicación, y no ICAE, debido al diseño del ensayo para limitar pacientes con peores resultados18,19. A pesar de esta limitación, los datos actuales sugieren que los stents metálicos desnudos tienen una ventaja sobre la angioplastia con balón en las lesiones de la arteria femoral superficial, ya que los stents de metal desnudo en la arteria femoral superficial de pacientes con ICAE superan a la angioplastia y tienen una tasa de permeabilidad del 58 al 68% y una tasa de salvación de la extremidad del 67 al 75% a los tres años18,19.
En la revascularización quirúrgica se debe realizar una planificación preoperatoria. La vena safena ipsilateral autógena es el conducto preferido para los injertos de derivación infrainguinales. Un conducto de alta calidad es fundamental para una derivación exitosa y tiene implicaciones directas para los resultados de permeabilidad a corto y largo plazo19,20.
Un ensayo aleatorizado y controlado publicado, el ensayo Bypass versus Angioplastia in Severe Ischemia of the Leg (BASIL), ha comparado directamente los resultados de la revascularización quirúrgica y endovascular entre pacientes con isquemia grave de las extremidades21.
Entre los 452 pacientes del ensayo no hubo diferencias significativas en el criterio principal de valoración de supervivencia sin amputación a los tres años entre los pacientes que habían sido asignados al azar para someterse a un bypass infrainguinal como primer procedimiento y los que habían sido asignados a un estrategia de angioplastia primero. Sin embargo, los pacientes que fueron tratados con derivación después del fracaso de la angioplastia tuvieron peores resultados que aquellos que fueron tratados con derivación primaria20,21.
En la fase III del ensayo BASIL-2 se determinó que el abordaje endovascular como primera línea de tratamiento se asoció con una mejor supervivencia sin amputación, que se debió en gran medida a menos muertes en el mejor grupo de tratamiento endovascular21.
Por último, el BEST (Endovascular Versus Best Surgical Therapy in Patients with Critical Limb Ischemia Trial [BEST-CLI]) comparó la efectividad del mejor tratamiento quirúrgico disponible contra el mejor tratamiento endovascular disponible; en aquellos pacientes adultos con ICAE que podían ser elegibles para ambas opciones de tratamiento, con un desenlace primario compuesto por eventos adversos mayores en las extremidades o muerte por cualquier causa. Después de 2.7 años de seguimiento, esto ocurrió en 302 de 709 pacientes (42.8%) en el grupo quirúrgico y en 408 de 711 pacientes (57.4%) en el grupo endovascular (p < 0.001)22,23.
Finalmente, todo paciente revascularizado debe continuar un tratamiento farmacológico en pro de un mayor tiempo libre de reestenosis y en aquellos pacientes no candidatos a revascularización puede ser la única opción terapéutica. Las guías globales sobre ICAE mencionan que los prostanoides pueden ser una opción terapéutica para aliviar el dolor en reposo, sin evidencia para la cicatrización de heridas o salvamento de extremidades. Otros enfoques terapéuticos prometedores son: la estimulación de la médula espinal, terapia hiperbárica y terapias regenerativas, incluida la terapia génica, y terapias con células madre, aún con resultados no concluyentes. En la figura 2 se puede observar un diagrama de flujo ante la sospecha de ICAE22,23.
Conclusiones
La ICAE es una entidad clínica compleja que requiere un manejo multidisciplinario y a su vez coordinado. El equipo médico debe estar compuesto por una amplia gama de especialistas, incluidos angiólogos, cardiólogos, diabetólogos, anestesistas (tratamiento del dolor), especialistas en heridas, radiólogos intervencionistas, cirujanos vasculares y, en casos específicos, ortopedistas, dermatólogos y cirujanos plásticos. Esto debido a que la viabilidad de la extremidad en cuestión puede verse amenazada, por lo que es importante un abordaje oportuno por medio de un equipo multidisciplinario, tanto en el diagnóstico adecuado como en la terapia de reperfusión (sea esta endovascular o quirúrgica), con el fin de prevenir la amputación de la extremidad o, peor aún, la muerte del paciente.











 nova página do texto(beta)
nova página do texto(beta)


