Antecedentes
Por su rápido incremento, la obesidad constituye un problema para la salud pública mundial. Esta enfermedad se caracteriza por aumento de tejido adiposo corporal, el cual se torna disfuncional, origina bajo grado de inflamación sistémica crónica y daño en diversos órganos, que se manifiestan a través del síndrome metabólico, de ahí la importancia de conocer los elementos esenciales que participan en la función inmune de este tejido, así como los cambios que se originan en él asociados con la obesidad, objetivos principales de esta revisión.
El tejido adiposo, generalmente considerado como un anexo útil para brindar protección, calor y energía, ha sobrepasado estas no menos importantes actividades y conforme avanza su estudio se ha posicionado como un órgano con funciones neuroinmuno-endocrinas, ya que a través de la producción de moléculas como hormonas, antimicrobianos, citocinas y adipocinas, participa en la función de diversas células y órganos, lo que le permite intervenir en la defensa y la homeostasis del organismo. Además, es el órgano con mayor plasticidad, ya que se regenera después de cirugía y aumenta o disminuye su tamaño dependiendo de la edad, la actividad física, la ingesta de alimentos, la función endocrina, la predisposición genética y la programación neonatal. A lo señalado, se suma su capacidad de transdiferenciación (paso de un tipo de adipocito a otro), que puede presentarse en el humano1,2 y ser reversible,3 así como la facilidad que, en ciertas condiciones, como en la inflamación crónica, tiene el adipocito de adoptar fenotipo y funciones muy similares a las del macrófago.4
Respecto a su participación en el balance de energía, el adipocito blanco la almacena, en tanto el pardo la gasta o disipa en forma de calor. A su vez, el beige tiene un fenotipo flexible y, acorde con las circunstancias fisiológicas, puede almacenar o disipar la energía.5
Publicaciones recientes incluyen un nuevo tipo de adipocito, el rosa, que proviene de la transformación reversible de adipocitos blancos y pardos en otros tipos celulares en la glándula mamaria de murinos.3
Origen y marcadores de los adipocitos
Aproximadamente la décima parte del total de grasa se renueva cada año, por muerte de adipocitos y adipogénesis; sin embargo, se ha señalado que un adipocito puede vivir hasta nueve años.
Hasta el momento, estudios encaminados a esclarecer el origen de los adipocitos parecen coincidir en que proceden de distintos linajes derivados de células madre de la mesénquima (6 1) y se han señalado numerosos genes diferentes entre los adipocitos blanco y pardo (figura 1).6 Una familia de factores de transcripción esencial para la maduración y la activación de los adipocitos blanco, pardo y beige son los PPAR (peroxisome proliferator-activated receptors).
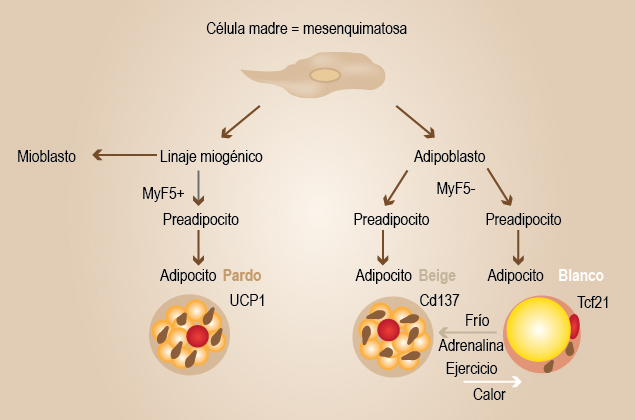
Figura 1 Origen de los adipocitos. Diversos linajes procedentes de la célula madre de la mesénquima generan los diferentes tipos de adipocitos, acorde con la expresión de distintos genes o factores de transcripción. En el humano, se originan también por el fenómeno de transdiferenciación de adipocito blanco a beige o a pardo, lo cual puede ser reversible.
Asimismo, las moléculas PAT2 (proton-coupled amino acid transporter 2) y P2RX5 (P2X purinergic receptor 5) son consideradas como marcadores de superficie de los tres tipos de adipocitos.7
El adipocito blanco deriva de la célula madre mesenquimatosa y tiene como etapas intermedias a los adipoblastos y a los preadipocitos que expresan el factor de transcripción 21. El pardo deriva de las células de la mesénquima que expresan el factor de transcripción MyF5 (myogenic regulatory factor 5) y BMP7 (morphogen bone morphogenetic protein 7).8 Los adipocitos beige pertenecen al linaje celular de los blancos y se relacionan más con BMP4,9 sin embargo, para explicar el origen del adipocito beige se han propuesto dos mecanismos:
La transdiferenciación del adipocito blanco.
Su procedencia de una población precursora diferente. Al respecto, se han señalado progenitores PDGFRα (platelet-derived growth factor receptor) los cuales son bipotenciales y pueden originar adipocitos blancos o beige. Los blancos en general no expresan MyF5, pero estudios recientes han detectado en algunos de sus progenitores a este marcador. Así, los adipocitos beige pueden ser MyF5+ o MyF5−, según el depósito de grasa donde se formen10 y expresar además marcadores como Cd137, UCP1 (uncoupling protein 1) y proteína transmembrana 26.11,12
El adipocito rosa tiene su origen en la glándula mamaria de murinos. Durante el embarazo, los adipocitos blancos se convierten en células epiteliales productoras de leche y los adipocitos pardos en células mioepiteliales, ambas consideradas como reservorios grasos. Expresan como marcadores a las moléculas S-100b y a la leptina. Al finalizar la lactancia revierten a su forma original.3
Características y funciones
Los depósitos de grasa son diferentes entre sí, aún entre los de un mismo tipo de tejido adiposo. Cada uno es complejo, integrado por distintas células, con diferentes funciones y variaciones tanto en la expresión génica,13,14 como en su respuesta a hormonas (el subcutáneo de muslos responde a hormonas sexuales, el de cuello, espalda alta y abdomen a corticoides).
Hay también diferencias metabólicas y en replicación en tejidos como el mesentérico y el omental, lo que sugiere que no son funcionalmente similares y que los diferentes depósitos del tejido adiposo constituyen “miniórganos” separados. Las diferencias regionales pueden influir en las complicaciones de la obesidad y la génesis de otra patología.
Tejido adiposo blanco
El adipocito almacena ácidos grasos y su diámetro varía de 20 a 200 μm. Contiene una gran gota de lípidos que desplaza al núcleo a la periferia, escasas mitocondrias, elementos, antibacterianos, radicales libres y óxido nítrico, citocinas y adipocinas. Posee numerosos receptores, entre otros para reconocimiento de patógenos y lípidos, tipo toll o scavenger, respectivamente, así como para insulina, citocinas y hormonas como TSH, tiroideas, corticoides, estrógenos, andrógenos.
Como responsables del paso de adipocito blanco a beige y a pardo se han señalado entre otros la exposición al frío y las cantidades elevadas de noradrenalina por tiempo prolongado, así como a la irisina y la meteorina, miocinas liberadas durante el ejercicio.15
En los depósitos de este tejido se ha observado que la densidad de las fibras nerviosas simpáticas correlaciona positivamente con el desarrollo de grasa beige;16 al respecto, estudios histoquímicos muestran que la exposición crónica al frío aumenta las fibras nerviosas noradrenérgicas. La transdiferenciación también se ha observado en pacientes con estrés prolongado por quemaduras,17 en caquexia por cáncer y en cirugía bariátrica,18 así como la conversión directa de tejido adiposo blanco a pardo en pacientes con feocromocitoma, tumor secretor de catecolaminas.19
Localización
El tejido adiposo blanco es el más abundante, está distribuido en todo el organismo y tiene varias áreas de depósito:
Subcutáneo: corresponde a 80% del total y tiene diferencias marcadas entre el hombre y la mujer. Provee aislamiento térmico y tiene menor relación con el daño metabólico secundario a obesidad, sin embargo, recientemente se ha asociado con trombosis venosa20 y disfunción de las células progenitoras.21
Perivascular: da protección y soporte estructural e influye en la contractilidad y homeostasis de la pared vascular.20
Visceral: se divide en omental o epiploico y mesentérico. Ocupa los espacios entre los órganos abdominales y los mantiene en su sitio; posee nódulos linfáticos y mayor cantidad de vasos sanguíneos y receptores adrenérgicos que el resto del tejido blanco. Los adipocitos en el tejido visceral expresan también un mayor número de receptores para corticoides y en obesidad se sobreexpresa la enzima 11 beta-hidroxiesteroide dehidrogenasa, que a partir de glucocorticoides inactivos genera activos, los cuales estimulan la adipogénesis y aumentan la grasa visceral.22
El tejido adiposo visceral tiene mayor relación con la génesis del síndrome metabólico y la patología asociada con la obesidad.22
Omental
El tejido adiposo blanco que conforma el omento, cubre y conecta bazo, estómago, páncreas y colon. Además de adipocitos, tiene gran cantidad de macrófagos y linfocitos (B1, B2, LI-2, TCD4, TCD8, T reguladores y NKT). Los linfocitos se sitúan alrededor de los vasos sanguíneos y forman conglomerados denominados “puntos lechosos”.23 Estos conglomerados colectan líquidos, partículas y bacterias de la cavidad peritoneal y son capaces de generar respuestas inmunes activadoras o supresoras y de reparación tisular peritoneal; su número aumenta cuando hay inflamación o infección abdominal.24 Existe una interacción recíproca entre los adipocitos y los grupos de linfocitos para que el omento ejerza sus funciones metabólicas, inmunitarias y de regeneración de tejidos.
En estas agrupaciones, los linfocitos B1 pueden ser estimulados por patógenos y producir IgM o IgA y los linfocitos B2 en respuestas dependientes de T, producir además IgG. Sin embargo, en el omento se puede generar un ambiente toleragénico cuando los linfocitos B1, NKT y T reguladores producen IL10.25 Como recolector, el omento es uno de los sitios principales al cual llegan metástasis de cáncer gastrointestinal y de ovario. Las células tumorales secretan TGFβ, que suprime la respuesta inmune y estimula a células mesoteliales para que segreguen factores de crecimiento y angiogénicos, lo cual, aunado a la transferencia de lípidos de los adipocitos a las células tumorales, favorece el rápido crecimiento de las metástasis.26
Mesentérico
En este sitio, los islotes de tejido adiposo se encuentran de la siguientes formas:
Conglomerados de linfocitos asociados con grasa, principalmente B1 e innatos tipo 2. Los LI-2 actúan como fagocitos, presentadores, secretan citocinas Th2 (IL4, IL5, IL6, IL13), estimulan la división de B1 y participan en la eliminación de parásitos.
Nódulos linfáticos con linfocitos predominantemente LI-2.
Funciones
Protección mecánica y soporte.
Almacén de lípidos.
Metabolismo de carbohidratos, lípidos y proteínas.
Regulación del apetito.
Fagocitosis.
Secreción de lípidos bioactivos, proteínas de fase aguda, moléculas inflamatorias, bactericidas, factores del complemento (B, D, C3), citocinas y adipocinas.
Producción de glucocorticoides.
Producción de hormonas sexuales.27
Algunos autores señalan su participación en el desarrollo de ciertas enfermedades como la de Crohn, ya que la grasa mesentérica se torna hiperplásica e hipertrófica y se desborda alrededor de los segmentos inflamados del intestino delgado, aumenta en ella la presencia de órganos linfoides terciarios y la densidad de vasos linfáticos. Se ha descrito, además, que el flujo linfático a través del mesenterio está alterado, lo que puede disminuir la captación antigénica y su función defensiva.28,29
Tejido adiposo pardo
Considerado termogénico, este tejido está constituido por células de menor tamaño que el blanco, contienen múltiples gotas de lípidos (multilocular) y el color refleja los citocromos presentes en sus numerosas mitocondrias. Estos organelos poseen abundantes crestas y una actividad sui generis, debido a la función de la proteína desacoplante (UCP1), conocida inicialmente como termogenina, que modifica la fosforilación oxidativa. Dicha modificación le permite disminuir la producción de ATP y aumentar la cantidad de energía que se disipa como calor.30
Este mecanismo aumenta la oxidación de ácidos grasos y glucosa, mejora la sensibilidad a la insulina. Se activa con la oscuridad, el frío, el estrés (noradrenalina) y las hormonas tiroideas.31 Al activarse, este tejido reduce el hipercolesterolemia y evita el desarrollo de aterosclerosis.32
El tejido pardo tiene numerosos capilares sanguíneos y terminaciones nerviosas noradrenérgicas involucradas en la regulación de su desarrollo y la termogénesis, funciones en las cuales también participan las neuronas sensoriales, situadas entre las células que integran este tejido.33,34
Localización
Predomina en el recién nacido, principalmente en regiones interescapular, perirrenal e inguinal. En el adulto, estudios basados en la captación de glucosa, a través de tomografía por emisión de positrones y de 18f-fluorodeoxyglucosa, lo han detectado en el cuello, disperso en tejido blanco y en regiones interescapular y supraclavicular. Está casi ausente en sujetos con obesidad y ancianos.35
Tejido adiposo beige
Las células tienen un tamaño intermedio entre el observado en las integrantes del tejido blanco y las del pardo; se desarrollan en los lechos capilares del tejido adiposo.38 Únicamente al ser estimuladas expresan en mitocondrias los componentes termogénicos característicos (UCP1) del adipocito pardo,12 con lo cual responden ante estímulos como el frío y algunas citocinas.39 En humanos, el envejecimiento celular impide la formación del adipocito beige por el frío.40
Además de los factores señalados en el párrafo correspondiente al tejido adiposo blanco, ciertos elementos del sistema inmune participan también en la transdiferenciación del adipocito beige. Así, se ha observado que la IL33 secretada por células del tejido adiposo activa a los linfocitos innatos LI-2, los cuales a través de elementos como el péptido met-encefalina y citocinas39 promueven la diferenciación en adipocitos beige.
Los LI-2 secretan IL5 e IL13, que activan a eosinófilos productores de IL4;39 esta citocina activa al macrófago M 2, secretor de catecolaminas, y a los precursores celulares PDGFRα+ para que se diferencien en adipocitos beige.41 Lo señalado evidencia la importante participación de las citocinas tipo Th2 (IL4, IL5, IL13) en la génesis de este adipocito. Por lo contrario, el TGF (transforming growth factor) β la inhibe.5
Funciones
Su fenotipo flexible le permite almacenar o eliminar energía acorde con las modificaciones ambientales o fisiológicas y solo expresa el componente UCP1 al ser estimulado.12 Sin embargo, estudios en ratones han mostrado que este adipocito tiene un mecanismo termogénico adicional e independiente del descrito, relacionado con el metabolismo de la creatina, el cual, como respuesta al frío o a la activación adrenérgica, utiliza energía y produce calor.42
Investigaciones recientes señalan que el tejido beige preactivado puede mejorar la tolerancia a la glucosa al ser trasplantado en ratones obesos.38
Efectos de la obesidad en el tejido adiposo
La función del tejido adiposo se modifica cuando hay obesidad; el exceso de moléculas liberadas por los adipocitos alterados y por el resto de las células locales y de nuevo ingreso en este tejido, origina un nivel bajo pero constante de inflamación (figura 2), entre otras cosas. A la remodelación del tejido blanco por hipertrofia e hiperplasia de adipocitos se suma la remodelación vascular y de la matriz extracelular.43
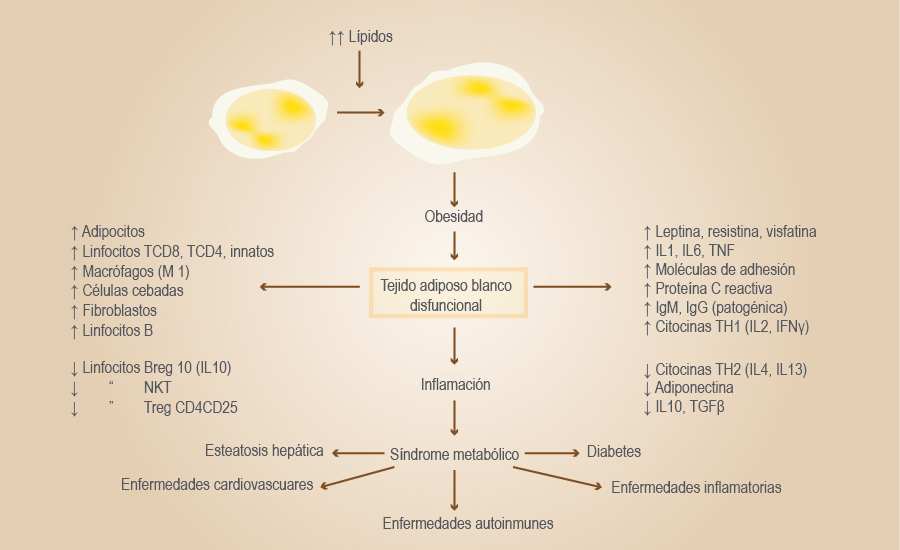
Figura 2 Alteraciones del tejido adiposo blanco y efectos inmunometabólicos. En la obesidad, tanto el número como la función normal de los integrantes celulares del tejido (columna izquierda) se alteran (columna derecha). El ambiente prooxidativo y proinflamatorio que se origina en este tejido induce resistencia a la insulina y daño en otros órganos, lo cual genera alteraciones inductoras del síndrome metabólico.
Acorde con lo anterior, en obesidad sostenida hay fibroinflamación, lo cual exacerba la alteración funcional del tejido adiposo, hay resistencia a la insulina y favorece la presentación de diabetes tipo II y enfermedad cardiovascular. Incluso, se ha señalado que el tejido adiposo pardo puede modificar su actuación y funcionar como el blanco.
Se han planteado varios mecanismos44 para explicar la patofisiología de los trastornos metabólicos inducidos por la obesidad, entre otros:
Desbalance crónico de energía.
Mayor captación por tejido adiposo de lípidos endógenos o provenientes de la dieta.
Depósitos ectópicos de grasa y aumento de los normales con predominio del visceral.
Expansión exagerada de adipocitos con limitación angiogénica que conduce a isquemia y fibrosis.
Hipoxia.
Apoptosis o necrosis de adipocitos.
Toxicidad inducida por lípidos, con daño a integrantes celulares.
Aumento de especies reactivas de oxígeno.
Estrés oxidativo del retículo endoplásmico y disfunción mitocondrial.
Ambiente prooxidativo que recluta células e induce polarización proinflamatoria.
Disfunción del tejido adiposo blanco, con modificaciones celulares tanto en número como en función y moléculas secretadas, que originan alteraciones inmunometabólicas e inflamación (figura 2). Esta disfunción incapacita al tejido adiposo para manejar a los lípidos del organismo, por lo que empiezan a acumularse en tejidos no adiposos como hígado, músculo, hueso, corazón, promoviendo en ellos resistencia a la insulina, inflamación y disfunción metabólica.
Células del tejido adiposo y modificaciones por obesidad
Numerosas células, de las cuales solo 50 % corresponde a los adipocitos, se encuentran en este tejido y participan en las funciones metabólicas e inmunitarias que ejerce en el individuo.
Célula madre mesenquimatosa
Son generadoras de diferentes tipos de adipocitos y de otras células como las de músculo y hueso, acorde con los estímulos locales o ambientales. En este tejido hay gran cantidad de células madre, por lo cual se utiliza cada vez más en procedimientos como los involucrados en la regeneración de tejidos.45
En los sujetos con obesidad, el tejido adiposo subcutáneo contiene un conjunto disfuncional de células madre precursoras de adipocitos,21 por cambios en el número y la forma de las mitocondrias.
Numerosos estudios han señalado que interacciones entre factores ambientales y genéticos son claves en el desarrollo de la obesidad. Al respecto, observaron que la obesidad induce cambios epigenéticos celulares por pérdida de metilación del ADN en ciertas regiones de las células madre mesenquimatosas. TBX 15 es uno de los genes hipometilados en sujetos obesos y es un regulador de las mitocondrias, por lo que impacta el fenotipo metabólico de los adipocitos maduros y les impide una mayor expansión, el adecuado manejo de lípidos y la prevención de la lipotoxicidad.46
Preadipocito
Los precursores del adipocito son altamente fagocíticos y en condiciones normales ayudan a eliminar gérmenes.
En obesidad se activa su transformación en adipocitos o lipogénesis; si el ingreso de ácidos grasos en este tejido es muy elevado, el preadipocito no se transforma y se torna secretor de citocinas inflamatorias. En los ancianos disminuye la transformación y aumenta la proliferación de los preadipocitos inflamatorios, así como la lipotoxicidad y la disfunción del tejido adiposo, la cual se acentúa por la presencia de adipocitos senescentes.40
Adipocito
Las principales características de los diferentes tipos han sido descritas en los rubros correspondientes.
En obesidad proliferan y aumentan de volumen por la gran captación de lípidos, a un ritmo superior a la formación de vasos sanguíneos. Como consecuencia, pueden sufrir lipotoxicidad e hipoxia, lo cual conduce a disfunción, apoptosis, lisis o necrosis, con la consiguiente liberación de moléculas inflamatorias y quimioatractantes, las cuales inducen la llegada de numerosas células (macrófagos, monocitos, linfocitos). Estimulan, además, la activación proinflamatoria tanto de las células recién llegadas como de las locales, sobre las cuales pueden actuar como inductoras de su proliferación.
Fibroblasto
A las funciones secretora de colágena, reparadora de tejidos y cicatricial, se añade su capacidad de movimiento a sitios dañados y la secreción de citocinas inflamatorias (IL1, L6, TNF), antivirales (IFN) y estimulantes de la producción celular (IL5: eosinófilos, IL11: plaquetas, GMCSF: granulocitos).47
En los individuos senescentes y con obesidad, el número de fibroblastos se incrementa, así como la producción de elementos inflamatorios (citocinas) e intercelulares como la colágena, lo cual origina fibrosis en el tejido adiposo, daño que pudiera acentuarse como consecuencia del estímulo que sobre el fibroblasto ejerce el TGF-β en obesidad.48
Célula cebada
Puede derivar localmente de las células madre;49 ejerce funciones antibacterianas, de fagocitosis y presentación de antígenos.
Con la secreción de citocinas (interleucinas 3, 4, 5, 6, 8, 10, 13, TNF, GM-CSF) y su contenido granular (histamina, PG, LT, etcétera) tiene una importante participación en la inflamación,47 la cual acompaña a la disfunción por obesidad.
Macrófagos
Comprenden 10 a 15 % de las células residentes en este tejido; fagocitan, procesan y presentan antígenos. Expresan principalmente el fenotipo M 2 (antiinflamatorio) con secreción de citocinas tipo Th2 (IL4, IL5, IL10, IL13) y TGFβ, el cual es inducido por varias células entre otros linfocitos NKT, TCD4+CD25+ y eosinófilos.50
En obesidad, la cantidad de macrófagos aumenta considerablemente como respuesta al microambiente proinflamatorio y prooxidativo del tejido adiposo, el cual recluta células e induce polarización proinflamatoria; la acumulación es mayor en los depósitos viscerales. Ingresan monocitos atraídos por CCL-2 o MCPl (monocyte chemoattractant protein), quimiocina que además induce la proliferación de los macrófagos locales. El macrófago cambia su fenotipo a M-1(clásico o inflamatorio), ejerce una importante actividad a través de la secreción de IL1, IL6, TNF y se ha señalado una relación positiva entre el número de macrófagos y el grado de resistencia a la insulina.51
Estas céluas endocitan ácidos grasos (LDL) a través de receptores basureros (scavenger SRA y CD36),52 lo que en exceso puede generar células espumosas y placas de aterosclerosis en diferentes sitios.
Linfocitos
Las células B, Th, Tc, NK, NKT, así como los linfocitos Tγδ, LI-2 y TCD4CD25 FoxP3, se encuentran a diferente concentración en los distintos depósitos del tejido. En condiciones normales, la función celular del tejido adiposo está regulada por la coordinación entre los LI-2 y los eosinófilos, ambos secretores de citocinas tipo Th2 (IL4, IL5, IL10, IL13) e, importantemente, por la interacción de estos dos grupos celulares con los linfocitos TCD4+CD25+FoxP3.53
Estos linfocitos T reguladores, producen las citocinas antiinflamatorias TGFβ e IL10, así como las moléculas CTLA4 (T lymphocyte antigen 4) inactivadora del linfocito T. Las células TCD4+CD25+FoxP3 pueden, además, en momentos precisos inducir en otras células la secreción de citocinas tipo Th2 o ejercer su función antiinflamatoria y supresora de la respuesta inmune, para mantener la homeostasis de este tejido.54
En obesidad, en el tejido adiposo se incrementa la llegada de células Tc, en menor grado la de Th55 y predomina la secreción de citocinas tipo Th1 (IFNγ, IL2, TNFα). La función de los linfocitos está alterada, ya que disminuyen los reguladores B10 (secretores de IL10), TCD4+CD25+FoxP3 y los NKT, que en el tejido adiposo a través de IL2 e IL7 estimulan la producción de los linfocitos innatos 2 y de los T reguladores.56
La acumulación de lípidos en el adipocito origina lisis, hipoxia y toxicidad, con daño en organelos. El estrés celular activa cascadas proinflamatorias de señalización molecular: genes PKC, nuclear factor κB (NFκB), JNK (c-Jun N-terminal kinase) se sobreexpresan y hay producción de citocinas proinflamatorias (IL1, IL6, TNF), matriz extracelular y adipocinas.44
Adipocinas
El tejido adiposo secreta adipocinas con actividad proinflamatoria como la leptina, visfatina y resistina, o antiinflamatoria como la adiponectina y la vaspina, las cuales funcionan como redes de señalización que comunican al tejido adiposo con diferentes órganos (cerebro, hígado, linfoides, etcétera) y regulan el metabolismo. En condiciones de obesidad, su secreción contribuye a un estado bajo pero constante de inflamación, que promueve aterosclerosis y resistencia a la insulina.24
Leptina
Antes llamada proteína OB, es conocida también como la hormona de la saciedad. Es sintetizada, entre otras células, por las del tejido adiposo, hueso, músculo, macrófagos, neuronas y Th1. Regula el balance de energía57 y cuando hay privación de alimentos, disminuye el gasto metabólico para conservar la energía requerida por los órganos vitales.
Participa en la termogénesis y en la regulación del apetito al suprimir neuropéptidos orexigénicos como el Y en el hipotálamo.58 Interviene en la hematopoyesis, formación de hueso, angiogénesis, reproducción y función de órganos como el páncreas e intestino. Ha sido aprobada por la Foof and Drugs Administration para su uso en individuos con lipodistrofia generalizada.59
Participa en la respuesta inmune innata y adaptativa, activa macrófagos y linfocitos, dirige la respuesta hacia Th1 (IL2, IFNγ) y disminuye la función de TCD4CD25FoxP3. Aumenta la proliferación de los linfocitos T vírgenes (TCD4Ra) y Th17, así como la apoptosis de células como los neutrófilos y los eosinófilos.60
En elevadas cantidades, esta citocina favorece enfermedades autoinmunes y se asocia con obesidad y procesos inflamatorios.61 Aumenta en obesidad, pero no siempre lleva a cabo su función supresora del apetito en los individuos que la presentan, debido a disfunción de sus receptores en hipotálamo.62 Su deficiencia se manifiesta por obesidad, hiperfagia e hiperinsulinemia.
Adiponectina
Es sintetizada por el adipocito del tejido adiposo visceral e inhiben su producción el TNF, la leptina, los corticoides y la hipoxia. Tiene actividad antiinflamatoria: induce producción de IL10 e IL1Ra,63 promueve la diferenciación de macrófagos al fenotipo M 2, evita su transformación en célula espumosa y reduce la expresión de moléculas de adhesión endotelial, por lo cual ha sido considerada como un factor antiaterosclerosis y de protección vascular.64
Aumenta la proliferación de células epiteliales intestinales y disminuye su apoptosis; en ratones su administración revierte la inflamación intestinal.29
Guarda relación inversa con la masa del tejido adiposo y la edad. Disminuye en individuos senescentes u obesidad65 y en pacientes con resistencia a la insulina. Su deficiencia se manifiesta por inflamación sistémica, disfunción endotelial, dislipidemia y aterosclerosis.
Visfatina
La sintetizan adipocitos viscerales. Participa en el metabolismo y la inmunidad. Interviene en la diferenciación de linfocitos B, inhibe la apoptosis de neutrófilos y se ha relacionado con inflamación. Mejora la sensibilidad a la insulina, pero favorece el depósito de grasa visceral. Visfatina se une al receptor para insulina, en un sitio diferente al utilizado por la insulina y reduce la liberación de glucosa por las células del hígado.66,67
Apelina
Es sintetizada por los adipocitos, mejora la homeostasis de la glucosa y puede actuar como pro o antiinflamatoria. Está involucrada en la función cardiovascular: aumenta la contractilidad cardiaca, promueve vasodilatación del endotelio, dependiente del NO, y reduce la presión sanguínea arterial.66
La apelina articipa en el desarrollo y estabilidad de los vasos linfáticos.68 Aumenta en el colon de ratones con colitis y en el tejido adiposo mesentérico de los pacientes con enfermedad de Crohn y se ha sugerido que incrementa la densidad de vasos linfáticos en esta enfermedad.69
Al estudiar el efecto de la administración de apelina en ratones con colitis, se observó mejoría de la enfermedad, con disminución de las moléculas inflamatorias (IL1, IL6 y TNF) y aumento del drenaje linfático.70
Zinc-α2-glicoproteína
Molécula inicialmente caracterizada como un producto tumoral asociado con caquexia. Su expresión disminuye en obesidad y aumenta en caquexia; moviliza lípidos, es antiinflamatoria y estimula la producción de adiponectina por los adipocitos.71 Correlaciona directamente con la creatinina sérica y aumenta en pacientes con alto grado de filtración glomerular, por ello ha sido propuesta como un marcador precoz de nefropatía diabética.72
Proteína unidora de ácidos grasos
Es producida por los adipocitos, participa en el transporte y metabolismo de lípidos, aumenta la producción de glucosa y correlaciona con obesidad y enfermedad metabólica;73 aumenta en mujeres con diabetes mellitus gestacional y resistencia severa a la insulina.74 Ha sido señalada como un marcador de enfermedades metabólicas y cardiovascular.75
Asprosina
Este polipéptido se expresa en adipocitos blancos y actúa en hígado estimulando la producción de glucosa e insulina. Aumenta en obesidad y sus niveles se relacionan con resistencia a la insulina.76
Neurorregulina 4
Nrg4 es producida por los tejidos adiposos blanco y pardo. Protege contra resistencia a la insulina inducida por la dieta y atenúa la señalización lipogénica hepática, lo que le confiere potencial terapéutico contra el hígado graso y trastornos metabólicos, como la diabetes por obesidad.77
Batocinas
Es el nombre que recibe un grupo de moléculas derivadas del tejido adiposo pardo y comprende entre otras a factores de crecimiento: endotelial vascular, nervioso y de fibroblastos. Estas moléculas promueven el crecimiento del tejido, así como su inervación, vascularización y flujo sanguíneo.78
SLIT2 (Slit homologue 2 protein)36 y PM20DI (peptidase M20 domain-containing protein 1).
Regulan la homeostasis de la glucosa y el gasto de energía.37
Conclusión
El tejido adiposo se perfila como uno de los más importantes reguladores inmunoendocrinos de la homeostasis del organismo. Asimismo, su capacidad tanto local como sistémica para incidir en otros órganos, a través de sus redes de citocinas y adipocinas, debe ser considerada, ya que alteraciones de este tejido que es el órgano central de la inflamación en obesidad, rápidamente se relaciona con el daño a epitelios, vasos sanguíneos, piel y órganos como el hígado y el corazón. Es necesario profundizar en el estudio de la función inherente a sus células y moléculas exocitadas, ya que, a través de ellas, participa importantemente tanto en la regulación neuroinmunoendocrina como en la patología del organismo











 nova página do texto(beta)
nova página do texto(beta)



