
Toxostoma longirostre. Imagen de: Ricardo Serna Lagunes
Tragan caligatus. Imagen de: Irving de Jesús Morales Leal
INTRODUCCIÓN
El bosque mesófilo de montaña (BMM) es un ecosistema que abarca apenas el 0.5 % de la superficie del territorio mexicano, pero que sostiene la mayor diversidad de flora y fauna (Villaseñor, 2017). Sin embargo, está frecuentemente amenazado por actividades antropogénicas, como el cambio en el uso del suelo, caza furtiva y sobreexplotación de especies maderables y epífitas de uso ornamental, de acuerdo con la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, 2010) y a lo reportado por Gual-Díaz y Rendón-Correa (2017). En México, el BMM ocupa aproximadamente 8 809 km2 , según informes del Instituto Nacional de Estadística y Geografía (INEGI, 2005), y se estima que su superficie se ha reducido a menos de la mitad de su extensión original (Toledo-Aceves, 2017). Dado que representa un importante hotspot de diversidad biológica, surge la necesidad de priorizar acciones a mediano y largo plazo para implementar estrategias encaminadas a su conservación, manejo sostenible y restauración (Partida-Sedas y col., 2017).
Las aves juegan un rol ecológico preponderante en el mantenimiento de los BMM (Navarro-Sigüenza y col., 2014). Contribuyen al proceso de dispersión de semillas de una buena cantidad de especies vegetales y fungen un papel determinante en el éxito de la restauración del bosque (Hernández-Ladrón-De-Guevara y col., 2012). Sin embargo, a medida que se pierden y fragmentan áreas de BMM, quedan islas de este, en remanentes geográficamente distantes entre sí, divididos por una matriz antrópica con actividades como cultivos agrícolas, ganadería e infraestructura humana (Williams-Linera y col., 2002), por lo que las aves tienen menor hábitat para forrajear. Esto disminuye su oportunidad de encontrar recursos y su capacidad para llevar a cabo su función ecológica de dispersión de semillas y de regeneración pasiva del ecosistema (Hernández-Ladrón-De-Guevara y col., 2012). Al respecto, el BMM ubicado en el centro del estado de Veracruz ha sido reducido a fragmentos aislados entre sí, creando un paisaje agroecológico con parches en forma de mosaico, algunos a modo de corredores biológicos y otros más sin conexión alguna, lo que irrumpe su estructura y función, afectando la dinámica de la comunidad biológica (Williams-Linera y col., 2002; Partida-Sedas y col., 2017).
En diferentes municipios del centro de Veracruz se ha estudiado el papel de las aves en la restauración pasiva del BMM y se ha documentado el efecto del gradiente de perturbación de este ecosistema en relación a la diversidad de aves (Hernández-Ladrón-De-Guevara y col., 2012). En fragmentos de BMM con distinto grado de perturbación, cafetales bajo sombra y café bajo sol, se han realizado estudios sobre el comportamiento de la diversidad avifaunística en cada tipo de cobertura (Tejeda-Cruz y Gordon, 2008), y se han evaluado los cambios en la comunidad de aves asociada a los tamaños de parche de BMM (Rueda-Hernández y col., 2015).
Los estudios sobre cómo las aves usan el paisaje de BMM y otros tipos de cobertura, como una matriz agropecuaria, son necesarios para evaluar los efectos de la fragmentación sobre los cambios en la comunidad de la avifauna (Cruz-Angón y col., 2008). Debido a que los remanentes de BMM, del municipio de Huatusco, Veracruz, México, son un importante reservorio de la avifauna de la región (Ugalde-Lezama y col., 2022), es relevante su constante monitoreo para evaluar el impacto de las actividades antrópicas sobre el potencial evolutivo y adaptativo de las aves, las cuales se enfrentan a un paisaje con un gradiente heterogéneo (Romero-Díaz y col., 2022). Sin embargo, a la fecha, no se han realizado evaluaciones del uso de coberturas de BMM y vegetación secundaria por las aves en esta región.
El objetivo de este estudio fue determinar la diversidad de aves en fragmentos de bosque mesófilo de montaña y vegetación secundaria, en el predio Finca La Pastoría, Huatusco, Veracruz, así como, asociar su presencia y/o alimentación a cada hábitat evaluado.
MATERIALES Y MÉTODOS
Área de estudio
El trabajo se realizó en el predio Finca La Pastoría, ubicado en el km 2.2 de la carretera a Elotepec, cerca de la localidad de Coxolo, municipio de Huatusco, Veracruz, México (Figura 1). El clima predominante es cálido-húmedo, con una temperatura promedio anual de 19 ºC y una precipitación media anual de 1 825 mm. La vegetación predominante es BMM, a una altitud de 1 200 m y 1 400 m (Ortiz y Florescano, 2010). La superficie del predio abarca 300 ha y está caracterizada por una proporción del 50 % de vegetación de BMM (aproximadamente 150 ha), donde se encuentran especies como Liquidambar macrophyla, L. styraciflua, Quercus sapotifolia, Q. insignis, Palicourea padifolia, Trema micrantha y Ocotea psychotrioides, las cuales se consideran abundantes y representativas de este tipo de ecosistema (Carvajal-Hernández y col., 2014). En el área de estudio se estimó in situ que, de las 150 ha de superficie que no eran de BMM, el 53.3 % de la cobertura correspondía a cultivos de aguacate (80 ha), 33.3 % (50 ha) a vegetación secundaria (VS) en etapa de crecimiento tardío y el restante 13.3 % de la superficie (20 ha) estaba constituida por potreros destinados a la ganadería extensiva.
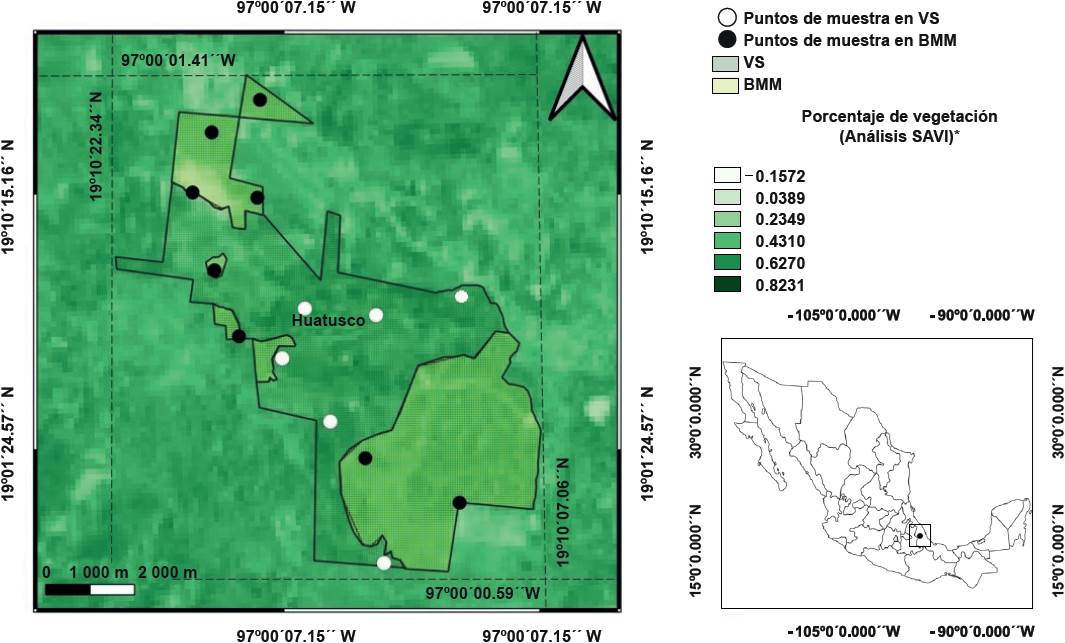
*Índice de Vegetación Ajustado al Suelo, por sus siglas en inglés: Soil Adjusted Vegetation Index (SAVI).
Figura 1 Localización del predio Finca La Pastoría, ubicado en el municipio de Huatusco, Veracruz, México. Los puntos negros representan las zonas de muestreo en el Bosque Mesófilo de Montaña (BMM) y los círculos blancos las de la Vegetación Secundaria (VS).
Características del monitoreo de aves
El registro de la diversidad de aves se hizo mediante una modificación del método propuesto por Ralph y col. (1996), que se basa en el establecimiento de puntos de muestreo con radio fijo de 25 m o 50 m según la densidad de vegetación. En el presente trabajo, los puntos fueron distribuidos aleatoriamente en las coberturas de BMM y VS, y debido a las diferentes condiciones topográficas y de acceso a diferentes zonas del área de estudio, se asignó un radio fijo de 30 m. Se establecieron 14 puntos de muestreo, 8 en remanentes de BMM y 6 en VS, a una distancia estimada de 350 m entre puntos. Los fragmentos de BMM y VS se ubicaron mediante imágenes satelitales de Google Earth Pro® y sistemas de información geográfica con el software QGIS® v. 3.18. Posteriormente, los puntos de muestreo se verificaron con recorridos en campo, de acuerdo con el Fondo Mexicano para la Conservación de la Naturaleza/Comisión Nacional Forestal/Agencia de los Estados Unidos para el Desarrollo Internacional y Servicio Forestal de los Estados Unidos (FMCN/ CONAFOR/USAID/USFS, 2018).
En cada punto de muestreo se registró a la especie y el número de individuos de la misma, durante el periodo de enero a noviembre de 2018. En total se desarrollaron 10 salidas de campo, cada una de 2 d consecutivos de duración (48 h), con un intervalo promedio entre salidas de campo de 33 d. En cada salida de campo se realizaron 2 monitoreos, uno matutino y otro vespertino. Se verificó en los puntos de muestreo, durante 30 min, el registro de cada especie observada y el número de individuos. Al finalizar el tiempo de registro en el sitio, se continuó el monitoreo en el punto de muestreo más cercano y, se dejaron pasar de 3 min a 5 min para que las aves retomaran su actividad normal (Ralph y col., 1996).
La observación de los caracteres diagnósticos de identificación de las aves se realizó con binoculares (Bushnell®, Overland Park, Kansas, USA) de 7 x 35 y una cámara digital Sony® modelo DSC-H400 (Tokio, Japón). Las especies de aves fueron identificadas taxonómicamente con las guías de campo de Peterson y Chalif (1989), Howell y Webb (1995), Sibley (2001),Ferguson y Christie (2005), y la de National Geographic (Dunn y Alderfer, 2017). En estas guías también se determinó el gremio trófico conductual con base en la preferencia alimentaria de cada ave registrada. La identificación de las especies de aves se complementó por medio de su canto, mismo que se comparó in situ con los espectogramas de vocalización de la base de datos de la aplicación web Merlin® (The Cornell Lab Ornitology, 2021); dicha aplicación se ha utilizado por ser confiable en la identificación de registros de aves por vocalización. Además, se verificó su posible presencia en la localidad, con el mapa de distribución de la especie (Barbosa y col., 2021; Tejeda y col., 2023). En el caso de registrar un ave imitadora de cantos, esta se verificó con sus caracteres de campo para asignarla a la especie correspondiente, lo que permitió descartar aves imitadoras de cantos registradas en la grabación de la aplicación de Merlin®.
El arreglo del orden y nomenclatura científica de las especies de aves, se basó en el tratado taxonómico establecido en la lista de la Sociedad Americana de Ornitología (AOS, por sus siglas en inglés: American Ornithological Society) (Chesser y col., 2021) y los nombres comunes en el listado de Escalante y col. (2014). Se registró la condición de estacionalidad de las especies basándose en Howell y Webb (1995) y Ridgely y col. (2005), y las categorías de endemismo en González-García y Gómez-de-Silva (2002). El estado de conservación de cada especie se basó en la NOM059-SEMARNAT-2010, de acuerdo con la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT, 2010).
Análisis de la diversidad (riqueza) de aves
Se calculó la suma de las probabilidades de las clases observadas, mediante el estimador de cobertura de la muestra, denominado Ĉn, utilizando la metodología descrita por Chao y Shen (2003). Este parámetro se obtiene a partir de la proporción del número total de individuos de la comunidad a la que pertenecen las especies representadas en la muestra. El método evalúa la completitud del inventario y el esfuerzo del muestreo a partir de la Ĉn, ya que mide la proporción que representan los individuos de cada especie en la muestra, con respecto al total de individuos y estandariza comunidades (Chao y Jost, 2012; López-Mejía y col., 2017), por lo que permite compararlas cuando Ĉn se aproxima a 100 en cada cobertura estudiada (Chao y Jost, 2012; Chao y col., 2016). También permite estimar el número probable de especies que debieron ser avistadas en el hábitat de estudio con base en la proporción de aves registradas. Para ello, se realizaron curvas de acumulación de la riqueza y abundancia de cada cobertura (BMM y VS) (Chao y Jost 2012), mismas que fueron comparadas mediante 100 réplicas bootstrap de inter y extrapolaciones, usando el software iNEXT (Chao y col., 2016). Se utilizaron intervalos de confianza al 95 % de las curvas de acumulación para determinar diferencias entre la comunidad de aves en el BMM y VS, cuando estos no se traslapaban (Gotelli y Colwell, 2001). Asimismo, se construyeron curvas de rango-abundancia por tipo de hábitat (BMM y VS) con la finalidad de comparar la abundancia absoluta de las 20 especies de aves con mayor presencia en el área de estudio (Aguilar y col., 2017).
La comunidad de la avifauna registrada, entre la cobertura de BMM y VS, fue evaluada mediante la comparación del número efectivo de especies (Hill, 1973) del orden q0 (análogo de la riqueza de especies), q1 (exponencial del índice de Shannon) y q2 (inverso del índice de Simpson) (Jost, 2006; Chao y col., 2014), en el software iNEXT (Chao y col., 2016), donde se estiman los intervalos de confianza al 95 % de probabilidad y se asumen diferencias significativas entre la comunidad de la avifauna si los intervalos de confianza no se traslapan (Cumming y col., 2007). Adicionalmente, dado que se consideraron condiciones ecológicas en la diversidad de aves, se realizó una prueba de Kruskall-Wallis. Este es un análisis de varianza no paramétrico que se aplicó con el fin de robustecer y dar mayor soporte al contraste de la diversidad de aves entre condiciones de hábitat a nivel de la estimación beta. Dicho análisis se realizó posterior a probar los supuestos de normalidad con una prueba de Shapiro-Wilks, y con una prueba de bondad de ajuste de Kolmogorov se evaluó la homogeneidad de varianzas de los datos de la comunidad de aves, los cuales no fueron normales y presentaron varianzas desiguales (ver resultados). Estos análisis se desarrollaron en el software Infostat (Di-Rienzo y col. 2021).
RESULTADOS Y DISCUSIÓN
Se registró un total de 100 especies de aves pertenecientes a 33 familias y 15 órdenes (Tabla 1). El orden con mayor número de especies fue Passeriformes con 66. La familia con mayor número de especies fue Tyrannidae con 13. Las especies Psilorhinus morio y Myadestes occidentalis fueron las más abundantes y su presencia fue observada con mayor frecuencia en BMM, con 98 y 82 individuos respectivamente; en tanto que, en VS se detectaron solo 18 y 22, respectivamente (Tabla 1; Figura 2). La especie Pionus senilis fue la tercera más abundante en BMM, pero su distribución fue más equitativa entre ambos hábitats con solo 53 individuos en BMM, y 41 individuos en VS, donde registró el segundo lugar en abundancia, mientras que la especie Stelgidopteryx serripennis reportó el primer lugar en este sitio, donde se obtuvieron 55 individuos. En la Figura 2 se observa que, en general, las especies mostraron mayor abundancia en BMM que en VS.
Tabla 1 Listado taxonómico de las especies de aves observadas en Finca Pastoría, Huatusco, Veracruz.
| Taxonomía | Nombre común | Estacionalidad | Endemismo | NOM | BMM | VS | Gremio |
|---|---|---|---|---|---|---|---|
| Galliformes | |||||||
| Cracidae | |||||||
| Ortalis vetula | Chachalaca vetula | R | NC | NC | 8 | 6 | OM |
| Odontophoridae | |||||||
| Dendrortyx barbatus | Codorniz-coluda veracruzana | R | E | P | 1 | 0 | OM |
| Columbiformes | |||||||
| Columbidae | |||||||
| Patagioenas flavirostris | Paloma morada | R | ne | NC | 48 | 6 | FR |
| Columbina inca | Tórtola cola larga | R | ne | NC | 2 | 0 | GR |
| Leptotila verreauxi | Paloma arroyera | R | E | Pr | 37 | 9 | GR |
| Cuculiformes | |||||||
| Cuculidae | |||||||
| Piaya cayana | Cuclillo canela | R | ne | NC | 16 | 2 | IN |
| Caprimulgiformes | |||||||
| Caprimulgidae | |||||||
| Nyctidromus albicollis | Chotacabras pauraque | R | NC | NC | 4 | 0 | IN |
| Apodiformes | |||||||
| Apodidae | |||||||
| Chaetura vauxi | Vencejo de Vaux | R | NC | NC | 4 | 6 | IN |
| Trochilidae | |||||||
| Selasphorus heloisa | Zumbador mexicano | R | NC | NC | 1 | 0 | NE |
| Campylopterus hemileucurus | Fandanguero morado | R | NC | NC | 10 | 0 | NE |
| Saucerottia cyanocephala | Colibrí corona azul | R | NC | NC | 1 | 0 | NE |
| Gruiformes | |||||||
| Rallidae | |||||||
| Aramides albiventris | Rascón cuello gris | R | ne | NC | 2 | 0 | FR |
| Charadriiformes | |||||||
| Charadriidae | |||||||
| Charadrius vociferus | Chorlo tildío | MI | NC | NC | 0 | 1 | IN |
| Pelecaniformes | |||||||
| Ardeidae | |||||||
| Ardea alba | Garza blanca | MI | ne | NC | 0 | 2 | CA |
| Bubulcus ibis | Garza ganadera | MI | Exo | NC | 11 | 2 | IN |
| Cathartiformes | |||||||
| Cathartidae | |||||||
| Cathartes aura | Zopilote aura | R | ne | NC | 18 | 7 | CR |
| Accipitriformes | |||||||
| Accipitridae | |||||||
| Elanus leucurus | Milano cola blanca | R | NC | NC | 1 | 1 | CA |
| Circus hudsonius | Gavilán rastrero | MI | NC | NC | 1 | 0 | CA |
| Rupornis magnirostris | Aguililla caminera | R | ne | NC | 29 | 14 | CA |
| Trogoniformes | |||||||
| Trogonidae | |||||||
| Trogon caligatus | Trogón listado | R | NC | NC | 21 | 1 | IN |
| Piciformes | |||||||
| Picidae | |||||||
| Melanerpes formicivorus | Carpintero bellotero | R | NC | NC | 30 | 17 | IN |
| Melanerpes aurifrons | Carpintero cheje | R | NC | NC | 20 | 1 | IN |
| Sphyrapicus varius | Chupasavia maculado | MI | NC | NC | 5 | 1 | IN |
| Dryobates scalaris | Carpintero mexicano | R | ne | NC | 2 | 0 | IN |
| Dryocopus lineatus | Carpintero lineado | R | NC | NC | 9 | 0 | IN |
| Falconiformes | |||||||
| Falconidae | |||||||
| Herpetotheres cachinnans | Halcón guaco | R | NC | NC | 2 | 0 | CA |
| Micrastur semitorquatus | Halcón-selvático de collar | R | ne | Pr | 4 | 1 | CA |
| Caracara cheriway | Caracara quebrantahuesos | R | NC | NC | 4 | 0 | CR |
| Falco sparverius | Cernícalo americano | MI | NC | NC | 3 | 4 | CA |
| Falco peregrinus | Halcón peregrino | R | NC | Pr | 0 | 1 | CA |
| Psittaciformes | |||||||
| Psittacidae | |||||||
| Amazona albifrons | Loro frente blanca | R | ne | Pr | 2 | 0 | FR |
| Amazona autumnalis | Loro cachete amarillo | R | NC | NC | 5 | 2 | GR |
| Pionus senilis | Loro corona blanca | R | ne | A | 53 | 41 | FR |
| Passeriformes | |||||||
| Thamnophilidae | |||||||
| Thamnophilus doliatus | Batará barrado | R | NC | NC | 1 | 0 | IN |
| Furnariidae | |||||||
| Xiphorhynchus flavigaster | Trepatroncos bigotudo | R | NC | NC | 1 | 2 | OM |
| Lepidocolaptes affinis | Trepatroncos corona punteada | R | NC | NC | 2 | 0 | IN |
| Tityridae | |||||||
| Tityra semifasciata | Titira enmascarada | R | NC | NC | 11 | 0 | IN |
| Tyrannidae | |||||||
| Mionectes oleagineus | Mosquero ocrillo | R | NC | NC | 0 | 1 | FR |
| Myiarchus tuberculifer | Papamoscas triste | R | NC | NC | 18 | 2 | IN |
| Pitangus sulphuratus | Luis bien-te-veo | R | ne | NC | 7 | 2 | IN |
| Megarynchus pitangua | Luis pico grueso | R | ne | NC | 1 | 0 | IN |
| Myiozetetes similis | Luis gregario | R | ne | NC | 30 | 19 | FR |
| Tyrannus melancholicus | Tirano tropical | R | ne | NC | 3 | 6 | IN |
| Tyrannus couchii | Tirano silbador | R | ne | NC | 0 | 3 | IN |
| Contopus cooperi | Pibí boreal | T | NC | NC | 5 | 0 | IN |
| Contopus pertinax | Pibí tengo frío | R | NC | NC | 0 | 1 | IN |
| Contopus virens | Pibí oriental | T | NC | NC | 1 | 0 | IN |
| Empidonax minimus | Mosquero mínimo | MI | NC | NC | 4 | 3 | IN |
| Sayornis nigricans | Papamoscas negro | R | NC | NC | 0 | 1 | IN |
| Pyrocephalus rubinus | Mosquero cardenal | R | NC | NC | 1 | 2 | IN |
| Vireonidae | |||||||
| Vireo griseus | Vireo ojos blancos | MI | E | A | 0 | 1 | IN |
| Vireo solitarius | Vireo cabeza azul | MI | NC | NC | 0 | 1 | IN |
| Corvidae | |||||||
| Psilorhinus morio | Chara papán | R | ne | NC | 98 | 18 | IN |
| Hirundinidae | |||||||
| Stelgidopteryx serripennis | Golondrina alas aserradas | R-MI | ne | NC | 29 | 55 | IN |
| Troglodytidae | |||||||
| Troglodytes aedon | Chivirín saltapared | R-MI | E | NC | 16 | 6 | IN |
| Campylorhynchus zonatus | Matraca tropical | R | ne | NC | 20 | 0 | IN |
| Campylorhynchus megalopterus | Matraca barrada | R | E | NC | 2 | 0 | IN |
| Pheugopedius maculipectus | Chivirín moteado | R | NC | NC | 16 | 2 | IN |
| Henicorhina leucosticta | Chivirín pecho blanco | R | ne | NC | 1 | 0 | IN |
| Polioptilidae | |||||||
| Polioptila caerulea | Perlita azul gris | R | NC | NC | 15 | 1 | IN |
| Turdidae | |||||||
| Sialia sialis | Azulejo garganta canela | R | NC | NC | 1 | 5 | FR |
| Myadestes occidentalis | Clarín jilguero | R | NC | Pr | 82 | 22 | FR |
| Catharus aurantiirostris | Zorzal pico anaranjado | R | NC | NC | 1 | 0 | FR |
| Turdus grayi | Mirlo pardo | R | ne | NC | 10 | 0 | IN |
| Mimidae | |||||||
| Melanotis caerulescens | Mulato azul | R | E | NC | 3 | 0 | FR |
| Dumetella carolinensis | Maullador gris | MI | ne | NC | 3 | 0 | IN |
| Toxostoma longirostre | Cuitlacoche pico largo | R | NC | NC | 2 | 0 | IN |
| Fringillidae | |||||||
| Euphonia hirundinacea | Eufonia garganta amarilla | R | ne | NC | 1 | 0 | FR |
| Euphonia elegantissima | Eufonia gorra azul | R | NC | NC | 1 | 1 | FR |
| Haemorhous mexicanus | Pinzón mexicano | R | NC | NC | 12 | 7 | GR |
| Spinus notatus | Jilguero encapuchado | R | NC | NC | 0 | 4 | GR |
| Passerellidae | |||||||
| Chlorospingus flavopectus | Chinchinero común | R | NC | NC | 7 | 0 | IN |
| Spizella passerina | Gorrión ceja blanca | MI | NC | NC | 2 | 0 | IN |
| Spizella pallida | Gorrión pálido | MI | NC | NC | 2 | 0 | IN |
| Melospiza lincolnii | Gorrión de Lincoln | MI | NC | NC | 3 | 0 | IN |
| Aimophila rufescens | Zacatonero rojizo | R | ne | NC | 3 | 0 | IN |
| Atlapetes albinucha | Atlapetes nuca blanca | R | E | NC | 2 | 1 | IN |
| Icteriidae | |||||||
| Icteria virens | Buscabreña | MI | NC | NC | 1 | 0 | IN |
| Psarocolius montezuma | Oropéndola de Montezuma | R | ne | Pr | 9 | 5 | FR |
| Icterus gularis | Bolsero de Altamira | R | ne | NC | 3 | 0 | IN |
| Icterus graduacauda | Bolsero cabeza negra | R | NC | NC | 1 | 0 | IN |
| Icterus gálbula | Bolsero de Baltimore | MI | ne | NC | 1 | 0 | IN |
| Dives dives | Tordo cantor | R | ne | NC | 3 | 1 | IN |
| Parulidae | |||||||
| Mniotilta varia | Chipe trepador | MI | ne | NC | 1 | 0 | IN |
| Leiothlypis ruficapilla | Chipe de coronilla | MI | NC | NC | 1 | 0 | IN |
| Geothlypis trichas | Mascarita común | R | ne | NC | 1 | 0 | IN |
| Setophaga coronata | Chipe coronado | MI | NC | NC | 1 | 1 | IN |
| Setophaga virens | Chipe dorso verde | MI | NC | NC | 9 | 0 | IN |
| Basileuterus rufifrons | Chipe gorra rufa | R | NC | NC | 18 | 2 | FR |
| Cardellina pusilla | Chipe corona negra | MI | ne | NC | 12 | 1 | IN |
| Myioborus pictus | Chipe ala blanca | R | NC | NC | 1 | 0 | IN |
| Cardinalidae | |||||||
| Piranga rubra | Tángara roja | MI | NC | NC | 2 | 0 | IN |
| Pheucticus ludovicianus | Picogordo pecho rosa | MI | ne | NC | 0 | 1 | IN |
| Passerina ciris | Colorín siete colores | MI | NC | Pr | 1 | 0 | GR |
| Thraupidae | |||||||
| Thraupis abbas | Tángara ala amarilla | R | ne | NC | 11 | 0 | IN |
| Volatinia jacarina | Semillero brincador | R | ne | NC | 2 | 1 | GR |
| Cyanerpes cyaneus | Mielero patas rojas | MV | NC | NC | 2 | 2 | FR |
| Sporophila torqueola | Semillero de collar | R | NC | NC | 7 | 2 | GR |
| Saltator atriceps | Picurero cabeza negra | R | ne | NC | 24 | 0 | FR |
Estacionalidad: R = residente; MI = migratoria de invierno; MV = migratoria de verano; R-MI: residente-migratoria de invierno; T = transitoria. Grado de endemismo para México: E = especie endémica; Exo = exótica; ne = no endémica; NC = no clasificada. Categoría de riesgo en la NOM-059- SEMARNAT-2010: Pr = sujeta a protección especial; A = amenazada; P = peligro de extinción; NC = no clasificada. Cantidad de individuos registrados por tipo de vegetación: BMM = Bosque Mesófilo de Montaña; VS = Vegetación Secundaria. Gremio trófico: OM = omnívora; CA = carnívora; CR = carroñera; FR = frugívora; GR = granívora; IN = insectívora; NE = nectarívora.
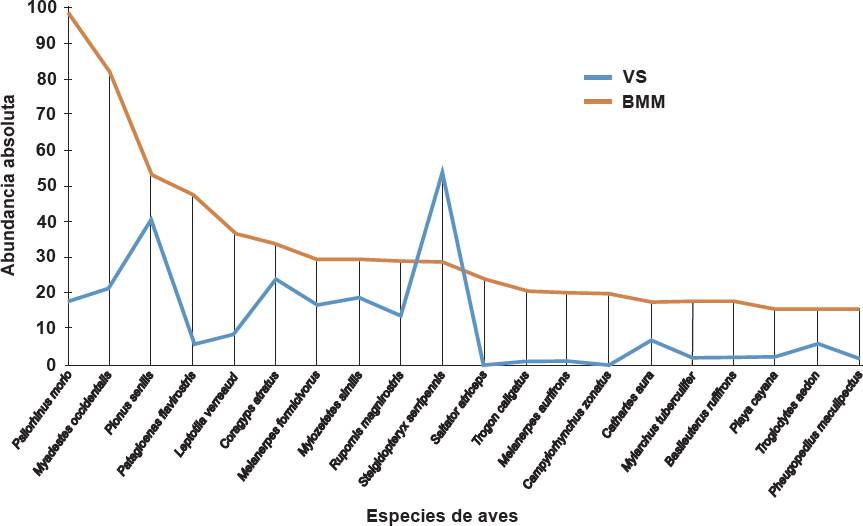
Figura 2 Curva rango-abundancia de la diversidad de aves registradas en BMM y VS en Huatusco, Veracruz, México.
De acuerdo con la NOM-059-SEMARNAT-2010, se registraron 10 especies de aves en alguna categoría de riesgo (Tabla 1). La codorniz-coluda veracruzana (D. barbatus) es una especie omnívora considerada en peligro de extinción y endémica del país, y fue avistada en una ocasión en el BMM. El loro corona blanca (Pionus senilis) y el vireo ojos blancos (Vireo griseus) son 2 especies amenazadas que habitan en la zona. Existen además 7 especies en la categoría sujetas a protección especial, la paloma arroyera (Leptotila verreauxi), el halcón selvático de collar (Micrastur semitorquatus), el halcón peregrino (Falco peregrinus), el loro frente blanca (Amazona albifrons), el clarín jilguero (Myadestes occidentalis), la oropéndola de Montezuma (Psarocolius montezuma) y el colorín siete colores (Passerina ciris).
El ecosistema es de interés particular para el seguimiento y manejo poblacional del loro corona blanca (41 avistamientos en VS y 53 en BMM), especie amenazada, ya que esta se encontró entre las primeras 3 especies de mayor abundancia en ambos sitios; y de las especies clarín jilguero (22 en VS y 82 en BMM) y paloma arroyera (9 en VS y 37 en BMM), las cuales están sujetas a protección especial y que además se registraron entre las 9 especies de mayor abundancia. Es conveniente dar seguimiento a este paisaje ecológico y a su entorno, con actividades que permitan promover la sobrevivencia y reproducción de las poblaciones de dichas especies.
En el área de estudio, en la clasificación de la avifauna reportada con base en su estacionalidad, se registró una mayor cantidad de especies residentes, seguida de las migratorias de invierno; las migratorias de verano, residentes-migratorias de invierno y las transitorias, presentaron los menores registros (Tabla 1; Tabla 2). En cuanto a su endemismo, se registraron 7 especies de aves endémicas de México y una exótica del país, las demás especies se consideran no endémicas a México o no han sido clasificadas.
Tabla 2 Clasificación de la diversidad de aves con base en su categoría de estacionalidad, grado de endemismo, categoría de riesgo, gremio trófico y cantidad de aves por gremio registrada en cada cobertura de vegetación evaluada en el estudio.
| Clasificación | BMM | VS | Área estudiada |
|---|---|---|---|
| Estacionalidad | |||
| Migratoria de invierno | 18 | 11 | 23 |
| Residente-migratoria de invierno | 2 | 2 | 2 |
| Migratoria de verano | 1 | 1 | 1 |
| Residente | 66 | 40 | 72 |
| Transitoria | 2 | 0 | 2 |
| Endemismo | |||
| Endémica | 5 | 3 | 6 |
| No endémica | 33 | 19 | 36 |
| Exótica | 1 | 1 | 1 |
| No clasificada | 50 | 31 | 57 |
| NOM-059-SEMARNAT-2010 | |||
| Amenazada | 1 | 2 | 2 |
| Peligro de extinción | 1 | 0 | 1 |
| Protección especial | 6 | 5 | 7 |
| No clasificada | 81 | 47 | 90 |
| Gremio | |||
| Carnívoras | 6 | 6 | 8 |
| Carroñeras | 3 | 2 | 3 |
| Frugívoras | 15 | 10 | 16 |
| Granívoras | 7 | 6 | 8 |
| Insectívoras | 52 | 28 | 59 |
| Nectarívoras | 3 | 0 | 3 |
| Omnívoras | 3 | 2 | 3 |
| Especies no encontradas en el BMM | |||
| Charadrius vociferus, Ardea alba, Falco peregrinus, Mionectes oleagineus, Tyrannus couchii, Contopus pertinax, Sayornis nigricans, Vireo griseus, Vireo solitarius, Spinus notatus, Pheucticus ludovicianus. | |||
| Especies no encontradas en la VS | |||
| Dendrortyx barbatus, Columbina inca, Nyctidromus albicollis, Selasphorus heloisa, Campylopterus hemileucurus, Saucerottia cyanocephala, Aramides albiventris, Circus hudsonius, Dryobates scalaris, Dryocopus lineatus, Herpetotheres cachinnans, Caracara cheriway, Amazona albifrons, Thamnophilus doliatus, Lepidocolaptes affinis, Tityra semifasciata, Megarynchus pitangua, Contopus cooperi, Contopus virens, Campylorhynchus zonatus, Campylorhynchus megalopterus, Henicorhina leucosticta, Catharus aurantiirostris, Turdus grayi, Melanotis caerulescens, Dumetella carolinensis, Toxostoma longirostre, Euphonia hirundinacea, Chlorospingus flavopectus, Spizella passerina, Spizella pallida, Melospiza lincolnii, Aimophila rufescens, Icteria virens, Icterus gularis, Icterus graduacauda, Icterus gálbula, Mniotilta varia, Leiothlypis ruficapilla, Geothlypis trichas, Setophaga virens, Myioborus pictus, Piranga rubra, Passerina ciris, Thraupis abbas, Saltator atriceps. | |||
El tipo de alimentación reportado para las aves identificadas, fue similar entre los gremios, sin embargo, destacó un mayor número de registros de aves insectívoras y frugívoras en el BMM; mientras que las granívoras y carnívoras tuvieron registros similares en ambos sitios; y las omnívoras y carroñeras muy cercanos; solo las nectarívoras estuvieron ausentes en VS (Tabla 2).
De acuerdo con el análisis de la cobertura de la muestra, Ĉn fue 0.97 (89 especies y N = 916 individuos) y 0.93 (54 especies y N = 331) para el BMM y VS, respectivamente. Las diferencias en la Ĉn de cada sitio están dadas principalmente por el valor diferencial entre la riqueza y abundancia de especies registradas en cada tipo cobertura. Es decir, en la curva de acumulación de especies construida para la cobertura de VS, se requirió un mayor número de extrapolaciones para llegar a la asíntota y alcanzar el 100 % de la Ĉn (Figura 3). Esto indica que se debieron haber registrado un total de 58 especies, es decir, 4 especies más de las avistadas durante el trabajo de campo. Esto sucede al dividir 100 (que es el porcentaje máximo) entre 93 (valor de Ĉn) y multiplicarlo por 54 especies. En tanto que, en el BMM, se debieron registrar 3 especies más usando el mismo cálculo (100/97 x 89) lo que da un valor de 92 especies.
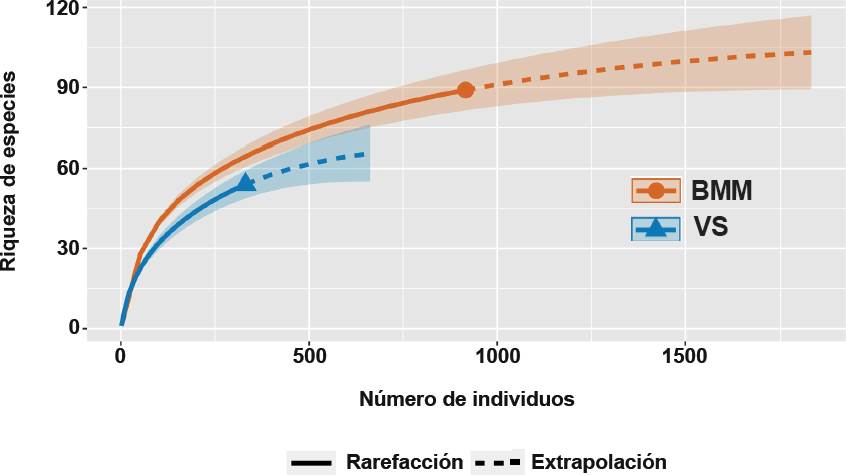
Figura 3 Curva de acumulación de la riqueza de especies y número de individuos de aves en Bosque Mesófilo de Montaña (BMM) y Vegetación Secundaria (VS). El área de color asociada a la línea de la curva de cada cobertura de vegetación representa el intervalo de confianza inferior y superior, calculados con un 95 % de confiabilidad.
En el análisis de comparación de los índices del número efectivo de especies del orden q0, q1 y q2, se presentaron diferencias significativas entre las dos coberturas de muestreo de BMM y VS. Esto indica que presentaron una riqueza de especies (q0 = 54 spp en VS, y 89 spp en BMM); especies comunes, es decir, que tuvieron una frecuencia mayor al promedio en el hábitat (q1 = 24 spp en VS, y 41 spp en BMM) y especies muy abundantes, aquellas que están muy por encima del promedio (q2 = 14 spp en VS, y 25 spp en BMM), significativamente diferentes a un alfa de 0.05 entre coberturas de muestreo, ya que no se traslapan los intervalos de confianza calculados al 95 % de confiabilidad para cada cobertura (Figura 4).
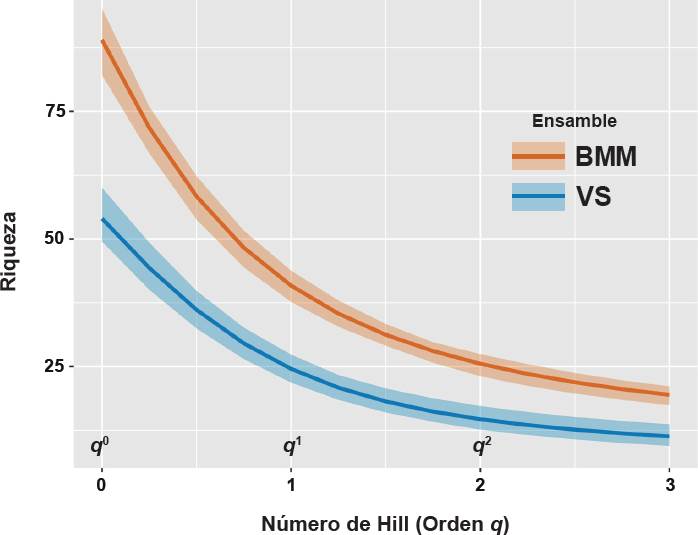
Figura 4 Comparación del número efectivo de especies de la comunidad de aves en BMM y VS del orden q0 (análogo de la riqueza de especies), q1 (exponencial del índice de Shannon) y q2 (inverso del índice de Simpson). Los intervalos de confianza no se traslapan en el número efectivo de especies de q0, q1 y q2, por lo que se asumen diferencias significativas.
La prueba de Shapiro-Wilk indicó que ambas muestras no provienen de una población normalmente distribuida, con un valor de P < 0.05 (BMM: n = 89, media = 10.29, DE = 16.31, Lambda de Wilk = 0.62, p-unilateral D = < 0.000 1; VS: n = 54, media = 6.13, DE = 10.13, Lambda de Wilk = 0.57, p-unilateral D = < 0.000 1). Esto fue consistente con la prueba de bondad de ajuste de Kolmogorov, que muestra la desigualdad de varianzas en los datos de la comunidad de aves registrada, ya que el valor de P fue menor a 0.05 (BMM: ajuste de Chi Cuadrado = 3, v = 10, n = 89, D = 0.32, P = < 0.000 1; VS: ajuste de Chi Cuadrado = 3, v = 6, n = 54, D = 0.20, P = 0.028 1). En este la diferencia entre la riqueza y abundancia de sentido, las diferencias registradas en la comu- especies (Kruskal-Wallis, medianas de BMM = 3; nidad de aves entre el BMM y VS, se deben a medianas de VS = 2; H = 3.47, P = 0.057).
La riqueza de aves registrada en Finca La Pastoría representa el 9 % de la diversidad de la avifauna de México (Navarro-Sigüenza y col., 2014) y el 14.2 % de las aves registradas para el estado de Veracruz (Montejo-Díaz y McAndrews, 2006), por lo que se infiere que el sitio aún cuenta con una proporción elevada de aves dependientes de recursos que provee el hábitat, tomando en consideración que dicha área está conformada por una porción de vegetación secundaria y otra porción de BMM. La Figura 5 muestra algunos de los ejemplares observados en el lugar de estudio.

Figura 5 Algunas aves registradas del presente estudio: a) Myadestes occidentalis, b) Pionus senilis, c) Myiozetetes similis, d) Vireo griseus.
Navarro-Sigüenza y col. (2014) estimaron que la riqueza de aves asciende a 551 especies en los BMM de todo México. En otras regiones del país, como el noreste de Hidalgo, que cuenta con presencia de BMM con buena condición de conservación, se han registrado hasta 181 especies de aves (Martínez-Morales, 2007). Por lo que, podría decirse que, las 100 especies de aves registradas en Finca La Pastoría equivalen a más del 50 % de la avifauna reportada para los BMM del noreste de Hidalgo (Martínez-Morales, 2007) y el 18 % de aves registradas para todos los BMM de México, según lo reportado por Navarro-Sigüenza y col. (2014). Dichas variaciones registradas en la riqueza avifaunística en este y otros estudios realizados en BMM, se deben a factores relacionados con el riesgo de extinción de las especies, su tipo de endemismo, su estatus de conservación, la disponibilidad de recursos de hábitat (disponibilidad de áreas de anidación y alimentación, fuentes de agua disponible, protección ante depredadores), características de la matriz antrópica, ubicación geográfica y el estado de conservación del BMM, que pueden generar cambios en la riqueza de la avifauna (Caballero-Cruz y col., 2020).
En este estudio se observó que la comunidad de aves estuvo ligada al tipo de cobertura de vegetación de BMM; es decir, la respuesta de la comunidad de aves se registró a partir de una mayor riqueza y abundancia en la cobertura del BMM, ya que en la vegetación primaria existen más recursos de hábitat para aves (Ugalde-Lezama y col., 2022). Esto explica que 89 especies y 916 individuos de aves se registraron con mayor frecuencia en el BMM y 54 especies y 331 individuos en la VS. Las diferencias estadísticas reportadas por las pruebas de Shapiro-Wilk, de Kolmogorov y Kruskal-Wallis se deben a las variaciones ecológicas, debidas al comportamiento en la distribución y la presencia de aves en las diferentes coberturas de hábitat evaluadas, aunado a la presencia de disturbios, principalmente antrópicos, que afectan la dinámica y nivel de organización de la comunidad avifaunística, y a la distribución de recursos de hábitat específicos que las aves encuentran en cada tipo de vegetación (Schondube y col., 2018).
Se encontró una asociación entre la cobertura de la vegetación estudiada con los requerimientos alimenticios de las aves. Al asociar el tipo de alimentación con la vegetación, se obtuvo un mayor número de registros de especies insectívoras y frugívoras asociadas al BMM, además, se reportaron especies nectarívoras solo en ese sitio, posiblemente porque hay mayor disponibilidad de recursos como insectos, frutos y flores, comparado con los registros en VS, donde fueron menores. Asimismo, un mayor número de registros de especies residentes, especies no endémicas y migratorias de invierno, hicieron mayor uso de la cobertura de BMM que la de VS, por lo que las acciones de conservación del bosque deben ser prioritarias para el manejo de la avifauna y otros grupos biológicos, como los murciélagos, asociados al ambiente de esta misma localidad, y que presentan similitud en el comportamiento de la diversidad (Cerón-Hernández y col., 2022).
El número de especies compartidas fue de 43 entre BMM y VS en Finca La Pastoría, es decir, dichas aves, aunque propiamente no son exclusivas del BMM o de VS, comparten recursos de hábitat en ambas coberturas de vegetación. Sin embargo, las especies generalistas, que no les “importa” el tipo de ambiente para alimentarse, anidar o reproducirse, usaron de manera diferencial ambas coberturas. Por un lado, ello podría ser un indicador de un proceso de adaptación de las aves a este paisaje heterogéneo con intervención humana constante (Ruelas-Inzunza y AguilarRodríguez, 2010), pero por otro lado, es posible que las aves con nichos exclusivos de BMM, como las que requieren las especies endémicas, se encuentren diezmando o reduciendo en tamaño poblacional (Caballero-Cruz y col., 2020), y en determinado plazo ocurra una extinción local de las poblaciones del Vireo griseus (complex griseus), una especie de ave endémica del que solo se tenían 2 registros de presencia en el municipio de Huatusco hasta el año 2015 (Naturalista, 2022) y en este estudio, se reporta la tercera localidad de presencia, en 2018, de la especie para el municipio en VS. Las 10 especies de aves registradas en la localidad del presente trabajo, que se encuentran listadas en la categoría de riesgo de extinción, de acuerdo a la NOM-059SEMARNAT- 2010, debido a que presentan tamaños poblacionales bajos y rangos de distribución restringidos, aún encuentran recursos de hábitat en ambas coberturas de vegetación en Finca La Pastoría, por lo que realizar prácticas de manejo agroecológico podría coadyuvar a mantener los recursos de hábitat para estas especies y así evitar su extinción poblacional local.
La comunidad de la avifauna registrada en el BMM y VS de Finca La Pastoría, Huatusco, Veracruz, puede conservarse mediante el fomento del aviturismo en el área de estudio (Alcántara-Salinas y col., 2018). Además, estas áreas pueden certificarse bajo el esquema de Unidad para la Conservación, Manejo y Aprovechamiento Sustentable de la Vida Silvestre (UMA) de acuerdo con el Instituto Nacional de Ecología (INE, 1997) o Área Destinada Voluntariamente a la Conservación (ADVC) de acuerdo con la Comisión Nacional de Áreas Naturales Protegidas (CONANP, 2019), donde los propietarios pueden hacer un aprovechamiento sustentable de los recursos naturales mediante planificación de distintas actividades encaminadas a la conservación a largo plazo.
CONCLUSIONES
En este estudio, de las 100 especies registradas, Psilorhinus morio (18 individuos en VS y 98 en BMM), Myadestes occidentalis (22 en VS y 82 en BMM), Pionus senilis (41 en VS y 53 en BMM), Patagioenas flavirostris (6 en VS y 48 en BMM) y Leptotila verreauxi (9 en VS y 37 en BMM) fueron las aves más abundantes en el área. La cobertura de BMM reportó la mayor riqueza y abundancia de aves. El tipo de alimentación, anidación, apareamiento y biología en general, pareció influir en su distribución por tipo hábitat, por lo que es recomendable desarrollar estrategias de conservación de las poblaciones y de manejo para su hábitat, ya que además, la zona de estudio permite la protección de 10 especies de aves bajo algún tipo de estatus en la NOM059-SEMARNAT-2010. El área presenta potencial para desarrollar actividades como el aviturismo que coadyuven a su conservación y estudio.











 nova página do texto(beta)
nova página do texto(beta)


