La conducta de ingesta de alimento es fundamental para la sobrevivencia; ésta es modulada por dos sistemas; el primero, un sistema homeostático que regula el balance energético, es decir, el equilibrio entre el ingreso y el gasto de energía necesaria para el adecuado funcionamiento del sistema; el segundo, el sistema de recompensa o regulación hedónica, el cual responde a características específicas del alimento, como su olor, color, textura (entre otras características) a fin de guiar el consumo (Liu & Kanoski, 2018).
Los alimentos con un alto contenido en grasas y/o carbohidratos son un estímulo potente para ejercer control sobre la conducta y la relativa facilidad para obtenerlos ha propiciado su sobreconsumo; se ha ligado a este equilibrio energético positivo al desarrollo de la obesidad (y la presencia de enfermedades relacionadas a la obesidad, como el cáncer, la hipertensión y diabetes tipo II) que ha alcanzado proporciones epidémicas en la última década (Kenny, 2011). Existen diversas explicaciones de la obesidad, que van desde la pérdida de regulación homeostática (Rasmussen, Robertson, & Rodriguez, 2016) hasta la adicción (Rogers, 2017). Por otro lado, se ha señalado que algunos pacientes con obesidad también presentan atracones, los cuales se caracterizan por un consumo abrupto de alimentos sabrosos en períodos breves, cabe señalar que dicho consumo no necesariamente está controlado por señales de hambre o necesidades metabólicas (Brownley, Berkman, Sedway, Lohr, & Bulik, 2007) y se observa a pesar de la eficacia de los mecanismos de regulación (Dalton, Blundell, & Finlayson, 2013). Además, dichos atracones con frecuencia se ven acompañados por sentimientos de pérdida de control y sensaciones psicológicas negativas (Ifland et al., 2009).
En modelos animales se ha observado que al limitar el acceso al alimento palatable los animales desarrollan un sobreconsumo cuando tienen acceso a dicho alimento reproduciendo los atracones observados en los pacientes (Avena, 2010). Adicional a los cambios observados en la ingesta de alimento, se han observado modificaciones conductuales como una mayor motivación para obtener el alimento palatable, lo cual se ve reflejado en puntos de quiebre más altos cuando los sujetos son evaluados en programas de razón progresiva y reciben como reforzador grasa vegetal (Wojnicki, Babbs, & Corwin, 2010; Wojnicki, Charny, & Corwin, 2008). También es importante señalar que los sujetos en los que se ha inducido ingesta tipo atracón presentan conductas similares a las de los sujetos que han tenido un consumo crónico de sustancias de abuso como nicotina, cocaína u opioides (Avena, Bocarsly, Rada, Kim, & Hoebel, 2008; Rada, Avena, & Hoebel, 2005), por lo que se ha sugerido que la ingesta tipo atracón comparte sustratos neuronales con la adicción a substancias de abuso (Rogers, 2017; Volkow, Wise, & Baler, 2017),.
La exposición a substancias de abuso genera cambios permanentes en el sistema nervioso central que, bajo condiciones apropiadas, vuelven a manifestase como una recaída (Vandaele & Janak, 2018), mientras que, en los pacientes que presentan conducta de atracón se ha observado que este patrón de ingesta es un rasgo persistente, difícil de eliminar (Bello & Yeomans, 2018; Pawaskar et al., 2016). Si bien es cierto que los modelos animales de ingesta tipo atracón reproducen la principal característica de sobreconsumo de alimento, los artículos que emplean dichos modelos animales no mencionan pruebas post-inducción a mediano o largo plazo de la conducta de atracón, aunque en general se tiene la hipótesis de que tiene una duración prolongada. Es decir, no se han llevado a cabo evaluaciones sobre el mantenimiento de la conducta de ingesta tipo atracón (una vez que ésta ha sido adquirida) para determinar el tiempo que se mantiene dicha alteración del patrón de ingesta. Información sobre la persistencia de la conducta de atracón es fundamental para validar el estudio de las alteraciones subyacentes de la patología así como para estudiar posibles modificaciones conductuales en las personas que sufren este tipo de patrón no adaptativo. El objetivo del presente trabajo fue determinar la persistencia de la conducta de ingesta tipo atracón al menos durante dos meses, para posteriormente determinar si la disponibilidad del alimento (privación o acceso ad libitum de alimento estándar) afecta la estabilidad del patrón de ingesta tipo atracón.
Método
Sujetos
Se utilizaron 12 ratas macho de la cepa Wistar con 60 días de edad y peso de 250-350g al inicio del experimento. Los sujetos se mantuvieron alojados individualmente en cajas de policarbonato transparente, en un cuarto con temperatura y humedad constantes, bajo un ciclo de luz-oscuridad de 12-12 h iniciando a las 8 am. Las condicones de alojamiento y manejo cumplieron con la Norma Oficial Mexicana NOM-062-ZOO-1999.
Alimentos
La comida estándar consistió en Rodent Laboratory Chow 5001 (Purina ®). La ingesta tipo atracón se indujo con una solución de sacarosa al 10% (v/p) (0.6 M), la cual se elaboró con azúcar refinada y agua potable. De la información de los proveedores se calculó 3.36 kcal/gr y 0.4 kcal/ml para el alimento y la glucosa a fin de presentar el consumo conjunto de ambas.
Procedimiento
A su llegada al laboratorio se tomó una línea base durante 3 días para obtener el peso corporal de cada rata; se calculó el 85% del peso promedio de estos días y se limitó el acceso a 5 g de alimento por cada 100 g de peso corporal hasta que los sujetos alcanzaron el 85% de su peso corporal; posteriormente se proporcionó un suplemento de alimento para mantener el peso corporal en este nivel durante dos meses antes de iniciar el protocolo de inducción de la conducta de atracón. Este periodo de privación se realizó en virtud de que en la mayoría de los estudios que evalúan el efecto de conducta de atracón sobre la ejecución de los sujetos es necesario colocar a los sujetos bajo privación para su entrenamiento.
Inducción de alimentación tipo atracón.
Se realizó una combinación de los protocolos desarrollados por Avena, Rada, and Hoebel (2006); Avena, Rada, Moise, and Hoebel (2006) y Corwin and Buda-Levin (2004); los primeros dan acceso al alimento y a la solución de sacarosa al 10% por 12 h alternando con privación de 12 horas. En el segundo caso dan acceso a la solución sabrosa únicamente 2 horas, 3 veces a la semana. El protocolo que utilizamos consistió en dar acceso ad libitum al alimento estándar y acceso a la solución sabrosa 2 horas diarias. Se asignaron de manera aleatoria 6 ratas al grupo control (GCon) y 6 al grupo de atracón (GExp). El GCon tuvo acceso ad libitum a la solución sacarosa al 10%, al alimento estándar y al agua. El GExp tuvo acceso a la solución sacarosa 2 h diarias (18:30-20:30 hrs) y acceso ad libitum al alimento y agua por 24 días. Se registró el consumo de alimento estándar, glucosa y agua al momento de proporcionar y luego al retirar el acceso a la glucosa al GExp. El peso corporal se registró diariamente antes del acceso a la glucosa del GExp.
Evaluaciones de la ingesta tipo atracón.
Una vez concluida la fase de inducción de alimentación tipo atracón, se restringió el acceso al alimento para mantenerlos al 85% del peso inicial durante dos semanas. Ambos grupos se subdividieron en subgrupos de 3 ratas, el día 14 después de la inducción de la ingesta tipo atracón, se presentaron nuevamente las condiciones de inducción para evaluar nuevamente la ingesta tipo atracón en 3 ratas. Las otras 3 ratas se evaluaron 7 días después y se realizaron otras 2 evaluaciones separadas 7 días cada una alternando los subgrupos de ratas. Después, se proporcionó acceso libre al alimento a fin de determinar si la condición nutricional modifica el mantenimiento de la conducta de atracón, por lo que después de 14 días con acceso libre, se realizaron 2 evaluaciones a cada subgrupo separando 7 días cada evaluación.
Resultados
Inducción de la conducta de atracón
En los tres días de restricción de alimento los sujetos alcanzaron el 85% de su peso ad libitum y se mantuvieron en ese peso hasta que se inició la inducción de la conducta de atracón, cuando se volvió a proporcionar acceso irrestricto al alimento. Durante el primer día de la inducción de la conducta de atracón no hubo diferencias significativas en el consumo de la solución de sacarosa entre el GCon y el GExp (Figura 1A); como se puede observar el GCon mantuvo su consumo de sacarosa, mientras el GExp incrementó su consumo durante los 25 días de inducción; esta diferencia entre los grupos alcanzó significancia estadística (F[1,23]=30.11, p<0.05) durante los últimos días de la inducción (Bonferroni, p< 0.0001). La Figura 1B muestra el consumo de alimento de 2 h (simultaneo con el acceso a la sacarosa del GExp), en tanto que la Figura 1C el consumo total de alimento y sacarosa (se presenta en kcal para poder combinar los ml de sacarosa y los g de alimento) de 24 h en ambos grupos. Para la condición de 2 horas el ANOVA de dos factores (Condición X Días) con medidas repetidas reveló que el factor días fue estadísticamente significativo (F[1,23]=4.264,p<0.0001), es decir, conforme transcurrió la inducción de la conducta de atracón el consumo final difirió del consumo inicial; el factor de condición reveló diferencias significativas (F[1,23]=9.049, p<0.05) entre los grupos el día 7. En el caso del consumo total a las 24 h se observó que hubo diferencias estadísticamente significativas en el factor días (F[1,23]=6.997, p<0.011) ya que el consumo de alimento de los primeros días fue mayor que al final del periodo de inducción. De mayor es importancia es que se observaron diferencias en el consumo entre los grupos (F[1,23]=13.11, p<0.0001), ya que el consumo del GExp fue mayor respecto del GCon a lo largo de la inducción de la conducta de atracón.

Figura 1 Inducción de ingesta tipo atracón. A) Consumo de glucosa en ml (ordenas derecha) o kcal (ordenadas izquierda). B) Consumo de alimento (g) durante las 2 h de acceso a la glucosa. C) Consumo total de alimento y glucosa (kcal) durante 24 h. D) Peso corporal. E) Consumo de agua durante el periodo de acceso de 2 h a la glucosa. F) Consumo total de agua. Media (N=6 por grupo) ± EEM. Las barras * denotan diferencias significativas (p<0.05) en el ANOVA de dos vías (medidas repetidas en el factor días) seguido de Bonferroni.
Se muestra el consumo de agua durante las 2 h del acceso a la sacarosa (1E) y el consumo total de 24 h (1F); en el caso del consumo durante 2 h el ANOVA de dos factores (Condición X Días con medidas repetidas) indicó que no hubo diferencias estadísticamente significativas (F[1,23]=1.525, p<0.3088) entre los grupos; sin embargo, en el día 19 se observó un incremento significativo del consumo de agua (F[1,23]=7.762, p<0.001). El GExp tuvo un consumo mayor de agua durante las 24 h, lo cual fue confirmado con el ANOVA (F[1,23]=157.2, p<0.0001); la prueba post-hoc de Bonferroni indico que dicho cambio se presentó a partir del segundo día de inducción. En ambos grupos el peso corporal aumento a lo largo de los días del periodo de inducción (F[1,23]= 5.265, p<0.0001), pero no entre los grupos (F[1,23]= 0.201, p<0.655).
Evaluaciones después de la inducción de alimentación tipo atracón
Una vez que se determinó que el patrón de alimentación tipo atracón fue adquirido por los sujetos, se restringió el acceso al alimento estándar por 15 días (sin presentar la solución de sacarosa); el día 14 post-inducción se colocaron nuevamente las condiciones de atracón y se obtuvieron 4 mediciones post-inducción (dos en cada sub-grupo de sujetos separadas 7 días); a continuación se proporcionó acceso ad libitum al alimento y se realizaron otras 4 evaluaciones. Con objeto de tener una N=6 para el análisis, se agruparon la primera y segunda evaluacion de ambos subrupos en cada condicion, en la Figura 2 se indica la condición correspondiente al pie de cada barra y se comparan contra el último día de la periodo de inducción; el ANOVA de medidas repetidas dos factores (Manipulación X Grupo) no mostró diferencias estadísticamente significativas (F[1,11]= 1.169, p<0.324) entre el último día de inducción, la condición de privación y el acceso ad libitum (ver Figura, 2A), pero se mantuvieron las diferencias entre los grupos a lo largo de las evaluaciones (F[1,11]= 103.7, p<0.01).
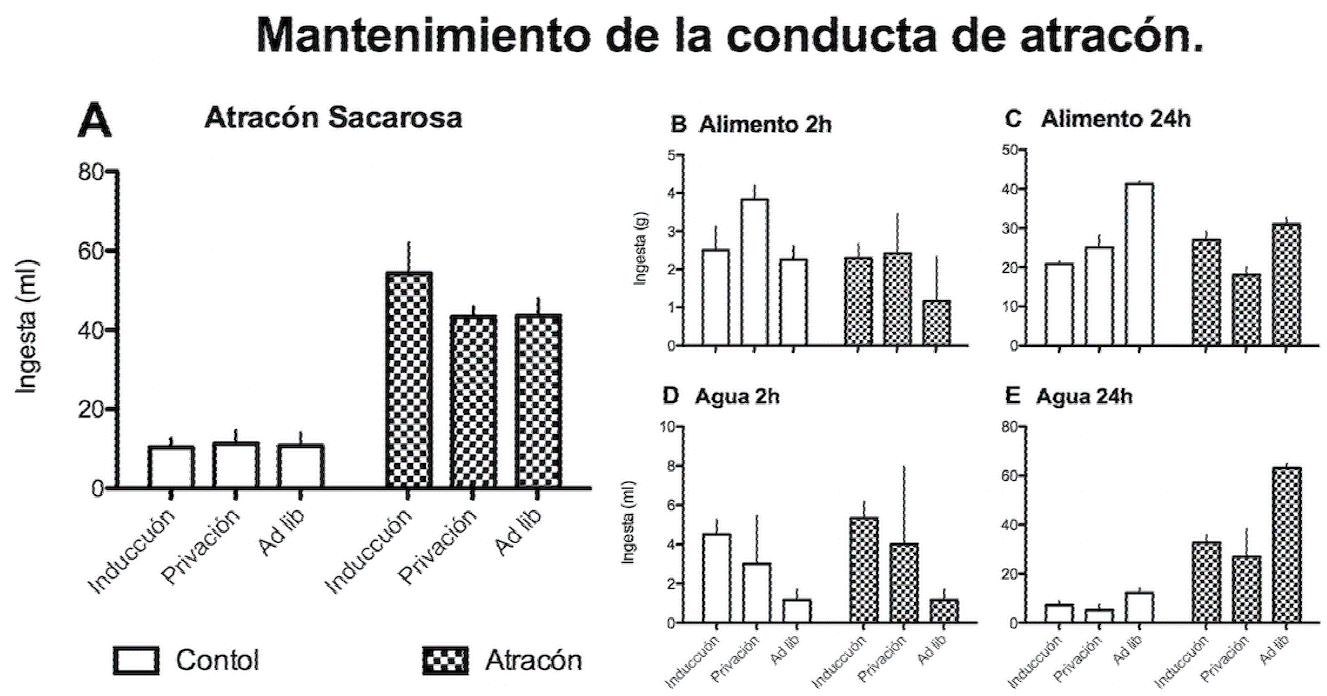
Figura 2 Mantenimiento de la conducta de atracón; la primera columna de cada serie presenta el consumo durante el último día del periodo de inducción; las columnas restantes presentan el promedio del consumo de las 2 evaluaciones en cada condición. Consumo de glucosa (A), alimento (B) o agua (D) durante las 2 horas de acceso a la glucosa y el consumo total (en kcal) de alimento y glucosa (C) y agua (E) a las 24 h de acceso. Media ± EE
En la Figura 2B se muestra el consumo de alimento durante las dos horas de acceso concurrente a la sacarosa; a pesar de que el GCon tuvo un mayor consumo de alimento durante la fase de privación respecto al GExp, el ANOVA no reveló diferencias estadísticamente significativas ni entre grupos (F[1,11]= 2.249, p<0.144) ni entre condiciones (F[1,11]= 1.858, p<0.173); sin embargo, se observó diferencias significativas, en el consumo total (kcal) entre condiciones (F[1,11]= 32.110, p<0.01) y entre los grupos en el consumo de 24 h (F[1,11]=5.545, p<0.025) (Figura 2C), pero dichas diferencias están relacionadas con las horas de acceso en virtud de que el consumo fue mayor cuando los sujetos tuvieron acceso libre que cuando su acceso al alimento estuvo restringido.
En el consumo de agua durante 2 h (Figura 2D), el ANOVA no reveló diferencias ni entre las condiciones (F[1,11]= 1.816, p<0.180) ni entre los grupos (F[1,11]= 0.141, p<0.709), mientras que en el consumo de 24 horas (Figura 2E) el ANOVA de dos factores, indicó diferencias estadísticamente significativas entre las condiciones (F[1,11]=10.14, p<0.01) y entre los grupos (F[1,11]= 61.21, p<0.001), pero a semejanza con el alimento, las diferencias están relacionadas con el periodo de acceso al agua (la privación de alimento reduce el consumo de agua) y se mantuvo el incremento en el consumo de agua asociado con el “binge” por la sacarosa.
Discusión
Los resultados muestran que el grupo que tuvo acceso restringido a la solución de sacarosa 2 h al día fue escalando el consumo conforme transcurrieron los días de entrenamiento; en los últimos días del entrenamiento, el consumo de sacarosa fue notablemente superior al grupo que tuvo acceso libre a la sacarosa. El incremento en el consumo de sacarosa fue acompañado por un incremento en el consumo de agua pero, a pesar de estos cambios, no hubo diferencias significativas en el peso corporal entre los grupos. El hallazgo más significativo es que a pesar de que transcurrieron 15 días entre cada una de las 8 evaluaciones posteriores realizadas a lo largo de 2 meses, el grupo experimental continuó manifestando la conducta de atracón (tal y como la presentó al final del entrenamiento) y, además, esta conducta se presentó independientemente de si las ratas tuvieron acceso libre o restringido al alimento.
Se ha reportado el desarrollo de la conducta de atracón a la sacarosa restringiendo su acceso simultáneamente con la restricción de alimento estándar (Avena et al., 2008; Avena, Rada, & Hoebel, 2006; Avena, Rada, Moise, et al., 2006); nuestros resultados indican, al igual que lo reportado por Corwin (2004), que no es necesaria la privación de alimento estándar para el desarrollo del escalamiento conductual de la ingesta tipo atracón de sacarosa, sino que el escalamiento en el consumo de alimento palatable esta relacionado con la restricción a su acceso (Kreisler, Ma ttock, & Zorrilla, 2018). No obstante, es posible que la privación de alimento estándar facilite la rapidez con la que se comienzan a observar diferencias entre el grupo de acceso restringido con respecto al grupo control; así, en nuestro caso se observaron diferencias entre los grupos a partir del día 8, mientras que en los experimentos reportados por Colantuoni et al. (2001) dichas diferencias se muestran desde el día 4 de la inducción. Posteriormente se deberán utilizar diferentes tiempos de privación del alimento estándar para determinar con precisión la influencia que tiene la privación de alimento estándar sobre la rapidez con la que se establece la conducta de atracón.
El patrón de ingesta de alimento estándar no se modificó a lo largo de la inducción, por lo cual se puede sugerir que el atracón no fue a consecuencia de que los sujetos se encontraran hambrientos. El incremento en el consumo está relacionado a lo sabroso de la solución sacarosa y su acceso restringido, lo cual coincide con los resultados obtenidos por otros grupos de investigación (Avena, 2010; Buda-Levin, Wojnicki, & Corwin, 2005; Colantuoni et al., 2002). Observamos un consumo de agua mayor en el grupo de atracón; es posible que esté relacionado a un aumento de glucosa en sangre que puede generar una diuresis osmótica causada por glucosa, a semejanza con la diabetes mellitus (Liamis, Liberopoulos, Barkas, & Elisaf, 2014); alternativamente, la ingesta de grandes cantidades de sacarosa puede generar sed postprandial. Para confirmar cualquiera de estas explicaciones se requieren pruebas de química sanguínea y determinación del volumen de orina, que serían de gran importancia para determinar si el desarrollo del patrón de ingesta tipo atracón se acompaña de fallas metabólicas y/o renales que se desarrollan con frecuencia en pacientes con obesidad. Se debe resaltar que los reportes del desarrollo de conducta de atracón con diversos modelos no reportan el consumo de agua (sólo mencionan que se proporciona acceso libre al agua), por lo cual será de importancia el seguimiento de esta observación.
Aún cuando el modelo en ratas de la conducta de atracón guarda similitudes con las descripciones de atracones en pacientes con obesidad (Rogers, 2017), ha sido difícil documentar en las ratas incrementos en su peso corporal (Kreisler et al., 2018). Nosotros no observamos diferencias significativas el peso corporal entre el grupo control y el experimental. Los estudios que han descrito incrementos en el peso corporal han utilizado ratas Sprague-Dawley y se ha reportado que es relativamente fácil observar cambios en el peso corporal en dichas ratas pero es muy difícil observar cambios en el peso corporal de las ratas Wistar (Hildebrandt, Klump, Racine, & Sisk, 2014; Tordoff, Alarcon, & Lawler, 2008). Así, aunque los modelos de acceso restringido (con animales y humanos) han sido de utilidad para el estudio de la conducta de atracón su utilidad para el estudio de la obesidad ha sido limitada (Linardon, 2018).
Los estudios de adicción a diversas substancias (tanto con pacientes adictos, como con modelos animales) han encontrado consistentemente que es difícil que los organismos abandonen la autoadministración de las substancias y que la re-exposición a las señales discriminativas o contextuales que acompañaban la administración de las substancias provoca la recaída (Smith & Laiks, 2018; Vandaele & Janak, 2018). Los resultados obtenidos en la presente investigación nos muestran la persistencia del patrón de ingesta tipo atracón al alimento: una vez que se ha adquirido se mantiene estable y, básicamente, similar al último día de inducción. De gran importancia es que la conducta de atracón al alimento sea insensible a las condiciones nutricionales del sujeto ya que se mantuvo prácticamente sin cambios a pesar de que los sujetos se evaluaron en condiciones de acceso libre o restringiendo el alimento estándar, lo que sugiere su independencia del sistema de regulación homeostática. Estas observaciones sugieren que la restricción del alimento altamente sabroso afecta irreversiblemente al sistema de regulación hedónica. En el caso de la conducta de atracón al alimento falta determinar la contribución de los estímulos ambientales a su persistencia.
En conclusión, los resultados presentes permiten sugerir que es posible desarrollar la conducta de atracón restringiendo el acceso al alimento sabroso sin necesidad de privar a los organismos de su alimentación normal. Además, y de gran importancia, una vez adquirido el patrón de la conducta de atracón es persiste a pesar de que los sujetos se encuentren bajo condiciones de acceso libre o irrestricto al alimento, lo que sugiere la confirmación de la hipótesis de que la conducta de atracón se debe a la generación de cambios relativamente permanentes en sistema nervioso central y, además, confirma que los modelos animales son de utilidad para explorar los cambios subyacentes a los cambios en el sistema de recompensa en animales y en humanos.











 nova página do texto(beta)
nova página do texto(beta)


