Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista bio ciencias
versão On-line ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub 28-Abr-2021
https://doi.org/10.15741/revbio.07.e946
Artículos Originales
Termo-hidrólisis para la liberación de azúcares monoméricos en residuos agrícolas (termo-hidrolisis de agroresiduos)
1Maestría en Ciencias en Horticultura, Universidad Autónoma Agraria Antonio Narro, México
3Departamento de Horticultura, Universidad Autónoma Agraria Antonio Narro, México.
4Departamento de Ciencia y Tecnología de Alimentos, Universidad Autónoma Agraria Antonio Narro; Calzada Antonio Narro 1923, Buenavista. Saltillo, Coahuila, 25315. México.
El vertido incontrolado de desechos y excedentes generados como residuos vegetales en el medio rural son considerados como foco importante de infección para los cultivos. Estos agroresiduos se consideran ricos en polímeros de almidón y lignocelulosa, los cuales están formados por azúcares sencillos. Esta investigación trabajó con bagazo de uva (variedad merlot) y granada (variedad wonderful), empleándolas como materia prima para su hidrólisis térmica. Las variables evaluadas fueron azúcares totales y azúcares reductores en los bagazos sin hidrolizar, en los “slurry” hidrolizados y en el caldo hidrolizado. El incremento en la concentración de azúcares tras los diferentes tratamientos, se logró efectivamente con residuos de uva (1.77 mg/mL), y granada (3.18 mg/mL), tomando en cuenta los resultados previos a la hidrólisis térmica plasmadas en este trabajo (1.31 mg/mL para uva; 2.08 mg/mL para granada). De acuerdo con los resultados obtenidos, existe una relación de eficiencia en la extracción de azúcares monoméricos y el tamaño de partícula empleado, mientras que el tiempo de procesamiento es un factor determinante en esta investigación. Por lo tanto, el tiempo de exposición en un proceso de hidrólisis térmica y el tamaño de partícula de la materia prima, son factores importantes por considerar, que afectan la liberación de glucosas de la materia lignocelulósica de residuos de uva y granada.
Palabras clave: Presión; Temperatura; Partículas; Uva; Granada
The uncontrolled dumping of waste and surpluses generated such as plant residues in rural areas is considered as an important source of infection for crops. These agro-wastes are considered as rich in polymers of starch and lignocellulose, which are formed by simple sugars. This research worked with grape bagasse (merlot variety) and pomegranate (wonderful variety), using them as raw material for thermal hydrolysis. The variables evaluated were total sugars and reducing sugars in the unhydrolyzed bagasse, in the hydrolyzed slurries and in the hydrolyzed broth. The increase in sugar concentration after the different treatments was effectively achieved with grape residues (1.77 mg/mL), and for pomegranate (3.18 mg/ mL), taking into account the results prior to thermal hydrolysis presented in this work (1.31 mg/mL for grapes; 2.08 mg/mL for pomegranate). According to the results obtained, there is an efficiency ratio between the extraction of monomeric sugars and the particles size used, while the processing time is a determining factor in this investigation. Therefore, the exposure time in a process of thermal hydrolysis and the particles size of the raw material are important factors to consider, which affect the release of glucose from lignocellulosic matter of grape and pomegranate residues.
Key words: Pressure; Temperature; Particles; Grape; Pomegranate
Introducción
A lo largo de los años, los procesos agrícolas han generado cantidades muy importantes de subproductos o residuos de difícil degradación (Castro Granado, 2018) en el ambiente (residuos vegetales, residuos plásticos, residuos de envases de plaguicidas, etc.), derivados del uso y mantenimiento de las explotaciones agrícolas (Saval, 2012).
La biotecnología permite la bio-conversión de residuos agroindustriales (Blanco, 2017) en productos de interés comercial mediante procesos de extracción directos o de transformación por química o microbiológica (Moldes et al., 2002). En México existe gran cantidad de agroindustrias, que generan residuos orgánicos con un gran potencial de aprovechamiento (Mejías-Brizuela et al., 2016), tal es el caso del bagazo de la uva que se utiliza para la elaboración de vinos en diferentes puntos del país. El cultivo de la uva representa el 0.83 % del GDP nacional con una producción en el 2018 de 444.45 miles de toneladas (SIAP, 2018), estimándose que para el 2024 serán 415.43 miles de toneladas (SAGARPA, 2017). En cuanto a la producción mundial de uva durante el periodo 2018/2019 se generaron 22.15 millones de toneladas (Shahbandeh, 2019). Para el caso del cultivo del granado, se generaron 8,073.88 toneladas del cultivo durante el 2018 en territorio nacional (SIAP, 2018). Mientras que a nivel global se producen alrededor de 3 millones de toneladas anuales (Financial-Tribune, 2016).
El origen del problema radica en el vertido de los desechos y excedentes generados como residuos vegetales en el medio rural, que ocasiona problemas creando un foco importante de infección para los cultivos, así como contaminación mediante la quema. En este panorama, se busca el aprovechamiento de carbohidratos complejos que forman la estructuración celular de mencionados residuos, como celulosas y hemicelulosas. Para lograr la utilización de estos carbohidratos complejos, primero deben ser simplificados en azúcares monoméricos y así crear caldos de cultivo enriquecidos, y por medio de procesos de fermentación generar diversos productos de interés en el mercado (Mestries, 2015).
El pretratamiento consiste en el fraccionamiento de la biomasa en sus componentes principales (celulosa, hemicelulosa y lignina) para facilitar el posterior ataque enzimático y microbiano. La hidrólisis, o ruptura de las moléculas en medio acuoso (Sun et al., 2016), tiene como finalidad la transformación de los polímeros de glucosa (almidón y celulosa) en azúcares sencillos (Álvarez et al., 2016). Las estrategias fisicoquímicas más utilizadas son el agua caliente líquida (LHW), la explosión de vapor, oxidación húmeda, pretratamiento con sulfito (SPORL), pretratamiento con amoníaco y el pretratamiento con microondas (Kumar % Sharma, 2017). El pretratamiento LHW se lleva a cabo solo con agua y sin catalizadores ni productos químicos adicionales, lo que es ventajoso, considerando lo amigable con el ambiente. El agua se calienta a temperaturas elevadas mientras se aplica una presión lo suficientemente alta como para mantener el agua en estado líquido. Este proceso provoca alteraciones en la estructura de la lignocelulosa.
El objetivo de este trabajo fue analizar la posibilidad de utilizar la hidrólisis hidrotérmica para la ruptura de los polímeros vegetales y el incremento en la disponibilidad de azúcares monoméricos para su utilización en diversas industrias del ramo biotecnológico.
Material y Métodos
El presente trabajo se llevó a cabo en el departamento de Ciencia y Tecnología de Alimentos, en el laboratorio de Fermentaciones de la Universidad Autónoma Agraria Antonio Narro. Esta investigación constó de dos etapas, en la primera se realizó un pretratamiento a la materia prima de secado y caracterización física y bioquímica. Se clasificó por tamaño de partícula y se determinó la concentración de azúcares totales, azúcares reductores y capacidad antioxidante en la materia prima. La segunda etapa consistió en la realización de termo-hidrólisis al bagazo de uva (variedad merlot) y granada (variedad wonderful) para la liberación de azúcares monoméricos en el “slurry” (bagazo de uva hidrolizado) y el caldo obtenidos de ésta. Se evaluaron 3 factores en tres niveles cada uno. Los factores fueron: tiempo (5, 10, 15 minutos), presión (10, 15 y 20 psi) y tamaño de partícula (0.85-1.00, 1.40-1.70 y 2.36-2.80 mm de diámetro). La selección de los factores fue determinada tomando en cuenta diversos estudios previos (Dos Santos Rocha et al., 2017; Kumar & Sharma, 2017; Moure et al., 2017) ajustando los niveles para el estudio de los materiales del presente experimento.
Obtención y pretratamiento de la materia prima
Se obtuvieron los residuos de uva (variedad merlot) y granada (variedad wonderful) en las regiones de Parras y Cuatro Ciénegas, Coahuila respectivamente. Debido a que estos residuos son perecederos, se les realizó un pretratamiento de deshidratación en una estufa de secado por convección (Biobase Biodustry BOV-T70C) a 60 °C por 24 horas. Se molieron los residuos secos de uva y granada en una licuadora convencional, y se clasificaron utilizando tamices Montinox (México) de tres tamaños, malla #8 (2.36 mm), malla #12 (1.40 mm) y malla #20 (0.85 mm). Se pesó 1 g de cada muestra vegetal, se colocó en 40 mL de agua destilada y se agitó por 20 min. Posteriormente se filtró y se recibió el filtrado en vasos con hielo, el cual fue utilizado para los posteriores análisis, considerada como muestra filtrada.
Determinación de azúcares totales
Para la cuantificación de azúcares totales (Dubois et al., 1956) en el extracto, se colocaron 500 μL de la muestra filtrada en un tubo, 500 μL de fenol (Fermont, México) al 5 % y se colocó a baño de agua con hielo por 5 minutos. Con los tubos dentro del baño con hielo, se añadió lentamente y por las paredes 1000 μL de ácido sulfúrico (Jalmek, México) y se dejó reposar por 15 minutos. Para detener la reacción, se agitó suavemente y se llevó a baño caliente a 50 °C por 5 minutos. Se dejó a enfriar a temperatura ambiente por 5 minutos. Se leyeron absorbancias en lector de microplacas BIOBASE EL-10 A ELISA a 470 nm. La curva de calibración se realizó utilizando glucosa (Jalmek, México) al 0.1 %.
Cuantificación de azúcares reductores
Para la determinación de azúcares reductores (Miller, 1959), se adicionaron 1000 μL de la muestra filtrada, 1000 μL del DNS preparado y se llevó a baño María (Thermo Scientific), a 50 °C por 5 minutos. Se adiciono 5 mL de agua destilada, se dejó reposar por 5 minutos a temperatura ambiente. Se leyeron absorbancias en lector de microplacas BIOBASE EL-10 A ELISA a 520 nm. Para la curva de calibración se utilizó glucosa (Jalmek, México) al 0.1 %. Para la preparación del reactivo DNS, se calentaron 10 mL de agua destilada a 50 °C en un baño María (Thermo Scientific), con agitación se agregó el ácido 3,5-dinitrosalicílico (Sigma-Aldrich, U.S.A.), hidróxido de sodio (Jalmek, México), tartrato de sodio y potasio (Jalmek, México), fenol (Fermont, México) y sulfito de sodio (Fermont, México) en ese orden, se aforó con agua destilada a 100 mL, para la conservación se mantuvo en oscuridad y en refrigeración.
Análisis de compuestos antioxidantes
Para la determinación de compuestos antioxidantes (Molyneux, 2004), se pesaron 100 mg de muestra y se colocaron 1.5 mL de metanol (Hycel, México) en un tubo cónico de 2 mL. Se agitó en vórtex por 20 segundos, se sonicó por 5 min y posteriormente se centrifugó a 12,000 rpm por 10 minutos. Se extrajo el sobrenadante y se filtró con pirinolas de nilón de poro 0.45 micrómetros para su posterior análisis. Se preparó el 2,2-difenil-1-picrilhidrasil (DPPH; Sigma-Aldrich, U.S.A.) a una concentración de 60 % p/v. Se colocó la muestra de material vegetal y el radical DPPH en una relación 50:50. Se leyeron absorbancias en lector de microplacas BIOBASE EL-10 A ELISA a 540 nm.
Optimización del proceso de hidrólisis térmica
El proceso de optimización se realizó mediante un diseño factorial fraccionado con arreglos ortogonales, mediante el software Minitab 17.1.0. Se seleccionaron tres factores (tiempo, presión y tamaño de partícula) y se estableció una matriz ortogonal L-9 con tres niveles de variación por factor (Tabla 1).
Tabla 1 Diseño Taguchi L-9 de tres factores en tres niveles.
| Treatment | Time (min) | Pressure (psig)* | Size (mesh) |
|---|---|---|---|
| T1 | 5 | 10 | 8 |
| T2 | 5 | 15 | 12 |
| T3 | 5 | 20 | 20 |
| T4 | 10 | 10 | 12 |
| T5 | 10 | 15 | 20 |
| T6 | 10 | 20 | 8 |
| T7 | 15 | 10 | 20 |
| T8 | 15 | 15 | 8 |
| T9 | 15 | 20 | 12 |
*Las temperaturas de hidrólisis fueron de 115, 120 y 125 °C, que corresponden a presiones de 10, 15 y 20 psig respectivamente.
Proceso de hidrólisis térmica
Para la hidrólisis se utilizaron 2 g de muestra de cada tamaño de material vegetal y se colocaron en bolsas Filtro para fibra (Ankom Technology F57), de porosidad 0.25 micras, junto con 500 mL de agua destilada. Posteriormente se colocaron las bolsas dentro de un reactor de presión de aluminio vaciado. Las muestras fueron clasificadas en “slurry”, haciendo referencia al bagazo de uva después del tratamiento de hidrólisis; y la fracción líquida derivada del tratamiento de hidrólisis, denominada caldo hidrolizado. A estas dos fracciones se les determinó azúcares totales. Después de haber obtenido los resultados de cada una de las muestras, se compararon y se hizo un análisis del diseño factorial, mediante el software estadístico Minitab (versión 17.1.0) para poder seleccionar los mejores valores.
Resultados y Discusión
El análisis inicial de azúcares totales y reductores en la materia prima, tanto de uva como de granada, muestra que la mayor concentración de azúcares totales en el bagazo de uva. Clasificado por tamaño de partícula se obtuvo con un tamaño entre 1.40-1.70 mm con 2.682 mg/mL (Tabla 2). La mayor concentración de azúcares reductores en bagazo de uva se obtuvo con diámetros de partícula entre 0.85-1.00 mm (1.333 mg/mL). En cuanto la actividad antioxidante (AOx) representada por el contenido de DPPH, la mayor concentración se presentó con diámetros de partícula entre 2.36-2.80 mm (2.43 mg/mL).
Tabla 2 Concentración de azúcares totales y reductores en el bagazo de uva y bagazo de granada, clasificada por tamaño de partícula.
| Grape | Pomegranate | |||||
|---|---|---|---|---|---|---|
| Particle size | TS (mg/mL) | RS (mg/mL) | AOx (mg/mL) | TS (mg/mL) | RS (mg/mL) | AOx (mg/mL) |
| 2.36-2.80 mm | 1.976±0.077c | 0.821±0.044c | 2.43±0.11a | 2.070±0.105c | 1.656±0.187b | 2.77±0.64b |
| 1.40-1.70 mm | 2.682±0.104a | 1.017±0.054b | 2.08±0.08b | 4.215±0.212a | 1.646±0.086b | 4.59±0.66a |
| 0.85-1.00 mm | 2.297±0.089b | 1.333±0.070a | 2.31±0.10a | 3.938±0.198b | 2.058±0.107a | 4.95±0.60a |
Promedios con letras iguales entre cada columna, no son diferentes estadísticamente (Tukey, p ≤ 0.05). TS: Azúcares totales; RS: Azúcares reductores; AOx: Actividad antioxidante.
Para la cáscara de granada, la mayor concentración de azúcares totales se obtuvo en partículas entre 1.40-1.70 mm (4.215 mg/mL). La mayor concentración de azúcares reductores, se obtuvo con diámetros entre 0.85-1.00 mm (2.058 mg/mL). La mayor concentración de DPPH se obtuvo con diámetros de partícula entre 0.85-1.00 mm (4.95 mg/mL).
Lo anterior refleja que el tamaño de partícula es un factor que afecta en la cuantificación de analitos de interés. Esta variación puede ser atribuida a la facilidad con la que puede interactuar el material con el compuesto químico, ya que permite una mejor distribución superficial. Jiménez Islas et al. (2012) mostraron el efecto de la concentración del ácido empleado en los procesos de hidrólisis y mencionan que la interferencia se puede dar debido a la variación en el tamaño de partícula del material, principalmente su interacción entre el área superficial y el ataque ácido hacia las partículas. Para mejorar la extracción de los azúcares por procesos de termo-hidrólisis, un menor tamaño de partícula supondrá menores cambios en las fuerzas de adhesión entre partículas de diferentes tamaños (Polachini et al., 2019).
Análisis experimental del tratamiento de hidrólisis térmica
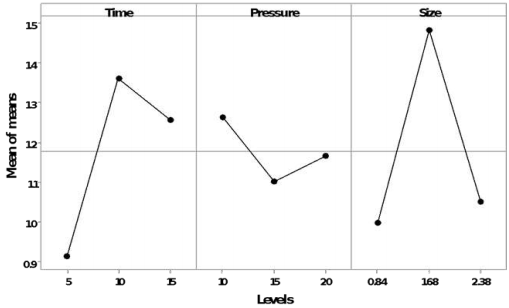
Los niveles evaluados experimentalmente para poder estudiar el proceso de hidrólisis térmica presentaron perfiles de calentamiento y enfriamiento con tiempos de 13±2 min y 22±2 min respectivamente. La Tabla 3 muestra los análisis de varianza efectuados para los azúcares reductores obtenidos de los tratamientos derivados del diseño ortogonal L-9. Para el hidrolizado líquido de uva, los factores tiempo, presión y tamaño de partícula en los niveles individuales evaluados, no mostraron efectos significativos (p ≤ 0.05). Sin embargo, el modelo estimado por el análisis de Taguchi logró determinar, que el mayor efecto para la liberación de azúcares reductores para el hidrolizado está dado por el tamaño de partícula, seguido por el tiempo de duración del proceso (Figura 1).
Tabla 3 ANOVA del diseño Taguchi para los azúcares reductores de residuos de uva.
| Hydrolysate | Source | DF | Seq SS | Adj SS | Adj MS | F | P |
| Time | 2 | 0.32786 | 0.32786 | 0.16393 | 1.24 | 0.447 | |
| Pressure | 2 | 0.03980 | 0.03980 | 0.01990 | 0.15 | 0.869 | |
| Size | 2 | 0.42639 | 0.42639 | 0.21319 | 1.61 | 0.383 | |
| Residual error | 2 | 0.26502 | 0.26502 | 0.13251 | |||
| Total | 8 | 1.05906 | |||||
| Slurry | Source | DF | Seq SS | Adj SS | Adj MS | F | P |
| Time | 2 | 0.47264 | 0.47264 | 0.236319 | 26.00 | 0.037 | |
| Pressure | 2 | 0.35601 | 0.35601 | 0.178004 | 19.58 | 0.049 | |
| Size | 2 | 0.37008 | 0.37008 | 0.185042 | 20.35 | 0.047 | |
| Residual error | 2 | 0.01818 | 0.01818 | 0.009091 | |||
| Total | 8 | 1.21691 |
DF: grados de libertad; Seq SS: suma de cuadrados secuenciales; Adj SS: Suma de cuadrados ajustada; Adj MS: Cuadrado medio ajustado.
Para el slurry de residuos de uva los tres factores evaluados mostraron un efecto significativo para la liberación de azúcares reductores (p ≤ 0.05), siendo el tiempo el factor que más beneficia al proceso, seguido de la presión en el sistema (Figura 2).
En el caso del hidrolizado líquido y del slurry de los residuos de granada, los factores tiempo, presión y tamaño de partícula en los niveles individuales evaluados, no mostraron efectos significativos (p ≤ 0.05) en ambos tratamientos.
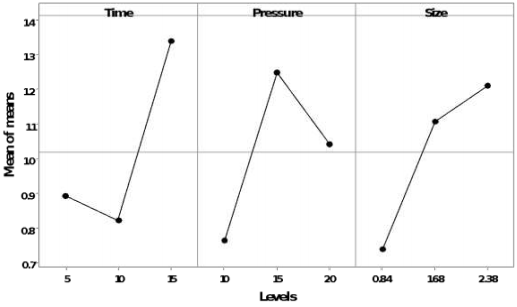
El mayor efecto para la liberación de azúcares reductores para el hidrolizado está dado por la presión en el proceso, seguido por el tiempo de duración del proceso (Figura 3); y el mayor efecto para la liberación de azúcares en el slurry, fue el tamaño de partícula, seguido del tiempo del proceso (Figura 4).

Figura 3 Efectos principales para las medias de azúcares reductores liberados en el hidrolizado de granada.

Figura 4 Efectos principales para las medias de azúcares reductores liberados en el slurry de granada.
Tabla 4 ANOVA del diseño Taguchi para los azúcares reductores de residuos de granada.
| Hydrolysate | Source | DF | Seq SS | Adj SS | Adj MS | F | P |
| Time | 2 | 1.2535 | 1.2535 | 0.6268 | 0.53 | 0.652 | |
| Pressure | 2 | 1.1289 | 1.1289 | 0.5644 | 0.48 | 0.675 | |
| Size | 2 | 0.5560 | 0.5560 | 0.2780 | 0.24 | 0.808 | |
| Residual error | 2 | 2.3454 | 2.3454 | 1.1727 | |||
| Total | 8 | 5.2838 | |||||
| Slurry | Source | DF | Seq SS | Adj SS | Adj MS | F | P |
| Time | 2 | 1.549 | 1.549 | 0.7745 | 0.24 | 0.808 | |
| Pressure | 2 | 1.463 | 1.463 | 0.7317 | 0.22 | 0.817 | |
| Size | 2 | 3.238 | 3.238 | 1.6189 | 0.50 | 0.668 | |
| Residual error | 2 | 6.521 | 6.521 | 3.2604 | |||
| Total | 8 | 12.771 |
DF: grados de libertad; Seq SS: suma de cuadrados secuenciales; Adj SS: Suma de cuadrados ajustada; Adj MS: Cuadrado medio ajustado.
La diferencia en los ANOVAs y el impacto de los factores evaluados en la liberación de los azúcares monoméricos se puede deber a las características del material vegetal. Al emplear los residuos de procesos industriales donde se requieren los azúcares como materia prima, estos carecen de azúcares hidrosolubles disponibles para extracción acuosa a bajas condiciones de tiempo y temperatura.
El análisis y optimización de las condiciones de hidrólisis térmica para los residuos de uva mostraron que las interacciones entre tiempo-tamaño y presión-tamaño presentan los mayores índices de severidad (27.41 % y 20.76 % respectivamente). Para los residuos de granada, la interacción más crítica con el 34.29 % de severidad fue la de presión-tamaño. El tamaño de partícula facilita la hidrólisis, debido a la ampliación del área de contacto, además de solubilizarse en mayor medida a tamaños más pequeños de partícula (Grajales Martínez et al., 2018).
Con lo anterior, se pudo determinar las condiciones que más favorecen la liberación de azúcares reductores de hidrolizados de residuos de uva, como son: tiempo de 10 min, presión de 10 psi y tamaño de 1.40-1.70 mm; mientras que para el slurry son: tiempo de 15 min, presión de 15 psi y tamaño de 2.36-2.80 mm. Las condiciones para los hidrolizados de residuos de granada son: tiempo de 15 min, presión de 20 psi y tamaño de 1.40-1.70 mm; mientras para el slurry: tiempo de 5 min, presión de 15 psi y tamaño de 2.36-2.80 mm.
Las condiciones antes mencionadas, logran una mejor extracción del contenido de azúcares reductores (Tabla 5), lo que permite generar un valor agregado a estos residuos, y poderlos emplear como sustrato en diversos procesos para la obtención de biomoléculas o biocombustibles.
Tabla 5 Comparación del contenido de azúcares y capacidad antioxidante (AOx) de la uva y granada, y los derivados del proceso de termo-hidrólisis.
| Glucose (mg/ml) | AOx (mg/ml) | |
|---|---|---|
| Grape-Initial | 1.31±0.04b | 2.27±0.18a |
| Grape-Hydrolysate | 1.77±0.02a | 0.99±0.53b |
| Grape-Slurry | 1.76±0.04a | 1.64±0.14b |
| Pomegranate-Initial | 2.08±0.02c | 4.10±0.17a |
| Pomegranate-Hydrolysate | 3.18±0.03a | 2.24±0.13b |
| Pomegranate-Slurry | 2.33±0.04b | 2.21±0.40b |
En ambos residuos vegetales, el proceso de hidrólisis logra incrementar la extracción de los azúcares reductores presentes en los vegetales, comparado con los valores iniciales de las respectivas muestras de uva y granada. La cantidad de agua absorbida en las partículas permite dar acceso a las moléculas de agua, lo que ayuda a hinchar el material vegetal, generando regiones amorfas y favorecer el proceso de hidrólisis (Kapoor et al., 2019).
Los tratamientos de hidrólisis logran convertir la pared vegetal recalcitrante, conformada principalmente por lignina, en compuestos de hemicelulosa de mayor accesibilidad hacia los azúcares monoméricos. Zietsman et al. (2017) identificaron que el tratamiento térmico al que sometieron sus muestras de residuos de uva logró eliminar la pectina incrementar los carbohidratos liberados (xilano, xiloglucano, celulosa y polímeros de manano) en los sobrenadantes obtenidos. Dos Santos Rocha et al. (2017) al realizar estudios de tratamientos hidrotérmicos sobre bagazo de caña de azúcar, reportan que los tratamientos térmicos pueden remover la hemicelulosa hasta un 85 % favoreciendo la conversión de carbohidratos en oligómeros y monómeros.
Las condiciones de presión (temperatura) y tamaños de partícula evaluadas logran remover la lignina de la fase líquida (hidrolizado) siendo más evidente en los residuos de granada que en los de uva (Tabla 4). La baja cantidad de glucosa en la uva hidrolizada se puede deber a la conversión de los azúcares monoméricos iniciales en hidroximetilfurfural y furfural (Dos Santos Rocha et al., 2017).
Los análisis de la capacidad antioxidante en los materiales de bagazo de uva y residuos de granada se ven relacionados con los tiempos de residencia y temperatura, debido a las características que presentan las proantocianidinas, antocianinas y flavonoides de sufrir hidrólisis conforme se incrementan los tiempos de hidrólisis (Petrović et al., 2016), lo que representa una baja en su actividad antioxidante al ser sometidas a mayores tiempos y temperaturas de proceso térmico. La actividad antioxidante está ligada a los compuestos fenólicos presentes en el material vegetal y a los derivados de la degradación de la lignina por el tratamiento térmico. En el caso de los hidrolizados de uva y granada, se mostraron reducciones en el efecto antioxidante de las muestras tratadas con la termo-hidrólisis. La concentración y el tipo de compuestos fenólicos presentes en los hidrolizados dependen de las condiciones de operación (temperatura y tiempos de residencia) así como del material lignocelulósico tratado y su contenido inicial de compuestos fenólicos (Moure et al., 2017).
Conclusión
El proceso de hidrólisis térmica logró liberar una mayor cantidad de azúcares en las muestras de uva y las muestras de granada, comparadas con las iniciales. La liberación de reductores indica que el proceso de termo-hidrólisis como pretratamiento logra remover la lignina vegetal y dar disponibilidad para los azúcares presentes.
El tiempo del proceso y el tamaño de partícula tienen un factor determinante en el proceso de hidrólisis. Queda claro que el tiempo de exposición es una variante para considerar en el futuro, sobre todo si se desea llegar a mayores concentraciones en la extracción de azúcares de residuos agroindustriales.
Agradecimientos
La autora Mariela Chávez García, agradece al CONACYT por la beca otorgada durante sus estudios de postgrado. El autor Armando Robledo Olivo, agradece a la Universidad Autónoma Agraria Antonio Narro por el apoyo otorgado a través de los proyectos internos de investigación.
REFERENCIAS
Álvarez, C., Reyes‐Sosa, F. M. and Díez, B. (2016). Enzymatic hydrolysis of biomass from wood. Microbial biotechnology, 9(2): 149-156. https://doi.org/10.1111/1751-7915.12346 [ Links ]
Blanco, L. I., Blanco, E. A. and Rodríguez, R. (2017). Oxidación Microbiana del Glicerol por Microorganismos Termotolerantes Aislados de Noreste de México. Revista de Ciencias Farmaceúticas y Biomedicina. III Simposio Nacional de Ciencias Farmacéuticas y Biomedicina I Simposio Nacional de Microbiología Aplicada http://www.rcfb.uanl.mx/index.php/rcfb/article/view/34/34 [ Links ]
Castro Granado, A. J. (2018). Estudio bibliográfico del estado del arte de la digestión anaerobia de residuos sólidos orgánicos y mejora del proceso mediante pretratamientos (Tesis de Licenciatura), Universidad de Cádiz, Facultad de Ciencias del Mar y Ambientales. Puerto Real, Cádiz. http://hdl.handle.net/10498/20924 [ Links ]
Rodrigues Dos Santos Rocha, M. S., Pratto, B., De Sousa Júnior, R., Garcia Almeida, R. M. R. and Goncalves da Cruz, A. J. (2017). A kinetic model for hydrothermal pretreatment of sugarcane straw. Tecnología Bioambiental, 228: 176-185. https://doi.org/10.1016/j.biortech.2016.12.087 [ Links ]
Dubois, M., Gilles, K. A., Hamilton, J. K., Rebersy, P. t. and Smith, F. (1956). Colorimetric method for determination of sugars and related substances. Analytical chemistry, 28(3): 350-356. https://doi.org/10.1021/ac60111a017 [ Links ]
Financial-Tribune. (2016). Pomegranate Production Estimated at Over 1m Tons. Financial Tribune. https://financialtribune.com/articles/economy-domestic-economy/53155/pomegranate-production-estimated-at-over-1m-tons [Last Checked: April 4th 2020]. [ Links ]
Grajales Martínez, A. F., Tello Aragón, J. P. and Verdugo Reátiga, O. (2018). Diseño de un proceso para el aprovechamiento de los residuos orgánicos generados en el proceso de extracción de la pulpa de Fruta Pontificia Universidad Javeriana ]. http://vitela.javerianacali.edu.co/handle/11522/10884 [Last Checked: April 4th 2020]. [ Links ]
Jiménez Islas, D., Abreu Corona, A., López y López, V. E., Tellez Jurado, A. and Gracida Rodríguez, J. N. (2012). Obtención de azúcares fermentables mediante hidrólisis ácida de Beta vulgaris L. Revista internacional de contaminación ambiental, 28(2): 151-158. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0188-49992012000200006 [ Links ]
Kapoor, M., Semwal, S., Satlewal, A., Christopher, J., Gupta, R. P., Kumar, R., Puri, S. K. and Ramakumar, S. S. V. (2019). The impact of particle size of cellulosic residue and solid loadings on enzymatic hydrolysis with a mass balance. Fuel, 245: 514-520. https://doi.org/10.1016/j.fuel.2019.02.094 [ Links ]
Kumar, A. K., & Sharma, S. (2017). Recent updates on different methods of pretreatment of lignocellulosic feedstocks: a review. Bioresources and bioprocessing, 4, 7. https://doi.org/10.1186/s40643-017-0137-9 [ Links ]
Mejías-Brizuela, N., Orozco-Guillén, E. and Galáan-Hernández, N. (2016). Aprovechamiento de los residuos agroindustriales y su contribución al desarrollo sostenible de México. Revista de Ciencias Ambientales y Recursos Naturales, 2(6): 27-41. http://ecorfan.org/spain/researchjournals/Ciencias_Ambientales_y_Recursos_Naturales/vol2num6/Revista_de_Ciencias_Ambientales_y_Recursos_Naturales_V2_N6_4.pdf [ Links ]
Mestries, F. (2015). Los posibles impactos de la biotecnología en la agricultura mexicana. Sociológica México (13) 5. http://www.sociologicamexico.azc.uam.mx/index.php/Sociologica/article/view/924 [ Links ]
Miller, G. L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical chemistry, 31(3): 426-428. https://doi.org/10.1021/ac60147a030 [ Links ]
Moldes, A. B., Cruz, J. M., Domíniquez, J. M. and Parajó, J. C. (2002). Production of a cellulosic substrate susceptible to enzymatic hydrolysis from prehydrolyzed barley husks. Agricultural and Food Science in Finland, 11(1): 51-58. http://urn.fi/URN:NBN:fi-fe201604069163 [ Links ]
Molyneux, P. (2004). The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J. sci. technol, 26(2): 211-219. http://rdo.psu.ac.th/sjstweb/journal/26-2/07-DPPH.pdf [ Links ]
Moure, A., Garrote, G. and Domínguez, H. (2017). Effect of Hydrothermal Pretreatment on Lignin and Antioxidant Activity. In Ruiz, H., Hedegaard Thomsen, M., & Trajano, H. (Eds.), Hydrothermal Processing in Biorefineries. Springer, Cham. https://doi.org/10.1007/978-3-319-56457-9_2 [ Links ]
Petrović, J., Perišić, N., Maksimović, J. D., Maksimović, V., Kragović, M., Stojanović, M., Laušević, M. and Mihajlović, M. (2016). Hydrothermal conversion of grape pomace: Detailed characterization of obtained hydrochar and liquid phase. Journal of Analytical and Applied Pyrolysis, 118: 267-277. https://doi.org/10.1016/j.jaap.2016.02.010 [ Links ]
Polachini, T. C., Mulet, A., Telis-Romero, J. and Cárcel, J. A. (2019). Influence of high-intensity ultrasound application on the kinetics of sugar release from acid suspensions of artichoke (Cynara scolymus) biomass. Chemical Engineering and Processing-Process Intensification, 145: 107681. https://doi.org/10.1016/j.cep.2019.107681 [ Links ]
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación [SAGARPA]. (2017). Uva Mexicana. In SAGARPA (Ed.), Planeación Agrícola Nacional 2017-2030 (pp. 1-16). https://www.gob.mx/cms/uploads/attachment/file/257085/Potencial-Uva.pdf [ Links ]
Saval, S. B. (2012). Aprovechamiento de residuos agroindustriales: pasado, presente y futuro. BioTecnología, 16(2): 14-46. https://smbb.mx/wp-content/uploads/2017/10/Revista_2012_V16_n2.pdf [ Links ]
Shahbandeh, M. (2019). Global grape production 2012/13-2018/19. https://www.statista.com/statistics/237600/world-grape-production-in-2007-by-region/ [Last Checked: April 4th 2020]. [ Links ]
Servicio de Información Agroalimentaria y Pesquera [SIAP]. (2018). Anuario Estadístico de la Producción Agrícola https://nube.siap.gob.mx/cierreagricola/ [Last Checked: April 4th 2020]. [ Links ]
Sun, S., Sun, S., Cao, X. and Sun, R. (2016). The role of pretreatment in improving the enzymatic hydrolysis of lignocellulosic materials. Bioresource technology, 199: 49-58. https://doi.org/10.1016/j.biortech.2015.08.061 [ Links ]
Zietsman, A. J. J., Moore, J. P., Fangel, J. U., Willats, W. G. T. and Vivier, M. A. (2017). Combining hydrothermal pretreatment with enzymes de-pectinates and exposes the innermost xyloglucan-rich hemicellulose layers of wine grape pomace. Food Chemistry, 232: 340-350. https://doi.org/10.1016/j.foodchem.2017.04.015 [ Links ]
Como citar este artículo: Chávez García, M., González Morales, S., Benavides Mendoza, A., Charles Rodríguez, A. V., Cabrera de la Fuente, M., Martínez Vázquez, D. G., Robledo Olivo, A. (2020). Thermo-hydrolysis for release of monomeric sugars in agricultural waste (agrowaste thermo-hydrolysis). Revista Bio Ciencias 7, e946. doi: https://doi.org/10.15741/revbio.07.e946
Recibido: 19 de Febrero de 2020; Aprobado: 08 de Octubre de 2020; Publicado: 19 de Octubre de 2020











 texto em
texto em