Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de biodiversidad
versão On-line ISSN 2007-8706versão impressa ISSN 1870-3453
Rev. Mex. Biodiv. vol.85 no.3 México Set. 2014
https://doi.org/10.7550/rmb.41756
Ecología
Efecto de los incendios forestales no controlados en el ensamble de escarabajos coprófagos (Coleoptera: Scarabaeidae) en un bosque templado del centro de México
Effect of uncontrolled forest fires on the coprophagous beetle assemblages (Coleoptera: Scarabaeidae) in a temperate forest in Central Mexico
Lucrecia Arellano1* y Citlalli Castillo-Guevara2
1 Red de Ecoetología, Instituto de Ecología, A. C. Carretera Antigua a Coatepec 351, El Haya, 91070 Xalapa Veracruz, México. * lucrecia.arellano@inecol.mx
2 Centro de Investigación en Ciencias Biológicas, Universidad Autónoma de Tlaxcala. Km. 10.5 Autopista Tlaxcala-San Martín Texmelucan, 90120 San Felipe Ixtacuixtla, Tlaxcala, México.
Recibido: 08 septiembre 2013
Aceptado: 25 marzo 2014
Resumen
Este trabajo analiza el efecto de los cambios en la vegetación y en el suelo, resultantes de un incendio forestal no controlado, en el ensamble de los escarabajos coprófagos (Scarabaeinae y Aphodiinae) en un área con bosque templado del centro de México. En sitios quemados, no quemados y de borde, se midieron las características del suelo y de la vegetación, y se realizaron muestreos mensuales de escarabajos coprófagos, incluyendo 2 temporadas de lluvias. Se obtuvieron un total de 6 786 especímenes de 6 especies. Ambas subfamilias tuvieron mayores abundancias en los sitios quemados y de borde, aunque estas diferencias no fueron significativas. La textura, humedad relativa y la cantidad de carbono y nitrógeno en el suelo, así como las relaciones de dominancia-diversidad de los ensamblajes de los escarabajos del estiércol, fueron significativamente diferentes entre los sitios. Las abundancias mensuales entre especies, entre meses y su interacción cambiaron significativamente. Aunque aparentemente el incendio no tuvo un impacto significativo en el corto plazo en el ensamble de los escarabajos coprófagos, hubo un decremento importante en las abundancias de las especies en la segunda temporada de muestreo.
Palabras clave: Aphodiinae, Scarabaeinae, bosque de Juniperus, perturbación, fuego, suelo.
Abstract
This paper examines the effect of changes in vegetation and soil, resulting from an uncontrolled forest fire, in the dung beetles assemblage (Scarabaeinae and Aphodiinae) in a temperate forest in central Mexico. In burned, unburned, and edge sites, soil and vegetation characteristics were measured, and dung beetles were sampled monthly (including over 2 rainy seasons). A total of 6 786 specimens of 6 species were obtained. Both subfamilies were more abundant at the burned and edge sites, though these differences were not significant. The texture, relative humidity and carbon and nitrogen content of the soil were significantly different, as were the dominance-diversity relationships for the dung beetles assemblages among sites. Monthly species abundance varied significantly among species, months and their interaction. Although the fire did not appear to have a significant impact on the dung beetle assemblage in the short term, there was a significant decrease in the abundance of species during the second rainy
season.
Key words: Aphodiinae, Scarabaeinae, Juniperus forest, disturbance, fire, soil.
Introducción
El fuego es un proceso físicoquímico que necesita un material combustible, la presencia de oxígeno y una fuente de calor. Aunque puede ser originado por fenómenos naturales derivados de eventos meteorológicos, tales como descargas eléctricas o erupción de volcanes, en la gran mayoría de los casos la presencia del fuego se debe a la acción humana (Retana y Gracia, 1998; Cochrane, 2002). En México se estima que los incendios provocados por el hombre representan el 99% del total de estos eventos y sólo 1% de ellos tiene como origen fenómenos naturales (Conafor, 2009).
En México, el fuego es usado principalmente en la preparación de las tierras para la agricultura y la ganadería, mediante el sistema roza-tumba y quema (SRTQ) (Lara-Ponce et al., 2012). Debido a que el SRTQ se aplica comúnmente durante la temporada de estiaje, las probabilidades de que estos incendios controlados se propaguen hasta las zonas boscosas son muy elevadas, dando origen a los incendios forestales no controlados, término que también incluye superficies de pastizales, arbustos y matorrales (Wong-González y Villers, 2007).
Los incendios de origen antrópico representan, desde el punto de vista ecológico, una perturbación, ya que se producen con mayor frecuencia e intensidad que los incendios de origen natural y pueden provocar una pérdida de individuos y biomasa de forma súbita o episódica. Una de las consecuencias del fuego es la liberación de espacio físico que provoca que se establezcan nuevas relaciones entre los organismos que sobreviven o que acceden al área perturbada (Lloret, 2004), ya sea por el aumento en la heterogeneidad ambiental o por la simplificación estructural del hábitat.
El fuego puede tener efectos negativos sobre las especies, no sólo por causar la muerte directa de los individuos, sino también porque provoca efectos indirectos más duraderos como estrés y desaparición de hábitat, territorios, cobijo y alimento. La desaparición de especies de gran importancia para los ecosistemas forestales, tales como polinizadores y descomponedores, puede retardar de forma muy significativa la recuperación del bosque (Boer, 1989).
Los insectos que habitan en la hojarasca y en el suelo, como son las hormigas (Castaño-Meneses y Palacios-Vargas, 2003), coleópteros, lepidópteros y dípteros, también pueden verse afectadas por el cambio de hábitat resultante de los incendios (Armúa et al., 2004), pues su composición de especies puede cambiar o puede haber una disminución en la abundancia y en el número de especies. Por ejemplo, la mayoría de las poblaciones de los coleópteros decrecen por impacto de los incendios forestales (Chandler et al., 1983).
Los incendios afectan de forma diferente a las especies. En algunos casos se facilita la entrada de especies invasoras (Martínez-Carretero, 1995; Pons, 2001a, 2001b); en otros, aumentan las densidades de insectos herbívoros (Kerstyng y Stiling, 1999); asimismo, favorecen el ataque de escarabajos escolítidos barrenadores a los árboles debilitados por los mismos incendios (Fonseca et al., 2008). En sitios que han sufrido incendios es común encontrar en la corteza y en la madera de algunas especies de pinos, como Pinus radiata, numerosos cerambícidos (Giganti y Dapoto, 1990) y en bosques de coníferas, en general, el número de individuos y de algunas especies se puede incrementar después de un incendio (Muona y Rutanen, 1994; Rivera-Cervantes y García-Real, 1998; Armúa et al., 2004; Dennis et al., 2001; Urones y Majadas, 2002; Yvärinen et al., 2009).
Se han hecho numerosos estudios del efecto de los incendios sobre los insectos (Hansen, 1986; Anderson et al., 1989; Swengel, 2001; Ron 2002; Kleinties et al., 2004; Kaynaş y Gürkan, 2008; Baum y Sharber, 2012; Frizzo et al., 2012; Vincent et al., 2012; Verble y Yanoviak, 2013; entre otros), y sobre los coleópteros (Wikars, 1997; Orgeas y Andersen, 2001; Fernández y Salgado, 2002; Zunino et al., 2002; Louzada et al., 2010, De Andrade et al., 2011, Iglay et al., 2012; Boulanger et al., 2013; entre otros). Sin embargo, aunque México ocupa el octavo lugar entre los países que pierden sus bosques a causa de los incendios (Wong-González y Villers, 2007), son aún muy escasos los trabajos que evalúan el efecto de los incendios forestales sobre las comunidades de insectos (Pérez-Chávez, 1981; Rivera-Cervantes y García-Real, 1998; Castaño-Meneses y Palacios-Vargas, 2003; Fonseca et al., 2008, 2009; Hernández y Adrián, 2012).
En Tlaxcala se han realizado algunos estudios sobre la fauna de Lamelicornios en la región de La Malinche (García-De Jesús, 2006), en el municipio de Panotla (Minor-Montiel, 2010) y en los municipios de Emiliano Zapata y Terrenate (García-De Jesús, 2011), pero no existen trabajos previos en cuanto al efecto del fuego en este grupo de insectos. Tlaxcala es 1 de los 3 estados con mayor riesgo de incendios y con los porcentajes más altos de superficie afectada en relación con su vegetación natural (Villers y Hernández, 2007), por lo que es importante estudiar el efecto que tiene el fuego sobre su vegetación y fauna. En este trabajo se analiza si los cambios en la vegetación y en las características del suelo, resultantes de un incendio no controlado, tienen un efecto en el ensamble de los escarabajos coprófagos (Scarabaeinae y Aphodiinae) de un bosque templado del centro de México. Nuestra hipótesis de trabajo es que, en el corto plazo posterior al incendio forestal no controlado, se observará una disminución en la riqueza y abundancia de especies, así como cambios en la composición y estructura del ensamble de estos coleópteros.
Materiales y métodos
Zona de estudio. El área de estudio se ubica en el municipio de Ixtacuixtla, Tlaxcala (19°20'03" N, 98°21'57" O; a 2 268 m snm) (Fig. 1). El clima es templado subhúmedo, con una temperatura media anual de 15.3° C y una precipitación media anual de 800 a 1 000 mm (SPP, 1987). El tipo de vegetación es bosque de sabino (Juniperus deppeana), el cual se encuentra rodeado por áreas sembradas de cebada (Hordeum vulgare) y trigo (Triticum spp.), así como de plantíos de Eucalyptus globulus. Otras especies que se encuentran en el estrato arbóreo son: Schinus molle, Buddleja cordata, Prunus serotina y Eysenhardtia polystachya; en el arbustivo Mimosa biuncifera, Opuntia tomentosa, Bouvardia ternifolia, Rhus standleyi, Brickelia veronicifolia y Adolphia infesta; y en el herbáceo: Argemone platyceras, Reseda luteola y Lycurus pleoides. De acuerdo con Lezama (2007), en la zona de estudio la cobertura de pastos era de 73-83%/ha, con una altura entre 0.63-0.49 m; la cobertura de arbustos era de 8.5-11%/ha, con una altura de 0.28-0.39 m; la de leñosas de 24-28%/ha con una altura de 7-7.1 m y la de herbáceas era de 5-33.5%/ha. Estas proporciones han cambiado a lo largo del tiempo (L. Arellano, datos no publicados).

A pesar de la expansión de la mancha urbana dentro del municipio de Ixtacuixtla, en la zona de estudio todavía es común encontrar fauna silvestre como, por ejemplo: conejo (Silvilagus cunicularius, S. floridanus), liebre (Lepus californicus), tlacuache (Didelphis marsupialis), cacomixtle (Bassariscus sumichrasti) y diversos roedores; zopilote (Coragyps atratus), gavilán (Falco sparverius) y otras especies de aves (Inegi, 1998).
Antecedentes sobre el incendio en Ixtacuixtla, Tlaxcala. En el 2009, el estado de Tlaxcala se ubicó como la sexta entidad con mayor número de incendios (Conafor, 2009). En el mes de abril de ese año ocurrió un incendio no controlado en la zona de estudio. De acuerdo con la Coordinación de Ecología del municipio de Ixtacuixtla, se afectaron 300 ha. El siniestro fue provocado, porque la quema para actividades agrícolas rebasó los límites deseados.
Recolección de ejemplares. Se realizaron muestreos mensuales posteriores al incendio a partir del mes de junio de 2009 a octubre de 2010. Con base en el conocimiento del área de estudio, a su tipo de vegetación, topografía y al objetivo del trabajo, se establecieron transectos de 125 m cada uno en un área de 15 ha. Los transectos estaban separados una distancia de 200 m: 2 transectos se ubicaron en el área de los bordes, límite del área donde llegó el fuego; 3 en el área quemada, área afectada por fuego, y 2 en el área sin afectación del fuego que sirvieron como áreas control.
En cada transecto se colocaron 6 trampas de caída, 3 fueron cebadas con excretas de caballo y 3 con excretas de conejo. Ambos tipos de excretas están presentes en el área, a diferencia del estiércol vacuno que no es un recurso existente en Ixtacuixtla. Se utilizaron 2 diseños de trampa (Halffter y Arellano, 2002): 1) botes de plástico con una capacidad de 1l con 200 ml de agua y con una malla que contenía el cebo sujeto a la tapa; 2) botes de plástico de la misma capacidad con 200 g de suelo en el fondo y el cebo encima de la tierra; ambos tipos tenían una protección en la parte superior contra la lluvia. Todas las trampas fueron enterradas a nivel del suelo y se revisaron y retiraron a las 48 h de ser colocadas.
Análisis de suelo. Se recolectaron 2 muestras de suelo por sitio; borde, área quemada y área control, que fueron tomadas a ras de suelo y a una profundidad de 20 cm, aproximadamente. En 2009, las muestras fueron tomadas en junio y agosto. En 2010, las muestras fueron tomadas en febrero, mayo y octubre. En el laboratorio de Suelos del Instituto de Ecología, A. C., se analizaron los siguientes parámetros de las muestras del suelo recolectado en cada sitio: pH, Ca (cmol/kg), Mg (cmol/kg), P (mg/kg) (Fósforo de Bray), Kint. (cmol/kg) y textura por Bouyocus (Nom-021-RECNAT-2000). El porcentaje de nitrógeno y de carbono por Analizador CN TruSpec, marca LECO, porcentaje de humedad (Gardner, 1986), densidad real y densidad aparente por cilindro (Blake y Hartge, 1986).
Vegetación. La cobertura de pastos, arbustos y leñosas fue medida en cada sitio, mediante líneas de intercepción (Mostacedo y Todd, 2000) en octubre 2009 y marzo 2010. El método de líneas de intercepción produce datos para cálculos de cobertura y frecuencia de especies; es rápido, objetivo y relativamente preciso. La cobertura de herbáceas se evaluó calculando el porcentaje visual del área que ocupan, en cuadrantes de 2x2 m. Dentro de cada sitio se trazaron 2 líneas continuas y en cada línea se evaluaron 6 cuadrantes.
Datos climáticos. La Comisión Nacional del Agua proporcionó los datos de precipitación y temperatura diaria en Ixtacuixtla para el periodo trabajado.
Análisis estadísticos. Para comparar las abundancias totales de escarabajos entre sitios se hizo una prueba de Kruskal Wallis, los datos no tenían una distribución normal. Se usaron gráficos de dominancia diversidad para explorar las relaciones de abundancia entre las especies.
Los datos de abundancia mensual fueron transformados mediante √x+1, para reducir la heterocedasticidad, después se realizó un ANOVA de medidas repetidas para comparar los cambios en la abundancia mensual de escarabajos entre sitios. Como factor repetido se uso la abundancia por mes, como factor de agrupamiento la condición: quemado, no quemado, control, y como réplicas las muestras obtenidas en los transectos según la condición. El factor intersujetos fue la especie. La suposición de asimetría no se cumplió (prueba de esfericidad; Dixon, 1992). La prueba de Friedman fue usada para comparar las características del suelo en los sitios en el tiempo. Esta prueba está indicada para muestras no independientes con distribuciones no normales. Finalmente, se llevaron a cabo pruebas de correlación de Spearman entre la abundancia mensual de escarabajos y la precipitación mensual, así como entre la abundancia mensual de escarabajos y la temperatura media mensual.
Para comparar las coberturas de pastos, herbáceas, arbustos y árboles en los diferentes muestreos en las áreas quemadas, control y borde, se hizo una prueba de independencia usando una X2. Debido a problemas sociales del área no se cuenta con la información de marzo 2010 en los transectos del área quemada, por lo que se omitió en el análisis.
Resultados
Se recolectaron un total de 6 786 especímenes de escarabajos representados en 6 especies: 2 especies de Aphodiinae y 4 especies de Scarabaeinae (Cuadro 1). Las áreas de borde fueron las que tuvieron la mayor abundancia (54% del total). Los Aphodiinae representaron el 97% del total registrado en esos sitios (Cuadro 1).
No se encontraron diferencias significativas en las abundancias entre sitios: quemado, control y borde (Kruskal-Wallis, X2= 5.992, gl= 5, p= 0.32). Todas las especies se recolectaron en todos los sitios, por lo que su riqueza fue similar. Aunque usamos 2 tipos de cebos, en las trampas cebadas con excretas de conejo las recolectas fueron muy escasas (0.5% del total), por lo que casi el total de los registros de individuos colectados se obtuvieron de las excretas de caballo.
Se encontró una correlación positiva entre la abundancia de los escarabajos coprófagos y la temperatura media mensual (Spearman, r= 0.58, n=16, p= 0.02) y la precipitación mensual (Spearman, r= 0.66, n=16, p= 0.006).
Dominancia-diversidad. En todos los sitios hubo una especie altamente dominante, que representó el 96% de la abundancia total (Cephalocyclus fuliginosus) (Fig. 2). En el área control Onthophagus chevrolati fue la segunda especie dominante y en el borde y en el área quemada fue Gonaphodiellus opisthius, el resto de las especies representaron menos del 1% en todos los sitios (Fig. 2).
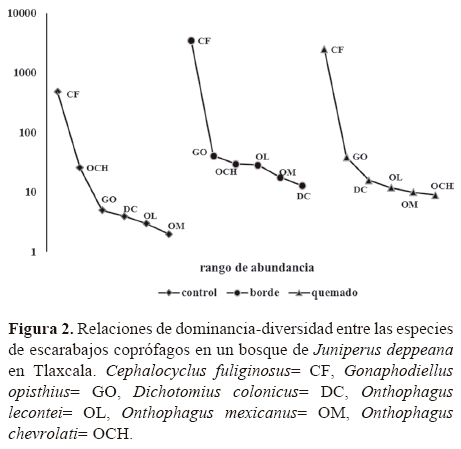
Estructura del ensamble. Todas las especies de Scarabaeinae capturadas son coprófagas, cavadoras y dominantemente nocturnas, con la excepción de Onthophagus lecontei, que es diurna, pues su periodo de actividad es entre 12:00 y 15:00 h. Las 2 especies de Aphodiinae son coprófagas, endocópridas y diurnas. En cuanto a su distribución espacial, las especies se colectaron en los bordes en más del 48% de las ocasiones y se registraron en menores proporciones en los otros sitios.
Distribución mensual. La distribución mensual de los escarabajos varió en los 6 sitios de colecta a lo largo del año (Fig. 3). Encontramos diferencias significativas en las abundancias entre especies (mr Andeva, F= 9.82, gl= 5, p= 0.00001), en las abundancias entre meses (mr Andeva, F= 8.23, gl= 14, p= 0.00001) y en la interacción especies*mes (mr Andeva, F= 7.88, gl= 70, p= 0.00001). Los Scarabaeinae tuvieron sus picos de abundancia en septiembre de 2009 y en julio de 2010 (Cuadro 2). Los Aphodiinae, por su parte, fueron muy abundantes en los meses de junio y agosto. En los meses más secos y fríos (enero a mayo de 2010) sólo se registró 1 individuo de C. fuliginosus.

En cuanto al número de especies presentes en los sitios, el mes de junio de ambos años fue el más alto, seguido por los meses de septiembre y octubre. En el mes de agosto de ambos años sólo se compartió el 50% de las especies (Cuadro 2).
Fenología de las especies en los sitios y tolerancia a los incendios. Cephalocyclus fuliginosus se distribuyó de junio a enero, pero a partir de octubre, su abundancia disminuyó considerablemente. En los sitios control fue más abundante en junio y agosto (Fig. 3a), en los sitios quemados y de borde se distribuyó preferentemente en junio (Figs. 3b, c).
Gonaphodiellus opisthius fue muy estacional, pues todos los ejemplares se encontraron entre junio y agosto, principalmente en los sitios quemados y de borde (Figs. 3b, c). Las abundancias relativas de ambas especies de Aphodiinae en el segundo año de muestreos, todavía fueron importantes en el tiempo, con respecto a la de las especies de Scarabaeinae (Fig. 3), sin embargo, hubo un decremento muy importante en su abundancia absoluta: Cephalocyclus fuliginosus presentó 2 433 individuos en el área quemada en junio de 2009 y sólo 27 individuos en junio de 2010 y en el área de borde se registraron 3 414 individuos en junio del 2009 y 82 individuos en junio de 2010. Se recolectaron 75 individuos de G. opisthius en junio del primer año y sólo 3 en junio del segundo año.
En cuanto a los Scarabaeinae, Dichotomius colonicus se distribuyó durante las lluvias, de junio a octubre, teniendo sus mayores abundancias en junio de 2009 en los sitios de borde (Fig. 3c). Es la especie que se colectó con mayor frecuencia en los sitios quemados. En el segundo año sus abundancias absolutas disminuyeron a menos del 50% en las áreas de borde y quemadas (Fig. 3). Onthophagus lecontei y O. mexicanus fueron 2 especies que se registraron entre junio y diciembre, siendo más frecuentes en los sitios de borde (Fig. 3c). Debido a sus bajas abundancias absolutas, no es posible observar una tendencia entre años. Onthophagus chevrolati fue la especie de Scarabaeinae más abundante, se distribuyó entre junio y noviembre y sus mayores abundancias se registraron en agosto y septiembre (Fig. 3). Se encontró preferentemente en sitios control y de borde durante el primer año de muestreo, en el segundo año fueron capturados escasamente en toda la localidad.
Análisis de suelo. Encontramos diferencias significativas en la textura del suelo entre los sitios: borde, quemado y control; en el tiempo (Friedman, X2= 23.33, gl=2, p< 0.0001), en las relaciones C/N (Friedman, X2= 28.13, gl=2, p< 0.0001), en la humedad relativa superficial y a 20 cm (Friedman, X2= 5.40, gl=1, p< 0.02). En el mes de junio de 2009, a 2 meses del incendio, tanto el N como el C habían aumentado en el área quemada en más del 50% con respecto al borde, y el C alcanzó sus mayores valores en agosto de 2009; sin embargo, entre febrero y octubre de 2010 las proporciones de nitrógeno en las áreas quemadas ya eran similares a las de las áreas no quemadas. En octubre de 2010, la cantidad de carbono en área control resultó ser casi el doble que la encontrada en el área quemada y mayor que la encontrada en el borde (Cuadro 3). No se encontraron diferencias significativas en el resto de los parámetros medidos (Cuadro 4).

Aunque no encontramos diferencias significativas en los valores de pH en el suelo (Friedman, X2= 3.02, gl=3, p> 0.05), en el área quemada el pH fue alto entre junio y agosto (7.5-8), volviéndose cada vez más ácido al paso del tiempo (6.1 en octubre del 2010). En el borde el suelo fue volviéndose gradualmente más alcalino con el paso del tiempo (de 6.2 en junio de 2009 hasta 7.4 en mayo 2010) y en el área control se mantuvo casi neutro (6.4-6.9).
Vegetación. En la figura 4 se muestra la cobertura por forma de vida en los sitios muestreados. En general, hubo un aumento en la cobertura de pastos, una disminución en la cobertura de herbáceas y un aumento en la cobertura de árboles. No hubo una tendencia general en la cobertura de los arbustos, ni hubo diferencias significativas en las proporciones de la cobertura vegetal entre el tiempo inicial (octubre 2009) y final (marzo 2010) en los sitios analizados: borde 1 (X2= 0.259, gl= 3, p≥ 0.05); borde 2 (X2= 0.451, gl= 3, p≥ 0.05); control (X2= 0.566, gl= 3, p≥ 0.05); quemado 1 (X2= 0.263, gl= 3, p≥ 0.05) y quemado 3 (X2= 0.617, gl= 3, p≥ 0.05).

Discusión
En este trabajo se evaluaron los cambios en el ensamble de escarabajos coprófagos, relacionados con las variaciones sufridas en la vegetación y en el suelo después del incendio. Contrario a lo esperado, no hubo una disminución en la riqueza total de especies de los sitios control a los quemados, sino que sus valores fueron similares. Sin embargo, la abundancia total en sitios de borde y en sitios quemados fue mayor que en los sitios control. Esta tendencia coincide, en parte, con lo encontrado por numerosos autores (Lussenhop, 1976; Muona y Rutanen, 1994; Armúa et al., 2004; Dress y Boerner, 2004; Prieto y Ves Losada, 2007; Bliss et al., 2012; Reyes et al., 2012; Jiménez-Gutiérrez, 2013; entre otros) quienes mencionan que la riqueza de especies y el número de individuos se pueden incrementar después de un incendio. En contraste, en otros estudios a corto plazo, se ha observado que numerosos grupos de insectos disminuyen su abundancia después de los incendios forestales (Hansen, 1986; Anderson et al., 1989; Siemann et al., 1997). Por ejemplo, Rivera-Cervantes y García-Real (1998) estudiaron coleópteros (Scarabaeinae y Silphidae) en la Reserva de la Biosfera Sierra de Manantlán, Jalisco y en las áreas no quemadas obtuvieron abundancias 2 veces mayores que en áreas quemadas.
Algunos trabajos coinciden en que el impacto inicial del fuego produce una drástica reducción en las abundancias de los organismos del suelo, pero su número se recupera con el tiempo (Metz y Dindal, 1980). Esto depende también del grupo de organismos estudiado, por ejemplo, Jiménez-Gutiérrez (2013) obtuvo abundancias altas para escarabajos del estiércol en los primeros años después del incendio y para Silphidae abundancias bajas, invirtiéndose este patrón con el paso del tiempo. En nuestro caso, la mayor parte de las especies presentaron menor abundancia en el segundo año, lo que sugiere un efecto a más largo plazo.
Se registraron diferencias importantes en la textura del suelo entre sitios quemados, control y de borde. Los Scarabaeinae prefieren texturas arcillosas (Arriaga et al., 2012) y un suelo húmedo. El suelo franco-arcilloso en el borde y la alta humedad superficial se sabe que facilita la elaboración de sus galerías para el enterramiento del estiércol y establecimiento de sus nidos (Martínez et al., 2009), lo que podría explicar su mayor abundancia en esas áreas. Los Aphodiinae fueron también muy abundantes en esos sitios, favorecidos posiblemente por la humedad del suelo (véase Cruz et al., 2002), pues ellos, aparentemente, no son afectados en su distribución por la textura del suelo (Arriaga et al., 2012).
Encontramos diferencias importantes en la relación C:N debidas a una disminución en el tiempo, principalmente de carbono. A los escarabajos no pareció afectarles esta reducción, es posible que este efecto quede enmascarado por la influencia de otros factores como la ubicación espacial de los sitios (Louzada et al., 2010), biomasa disponible, intensidad (temperaturas alcanzadas y duración), área y tiempo desde el último incendio (Bodí et al., 2012).
En Ixtacuixtla el área quemada quedó inmediatamente desprovista de herbáceas, pastos y de algunos arbustos después del incendio; sin embargo, la mayor parte de los árboles se mantuvieron en pie, principalmente J. deppeana, especie tolerante al fuego, que puede sobrevivir y/o regenerarse rápidamente tras un incendio.
A pesar de que los cambios observados en la vegetación no fueron estadísticamente significativos, en los bordes se observó mayor cobertura de pastos que en los otros sitios, lo que generó un ambiente favorable para el reestablecimiento de poblaciones de conejos (S. cunicularius) (Virgós et al., 2003), quienes se encuentran habitualmente en la zona y la abandonaron temporalmente al presentarse el incendio. Cinco meses después del incendio, se observaban excretas frescas de conejo, poco numerosas y aisladas, pero todavía no se restablecían las letrinas. En octubre del 2011, de acuerdo con nuestros censos, ya había 73 letrinas bien establecidas en 1 ha. La alta densidad habitual de conejos (Lezama, 2007) permite una continua oferta de recursos alimenticios para la persistencia de Scarabaeinae, principalmente para aquellos que tienen preferencia por excretas con bajo grado de humedad, como O. lecontei (Arellano et al., 2009), aunque también hay una población de cacomixtles (Bassariscus sp.), cuyas excretas son otro recurso importante.
Los Aphodiinae originalmente consumen materia humificada del suelo y están asociados a madrigueras de mamíferos y/o a raíces de gramíneas, sin embargo, en Ixtacuixtla, después del incendio, al escasear los recursos antes mencionados, se les colectó al igual que a los Scarabaeinae, preferentemente en estiércol de caballo, que se volvió un recurso atractivo e importante para ambos grupos.
Los Scarabaeinae se distribuyeron de manera preferente en las áreas de borde. La única especie cuyas abundancias fueron similares en el borde y en el área control fue O. chevrolati, siendo muy escasa en áreas quemadas, donde deben existir condiciones limitantes para su presencia, cantidad de materia orgánica y humedad relativa en el suelo. Dichotomius colonicus, especie característica de áreas perturbadas, fue encontrada más frecuentemente en las áreas quemadas que las demás especies. Se capturaron, en general, pocos individuos, por la ausencia de ganado vacuno en la localidad y por su distribución altitudinal; es más frecuente en tierras bajas, que en sitios por arriba de los 2 000 m (Arellano, 2002).
Se encontró un dominio de Scarabaeinae cavadores y mayormente nocturnos, como sucede en áreas boscosas de otros paisajes templados (Morón y Terrón, 1984; García-Real 1991, 1995; Martín-Piera y Lobo, 1993; Halffter et al., 1995; Rivera-Cervantes y García-Real, 1998; Arellano y Halffter, 2003; Arriaga et al., 2012), pues en las áreas abiertas se encuentran preferentemente especies diurnas y rodadoras (Canthonina). La excepción en nuestros datos fue O. lecontei (diurna).
Las 2 especies dominantes de Aphodiinae (C. fuliginosus y G. opisthius) son comunes en pastizales de montaña (Martínez y Alvarado, 2001; Cruz et al., 2002; Arellano, 2002; Martínez, 2005, Cabrero-Sañudo et al., 2007), la primera fue encontrada en todos los sitios y la segunda fue muy importante en el borde y en el área quemada. Ambas especies fueron favorecidas por el aumento en la extensión de áreas abiertas al presentarse el incendio, por lo que en el segundo año, cuando la vegetación comenzó a recuperarse, sus abundancias disminuyeron considerablemente.
Se encontró una correlación positiva entre la abundancia de los escarabajos coprófagos y 2 variables ambientales, la temperatura media mensual y la precipitación mensual. Esto es similar a lo encontrado para Scarabaeinae en otros trabajos (Morón y Terrón, 1984; Arellano, 1992; García-Real, 1995; Halffter et al., 1995) y se refleja claramente en la fenología de las especies. La distribución temporal de los adultos de Scarabaeinae, durante las lluvias, y sus picos de abundancia, septiembre de 2009 y julio de 2010, coinciden con lo observado en bosques de pino de Jalisco por Rivera-Cervantes y García-Real (1998).
Los Scarabaeinae fueron muy abundantes en los bordes y poco numerosos en los sitios quemados. En contraste, los adultos de Aphodiinae fueron muy abundantes en áreas de borde y quemadas, en junio y agosto de ambos años, los meses más cálidos del año. Entre diciembre y mayo la presencia de los 2 grupos fue casi nula. Lo que coincide también con lo encontrado por Rivera-Cervantes y García-Real (1998).
Históricamente, la mayor parte de los incendios en Ixtacuixtla han sido intensos y rápidos, de severidad baja a moderada y, generalmente se han producido por quemas no controladas (como en abril de 2009). Ese tipo de fuegos al no ser muy fuertes permiten la renovación de la vegetación y producen cambios reversibles en el suelo (Carracedo-Martín et al., 2009), que es donde se desarrolla la mayor parte del ciclo de vida de los Scarabaeinae (Halffter, 1991). Si la cantidad de combustible es alta, en este tipo de incendios, el fuego no suele transferir calor por debajo de los 20-30 cm y las temperaturas en los primeros 5 cm de suelo mineral no sobrepasan los 150° C (Úbeda, 2001; Carracedo-Martín et al., 2009). Entonces, el fuego puede matar algunos o muchos escarabajos por calor o asfixia, pero otros pueden sobrevivir por desplazamiento o vuelo rápido y/o por enterramiento a zonas más profundas (Armúa et al., 2004). La época reproductiva de los Scarabaeinae en Ixtacuixtla se presenta en la mayor parte de las especies entre agosto y septiembre y en los Aphodiinae en junio. Entre enero y mayo los escarabajos se encontraban enterrados, como adultos inactivos (Germán-García 2013), ya que el frío intenso provoca que algunas especies entren en diapausa reproductora de enero a abril (Cruz et al., 2002; Martínez y Alvarado, 2001; Martínez, 2005). Dado que el incendio se presentó en abril cuando los escarabajos no estaban activos en campo, entonces es factible que sus poblaciones no hayan sido tan fuertemente afectadas por el fuego a corto plazo. Sin embargo, el hecho de que se haya detectado una disminución de sus abundancias el siguiente año, sugiere que puede haber un efecto a más largo plazo.
En el municipio de Ixtacuixtla, ha ido en aumento el número de incendios, ya que en el 2013 se presentaron casi 3 veces más que en los años anteriores (Padilla-Pérez, 2014). Si además de la frecuencia de los eventos, cambiaran las fechas de los mismos y se presentaran en los meses más fríos y secos, las poblaciones, no sólo de escarabajos coprófagos podrían verse afectadas severamente a largo plazo (García-Villanueva, 1992).
En conclusión, los incendios intensos y rápidos, pero de severidad baja, están causando cambios que no han afectado de manera significativa las condiciones de vegetación y suelo que requiere el ensamble de escarabajos coprófagos para persistir. Sin embargo, los estudios de corta duración como éste, capturan sólo una porción de la variabilidad, por lo que hacen falta trabajos de larga duración sobre el efecto de los incendios en los escarabajos coprófagos, tomando en cuenta no sólo las áreas quemadas y no quemadas, sino también las áreas de borde, que según este trabajo son importantes para la persistencia de este grupo de insectos.
Agradecimientos
Los autores agradecen a Martín Michimani por su valiosa ayuda en la toma de datos y a Sandra Rocha por la elaboración de los análisis de suelo. A Luis Alberto Salinas, Geovani Pérez, Emmanuel Núñez y Francisco Pérez por su ayuda en el campo; así como a Armando Martínez-Chacón por su apoyo en la medición de las coberturas de la vegetación. Martín Michimani recibió una beca como auxiliar de investigación de parte de la Secretaría de Investigación de la Universidad Autónoma de Tlaxcala.
Literatura citada
Anderson, R. C., T. Leahy y S. Dhillion. 1989. Numbers and biomass of selected insect groups on burned and unburned sand prairie. American Midland Naturalist 122:151-162. [ Links ]
Arellano, L. 1992. Distribución y abundancia de Scarabaeidae y Silphidae (Insecta: Coleoptera) en un transecto altitudinal en el estado de Veracruz. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D. F. 139 p. [ Links ]
Arellano, L. 2002. Evaluación de la diversidad alfa, beta y gamma de Scarabaeoidea y Silphidae (Insecta: Coleoptera) en la Región Cofre de Perote, Veracruz, México. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D. F. 205 p. [ Links ]
Arellano, L. y G. Halffter. 2003. Gamma diversity: derived from and determinant of alpha diversity and beta diversity, an analysis of three tropical landscape. Acta Zoológica Mexicana (nueva serie.) p. 27-76.
Arellano, L., A. J. Martínez, M. Zunino y E. Lezama-Delgado. 2009. Dung beetles (Coleoptera: Scarabaeinae) associated with rabbit dung heaps: the first American report. The Coleopterist Bulletin 63:101-104. [ Links ]
Armúa, A. C., A. C. Bernardis, S. M. Mazza y M. C. Goldfarb. 2004. Efecto del fuego sobre la fauna de invertebrados de un pastizal al Noreste de Corrientes. Agrotecnia 13:3-7. [ Links ]
Arriaga, A., G. Halffter y C. Moreno. 2012. Afinidades biogeográficas y riqueza de especies de escarabajos copronecrófagos (Scarabaeoidea) en el sureste del Altiplano Mexicano. Revista Mexicana de Biodiversidad 83:519-529. [ Links ]
Baum, K. A. y W. V. Sharber. 2012. Fire creates host plant patches for monarch butterflies. Biology Letters 8:968-971. [ Links ]
Blake, G. R. y K. H. Hartge. 1986. Bulk density. In Methods of soil analysis. Part I. Physical and mineralogical methods, A. Klute (ed.). Soil Science Society of America, Inc., Madison, Wisconsin. p. 363-376. [ Links ]
Bliss, G., L. Marz y S. Steenhoeck. 2012. Forest fire has no significant effect on abundance or diversity of edaphic arthropods at CERA. Tillers 1:25-29. [ Links ]
Bodí, M. B., A. Cerdà, J. Mataix-Solera y S. H. Doerr. 2012. Efectos de los incendios forestales en la vegetación y el suelo en la cuenca mediterránea: revisión bibliográfica. Boletín de la Asociación de Geógrafos Españoles 58:33-56. [ Links ]
Boer, C. 1989. Effects of the forest fire 1982-83 in East Kalimantan on wildlife. FR Report Núm. 7. Samardinda, Indonesia, Deutsche Forstservice GmbH. p. 1-7. [ Links ]
Boulanger, Y., L. Sirois y C. Hébert. 2013. Distribution patterns of three long-horned beetles (Coleoptera: Cerambycidae) shortly after fire in boreal forest: adults colonizing stands versus progeny emerging from trees. Environmental Entomology 42:17-28. [ Links ]
Cabrero-Sañudo, F. J., I. M. Martínez y N. Trotta-Moreu. 2007. Phenology, reproductive cycles, and species composition of a dung beetle community (Coleoptera: Scarabaeoidea) from a high mountain pasture system on the Sierra Madre Oriental (Veracruz, Mexico). Proceedings of the Entomological Society of Washington 109:813-828. [ Links ]
Carracedo-Martín, V, D. Liaño, J. C. García-Codrón y D. F. Álvarez. 2009. Los incendios forestales. Davinci. Barcelona. 250 p. [ Links ]
Castaño-Meneses, G. y J. Palacios-Vargas. 2003. Effects of fire and agricultural practices on neotropical ant communities. Biodiversity and Conservation 12:1913-1919. [ Links ]
Chandler, C., P. Cheney, P. Thomas, L. Trabaud y D. Williams. 1983. Fire in forestry. Vol. 1. Fire behavior and effects. John Wiley & Sons, Inc. New York. 450 p. [ Links ]
Cochrane, M. A. 2002. Incendios en bosques tropicales en América Latina y el Caribe, prevención, evaluación y alerta temprana. Programa de las Naciones Unidas para el Medio Ambiente (PNUMA). Santiago, República de Chile. 109 p. [ Links ]
Conafor (Comisión Nacional Forestal). 2009. Incendios forestales generalidades, México. Reporte de incendios forestales. http://www.conafor.gob.mx/; última consulta: 1.VIII.2013. [ Links ]
Cruz, R. M., I. M. Martínez y M. O. Alvarado. 2002. Population and reproductive features of Aphodius (Trichaphodius) opisthius Bates and Cephalocyclus hogei Bates (Coleoptera, Aphodiidae: Aphodiinae). The Coleopterist Bulletin 56:221-235. [ Links ]
De Andrade, R. B., J. Barlow, J. Louzada, F. Z. Vaz-de-Mello, M. Souza, J. M. Silveira y M. A. Cochrane. 2011. Quantifying responses of dung beetles to fire disturbance in tropical forests: the importance of trapping method and seasonality. PloS one 6:26208. [ Links ]
Dennis, R., E. Meijaard, G. Applegate, R. Nasi y P. Moore. 2001. Impact of human-caused fires on biodiversity and ecosystem functioning, and their causes in tropical, temperate and boreal forest biomes. CBD Technical Series No. 5. Montreal, Canadá, Convenio sobre la Diversidad Biológica. [ Links ]
Dress, W. J. y R. E. Boerner. 2004. Patterns of microarthropod abundance in oak-hickory forest ecosystems in relation to prescribed fire and landscape position. Pedobiologia 48:1-8. [ Links ]
Fernández, F. M. y J. M. Salgado, C. 2002. Recolonization of a burnt pine forest (Pinus pinaster) by edaphic Coleopteran. Entomologia generalis 26:17-28. [ Links ]
Fonseca, J., H. C. De los Santos, C. Llanderal-Cázares, D. Cibrián-Tovar, D. Rodríguez-Trejo y J. Vargas. 2008. Ips e insectos barrenadores en árboles de Pinus montezumae dañados por incendios. Madera y Bosques 14:69-80. [ Links ]
Fonseca, J., C. Llanderal-Cázares, D. Cibrián-Tovar, A. Equihua-Martínez y H. M. De los Santos P. 2009. Secuencia de arribo de coleópteros en árboles de Pinus montezumae Lamb dañados por incendios. Ciencia Forestal en México 34:149-170. [ Links ]
Frizzo, T. L., R. I. Campos y H. L. Vasconcelos. 2012. Contrasting effects of fire on arboreal and ground-dwelling ant communities of a Neotropical Savanna. Biotropica 44:254-261. [ Links ]
García-De Jesús, S. 2006. Estudio faunístico de Coleoptera Lamellicornia de la región La Malinche, Tlaxcala, México. Tesis, Facultad de Agrobiología, Benemérita Universidad Autónoma de Puebla, Puebla. 89 p. [ Links ]
García-De Jesús, S. 2011. Fauna Coleóptera Scarabaeoidea de los bosques de coníferas de los municipios de Emiliano Zapata y Terrenate, Tlaxcala México. Tesis de maestría, Posgrado de Ciencias Biológicas, Universidad Autónoma de Tlaxcala. Tlaxcala. 90 p. [ Links ]
García-Real, E. 1991. Abundancia y distribución altitudinal de los escarabajos coprófagos y necrófagos en 5 tipos de vegetación, en la sierra de Manantlán. Tesis, Facultad de Ciencias Biológicas. Universidad de Guadalajara, Guadalajara. 76 p. [ Links ]
García-Real, E. 1995. Abundancia, distribución y estructura de la comunidad de escarabajos coprófagos y necrófagos (Coleoptera: Scarabaeidae), en un gradiente altitudinal de la sierra de Manantlán, Jalisco-Colima, México. Tesis de maestría en Ciencias, Colegio de Postgraduados, Montecillos, Texcoco, Estado de México. 129 p. [ Links ]
García-Villanueva, J. A. 1992. Recolonización por artrópodos de zonas alteradas por el fuego y otros procesos degradativos. Tesis de doctorado, Universidad de León, España. 150 p. [ Links ]
Germán-García, A. 2013. Ciclo biológico de Onthophagus lecontei (Coleoptera: Scarabaeinae) y uso de diferentes recursos alimenticios bajo condiciones de laboratorio. Tesis de maestría, Posgrado de Ciencias Biológicas, Centro Tlaxcala de Biología de la Conducta. Universidad Autónoma de Tlaxcala. Tlaxcala, Tlaxcala. 57 p. [ Links ]
Gardner, W. H. 1986. Water content. In Methods of soil analysis Part 1: physical and mineralogical methods. Agronomy Núm. 9, A. Klute (ed.). American Society of Agronomy, Soil Science Society of America, Madison, Wisconsin. p. 493-544. [ Links ]
Giganti, H. y G. Dapoto. 1990. Coleópteros de los bosques nativos del Departamento Aluminé (Neuquén-Argentina). Bosque 11:37-44. [ Links ]
Halffter, G. 1991. Historical and ecological factors determining the geographical distribution of beetles (Coleoptera: Scarabaeidae: Scarabaeinae). Folia Entomológica Mexicana 82:195-238. [ Links ]
Halffter, G., M. E. Favila y L. Arellano. 1995. Spatial distribution of three groups of Coleoptera along an altitudinal transect in the Mexican Transition Zone and its biogeographical implications. Elytron 9:151-185. [ Links ]
Halffter, G. y L. Arellano. 2002. Response of dung beetle diversity to human-induced changes in a tropical landscape. Biotropica 34:144-154. [ Links ]
Hansen, J. D. 1986 Comparison of insects from burned and unburned areas after a range fire. Great Basin Naturalist 46:721-727. [ Links ]
Hernández, L. H. y K. Y. B. Adrián. 2012. Efecto del disturbio en la vegetación sobre la composición de Coleoptera en un fragmento de matorral de Victoria, Tamaulipas, México. Dugesiana 19:49-56. [ Links ]
Iglay, R. B., D. A. Miller, B. D. Leopold y G. Wang. 2012. Carabid beetle response to prescribed fire and herbicide in intensively managed, mid-rotation pine stands in Mississippi. Forest Ecology and Management 281:41-47. [ Links ]
Inegi (Instituto Nacional de Estadística, Geografía e Informática). 1998. Los municipios de Tlaxcala. Monografía de Ixtacuixtla de Mariano de Matamoros, Tlaxcala, Tlaxcala. 45 p. [ Links ]
Jiménez-Gutiérrez, V. 2013. Efecto de los incendios forestales sobre la composición de coleópteros necrófagos (Insecta: Scarabaeidae y Silphidae) en la sierra de Manantlán, Jalisco, México. Tesis, Centro Universitario de la Costa Sur, Universidad de Guadalajara. Autlán de Navarro, Jalisco. 112 p. [ Links ]
Kaynaş, B. Y. y B. Gürkan. 2008. Species richness and abundance of insects during post-fire succession of a Pinus brutia forest in Mediterranean region. Polish Journal of Ecology 56:165-172. [ Links ]
Kerstyn, A. y P. Stiling. 1999. The effects of burn frequency on the density of some grasshoppers and leaf miners in a Florida sandhill community. The Florida Entomologist 82:499-505. [ Links ]
Kleinties, P. K., B. F. Jacobs y S. M. Fettig. 2004. Initial response of butterflies to an overstory reduction and slash mulching treatment of a degraded pinon-juniper woodland. Restoration Ecology 12:231-238. [ Links ]
Lara-Ponce, E., B. L. Caso, F. M. Aliphat. 2012. El sistema milpa roza, tumba y quema de los maya itzá de San Andrés y San José, Petén, Guatemala. Ra Ximhai 8:71-92. [ Links ]
Lezama, D. E. 2007. Dispersión espaciotemporal de semillas de Juniperus deppeana por el conejo montés Sylvilagus cunicularius en un fragmento de bosque de sabinos en Ixtacuixtla, Tlaxcala. Tesis, Facultad de Biología Agropecuaria. Universidad Autónoma de Tlaxcala, Tlaxcala, Tlaxcala. 46 p. [ Links ]
Louzada, J., J. P. Lima, R. Matavelli, L. Zambaldi y J. Barlow. 2010. Community structure of dung beetles in Amazonian savannas: role of fire disturbance, vegetation and landscape structure. Landscape Ecology 25:631-641. [ Links ]
Lloret, F. 2004. Régimen de incendios y regeneración. In Ecología del bosque mediterráneo en un mundo cambiante, F. Valladares (ed.). Ministerio de Medio Ambiente, EGRAF, S. A., Madrid. p. 101-126. [ Links ]
Lussenhop, J. 1976. Soil arthropod response to prairie burning. Ecology 57:88-98. [ Links ]
Martín-Piera, F. y J. M. Lobo. 1993. Altitudinal distribution patterns of copro-necrophage Scarabaeoidea (Coleoptera) in Veracruz, Mexico. The Coleopterist Bulletin 47:321-334. [ Links ]
Martínez-Carretero, E. 1995. Los incendios forestales en la Argentina. Multequina 4:105-114. [ Links ]
Martínez, I. 2005. Abundancias poblacionales y ciclos reproductivos de 3 especies de escarabajos estercoleros (Coleoptera: Aphodiinae: Aphodiini) del volcán Cofre de Perote, Veracruz, México. Folia Entomológica Mexicana 44:27-36. [ Links ]
Martínez, M. I. y M. Alvarado. 2001. Comportamiento de oviposición en Aphodius opisthius Bates 1887 (Coleoptera: Scarabaeoidea: Aphodiidae). Elytron 15:73-78. [ Links ]
Martínez, J. N., H. García, L. A. Pulido, D. Ospino y J. C. Narváez. 2009. Escarabajos coprófagos (Coleoptera: Scarabaeinae) de la vertiente noroccidental, sierra Nevada de Santa Marta, Colombia. Neotropical Entomology 38:708-715. [ Links ]
Metz, L. y D. Dindal. 1980. Effects of fire on soil fauna in North America. In Soil biology as related to land use practices. D. L. Dindal (ed.). Office of pesticide and Toxic Substance, EPA, Washington, D. C. p. 450-459. [ Links ]
Minor-Montiel, P. 2010. Coleópteros Lamelicornios de la barranca de Huehuetitla, Tlaxcala, México. Tesis, Facultad de Agrobiología, Universidad Autónoma de Tlaxcala, Tlaxcala. 94 p. [ Links ]
Morón, M. y R. Terrón. 1984. Distribución altitudinal de los insectos necrófilos en la sierra Norte de Hidalgo, México. Acta Zoológica Mexicana (nueva serie) p. 1-47.
Mostacedo, B. y F. Todd S. 2000. Manual de métodos básicos de muestreo y análisis en ecología vegetal. Proyecto de Manejo Forestal Sostenible (Bolfor). Santa Cruz, Bolivia. 87 p. [ Links ]
Muona, J. y I. Rutanen. 1994. The short-term impact of fire on the beetle fauna in boreal coniferous forest. Annales Zoological Fennici 31:109-121. [ Links ]
Nom-021-Recnat-2000 (Norma Oficial Mexicana). 2000. Que establece especificaciones de fertilidad, salinidad y clasificación de suelos, estudio, muestreo y análisis. http://www.profepa.gob.mx/innovaportal/file/3335/1/nom-021-semarnat-2000.pdf; última consulta:1.VI.2009. [ Links ]
Orgeas, J. y A. N. Andersen. 2001. Fire and biodiversity: responses of grass-layer beetles to experimental fire regimes in an Australian tropical savanna. Journal of Applied Ecology 38:49-62. [ Links ]
Pérez-Chávez, R. 1981. Los incendios forestales como vectores de las plagas del bosque. Revista Mexicana de Ciencias Forestales 629:17-30.
Pons, P. 2001a. The wintering of migrant Dunnocks Prunella modularis in two Mediterranean habitats after fire. Bird Study 48:68-75. [ Links ]
Pons, P. 2001b. Consecuencias de los incendios forestales sobre los vertebrados y aspectos de su gestión en regiones mediterráneas. In Conservación de la biodiversidad y gestión forestal: su aplicación en la fauna vertebrada, J. Camprodon y E. Plana (eds.). Publicaciones y Ediciones Universidad de Barcelona, Barcelona. p. 197-211. [ Links ]
Prieto, S. E. y Ves Losada, J. C. 2007. Efecto del fuego sobre la fauna edáfica en un área del Caldenal de la provincia de La Pampa, Argentina. Publicación Técnica Núm. 68. Estación Experimental Agropecuaria, Instituto Nacional de Tecnología Agropecuaria (INTA) Anguil. 26 p. [ Links ]
Padilla-Pérez, R. 2014. Más de 600 hectáreas perdidas por incendios en Ixtacuixtla. ABC Tlaxcala. ??; última consulta: 1.II.2014. [ Links ]
Retana, J. y M. Gracia. 1998. Incendios forestales ¿La solución al problema es reforestar? Ecofronteras 5:14-18. [ Links ]
Rivera-Cervantes, L. E. y E. García-Real. 1998. Análisis preliminar sobre la composición de escarabajos necrófilos (Coleoptera: Silphidae y Scarabaeidae) presentes en 2 bosques de pino (uno dañado por fuego), en la Estación Científica Las Joyas, sierra de Manantlán, Jalisco, México. Dugesiana 5:11-22. [ Links ]
Ron, P. 2002. Compatibility of prescribed burning with the conservation of insects in small, isolated prairie reserves. Conservation Biology 16:1296-1307. [ Links ]
Reyes, U. J. S., S. N. Maldonado, E. I. D. L. González, I. Rubí, R. De León, L. H. Hernández y K. Y. B Adrián. 2012. Efecto del disturbio en la vegetación sobre la composición de Coleoptera en un fragmento de matorral de Victoria, Tamaulipas, México. Dugesiana 19:49-56. [ Links ]
SPP (Secretaría de Programación y Presupuesto). 1987. Clima. Carta Estatal del Estado de Tlaxcala. Dirección General de Territorio Nacional. [ Links ]
Siemann, E., J. Haastard y D. Tilman. 1997. Short term and long term effects of burning on oak savanna arthropods. American Midland Naturalist 137:349-361. [ Links ]
Swengel, A. B. 2001. A literature review of insect responses to fire, compared to other conservation managements of open habitat. Biodiversity and Conservation 10:1141-1169. [ Links ]
Úbeda, X. 2001. Influencia de la intensidad de quemado sobre algunas propiedades del suelo después de un incendio forestal. Edafología 8:41-49. [ Links ]
Urones, C. y A. Majadas. 2002. Cambios en la comunidad de Araneae durante la sucesión postfuego en matorrales mediterráneos de montaña. Revista Ibérica de Aracnología 5:19-28. [ Links ]
Verble, R. M. y S. P. Yanoviak. 2013. Short-term effects of prescribed burning on ant (Hymenoptera: Formicidae) assemblages in ozark forests. Annals of the Entomological Society of America 1062:198-203. [ Links ]
Villers, L. y J. H. Hernández, 2007. Incendios forestales y el fenómeno de El Niño en México. Wildfire, Sevilla. 10 p. [ Links ]
Vincent, K., K. Moening y H. Colter. 2012. Effects of annual fire on the litter fauna populations and soil compositions of an upland white-oak forest. Tillers 6:17-20. [ Links ]
Virgós, E., S. Cabezas-Díaz, A. Malo, J. Lozano, J. y D. López-Huertas. 2003. Factors shaping European rabbit abundance in continuous and fragmented populations of central Spain. Acta Theriologica 48:113-122. [ Links ]
Wikars, L. O. 1997. Effects of forest fire and the ecology of fire-adapted insects. Acta Universitatis Upsaliensis Comprehensive summaries of Uppsala dissertations from the Faculty of Science and Technology Núm. 272. p. 1-35. [ Links ]
Wong-González, J. L. y M. L. Villers. 2007. Evaluación de combustibles y su disponibilidad en incendios forestales: un estudio en el Parque Nacional La Malinche. Investigaciones Geográficas, Boletín del Instituto de Geografía, Universidad Nacional Autónoma de México 62:87-103. [ Links ]
Yvärinen, E. H., J. I. Kouki y P. Martikainen. 2009. Prescribed fires and retention trees help to conserve beetle diversity in managed boreal forests despite their transient negative effects on some beetle groups. Insect Conservation and Diversity 2:3-105. [ Links ]
Zunino, S., J. Arancibia y S. Quiroz. 2002. Flora y fauna de Valparaíso. Universidad de Valparaíso, Chile. Facultad de Ciencias. Contribuciones del Departamento de Biología y Ciencias Ambientales. Valparaíso. 24 p. [ Links ]














