Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
REB. Revista de educación bioquímica
versão impressa ISSN 1665-1995
Rev. educ. bioquím vol.33 no.2 Ciudad de México Jun. 2014
Artículos
El uso de la ecuación de Henderson-Hasselbalch para el cálculo del pH en sangre
Juan Pablo Pardo Vázquez y Deyamira Matuz Mares
Departamento de Bioquímica, Facultad de Medicina, UNAM, México D.F. Correo E: pardov@bq.unam.mx
Recibido: 19 de febrero de 2014.
Aceptado: 15 de mayo de 2014.
Resumen
Los procesos fisiológicos que tienen lugar en nuestro organismo, como la función adecuada de las enzimas y el metabolismo celular, están influidos por el pH de nuestro medio interno. El equilibrio ácido-base (que determina el pH) es regulado por amortiguadores tanto intracelulares como extracelulares, así como por los sistemas renal y respiratorio. El principal sistema amortiguador de la sangre es el formado por el par bicarbonato/ácido carbónico, sin embargo la nomenclatura general de los sistemas amortiguadores (base conjugada/ácido) conduce al uso incorrecto de los términos en la ecuación de Henderson-Hasselbalch para el sistema de bicarbonato/ácido carbónico.
Palabras clave: pH, sangre, amortiguadores, bicarbonato, ácido carbónico, Henderson-Hasselbalch.
Abstract
Physiological processes that take place in our body, such as the proper function of enzymes and cellular metabolism are influenced by the pH of our internal environment. The acid-base balance (to determine the pH) is regulated both intracellular and extracellular buffers, as well as renal and respiratory systems. The main blood buffer system is formed by the pair bicarbonate/carbonic acid, however the general classification of the buffer systems (conjugate base/acid) leads to the incorrect use of the terms in the Henderson-Hasselbalch equation for the bicarbonate/carbonic acid system.
Key words: pH, blood, buffers, bicarbonate, carbonic acid, Henderson-Hasselbalch.
INTRODUCCIÓN
El equilibrio ácido-base es regulado por amortiguadores tanto intracelulares como extracelulares, así como por los sistemas renal (excreta de H+, amoniaco y regenera bicarbonato) y respiratorio (excreta dióxido de carbono) (1, 2). Conservar este equilibrio constituye un complicado proceso fisiológico que permite mantener estable el pH en la sangre. Para la función óptima de las enzimas y del metabolismo celular el pH debe mantenerse en valores entre 7,35-7,45 (3). Los trastornos del equilibrio acido/base pueden interferir con los mecanismos fisiológicos que conducen a acidosis (pH arterial <7,35) o alcalosis (pH arterial> 7,45) y pueden poner en riesgo la vida (2, 4, 5). El principal sistema amortiguador de la sangre es el formado por el par bicarbonato/ácido carbónico (2, 6). Sin embargo, el funcionamiento de este sistema es mucho más complejo que el de cualquier amortiguador clásico, como el de HPO42-/H2PO4- (6, 7) o los residuos de histidina que forman parte de las proteínas (prot-his/prot-hisH+) (5, 8). Por otro lado, la nomenclatura general de los sistemas amortiguadores (base conjugada/ácido) conduce al uso incorrecto de los términos en la ecuación de Henderson-Hasselbalch para el sistema de bicarbonato/ácido carbónico. Por ejemplo, con frecuencia se menciona que hay que colocar en el denominador del término logarítmico de la ecuación de Henderson-Hasselbalch a la concentración del ácido carbónico, y esto debido a que no se define con precisión la relación que existe entre la concentración de ácido carbónico y la del dióxido de carbono, de tal suerte que a veces se pide calcular el pH de la sangre para una concentración de ácido carbónico de 1 mM (6, 7), o dado un pH y una concentración del anión bicarbonato, encontrar la concentración del ácido carbónico en sangre. Como se muestra en esta pequeña revisión, en la ecuación de Henderson-Hasselbalch se debe utilizar la concentración de dióxido de carbono, ya que la concentración de ácido carbónico en la sangre está en el orden micromolar.
EL SISTEMA BICARBONATO/ÁCIDO CARBÓNICO
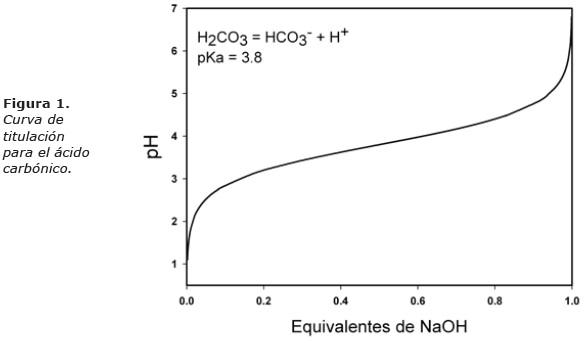
Como se muestra en la figura 1, el pK de este sistema es de 3.8 (9), por lo que el intervalo de pH en el que sirve como amortiguador del pH es de 2.8 a 4.8, (pK ± 1). Como el pH del plasma es de 7.4, 3.6 unidades por arriba del pK de este sistema, la capacidad amortiguadora del par bicarbonato/ácido carbónico es prácticamente nula.
EL SER HUMANO ES UN SISTEMA ABIERTO
Sin embargo, cuando se toma en cuenta la enorme capacidad que tiene el ser humano de producir CO2 a través del metabolismo y de eliminar este gas por el sistema respiratorio, se puede incluir el equilibrio de la reacción catalizada por la anhidrasa carbónica (CO2 + H2O D H2CO3) presente en los eritrocitos, las nefronas, intestino, páncreas, músculo estriado y el endotelio capilar pulmonar (7, 8) para explicar la capacidad del sistema bicarbonato/ácido carbónico para amortiguar el pH sanguíneo (3), la reacción es reversible y mirándola de izquierda a derecha, describe la hidratación del dióxido de carbono para dar al ácido carbónico (5), en sentido contrario, se tiene la formación del anhídrido del H2CO3. La constante de equilibrio de esta reacción es de 5x10-3 (9), de donde se puede calcular un pK de 2.3. Es importante mencionar que el valor de la constante de equilibrio de esta reacción incluye a la concentración de agua, debido a que ésta virtualmente se mantiene constante (55.5 M) (10).
En una segunda reacción el H2CO3 se disocia en un protón y su base conjugada:

El pK de esta reacción es de 3.8 (constante de equilibrio de 1.58 x 10-4 M). Si ahora se suman ambas reacciones:

La constante de equilibrio para la reacción resultante (7.9 x 10-7) se obtiene de multiplicar las constantes de equilibrio de las reacciones que se suman, y el pK (6.1) es el resultado de sumar los dos valores de pK (5, 8, 9). De esta manera, si se considera que la especie que participa en la reacción es el anhídrido del ácido carbónico (CO2) y se quita al agua debido a que ya está incluida en la constante de equilibrio, se obtiene la siguiente ecuación de Henderson-Hasselbalch:

Sin embargo, los laboratorios reportan la presión parcial de CO2 (Pm) (2) en vez de la concentración de CO2, pero esta última se puede relacionar con la Pco2 a través de la siguiente ecuación:

En donde la concentración de CO2 se expresa en mM, la Pco2 en milímetros de mercurio (mm Hg) y las unidades del factor de conversión son: mM-(mm Hg-1). Así, la anterior ecuación de Henderson-Has-selbalch se transformaría en:

DATOS DE LABORATORIO
Supongamos que obtenemos los siguientes valores:
pH = 7.4
[H+] = 3.9811 x 10-8 M (se calcula a partir del pH)
HCO3- = 24 mM
[CO2] = 1.2 mM
Si ahora se supone que el sistema está en equilibrio (y esta es una suposición razonable, ya que las constantes de velocidad asociadas a estas reacciones son grandes), se puede calcular la concentración de H2CO3, dadas las concentraciones de CO2 y HCO3- descritas anteriormente, de la siguiente manera:
Se comienza con la reacción de disociación del ácido carbónico

y se define la constante termodinámica para la disociación del ácido

Al despejar la concentración del ácido carbónico se obtiene

Si se sustituyen los valores que corresponden a las concentraciones de bicarbonato, hidrogeniones y de la constante de equilibrio, se obtiene que la concentración de ácido carbónico en sangre es de 6.05 uM (6.05 x 10-6 M). La concentración de este ácido es aproximadamente tres órdenes de magnitud más pequeña que la concentración de CO2 (1 mM). Si se sustituye la verdadera concentración de ácido carbónico en la ecuación de Henderson Hasselbalch sin cambiar el valor del pK de 6.1, se obtiene un resultado (9.7) que nada tiene que ver con el pH de la sangre (7.4). Sin embargo, si se utiliza el pK de 3.8 y las concentraciones de H2CO3 (6.05 uM) y HCO3- (24 mM), se obtiene que el pH es de 7.4. En resumen, para conocer el pH de la sangre, en la ecuación de Henderson-Hasselbalch se tiene que utilizar la concentración de dióxido carbono y no la del ácido carbónico.
REFERENCIAS
1. Siggaard-Andersen O (2006) Acid-Base Balance. En: Encyclopedia of respiratory medicine. Editores: Geoffrey J. Laurent and Steven D. Shapiro, Academic Press, Amsterdam; Boston, pp. 5-10. [ Links ]
2. Ayers P, Dixon C (2012) Simple acid-base tutorial. J Parenter Enteral Nutr 36:18-23. [ Links ]
3. Carrillo Esper R, Visoso Palacios P (2006) Equilibrio ácido base. Conceptos actuales. Rev Asoc Mex Med Crit y Ter Int 20:184-192. [ Links ]
4. Meza García M (2011) Acid-base disturbances in Critically ill patients. Acta Med Per 28: 4655. [ Links ]
5. Goel N, Calvert J (2012) Understanding blood gases/acidebase balance. Paediatrics and Child Health 22: 142-148. [ Links ]
6. Palazzo M G A (2009) Sodium bicarbonate the bicarbonate challenge test in metabolic acidosis:A practical consideration. Current Anaesthesia & Critical Care 20: 259-263. [ Links ]
7. Marshall WJ, Bangert SK, Lapsley M (2013) Bioquímica Clinica.7a Ed. Elsevier Mosby, Barcelona, España, p 367. [ Links ]
8. Greenbauma J, Nirmalan M (2005) Acid-base balance: The traditional approach. Current Anaesthesia & Critical Care 16:137-142. [ Links ]
9. Segel IH (1976) Biochemical calculations.2a Ed. John Wiley & Sons, Inc, Canada, p 464. [ Links ]
10. Ortiz Salazar JP, García H (2010) Strong ion difference (SID): an approach to Stewart's theory. Rev Colomb Neumol 22: 17-21. [ Links ]














