Introducción
La propagación sexual del género Bursera tiene bajos porcentajes de germinación aún cuando a las semillas les es aplicado algún tratamiento pregerminativo (Bonfil-Sanders et al., 2008).Castellanos-Castro y Bonfil (2013), Loeza-Corte et al. (2013) entre otros investigadores, propagaron a Bursera glabrifolia (Sapindales:Burceraceae) por medio de estacas, no obstante los porcentajes de enraizamiento son bajos. Zahawi y Holl (2009) mencionan que los campesinos locales propagan algunas especies de Bursera por medio de estacas largas (~1.5 m de largo), sin embargo, el uso de largas ramas limita el número de plantas que se pudieran obtener y a la vez generaría un impacto negativo en pequeñas poblaciones de Bursera.
La lombricomposta es el producto de transformaciones bioquímicas y microbiológicas de la materia orgánica, al pasar a través del tracto digestivo de las lombrices que a su vez mejora las características estructurales del suelo, teniendo un impacto benéfico al estímular el eficiente desarrollo del crecimiento (Edwards et al., 1984; Alvarado-Ruffo et al., 2012; Reyes-Pacheco et al., 2017). Rzedowski y Kruse (1979), indicaron que se desconoce el tipo de suelo en el que se desarrollan las Burseraceae, groso modo mencionan que los individuos se encuentran en cerros, suelos de ladera, tierras aluviales profundas, terrenos con drenaje deficiente sin discriminar ningún tipo de roca madre, hasta la fecha se sigue desconociendo el dato.
La profundidad de plantación es un factor detonante para el prendimiento de Bursera (Bonfil-Sanderset al., 2007), cabe mencionar que para el caso de arboles ornamentales de tronco ramificado la efectividad de prendimiento radica al dejar el tallo al descubierto de 2.5-3 cm de la superficie del suelo, mientras que para otras especies la estaca se entierra en su totalidad Toogood (2010).
La madera del género Bursera es de importancia económica en el estado de Oaxaca, debido a que es la base para la elaboración de alebrijes (artesanías) (Purata et al., 2004). Por lo cual se requieren de técnicas que ayuden y mejoren la reproducción de la especie para su aprovechamiento (Bonfil-Sanders et al., 2007).
La palabra “copal” proviene del vocablo Náhuatl “copalli” (resina) y cuahuitl (árbol), el árbol se designa copal-cuahitl, refiriéndose así a varias resinas aromáticas (Hill, 1965; Cházaro-Basañez et al., 2010). La familia Burseraceae está constituida por 17 géneros y aproximadamente 540 especies distribuidas en América Tropical, África, Ceilán, Madagascar, Arabia, India y Malasia (Mabberley, 1987). El genero Bursera comprende arboles y arbustos distribuidos en la selva baja caducifolia, algunas especies forman parte de la composicion de bosques espinosos y de matorrales xerofitos, otras se encuentran en el bosque tropical subcaducifolio y aun en el perennifolio (Rzedowski y Kruse, 1979); generalmente son arboles de tamano bajo o medio (5 a 15 m); corteza gris, amarilla o roja, delgada y con frecuencia no exfoliante, la mayoria de sus especies son caducifolias en la temporada seca y florecen al final de la misma (Bonfil-Sanders et al., 2007; Rzedowski et al., 2005).
El objetivo de la investigación fue evaluar el prendimiento de estacas de copal (Bursera glabrifolia (Kunth)) Engl. con asociación de dos fechas, cuatro proporciones de suelo-lombricomposta y cinco profundidades de plantación.
Materiales y métodos
La fecha recomendada para propagar B. glabrifolia es definida en marzo cuando los árboles están en reposo (Castellanos-Castro y Bonfil, 2013), no obstante Bonfil-Sanders et al. (2007) menciona que en un ensayo colectaron estacas del género Bursera al final de las temporadas de lluvias (no-viembre) pero con diferentes condiciones, tales que no son comparables con su propio experimento y menciona que no produjeron raíces, lo cual permite establecer una brecha en su reproducción, por ello las fechas del 26 de marzo y el 5 de diciembre fueron elegidas para hacer el compartivo, dado que en 2016 se realizó un ensayo en NovaUniversitas por los autores del artículo en curso, con la propagación de B. glabrifolia por estacas, donde se utilizaron enraizadores (agua de coco y fitorreguladores sintéticos) y sustratos (abono de borrego, vermicomposta y suelo de la región), en el experimento se pudo percatar que la especie enraízo en temporada invernal.
Instalaciones
El experimento se realizó en el vivero con malla del 40 % sombra, estructura de tubo galvanizado, con una división en su interior de madera. Las condiciones climáticas del municipio de Ocotlán de Morelos fueron temperatura media anual de 19.4 °C, temperatura mínima 12 °C y máxima 24.7 °C; precipitación anual de 811.3 mm, donde el periodo lluvioso es comprendido de junio a septiembre (CONAGUA, 2010).
Preparación de sustratos
El suelo se obtuvo en NovaUniversitas (16°47’11.5” N, 96°40’ 30.7” W) (INEGI, 2018), con la característica de que no fuera de uso agrícola, dado que en la región se acostumbra a sembrar de temporal los cultivos de maíz, frijol y calabaza, con labranza por medio de yunta y fertilizaciones granuladas ricas en nitrogeno. El pH, conductividad eléctrica, contenido de materia orgánica y textura se determinaron en las instalaciones del CIIDIR Oaxaca (Tabla 1). La lombricomposta fue elaborada en el mismo lugar. Se tamizaron ambos sustratos para obtener un tamaño de partícula de hasta 5 mm. Los sustratos se mezclaron en las proporciones suelo:lombri-composta S1 (100:0), S2 (75:25), S3 (50:50) y S4 (25:75) (López et al., 2015). Una vez realizada esta labor se dio paso a la desinfección realizada por vaporización, colocando 80 dm3 de suelo a baño maría en contenedores con 30 L de agua a 80°-82 °C durante 30 minutos (Chávez-Aguilera et al., 2010).
>Table 1 Analysis of soil used for B. glabrifolia propagation.
| Parámetro | Unidad de medida | Interpretación1 | |
|---|---|---|---|
| pH | 8.14 | Medianamente alcalino | |
| Conductividad eléctrica | 0.632 | dS m-1 | Efectos despreciables de salinidad |
| Contenido de materia orgánica (%) | 4.03 | Alto | |
| Textura | Franco arenoso |
De acuerdo a la NOM-021-RECNAT-2000.
Colecta de material vegetativo
Para los fines del experimento se realizaron dos colectas de material vegetativo en San Jerónimo Taviche paraje “La Colorada” (16°40’26” N, 96°33’17.52” W) (INEGI, 2018), Ocotlán de Morelos, Oaxaca, el 4 de diciembre del 2017 y el 25 de marzo del 2018.
De acuerdo con Castellanos- Castro y Bonfil (2013) se eligieron 30 árboles con porte sano, vigoroso y copa expuesta al sol, en estado de reposo, sin tomar más de dos estacas por rama. De cada árbol se obtuvieron 20 estacas que correspondieron de ramas apicales laterales con yemas vegetativas, un grosor de aproximadamente de 12.4 ±3.2 mm y una longitud de 30 cm. Las estacas se etiquetaron y colocaron en bolsas de polietileno transparente, y se plantaron antes de las 24 h.
Preparación de la plantación
Dos días antes de la plantación se realizó un riego a capacidad de campo. Posteriormente se adecuo la estaca de 26±2.0 cm, corte basal biselado, con cuatro yemas distribuidas en toda la estaca; en la parte basal de las estacas se realizaron dos cortes longitudinales de ~5 cm con 1-2 mm de profundidad (Bonfil-Sanders, 2007).
Posteriormente se preparó una solución con ácido Indol-3-butírico (Radix® 10 000) 1.25 g L-1, las estacas se sumergieron por un minuto en la solución a la profundidad de plantación propuesta 5, 10, 15, 20 y 25 cm. Una vez transcurrido el tiempo, se realizó un agujero cónico en el sustrato con una varilla de 40 cm de longitud y un grosor de 1.25 cm, la plantación en los sustratos consistió en enterrar la estaca a la profundidad propuesta. Los riegos fueron cada 48 horas a capacidad de campo, sin suministro adicional de fertilizante. Se realizaron aplicaciones periódicas de Previcure® (Propa-mocarb clorhidrato: Propil 3(dimetilamino) propilcarbama-to-hidrocloruro) (1 ml/L) y Captan® (N-triclorometiltio-4- ci-clohexeno -1,2- dicarboximida) (1 g/L) (una vez por mes). El control de malezas fue manual.
Variables evaluadas
Variables no destructivas. La medición se realizó cada 24 horas. Días de aparición de la yema (DA), contabilización de las yemas que de un momento a otro aparecen; días a brotación (DB), se contabilizó el número de días al momento que se observó el desarrollo de la yema (aparición de una hoja pequeña); tiempo de brotación TB = DB-DA.
Variables destructivas. La medición se realizó pasadas 12 semanas despues
de la siembra. Longitud de la raíz más larga (cm) mediante el uso
de hojas milimétricas; número de brotes aéreos, contabilización de brotes ≥0.5
cm de longitud; longitud de los brotes (cm) la medición se realizó al cortar el
brote y medirlo a lo largo con una hoja milimétricas; número de hojas por conteo
de hojas formadas al deshacer el brote. Para cada variable se obtuvo la biomasa,
las muestras se secaron por medio de una estufa de secado tradicional, hasta
obtener peso constante, el peso se tomó con la balanza analítica de precisión
(Velab®, modelo VE-204). Una vez obtenidos los datos se
calcularon los porcentajes de enraizamiento, brotes y callos. El porcentaje de
enraizamiento (Pe), calculado con la fórmula
Análisis estadístico
Para los análisis de la información en cada tratamiento se tuvo una población de 30 estacas. Se realizó un análisis de varianza factorial donde se analizaron los factores e interacciones por fecha de plantación (A), sustrato (B) y profundidades (C). Las variables que correspondieron a porcentajes de estacas brotadas, callos y enraizamiento, se realizó mediante un ANOVA factorial con modelo aditivo.
La prueba de comparación de medias de todas las variables se realizó con la prueba de Tukey (p≤0.05). El análisis de la información estadística fue con el paquete estadístico SAS (Statistical Analysis System) 9.1.
Resultados y discusión
Efecto de fechas de plantación en el desarrollo de estacas de B. glabrifolia
Se determinó que la fecha de plantación 26 de marzo (primavera) fue mejor que la de 5 de diciembre (invierno) debido a que los días de aparición de yemas fueron más rápidos, ya que se presentaron a los 18 días (Figura 1a), dicha variable indica que existió una fuerte interacción con el medio ambiente donde se desarrolló (79.21 %) (Tabla 2), el número de hojas fue mayor con respecto a la fecha de invierno en un 234.31 % (Figura 1b); la longitud del brote de la misma forma fue más largo en un 194.26 % (Figura 1c), por ende la biomasa de brote tuvo la misma respuesta con un 700 % mayor con respecto a la fecha de invierno (Figura 1d).

Figura 1 a) variables no destructivas; b) numero de brotes y hojas por estaca; c)longitud de brote y raíz; d) biomasa de brote y raíz. Prueba de comparación de medias en estacas de B. glabrifolia en dos fechas de plantación. Valores con la misma letra son estadísticamente iguales (Tukey, 0.05). DA (Días de aparición de la yema); TB (Tiempo de brotación); NBA (Número de brotes aéreos); NH (Número de hojas); LB (Longitud de brote); LR (Longitud de raíz); BB (Biomasa de brote); BR (Biomasa de raíz).
Figure 1 Means comparison test in B. glabrifolia cuttings at two planting dates. Values with the same letter are statistically equal (Tukey, 0.05). DA (Days of bud appearance); TB (Budding Time); NBA (Number of aerial shoots); NH (Number of leaves); LB (Length of Shoot); LR (Root Length); BB (sprout biomass); BR (Root biomass).
Tabla 2 Contribución relativa (%) de las variables destructivas y no destructivas evaluados en estacas de B. glabrifolia.
Table 2 Relative contribution (%) of destructive and non-destructive variables evaluated in B. glabrifolia cuttings.
| Fuente de variación | Variables destructivas | Variables no destructivas | ||||||
|---|---|---|---|---|---|---|---|---|
| DA | TB | NBA | NH | LB | LR | BB | BR | |
| Fecha | 79.21 | 1.64 | 42.39 | 2.78 | 21.94 | - | 12.34 | - |
| Sustrato | 1.69 | 16.86 | 1.59 | 2.55 | 0.31 | 8.82 | 2.21 | 22.95 |
| Profundidad | 6.96 | 24.75 | 29.53 | 83.61 | 35.86 | 35.90 | 49.83 | 57.85 |
| A×B | 1.97 | 9.82 | 8.51 | 2.79 | 23.42 | - | 18.97 | - |
| A×C | 1.01 | 11.03 | 2.55 | 0.81 | 0.36 | - | 1.73 | - |
| B×C | 7.14 | 17.83 | 10.20 | 6.55 | 13.98 | 55.28 | 11.54 | 19.20 |
| A×B×C | 2.02 | 18.07 | 5.22 | 0.91 | 4.12 | - | 3.39 | - |
| Suma | 100.00 | 100.00 | 100.0 | 100.00 | 100.00 | 100.00 | 100.00 | 100.00 |
A (fecha de plantación); B (sustrato); C (profundidad); DA (Días de aparición de la yema); TB (Tiempo de brotación); NBA (Número de brotes aéreos); NH (Número de hojas); LB (Longitud de brote); LR (Longitud de raíz); BB (Biomasa de brote); BR (Biomasa de raíz).
Tal comportamiento de las variables se debió a que las condiciones ambientales tienen un papel fundamental en el desarrollo de las especies (Castillo-Flores et al., 2013). El efecto causado por el tiempo atmosférico, retardó y aceleró el desarrollo de los brotes, ya que en días con temperaturas bajas los brotes retardaron su desarrollo y en temperaturas cálidas los brotes se desarrollaban en menor tiempo (~2 días), tales datos concuerdan con Rodríguez-Cabello et al. (2015) donde en Carica papaya reportaron tasas de crecimiento lento en la temporada de noviembre-marzo y crecimiento acelerado con temperaturas más cálidas, pues el desarrollo del área foliar depende la intercepción de la radiación fotosintéticamente activa (PAR), necesaria para la producción de biomasa y aporte correspondiente al rendimiento (Soto-Carreño et al., 2012). Así mismo en la producción de caña, las fechas de siembra que comprenden temporadas invernales el rendimiento de follaje disminuye (Jiménez et al., 2020).
En cuanto al tiempo de brotación y número de brotes aéreos (Figura 1a, 1b) no se presentaron diferencias significativas entre las fechas, pero superaron los datos de Jarquín-Ríos et al. (2014), quienes mencionan que la propagación por estacas de B. glabrifolia con diferentes grados de lignificación la brotación se da a los 60 días. Con la metodología implementada durante la investigación se superaron los porcentajes de estacas brotadas de B. morelensis y B. galeottiana con bajos grados de lignificación (Loeza-Corte et. al, 2013). Así como los porcentajes de callos presentados por Bonfil-Sanders et al. (2007) y Mero-Jalca et al. (2017).
Por otra parte, el comportamiento de los brotes durante la temporada invernal en algunos casos se observaron cubiertos de resina y el desarrollo vegetativo sin anomalías. Con respecto a las yemas que estuvieron inmersas en el sustrato de la fecha 5 de diciembre, las estacas generaron brotes albinos al final de la estancia del cultivo (los brotes no fueron considerados en el análisis estadístico). Dicho comportamiento estuvo asociado a la calidad e intensidad de la luz, ya que la radiación fotosintéticamente activa (PAR) no llegó a los brotes y la fijación de carbono no fue efectiva (Casierra-Posada et al., 2011). Durante la estancia del cultivo en ambas fechas, se pudo observar la presencia de pseudo-brotes, brotes que emergieron y marchitaron gradualmente, debido al contenido de sustancias nutritivas en el material vegetal (Morillo-Infante et al., 2016; Mero-Jalca et al., 2017).
El enraizamiento en invierno no tuvo éxito, debido a que no se propiciaron las condiciones necesarias para la diferenciación de células parenquimatosas, encargadas de la regeneración de tejido (Mero-Jalca et al., 2017), no obstante, en primavera, se presentó el 10.83 % de enraizamiento de la población total. Con ello se puede atribuir que B. glabrifolia es de difícil enraizamiento y la mejor fecha para el enraizamiento es el 26 de marzo, ya que Bonfil-Sanders (2007) obtuvo enraizamientos hasta del 50 %, Arellano-Ostoa et al. (2018) 35 % con B. linaloe; Loeza-Corte et al. (2013) 20 % en B. morelensis y 12 % en B. galeottiana y Mero-Jalca et al. (2017) en B. graveolens de 0 %. Se hace mención que el porcentaje de callos presente en invierno fue de 85 % y en primavera de 65.30 %.
El comportamiento de la especie se asocia a las condiciones fisiológicas del material vegetal utilizado y a las condiciones del ambiente donde se desarrolla (Navarrete y Vargas, 2005). Del mismo modo Abanto-Rodríguez et al. (2014) mencionan que el porcentaje de enraizamiento se ve influenciado por la variabilidad genotípica de las plantas madre. Asimismo, el potencial de la especie al emitir raíces varía con la época del año y por ello las dosis de enraizador no han podido ser determinadas para la especie (Wendling, 2000). Tal fenómeno se debe a que las especies del género Bursera necesitan de estimulantes hormonales ubicados entre las 8 000 y 10 000 ppm para favorecer el desarrollo de raíces (Arellano-Ostoa et al., 2018).
Efecto de los sustratos en el desarrollo de estacas de B. glabrifolia
Se observó que el sustrato donde se desarrollaron las estacas de B. glabrifolia generaron diferentes respuestas en los días de aparición de la yema por el contenido de lombri-composta, ya que el sustrato S3 (50 % suelo sin uso agrícola: 50 % lombricomposta) fue en donde las yemas aparecieron más temprano comparado con el sustrato S4 donde la aparición de yemas tomó 6 días más. Sin embargo, se observó que a bajos contenidos de materia orgánica (S1) el tiempo de brotación ocurre en menor cantidad de días, caso que contrasta con los sustratos S3 y S4 donde los brotes tardaron 3 días más en desarrollarse (Tabla 2) (Figura 2a).

Figura 2 a) variables no destructivas; b) numero de brotes y hojas por estaca; c)longitud de brote y raíz; d) biomasa de brote y raíz. Prueba de comparación de medias de estacas de B. glabrifolia en cuatro sustratos. Valores con la misma letra son estadísticamente iguales (Tukey, 0.05). DA (Días de aparición de la yema); TB (Tiempo de brotación); NBA (Número de brotes aéreos); NH (Número de hojas); LB (Longitud de brote); LR (Longitud de raíz); BB (Biomasa de brote); BR (Biomasa de raíz). Sustrato. Proporción suelo sin uso agrícola: lombricomposta. S1=100:0; S2=75:25; S3=50:50; S4=25:75.
Figure 2 Means comparison test of B. glabrifolia cuttings in four substrates. Values with the same letter are statistically equal (Tukey, 0.05). DA (Days of bud appearance); TB (Budding Time); NBA (Number of aerial shoots); NH (Number of leaves); LB (Length of Shoot); LR (Root Length); BB (sprout bio-mass); BR (Root biomass). Substratum. Proportion of land without agricultu-ral use: vermicompost. S1=100:0; S2=75:25; S3=50:50; S4=25:75.
Dicho fenómeno se le atribuye al contenido de lombricomposta, ya que al considerarlo como enmienda o mejorador de suelo, las dosis utilizadas generalmente son altas en comparación con las de los fertilizantes minerales y su efecto puede alterar el crecimiento vegetal mediante el incremento de la actividad enzimática, supresión de enfermedades o producción de sustancias reguladoras de crecimiento (Bertsch, 1998; Domínguez et al., 2010). Cabe destacar que este efecto se evaluó en un periodo corto (3 meses) por lo que se recomienda evaluarlo en un periodo más amplio, ya que la adición de lombricomposta influye en la dinámica de la estabilidad de los agregados (Ochoa-Espinosa et al., 2018).
Las variables número de brotes aereos (NBA), número de hojas (NH), longitud de brote (LB), longitud de raíz (LR), biomasa de brote (BB), biomasa de raíz (BR) (Figura 2b, 2c, 2d), porcentajes de estacas brotadas y porcentajes de enraizamiento no presentaron diferencias significativas.
Por otro lado, el porcentaje de callos se vio afectado por el sustrato, ya que a mayor contenido de lombricomposta en los sustratos de invierno se obtuvieron altos porcentajes de callos (95.33 %), caso contrario con primavera donde a menor contenido de lombricomposta el porcentaje de callos fue de 76.66 % (Tabla 4), de manera general (ambas fechas) los sustratos no fueron diferentes estadísticamente en las variables presentadas en la Figura 2. Por lo cual se atribuye que el enraizamiento no depende del sustrato donde se dearrolla, ya que el género Bursera no hace distinción de este (Rzedowski y Kruse, 1979; Cuisance, 1998).
Los días de aparición de la yema y el tiempo de brotación de B. glabrifolia en los sustratos S3 y S4 fueron beneficiados con la adición de lombricomposta, ya que incrementó el área foliar y el prendimiento, dado que fuente de materia orgánica mejora el desarrollo vegetativo (González-Castellanos et al., 2011).
Efecto de las profundidades de plantación en estacas de B. glabrifolia
La profundidad de plantación de B. glabrifolia, determinó la cantidad de días para emitir yemas y brotes, se encontró que conforme se aumenta dicha profundidad, los cambios fisiológicos son más precoces, ya que para la profundidad de 5 cm tomó 11 días más en emitir una yema en comparación de la profundidad de 25 cm (Figura 3a).
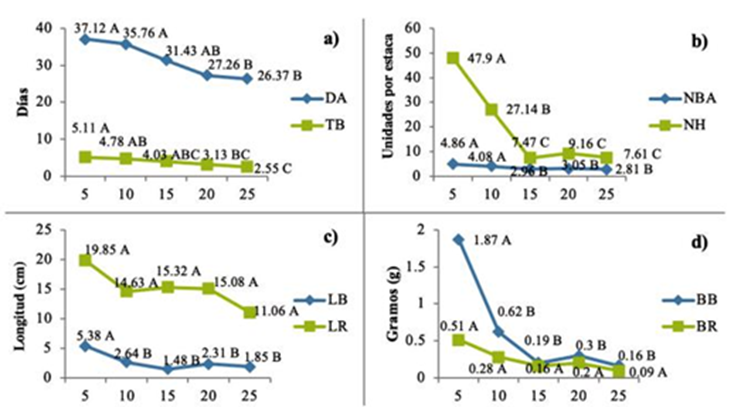
Figura 3 a) variables no destructivas; b) numero de brotes y hojas por estaca; c)longitud de brote y raíz; d) biomasa de brote y raíz. Prueba de comparación de medias de estacas de B. glabrifolia en cinco profundidades de plantación (cm). Valores con la misma letra son estadísticamente iguales (Tukey, 0.05). DA (Días de aparición de la yema); TB (Tiempo de brotación); NBA (Número de brotes aéreos); NH (Número de hojas); LB (Longitud de brote); LR (Longitud de raíz); BB (Biomasa de brote); BR (Biomasa de raíz).
Figure 3 Means comparison test of B. glabrifolia cuttings at five planting depths (cm). Values with the same letter are statistically equal (Tukey, 0.05). DA (Days of bud appearance); TB (Budding Time); NBA (Number of aerial shoots); NH (Number of leaves); LB (Length of Shoot); LR (Root Length); BB (sprout biomass); BR (Root biomass).
La profundidad de 5 cm tuvo mayor superficie, lo cual ocasionó que el número de brotes aéreos y su longitud fuera mayor en comparación con los demás tratamientos. Sin embargo, las profundidades de 10, 15, 20 y 25 cm tuvieron un crecimiento similar entre ellas estadísticamente (Figura 3b), lo cual manifiesta que las profundidades de plantación son influyentes (Tabla 3) en el desarrollo de biomasa de brotes (Figura 3d). La longitud de raíz no presentó diferencias significativas (Figura 3c).
Tabla 3 Contribución relativa (%) de los porcentajes de estacas brotadas, callos y de enraizamiento en los tratamientos de estacas de B. glabrifolia.
Table 3 Relative contribution (%) of the percentages from sprouted cuttings, calluses and rooting in the treatments of B. glabrifolia cuttings.
| Fuente de variación | Porcentajes de estacas brotadas | Porcentaje de callos | Porcentaje de enraizamiento | ||||
|---|---|---|---|---|---|---|---|
| Invierno | Primavera | Ambas fechas | Invierno | Primavera | Ambas fechas | Primavera | |
| Sustratos | 4.04 | 28.16 | 8.73 | 18.24 | 38.73 | 8.08 | 3.15 |
| Profundidades | 95.96 | 71.84 | 91.27 | 81.76 | 61.27 | 91.92 | 96.85 |
| Suma | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
Se observó que, en invierno, las profundidades de 10 y 20 cm y en primavera profundidades de 20 y 25 cm respectivamente, tuvieron mayor porcentaje de brotación en comparación de la profundidad de plantación de 5 cm. Pero a los 5 cm de profundidad mejoró en 41 % los días a brotación, 100 % el tiempo de brotación, 73 % número de brotes aéreos, 529 % en número de hojas, 191 % longitud de brote, 79 % longitud de raíz, 1069 % biomasa de brote y 467 % biomasa de raíz todas estas variables en comparación con la profundidad de 25 cm.
El comportamiento de las estacas al momento del enraizado fue generar callos en todos los tratamientos, se observó que las profundidades fueron el factor principal para la emisión de callos, ya que conforme se aumenta la profundidad a partir de los 10 cm, el porcentaje de callosidad también aumentó (Tabla 4).
Tabla 4 Prueba de comparación de medias por sustratos para el porcentaje de callos en estacas de B. glabrifolia, en dos fechas de propagación y su interacción.
Table 4 Means Comparison test by substrates for the percentage of callus in cuttings of B. glabrifolia, in two spread dates and their interaction.
| 5 de diciembre | 26 de marzo | Ambas Fechas | ||||||
|---|---|---|---|---|---|---|---|---|
| Sustratos | Porcentajes | Sustratos | Porcentajes | Sustratos | Porcentajes | |||
| S4 | 95.33 | A | S1 | 76.66 | A | S4 | 79.00 | A |
| S3 | 86.67 | A | S2 | 66.0 | AB | S1 | 77.66 | A |
| S2 | 79.33 | A | S4 | 62.66 | AB | S2 | 72.66 | A |
| S1 | 78.66 | A | S3 | 56.0 | B | S3 | 71.33 | A |
Nota. Sustrato S:L, Proporción suelo sin uso agrícola: lombricomposta, S1 (100:0), S2 (75:25), S3 (50:50), S4 (25:75). Valores con la misma letra son estadísticamente iguales (Tukey, 0.05).
El enraizamiento se le atribuye a la profundidad de plantación en 96.85 % (Tabla 5), debido a que el incremento de la profundidad el enraizamiento se ve disminuido (Figura 4). Dicho dato concuerda con Martínez-Aguirre (2007) y Ayma-Romay et al. (2015), donde en una profundidad de 3 cm se puede tener enraizamientos exitosos en Tamarix boveana Bunge (Caryophyllales: Tamaricaceae) y Polylepis lanata (Kuntze) (Rosales: Rosaseae).
Tabla 5 Prueba de comparación de medias para el porcentaje de estacas brotadas y callos de B. glabrifolia en dos fechas de propagación y su interacción.
Table 5 Means comparison test for the percentage of sprouted cuttings and calluses of B. glabrifolia, at two spread dates and their interaction.
| Profundida- des (cm) | Invierno | Primavera | Ambas fechas | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estacas das (%) | brota- | Callos (%) | Estacasdas (%) | brota- | Callos (%) | Estacas das (%) | brota- | Callos (%) | ||||
| 5 | 46.6 | B | 57.5 | B | 23.3 | C | 52.5 | B | 35.0 | C | 55.0 | B |
| 10 | 61.6 | A | 85.0 | A | 42.5 | BC | 62.5 | AB | 52.0 | B | 73.7 | AB |
| 15 | 57.5 | AB | 95.0 | A | 55.8 | AB | 61.6 | AB | 56.6 | AB | 78.3 | AB |
| 20 | 64.9 | A | 91.6 | A | 73.3 | A | 80.8 | A | 69.1 | A | 86.2 | A |
| 25 | 55.0 | AB | 95.8 | A | 66.6 | A | 69.1 | AB | 60.8 | AB | 82.5 | A |
Valores con la misma letra son estadísticamente iguales (Tukey, 0.05).
Conclusiones
La mejor fecha de plantación fue la del 26 de marzo, ya que la emisión de yemas y brotes fue en menor cantidad de días y se presentó enraizamiento en estacas de B. glabrifolia a los 5 cm de profundidad. Los sustratos no influyeron en el desarrollo de B. glabrifolia. Cabe destacar que, a mayor profundidad de plantación, el tiempo de brotación también se ve reducido.











 nova página do texto(beta)
nova página do texto(beta)



